第二章 第三节 物质的量 第3课时--人教版高中化学必修第一册教学课件(共41张PPT)
文档属性
| 名称 | 第二章 第三节 物质的量 第3课时--人教版高中化学必修第一册教学课件(共41张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 232.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 00:00:00 | ||
图片预览











文档简介
第3课时 物质的量浓度
第三节 物质的量
化学
1.通过对物质的量浓度的学习,从微观上理解溶液是由一定物质的量的溶质分散在溶剂中形成的,进而从宏观上明确物质的量浓度的基本应用。
2.建立溶液组成的简单模型,通过对溶质的质量分数与物质的量浓度的对比,提高比较、归纳、推理的能力。
3.对比生活中不同的溶液浓度的表示方法,理解在不同应用下选择不同的表示方法的科学意义,体会物质的量浓度在环保、检验、检疫中的应用价值。
学习目标
重点、难点:
有关物质的量浓度的计算、一定物质的量浓度的溶液的配制。
学习重难点
物质的量浓度
(1) 概念:单位体积溶液里所含溶质B的物质的量,符号 ,公式为 ,单位常用 。
(2) 计算:可由溶质物质的量与溶液体积直接算;也可由溶液质量、溶质质量分数结合密度来算;溶液稀释遵循 。
(3) 注意:体积是溶液体积,而非溶剂体积,计算注意单位换算,确定溶质时要考虑特殊情况如结晶水合物。
自主预习
cB=????B????
?
c1V1=c2V2
cB
mol/L
在初中学习中,在溶液这一章节初步认识溶液是由溶质和溶剂组成的均一、稳定的混合物。回忆溶液相关知识,回答问题。
【问题1】什么叫溶液?
【问题2】溶液由什么组成?
知识回顾
溶液是一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
溶液由溶质和溶剂两部分组成。
【问题3】溶液有什么特点?
【问题4】溶液浓度的表示方法是什么?
知识回顾
均一性、稳定性。
溶质质量分数=溶液质量×100%。
溶质质量
例如,把食盐放入水中,充分搅拌后形成的食盐水就是溶液。
溶质是被溶解的物质,如上述食盐水里的食盐;溶剂是能溶解其他物质的物质,食盐水里的水就是溶剂。溶质可以是固体、液体或气体,而溶剂一般是液体,常见的溶剂是水,此外还有酒精、汽油等。
知识回顾
1.溶液的组成及特征
溶液是由______和______两部分组成的,其特征是______、______、______。
2.溶质的质量分数
知识回顾
[知识梳理]
溶质
溶液
????(溶质)????(溶液)×100%
?
溶质
溶剂
均一
稳定
透明
导入新课
[情境设问]
我们已经学会了通过质量和摩尔质量来计算物质的量,那如果现在有一个新的情境,我们有一定物质的量的氯化钠要溶解在水里配成溶液,只知道氯化钠的物质的量和溶液最终的体积,那我们要怎么来表示这个溶液里氯化钠的含量呢?
比如有2mol氯化钠溶解在1L水里,这个溶液和1mol氯化钠溶解在0.5L水里有什么不同和相同呢?
实验过程中,为了操作方便,取用溶液时,一般量取它的体积,而不是称量其质量。这是为什么?
课堂探究
一、物质的量浓度
[课题引入]
? 操作便利性:量取体积操作简便快捷,可直接读出所需量,便于控制溶质和溶剂的比例;而称量质量需先测容器的质量等,操作繁琐耗时。
? 仪器精度与准确性:量取体积的仪器如量筒、移液管在一定量程内精度高,能满足实验对溶液量的准确要求;天平对溶液质量的测量在精度等方面相对不占优势。
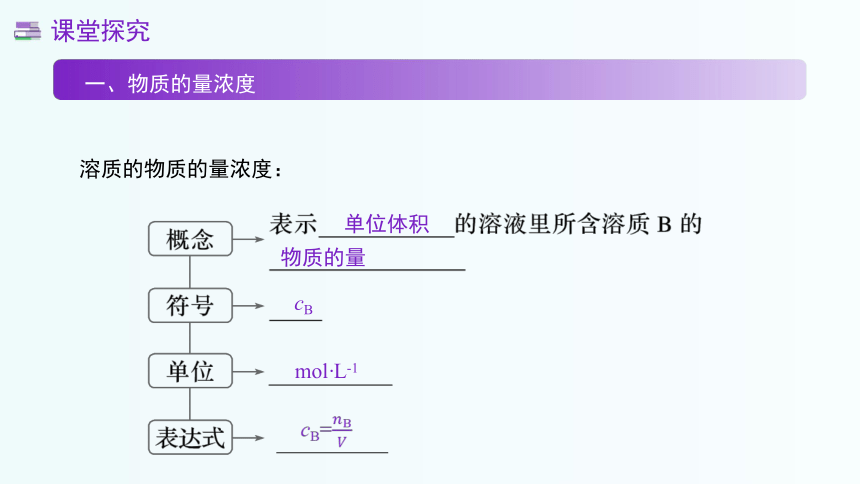
溶质的物质的量浓度:
课堂探究
一、物质的量浓度
单位体积
物质的量
cB
mol·L-1
cB=????B????
?
【问题1】从1 L 1 mol·L-1的NaOH溶液中取出100 mL,取出的溶液中NaOH的物质的量浓度是多少?为什么?
课堂探究
一、物质的量浓度
[课堂研究]
物质的量浓度依然是1 mol·L-1 。
溶液具有均一性,即溶液中各部分的性质完全相同,包括物质的量浓度。对于给定的氢氧化钠溶液,无论取出多少体积,其溶质的物质的量浓度都不会发生改变。
【问题2】2 L 0.1 mol·L-1的NaCl溶液和1 L 0.2 mol·L-1的HCl溶液,溶质的物质的量相同吗?质量相同吗?
课堂探究
一、物质的量浓度
[课堂研究]
两种溶液溶质的物质的量相同,但质量不同。
判断下列说法的正误。对的打“√”,错的打“×”。
1.将1 mol NaCl溶于1 L水中所得到的溶液中溶质的物质的量浓度是1 mol·L-1。 ( )
课堂练习
一、物质的量浓度
[判断正误]
将1 mol 氯化钠溶于1 L 水中,所得溶液的体积并不是1L。因为氯化钠溶解后,溶液的体积会发生变化,通常会略有增大。
×
判断下列说法的正误。对的打“√”,错的打“×” 。
2.物质的量浓度是指1 L水里所含溶质的物质的量。 ( )
课堂练习
一、物质的量浓度
[判断正误]
×
物质的量浓度是指单位体积溶液里所含溶质B的物质的量,常用单位为mol/L。
判断下列说法的正误。对的打“√”,错的打“×” 。
3.物质的量浓度是指1 L溶液里所含溶质的物质的量。 ( )
课堂练习
一、物质的量浓度
[判断正误]
物质的量浓度的是指单位体积溶液里所含溶质的物质的量,当单位体积为1L时,1L该溶液中所含溶质的物质的量就是该溶液的物质的量浓度。
√
判断下列说法的正误。对的打“√”,错的打“×” 。
4.将40 g NaOH溶于水,得到1 L溶液,溶液中溶质的物质的量浓度为1 mol·L-1。 ( )
课堂练习
一、物质的量浓度
[判断正误]
√
首先计算40g 氢氧化钠的物质的量,可得n(NaOH)=1mol。
将其溶于水配成1L 溶液,根据物质的量浓度的定义式,其中n为溶质的物质的量,V为溶液的体积,可得该氢氧化钠溶液中溶质的物质的量浓度1mol/L。
课堂探究
一、物质的量浓度
[归纳总结]
1.根据cB=????????????,欲求 cB ,先求nB和V。
2.溶液中溶质的几种特殊情况
(1)某些物质溶于水后与水发生反应生成了新物质,此时溶质为反应后的生成物,如Na、Na2O、Na2O2---→NaOH,溶质为NaOH,SO3---→H?SO4,溶质为 H2SO4。
(2)带有结晶水的物质如CuSO4·5H2O溶于水时,其溶质是CuSO4,而不是 CuSO4·5H2O。
(3)NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
3.混合后溶液的体积
(1)单位体积的溶液(1L),注意溶液的体积不等于溶剂的体积;
(2)若指出不考虑溶液体积改变,可认为是原溶液的体积之和。
(3)若给出混合后溶液的密度,应根据V(混) =m混ρ混 =ρ1V1?+ρ2V2ρ混来计算。
?
水
水
1.物质的量浓度:物质的量浓度的定义为 。符号为______,单位是____________,表达式为________________。
2.溶解度:在一定温度下,某固态物质在100 g______中达到__________时所溶解的溶质的质量,叫做这种物质在这种溶剂中的________。物质的溶解度属于物理性质。若溶液中某溶质的溶解度用S表示,则该温度下此饱和溶液中溶质的质量分数可表示为________________。
课堂探究
二、有关物质的量浓度的计算
[知识梳理]
单位体积(1L)溶液里所含溶质B的物质的量
cB
mol/L
cB=
溶剂
溶解度
饱和状态
w=????100+????×100%
?
nBV?
?
配制500 mL 0.1 mol·L-1NaOH溶液所需NaOH的质量是多少?
课堂探究
二、有关物质的量浓度的计算
本题可先根据物质的量浓度的公式可得到n = cB·V,求出氢氧化钠的物质的量,再根据m = n·M求出氢氧化钠的质量。
500 mL 0.1 mol·L-1 NaOH溶液中:
n(NaOH)=c(NaOH)·V(NaOH溶液)=0.1 mol·L-1×0.5 L=0.05 mol。
0.05 mol NaOH的质量:
m(NaOH)=n(NaOH)·M(NaOH)=0.05 mol×40 g·mol-1=2 g。
答:配制500 mL 0.1 mol·L-1 NaOH溶液所需NaOH的质量为2 g。。
标准状况下,n(HCl)=????(HCl)22.4L/mol=33.6L?22.4L/mol=1.5mol,
盐酸的物质的量浓度为c(HCl)=????(HCl)????(盐酸)=1.5mol?0.5L=3mol/L 。
?
(1)在标准状况下,用33.6 L HCl气体配制成0.5 L盐酸,HCl的物质的量浓度是多少?
课堂练习
二、有关物质的量浓度的计算
(2)物质的量浓度为2 mol·L-1的硫酸溶液500 mL,含H2SO4的物质的量是多少?
课堂练习
二、有关物质的量浓度的计算
(3)10 mol HCl能配成几升物质的量浓度为2 mol·L-1的盐酸?
物质的量浓度为2mol·L-1的H2SO4溶液500mL,根据公式
n =cB·V,所以溶液中含H2SO4的物质的量为0.5L×2mol/L=1mol。
配成2 mol·L-1的盐酸的体积为10?mol2?mol·L?1=5L。
?
(4)将2 mol Na2SO4配成1 L溶液,Na2SO4的物质的量浓度是多少?其中Na+的物质的量浓度为多少?SO42?的物质的量浓度为多少?
?
课堂练习
二、有关物质的量浓度的计算
[练习]
Na2SO4的物质的量浓度:c(Na2SO4)=n(Na2SO4)????=2?mol1L=2 mol/L;
Na+的物质的量浓度:c(Na+)=2 xc(Na2SO4) =2x2 mol/L=4 mol/L;
SO42?的物质的量浓度:c (SO42?)= c(Na2SO4) =2mol/L。
?
离子的物质的量浓度
(1)离子的物质的量浓度与溶质的物质的量浓度之间有什么关系?
(2)各离子的物质的量浓度之间有什么关系?
课堂探究
二、有关物质的量浓度的计算
离子的物质的量浓度与溶质的物质的量浓度的关系取决于溶质在溶液中的电离情况。
离子的物质的量浓度与溶质的组成以及电离情况有关。
离子的物质的量浓度
(3)1 mol MgCl2中含有 mol Mg2+, mol Cl-。
?
(4)1 mol·L-1 MgCl2溶液中,各微粒的物质的量浓度分别为
c(MgCl2)= mol·L-1,c(Mg2+)= mol·L-1,c(Cl-)= mol·L-1。?
课堂探究
二、有关物质的量浓度的计算
1
2
1
1
2
溶液的稀释
家里只有一瓶蔗糖水,但是小明偏要喝两瓶,于是妈妈把蔗糖水稀释成两瓶,小明吃到的糖有没有变多?为什么?
课堂探究
二、有关物质的量浓度的计算
小明吃到的糖没有变多。因为蔗糖水稀释只是增加了溶液的体积,而溶质蔗糖的量并没有改变。就像一杯糖水,你往里面加更多的水,糖的量还是原来那么多,只是糖水变得更淡了。
溶液的稀释
配制250 mL 1.0 mol·L-1 H2SO4溶液,需要18 mol·L-1 H2SO4溶液的体积约是多少(结果保留到整数)?
课堂探究
二、有关物质的量浓度的计算
1.求250 mL 1 mol·L-1 硫酸溶液中溶质的物质的量
根据物质的量浓度公式n=cB·V(n是溶质的物质的量,c是物质的量浓度,V是溶液体积), 则n = 1.0 mol·L-1 x0.25 L =0.25mol 。
2.求18 mol·L-1硫酸溶液的体积
设需要18 mol·L-1硫酸溶液的体积为V1 L 。因为稀释前后溶质物质的量不变,所以n =cB·V , V1 =0.25mol18?mol·L?1≈ 0.0139 L = 13.9 mL ≈ 14 mL 。
?
c混V混=c1V1+c2V2
c混= c1V1+c2V2V混 =2?mol·L?1×200L+4mol·L?1×100L200L+100L=800?mol300L ≈2.67 mol·L-1 。
答:混合后溶液中HCl的物质的量浓度是2.67 mol·L-1。
?
混合溶液的物质的量浓度
2 mol·L-1的盐酸200 L和4 mol·L-1的盐酸100 L混合,求混合后溶液中HCl的物质的量浓度是多少?(保留三位有效数字,假设溶液混合时体积没有变化)
课堂探究
二、有关物质的量浓度的计算
课堂探究
二、有关物质的量浓度的计算
[小结]
课堂探究
二、有关物质的量浓度的计算
[小结]
【问题1】如何配制100 g溶质的质量分数为5%的NaCl溶液?
课堂探究
三、一定物质的量浓度溶液的配制
首先算出溶质氯化钠的质量为 5 g,溶剂水的质量为 95 g,然后称取 5 g氯化钠放入烧杯中,量取 95 mL水倒入。
【问题2】实验室配制一定物质的量浓度的溶液时,使用的定量玻璃仪器是什么?该仪器的规格有哪些?容量瓶上有哪些标注?使用时如何检查容量瓶是否漏水?
课堂探究
三、一定物质的量浓度溶液的配制
容量瓶;常见的规格有 50mL、100mL、250mL、500mL 和 1000mL 等。
一般标有刻度线、温度和容量。
检查容量瓶是否漏水:加水塞紧瓶塞,倒立观察瓶塞处是否漏水,若不漏,正立瓶塞旋转 180 度,倒立再观察,若仍不漏即可使用。
实验室容量瓶使用:
课堂探究
三、一定物质的量浓度溶液的配制
【问题3】如何配制100 mL 1 mol·L-1的NaCl溶液?
课堂探究
三、一定物质的量浓度溶液的配制
(1)计算需要的NaCl固体的质量为5.85 g。
(2)称量NaCl固体(应该使用精度比较高的分析天平或电子天平,但是本实验中使用托盘天平代替)。
(3)将称量好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体完全溶解。
(4)将烧杯中的溶液沿玻璃棒转移至100 mL容量瓶中,用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也转移至容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(5)向容量瓶内注入蒸馏水,至液面距离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(6)将配制好的溶液倒入试剂瓶中,并贴好标签。
【练习1】
将4 g氢氧化钠溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度是( )
A.10 mol·L-1
B.1 mol·L-1
C.0.1 mol·L-1
D.0.01 mol·L-1
课堂练习
C
【练习2】
1 mol·L-1硫酸溶液的含义是( )
A.1 L水中含有1 mol硫酸
B.1 L溶液中含有1 mol氢离子
C.将98 g硫酸溶于1 L水中配成溶液
D.1 L硫酸溶液中含98 g硫酸
课堂练习
D
【练习3】
下列关于物质的量浓度的表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42?的总物质的量为0.9 mol
B.50 mL 1 mol·L-1的KCl溶液和100 mL 0.25 mol·L-1 的MgCl2溶液中,Cl-的物质的量浓度相等
C.将10 mL 1 mol·L-1的H2SO4溶液稀释成0.1 mol·L-1的H2SO4溶液,可向其中加入100 mL水
D.20 ℃时,0.023 mol·L-1的氢氧化钙饱和溶液100 mL 加入5 g生石灰,冷却到20 ℃时,溶液的体积小于100 mL,溶质的物质的量浓度仍为0.023 mol·L-1
?
课堂练习
D
【练习4】
下列关于容量瓶及其使用的叙述正确的是( )
A.用容量瓶配制溶液前应将其干燥
B.用容量瓶配制溶液前应用欲配制的溶液润洗
C.容量瓶可用来长期贮存溶液
D.容量瓶不能用作溶解固体、稀释浓溶液的容器
课堂练习
D
【练习5】
配制100 mL一定物质的量浓度的硫酸溶液,不需要用到的仪器是( )
课堂练习
C
布置作业
课本P61课后题。
思考物质的量浓度与溶质的质量分数之间如何转换?
请在课后通过观察、上网或者查阅资料的方法找出在生产、生活中还有哪些地方用到物质的量浓度这种表达方式。
谢谢大家
第三节 物质的量
化学
1.通过对物质的量浓度的学习,从微观上理解溶液是由一定物质的量的溶质分散在溶剂中形成的,进而从宏观上明确物质的量浓度的基本应用。
2.建立溶液组成的简单模型,通过对溶质的质量分数与物质的量浓度的对比,提高比较、归纳、推理的能力。
3.对比生活中不同的溶液浓度的表示方法,理解在不同应用下选择不同的表示方法的科学意义,体会物质的量浓度在环保、检验、检疫中的应用价值。
学习目标
重点、难点:
有关物质的量浓度的计算、一定物质的量浓度的溶液的配制。
学习重难点
物质的量浓度
(1) 概念:单位体积溶液里所含溶质B的物质的量,符号 ,公式为 ,单位常用 。
(2) 计算:可由溶质物质的量与溶液体积直接算;也可由溶液质量、溶质质量分数结合密度来算;溶液稀释遵循 。
(3) 注意:体积是溶液体积,而非溶剂体积,计算注意单位换算,确定溶质时要考虑特殊情况如结晶水合物。
自主预习
cB=????B????
?
c1V1=c2V2
cB
mol/L
在初中学习中,在溶液这一章节初步认识溶液是由溶质和溶剂组成的均一、稳定的混合物。回忆溶液相关知识,回答问题。
【问题1】什么叫溶液?
【问题2】溶液由什么组成?
知识回顾
溶液是一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
溶液由溶质和溶剂两部分组成。
【问题3】溶液有什么特点?
【问题4】溶液浓度的表示方法是什么?
知识回顾
均一性、稳定性。
溶质质量分数=溶液质量×100%。
溶质质量
例如,把食盐放入水中,充分搅拌后形成的食盐水就是溶液。
溶质是被溶解的物质,如上述食盐水里的食盐;溶剂是能溶解其他物质的物质,食盐水里的水就是溶剂。溶质可以是固体、液体或气体,而溶剂一般是液体,常见的溶剂是水,此外还有酒精、汽油等。
知识回顾
1.溶液的组成及特征
溶液是由______和______两部分组成的,其特征是______、______、______。
2.溶质的质量分数
知识回顾
[知识梳理]
溶质
溶液
????(溶质)????(溶液)×100%
?
溶质
溶剂
均一
稳定
透明
导入新课
[情境设问]
我们已经学会了通过质量和摩尔质量来计算物质的量,那如果现在有一个新的情境,我们有一定物质的量的氯化钠要溶解在水里配成溶液,只知道氯化钠的物质的量和溶液最终的体积,那我们要怎么来表示这个溶液里氯化钠的含量呢?
比如有2mol氯化钠溶解在1L水里,这个溶液和1mol氯化钠溶解在0.5L水里有什么不同和相同呢?
实验过程中,为了操作方便,取用溶液时,一般量取它的体积,而不是称量其质量。这是为什么?
课堂探究
一、物质的量浓度
[课题引入]
? 操作便利性:量取体积操作简便快捷,可直接读出所需量,便于控制溶质和溶剂的比例;而称量质量需先测容器的质量等,操作繁琐耗时。
? 仪器精度与准确性:量取体积的仪器如量筒、移液管在一定量程内精度高,能满足实验对溶液量的准确要求;天平对溶液质量的测量在精度等方面相对不占优势。
溶质的物质的量浓度:
课堂探究
一、物质的量浓度
单位体积
物质的量
cB
mol·L-1
cB=????B????
?
【问题1】从1 L 1 mol·L-1的NaOH溶液中取出100 mL,取出的溶液中NaOH的物质的量浓度是多少?为什么?
课堂探究
一、物质的量浓度
[课堂研究]
物质的量浓度依然是1 mol·L-1 。
溶液具有均一性,即溶液中各部分的性质完全相同,包括物质的量浓度。对于给定的氢氧化钠溶液,无论取出多少体积,其溶质的物质的量浓度都不会发生改变。
【问题2】2 L 0.1 mol·L-1的NaCl溶液和1 L 0.2 mol·L-1的HCl溶液,溶质的物质的量相同吗?质量相同吗?
课堂探究
一、物质的量浓度
[课堂研究]
两种溶液溶质的物质的量相同,但质量不同。
判断下列说法的正误。对的打“√”,错的打“×”。
1.将1 mol NaCl溶于1 L水中所得到的溶液中溶质的物质的量浓度是1 mol·L-1。 ( )
课堂练习
一、物质的量浓度
[判断正误]
将1 mol 氯化钠溶于1 L 水中,所得溶液的体积并不是1L。因为氯化钠溶解后,溶液的体积会发生变化,通常会略有增大。
×
判断下列说法的正误。对的打“√”,错的打“×” 。
2.物质的量浓度是指1 L水里所含溶质的物质的量。 ( )
课堂练习
一、物质的量浓度
[判断正误]
×
物质的量浓度是指单位体积溶液里所含溶质B的物质的量,常用单位为mol/L。
判断下列说法的正误。对的打“√”,错的打“×” 。
3.物质的量浓度是指1 L溶液里所含溶质的物质的量。 ( )
课堂练习
一、物质的量浓度
[判断正误]
物质的量浓度的是指单位体积溶液里所含溶质的物质的量,当单位体积为1L时,1L该溶液中所含溶质的物质的量就是该溶液的物质的量浓度。
√
判断下列说法的正误。对的打“√”,错的打“×” 。
4.将40 g NaOH溶于水,得到1 L溶液,溶液中溶质的物质的量浓度为1 mol·L-1。 ( )
课堂练习
一、物质的量浓度
[判断正误]
√
首先计算40g 氢氧化钠的物质的量,可得n(NaOH)=1mol。
将其溶于水配成1L 溶液,根据物质的量浓度的定义式,其中n为溶质的物质的量,V为溶液的体积,可得该氢氧化钠溶液中溶质的物质的量浓度1mol/L。
课堂探究
一、物质的量浓度
[归纳总结]
1.根据cB=????????????,欲求 cB ,先求nB和V。
2.溶液中溶质的几种特殊情况
(1)某些物质溶于水后与水发生反应生成了新物质,此时溶质为反应后的生成物,如Na、Na2O、Na2O2---→NaOH,溶质为NaOH,SO3---→H?SO4,溶质为 H2SO4。
(2)带有结晶水的物质如CuSO4·5H2O溶于水时,其溶质是CuSO4,而不是 CuSO4·5H2O。
(3)NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
3.混合后溶液的体积
(1)单位体积的溶液(1L),注意溶液的体积不等于溶剂的体积;
(2)若指出不考虑溶液体积改变,可认为是原溶液的体积之和。
(3)若给出混合后溶液的密度,应根据V(混) =m混ρ混 =ρ1V1?+ρ2V2ρ混来计算。
?
水
水
1.物质的量浓度:物质的量浓度的定义为 。符号为______,单位是____________,表达式为________________。
2.溶解度:在一定温度下,某固态物质在100 g______中达到__________时所溶解的溶质的质量,叫做这种物质在这种溶剂中的________。物质的溶解度属于物理性质。若溶液中某溶质的溶解度用S表示,则该温度下此饱和溶液中溶质的质量分数可表示为________________。
课堂探究
二、有关物质的量浓度的计算
[知识梳理]
单位体积(1L)溶液里所含溶质B的物质的量
cB
mol/L
cB=
溶剂
溶解度
饱和状态
w=????100+????×100%
?
nBV?
?
配制500 mL 0.1 mol·L-1NaOH溶液所需NaOH的质量是多少?
课堂探究
二、有关物质的量浓度的计算
本题可先根据物质的量浓度的公式可得到n = cB·V,求出氢氧化钠的物质的量,再根据m = n·M求出氢氧化钠的质量。
500 mL 0.1 mol·L-1 NaOH溶液中:
n(NaOH)=c(NaOH)·V(NaOH溶液)=0.1 mol·L-1×0.5 L=0.05 mol。
0.05 mol NaOH的质量:
m(NaOH)=n(NaOH)·M(NaOH)=0.05 mol×40 g·mol-1=2 g。
答:配制500 mL 0.1 mol·L-1 NaOH溶液所需NaOH的质量为2 g。。
标准状况下,n(HCl)=????(HCl)22.4L/mol=33.6L?22.4L/mol=1.5mol,
盐酸的物质的量浓度为c(HCl)=????(HCl)????(盐酸)=1.5mol?0.5L=3mol/L 。
?
(1)在标准状况下,用33.6 L HCl气体配制成0.5 L盐酸,HCl的物质的量浓度是多少?
课堂练习
二、有关物质的量浓度的计算
(2)物质的量浓度为2 mol·L-1的硫酸溶液500 mL,含H2SO4的物质的量是多少?
课堂练习
二、有关物质的量浓度的计算
(3)10 mol HCl能配成几升物质的量浓度为2 mol·L-1的盐酸?
物质的量浓度为2mol·L-1的H2SO4溶液500mL,根据公式
n =cB·V,所以溶液中含H2SO4的物质的量为0.5L×2mol/L=1mol。
配成2 mol·L-1的盐酸的体积为10?mol2?mol·L?1=5L。
?
(4)将2 mol Na2SO4配成1 L溶液,Na2SO4的物质的量浓度是多少?其中Na+的物质的量浓度为多少?SO42?的物质的量浓度为多少?
?
课堂练习
二、有关物质的量浓度的计算
[练习]
Na2SO4的物质的量浓度:c(Na2SO4)=n(Na2SO4)????=2?mol1L=2 mol/L;
Na+的物质的量浓度:c(Na+)=2 xc(Na2SO4) =2x2 mol/L=4 mol/L;
SO42?的物质的量浓度:c (SO42?)= c(Na2SO4) =2mol/L。
?
离子的物质的量浓度
(1)离子的物质的量浓度与溶质的物质的量浓度之间有什么关系?
(2)各离子的物质的量浓度之间有什么关系?
课堂探究
二、有关物质的量浓度的计算
离子的物质的量浓度与溶质的物质的量浓度的关系取决于溶质在溶液中的电离情况。
离子的物质的量浓度与溶质的组成以及电离情况有关。
离子的物质的量浓度
(3)1 mol MgCl2中含有 mol Mg2+, mol Cl-。
?
(4)1 mol·L-1 MgCl2溶液中,各微粒的物质的量浓度分别为
c(MgCl2)= mol·L-1,c(Mg2+)= mol·L-1,c(Cl-)= mol·L-1。?
课堂探究
二、有关物质的量浓度的计算
1
2
1
1
2
溶液的稀释
家里只有一瓶蔗糖水,但是小明偏要喝两瓶,于是妈妈把蔗糖水稀释成两瓶,小明吃到的糖有没有变多?为什么?
课堂探究
二、有关物质的量浓度的计算
小明吃到的糖没有变多。因为蔗糖水稀释只是增加了溶液的体积,而溶质蔗糖的量并没有改变。就像一杯糖水,你往里面加更多的水,糖的量还是原来那么多,只是糖水变得更淡了。
溶液的稀释
配制250 mL 1.0 mol·L-1 H2SO4溶液,需要18 mol·L-1 H2SO4溶液的体积约是多少(结果保留到整数)?
课堂探究
二、有关物质的量浓度的计算
1.求250 mL 1 mol·L-1 硫酸溶液中溶质的物质的量
根据物质的量浓度公式n=cB·V(n是溶质的物质的量,c是物质的量浓度,V是溶液体积), 则n = 1.0 mol·L-1 x0.25 L =0.25mol 。
2.求18 mol·L-1硫酸溶液的体积
设需要18 mol·L-1硫酸溶液的体积为V1 L 。因为稀释前后溶质物质的量不变,所以n =cB·V , V1 =0.25mol18?mol·L?1≈ 0.0139 L = 13.9 mL ≈ 14 mL 。
?
c混V混=c1V1+c2V2
c混= c1V1+c2V2V混 =2?mol·L?1×200L+4mol·L?1×100L200L+100L=800?mol300L ≈2.67 mol·L-1 。
答:混合后溶液中HCl的物质的量浓度是2.67 mol·L-1。
?
混合溶液的物质的量浓度
2 mol·L-1的盐酸200 L和4 mol·L-1的盐酸100 L混合,求混合后溶液中HCl的物质的量浓度是多少?(保留三位有效数字,假设溶液混合时体积没有变化)
课堂探究
二、有关物质的量浓度的计算
课堂探究
二、有关物质的量浓度的计算
[小结]
课堂探究
二、有关物质的量浓度的计算
[小结]
【问题1】如何配制100 g溶质的质量分数为5%的NaCl溶液?
课堂探究
三、一定物质的量浓度溶液的配制
首先算出溶质氯化钠的质量为 5 g,溶剂水的质量为 95 g,然后称取 5 g氯化钠放入烧杯中,量取 95 mL水倒入。
【问题2】实验室配制一定物质的量浓度的溶液时,使用的定量玻璃仪器是什么?该仪器的规格有哪些?容量瓶上有哪些标注?使用时如何检查容量瓶是否漏水?
课堂探究
三、一定物质的量浓度溶液的配制
容量瓶;常见的规格有 50mL、100mL、250mL、500mL 和 1000mL 等。
一般标有刻度线、温度和容量。
检查容量瓶是否漏水:加水塞紧瓶塞,倒立观察瓶塞处是否漏水,若不漏,正立瓶塞旋转 180 度,倒立再观察,若仍不漏即可使用。
实验室容量瓶使用:
课堂探究
三、一定物质的量浓度溶液的配制
【问题3】如何配制100 mL 1 mol·L-1的NaCl溶液?
课堂探究
三、一定物质的量浓度溶液的配制
(1)计算需要的NaCl固体的质量为5.85 g。
(2)称量NaCl固体(应该使用精度比较高的分析天平或电子天平,但是本实验中使用托盘天平代替)。
(3)将称量好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体完全溶解。
(4)将烧杯中的溶液沿玻璃棒转移至100 mL容量瓶中,用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也转移至容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(5)向容量瓶内注入蒸馏水,至液面距离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(6)将配制好的溶液倒入试剂瓶中,并贴好标签。
【练习1】
将4 g氢氧化钠溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度是( )
A.10 mol·L-1
B.1 mol·L-1
C.0.1 mol·L-1
D.0.01 mol·L-1
课堂练习
C
【练习2】
1 mol·L-1硫酸溶液的含义是( )
A.1 L水中含有1 mol硫酸
B.1 L溶液中含有1 mol氢离子
C.将98 g硫酸溶于1 L水中配成溶液
D.1 L硫酸溶液中含98 g硫酸
课堂练习
D
【练习3】
下列关于物质的量浓度的表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42?的总物质的量为0.9 mol
B.50 mL 1 mol·L-1的KCl溶液和100 mL 0.25 mol·L-1 的MgCl2溶液中,Cl-的物质的量浓度相等
C.将10 mL 1 mol·L-1的H2SO4溶液稀释成0.1 mol·L-1的H2SO4溶液,可向其中加入100 mL水
D.20 ℃时,0.023 mol·L-1的氢氧化钙饱和溶液100 mL 加入5 g生石灰,冷却到20 ℃时,溶液的体积小于100 mL,溶质的物质的量浓度仍为0.023 mol·L-1
?
课堂练习
D
【练习4】
下列关于容量瓶及其使用的叙述正确的是( )
A.用容量瓶配制溶液前应将其干燥
B.用容量瓶配制溶液前应用欲配制的溶液润洗
C.容量瓶可用来长期贮存溶液
D.容量瓶不能用作溶解固体、稀释浓溶液的容器
课堂练习
D
【练习5】
配制100 mL一定物质的量浓度的硫酸溶液,不需要用到的仪器是( )
课堂练习
C
布置作业
课本P61课后题。
思考物质的量浓度与溶质的质量分数之间如何转换?
请在课后通过观察、上网或者查阅资料的方法找出在生产、生活中还有哪些地方用到物质的量浓度这种表达方式。
谢谢大家
