第41练 实验方案设计 课时作业(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第41练 实验方案设计 课时作业(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 335.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 21:18:39 | ||
图片预览



文档简介
第41练 实验方案设计
1. (2024·南通高三下模拟预测)补充完整用含铬污泥[含Cr(OH)3、Fe(OH)3及不溶于酸的杂质]制备CrCl3·6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,__________________________________________________________________________________________________________________________________________________________,抽滤,干燥,得到CrCl3·6H2O晶体。[已知:2CrCl3+3Fe+6H2O===2Cr(OH)3↓+3FeCl2+3H2↑。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
2.
(2024·南通中学高三下月考)实验室也可以制备FePO4,不同pH对磷酸铁沉淀的影响如图所示。补充完整由FeSO4·7H2O制备FePO4的实验步骤:取一定量的FeSO4·7H2O溶解于稍过量的H3PO4中,____________________________________________________________________________________________________________________________________________________________________________________________________________________。
(已知:铁氰化钾(K3[Fe(CN)6])溶液与Fe2+反应产生深蓝色沉淀,与Fe3+不反应。实验中须使用的试剂:20% H2O2溶液、K3[Fe(CN)6]溶液、NaOH溶液、蒸馏水)
3. 实验室用钛精矿酸浸废液(含FeCl2及少量Al3+、Ca2+和Mg2+)制备FeCl2·4H2O。
已知:①经测定,废液中c(FeCl2)=0.1 mol·L-1。有关金属离子沉淀的pH如表:
氢氧化物 Fe(OH)2 Al(OH)3 Ca(OH)2 Mg(OH)2
开始沉淀的pH 6.3 3.4 11.9 7.7
完全沉淀的pH 8.3 4.7 13.9 9.8
②Ksp(FeF2)=6.4×10-6、Ksp(CaF2)=1.6×10-10、Ksp(MgF2)=1.0×10-11;
③当溶液中离子浓度小于1.0×10-5 mol·L-1,可视为该离子已沉淀完全。
为获得较高纯度的FeCl2·4H2O,请补充实验方案:向钛精矿酸浸废液中加入改性聚丙烯酰胺吸附溶液中的胶体杂质,静置一段时间后加入活性炭,_______________________________________________________,冷却至15 ℃结晶,过滤,用乙醇洗涤晶体,低温真空烘干。(实验中须使用的试剂有:HCl气体、NaOH溶液、NaF溶液;除常用仪器外须使用的仪器有:pH传感器、F-浓度传感器)
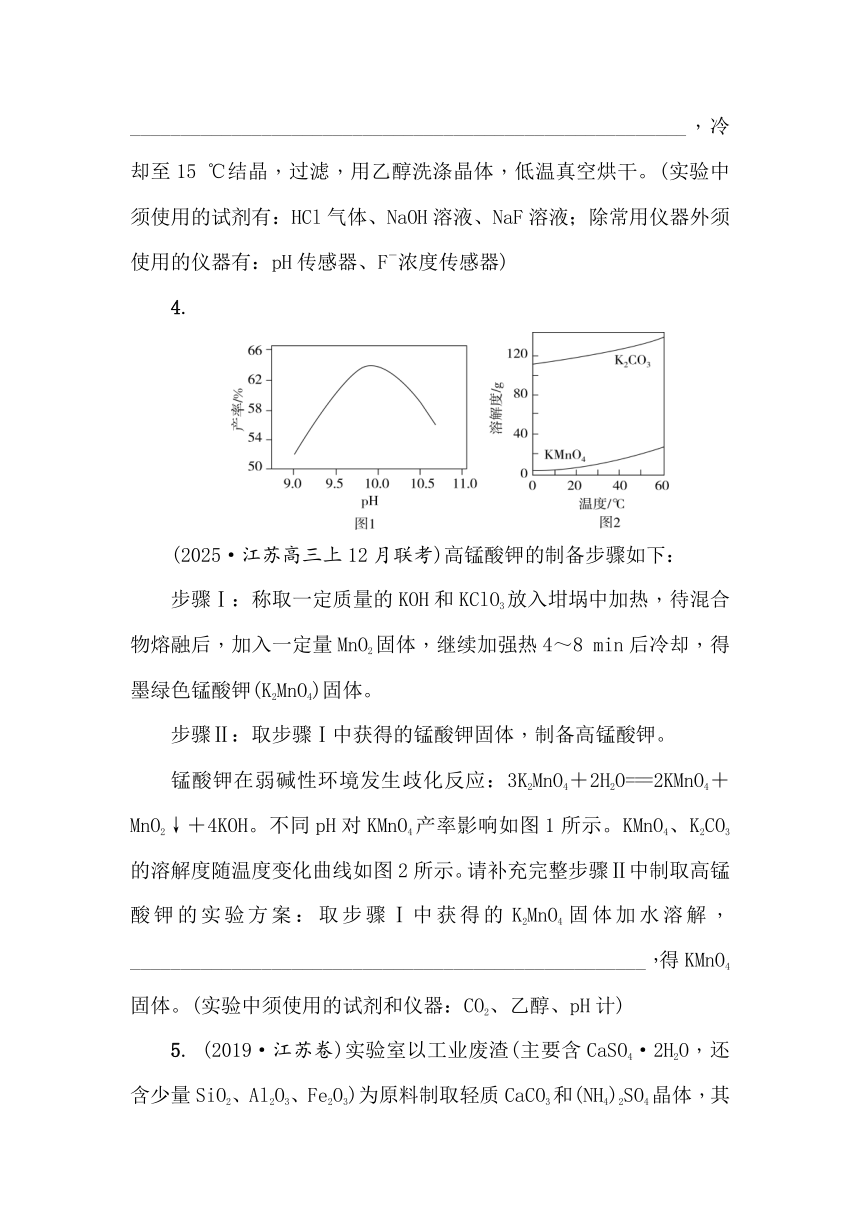
4.
(2025·江苏高三上12月联考)高锰酸钾的制备步骤如下:
步骤Ⅰ:称取一定质量的KOH和KClO3放入坩埚中加热,待混合物熔融后,加入一定量MnO2固体,继续加强热4~8 min后冷却,得墨绿色锰酸钾(K2MnO4)固体。
步骤Ⅱ:取步骤Ⅰ中获得的锰酸钾固体,制备高锰酸钾。
锰酸钾在弱碱性环境发生歧化反应:3K2MnO4+2H2O===2KMnO4+MnO2↓+4KOH。不同pH对KMnO4产率影响如图1所示。KMnO4、K2CO3的溶解度随温度变化曲线如图2所示。请补充完整步骤Ⅱ中制取高锰酸钾的实验方案:取步骤Ⅰ中获得的K2MnO4固体加水溶解,___________________________________________________,得KMnO4固体。(实验中须使用的试剂和仪器:CO2、乙醇、pH计)
5. (2019·江苏卷)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:_________________________________________________________________________[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
6. (2025·连云港中学高三下月考)CoO可用于制取催化剂,可以由含钴废料(主要成分为Co2O3,还含有少量SiO2、Fe2O3、Al2O3和MgO)经过如下过程进行制取:
已知:①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
Fe3+ Al3+ Fe2+ Co2+ Mg2+
开始沉淀pH 1.9 3.4 6.9 6.6 9.1
沉淀完全pH 3.2 4.7 8.9 9.2 11.1
补充完整由“浸取液”制取CoC2O4·2H2O的实验方案:取一定量的浸取液____________________________________________________________________________________________________________________________________________________________________________________________________________________,过滤,向滤液中滴加2 mol·L-1 (NH4)2C2O4溶液,……,得到CoC2O4·2H2O晶体(实验中须使用的试剂:2 mol·L-1的氨水、5%的H2O2溶液、K3[Fe(CN)6]溶液、1 mol·L-1的NH4F溶液)。
7. 将Fe2(SO4)3与Na2HPO4溶液混合可以得到FePO4·2H2O。设计以Fe2(SO4)3与Na2HPO4溶液为原料,补充完整制备FePO4·2H2O的实验方案:_________________________________________________________________,干燥得到FePO4·2H2O。[实验中必须使用的试剂:盐酸、BaCl2溶液,Fe(OH)3开始沉淀的pH=2.7]
8. (2025·灌南中学高三月考)实验室以废旧锂电池正极材料(含LiCoO2及少量Al、Fe等)为原料制备Co3O4。
“沉钴”时,也可先制得CoCO3再制备Co3O4。CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。为获得较高产率的Co3O4,请补充实验方案:取反萃取后得到的水相,_________________________________________________________________________。
(可选用的试剂:0.1 mol·L-1 NH4HCO3溶液、空气、0.1 mol·L-1 HCl溶液、0.1 mol·L-1 BaCl2溶液)
第41练 实验方案设计
1. 边搅拌边向滤液中分批加入铁粉至不再产生气体,充分反应后过滤,将所得滤渣用蒸馏水洗涤至最后一次洗涤滤液中加入硝酸酸化的硝酸银溶液不再产生沉淀;将滤渣加入过量盐酸中,加热浓缩至表面有晶膜,在室温下冷却结晶,过滤,所得晶体用乙醚洗涤2~3次
2. 向混合溶液中边搅拌边加入20%H2O2溶液,直至取少量溶液滴加K3[Fe(CN)6]溶液不出现深蓝色沉淀为止,然后加入NaOH溶液调节pH约为2.5,出现大量白色沉淀,过滤,用蒸馏水洗涤,干燥
解析:由FeSO4·7H2O制备FePO4,需加入20%H2O2溶液,将FeSO4转化为Fe2(SO4)3,检验Fe2+是否完全被氧化为Fe3+,然后加入NaOH溶液,调节pH=2.5,将生成的沉淀洗涤、干燥。
3. 搅拌后静置过滤,向滤液中边搅拌边滴加NaOH溶液,至pH传感器显示pH值在4.7~6.3之间,静置过滤,向滤液中边搅拌边滴加NaF溶液,至F-浓度传感器显示c(F-)在4×10-3~8×10-3 mol·L-1,过滤,将滤液在HCl气体氛围中蒸发浓缩
4. 向溶液中通入CO2气体,用pH计测定溶液的pH,当pH在10.0时停止通入气体,过滤,将滤液加热浓缩至表面出现晶膜,停止加热,冷却结晶,过滤,用乙醇洗涤2~3次,干燥
解析:取步骤Ⅰ中获得的K2MnO4固体加水溶解,向溶液中通入CO2气体,用pH计测定溶液的pH,当pH在10.0时停止通入气体,过滤,将滤液加热浓缩至表面出现晶膜,停止加热,冷却结晶,过滤,用乙醇洗涤2~3次,干燥,得KMnO4固体。
5. 在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
解析:工业废渣主要含CaSO4·2H2O,还含有少量SiO2、Al2O3和Fe2O3,加入(NH4)2CO3溶液浸取,其中CaSO4与(NH4)2CO3反应生成CaCO3和(NH4)2SO4,SiO2、Al2O3和Fe2O3都不反应,过滤后所得滤渣中含CaCO3、SiO2、Al2O3和Fe2O3;若以水洗后的滤渣为原料制取CaCl2溶液,根据题给试剂,首先要加入足量盐酸将CaCO3完全转化为CaCl2,发生的反应为CaCO3+2HCl===CaCl2+H2O+CO2↑,与此同时发生反应Al2O3+6HCl===2AlCl3+3H2O、Fe2O3+6HCl===2FeCl3+3H2O,SiO2不反应,经过滤除去SiO2;得到的滤液中含CaCl2、AlCl3、FeCl3,根据“pH=5时Fe(OH)3和Al(OH)3沉淀完全,pH=8.5时Al(OH)3开始溶解”,为了将滤液中Al3+、Fe3+完全除去,应加入Ca(OH)2调节溶液的pH介于5~8.5[加入Ca(OH)2的过程中要边加边测定溶液的pH],然后过滤即可制得CaCl2溶液。
6. 向其中边搅拌边加入5%的H2O2溶液,直至取少许溶液加入K3[Fe(CN)6]溶液,不出现蓝色沉淀时停止加入,再向其中滴加2 mol·L-1氨水,调pH在4.7~6.6之间,过滤,向滤液中滴加1 mol·L-1的NH4F溶液直至静置后向上层清液中再滴加NH4F溶液无沉淀产生
解析:溶液浸出后,溶液中含有的阳离子是Na+、H+、Co2+、Fe2+、Fe3+、Al3+和Mg2+,题中信息已知Fe3+、Al3+与F-可生成配合物难以沉淀,因此Fe3+、Al3+要以氢氧化物形式除去,观察各杂质离子的沉淀pH可知,Fe2+和Co2+在转化为氢氧化物过程中的pH有重叠的部分,因此要先将Fe2+氧化为Fe3+,而后调节pH后除去Fe3+、Al3+,再根据题中所给信息CoF2可溶于水而MgF2难溶于水,因此需要加入NH4F除去,步骤为:向其中边加入5%的H2O2溶液,直至取少许溶液加入K3[Fe(CN)6]溶液,不出现蓝色沉淀时停止加入,再向其中滴加2 mol·L-1氨水,调pH在4.7~6.6之间,过滤,向滤液中滴加1 mol·L-1的NH4F溶液直至静置后至上层清液中再滴加NH4F溶液无沉淀产生。
7. 在搅拌下向Fe2(SO4)3溶液中缓慢加入Na2HPO4溶液,控制溶液的pH<2.7,充分反应后,向上层清液中继续加入Na2HPO4溶液不再产生沉淀,静置后过滤,用蒸馏水洗涤沉淀2~3次,取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不再出现白色沉淀
8. 向其中加入过量的0.1 mol·L-1 NH4HCO3溶液,然后过滤,洗涤滤渣,用0.1 mol·L-1 BaCl2检验滤渣洗涤干净后,将滤渣加热至400~600 ℃左右,当固体质量不再改变时,得到Co3O4
1. (2024·南通高三下模拟预测)补充完整用含铬污泥[含Cr(OH)3、Fe(OH)3及不溶于酸的杂质]制备CrCl3·6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,__________________________________________________________________________________________________________________________________________________________,抽滤,干燥,得到CrCl3·6H2O晶体。[已知:2CrCl3+3Fe+6H2O===2Cr(OH)3↓+3FeCl2+3H2↑。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
2.
(2024·南通中学高三下月考)实验室也可以制备FePO4,不同pH对磷酸铁沉淀的影响如图所示。补充完整由FeSO4·7H2O制备FePO4的实验步骤:取一定量的FeSO4·7H2O溶解于稍过量的H3PO4中,____________________________________________________________________________________________________________________________________________________________________________________________________________________。
(已知:铁氰化钾(K3[Fe(CN)6])溶液与Fe2+反应产生深蓝色沉淀,与Fe3+不反应。实验中须使用的试剂:20% H2O2溶液、K3[Fe(CN)6]溶液、NaOH溶液、蒸馏水)
3. 实验室用钛精矿酸浸废液(含FeCl2及少量Al3+、Ca2+和Mg2+)制备FeCl2·4H2O。
已知:①经测定,废液中c(FeCl2)=0.1 mol·L-1。有关金属离子沉淀的pH如表:
氢氧化物 Fe(OH)2 Al(OH)3 Ca(OH)2 Mg(OH)2
开始沉淀的pH 6.3 3.4 11.9 7.7
完全沉淀的pH 8.3 4.7 13.9 9.8
②Ksp(FeF2)=6.4×10-6、Ksp(CaF2)=1.6×10-10、Ksp(MgF2)=1.0×10-11;
③当溶液中离子浓度小于1.0×10-5 mol·L-1,可视为该离子已沉淀完全。
为获得较高纯度的FeCl2·4H2O,请补充实验方案:向钛精矿酸浸废液中加入改性聚丙烯酰胺吸附溶液中的胶体杂质,静置一段时间后加入活性炭,_______________________________________________________,冷却至15 ℃结晶,过滤,用乙醇洗涤晶体,低温真空烘干。(实验中须使用的试剂有:HCl气体、NaOH溶液、NaF溶液;除常用仪器外须使用的仪器有:pH传感器、F-浓度传感器)
4.
(2025·江苏高三上12月联考)高锰酸钾的制备步骤如下:
步骤Ⅰ:称取一定质量的KOH和KClO3放入坩埚中加热,待混合物熔融后,加入一定量MnO2固体,继续加强热4~8 min后冷却,得墨绿色锰酸钾(K2MnO4)固体。
步骤Ⅱ:取步骤Ⅰ中获得的锰酸钾固体,制备高锰酸钾。
锰酸钾在弱碱性环境发生歧化反应:3K2MnO4+2H2O===2KMnO4+MnO2↓+4KOH。不同pH对KMnO4产率影响如图1所示。KMnO4、K2CO3的溶解度随温度变化曲线如图2所示。请补充完整步骤Ⅱ中制取高锰酸钾的实验方案:取步骤Ⅰ中获得的K2MnO4固体加水溶解,___________________________________________________,得KMnO4固体。(实验中须使用的试剂和仪器:CO2、乙醇、pH计)
5. (2019·江苏卷)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:_________________________________________________________________________[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
6. (2025·连云港中学高三下月考)CoO可用于制取催化剂,可以由含钴废料(主要成分为Co2O3,还含有少量SiO2、Fe2O3、Al2O3和MgO)经过如下过程进行制取:
已知:①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
Fe3+ Al3+ Fe2+ Co2+ Mg2+
开始沉淀pH 1.9 3.4 6.9 6.6 9.1
沉淀完全pH 3.2 4.7 8.9 9.2 11.1
补充完整由“浸取液”制取CoC2O4·2H2O的实验方案:取一定量的浸取液____________________________________________________________________________________________________________________________________________________________________________________________________________________,过滤,向滤液中滴加2 mol·L-1 (NH4)2C2O4溶液,……,得到CoC2O4·2H2O晶体(实验中须使用的试剂:2 mol·L-1的氨水、5%的H2O2溶液、K3[Fe(CN)6]溶液、1 mol·L-1的NH4F溶液)。
7. 将Fe2(SO4)3与Na2HPO4溶液混合可以得到FePO4·2H2O。设计以Fe2(SO4)3与Na2HPO4溶液为原料,补充完整制备FePO4·2H2O的实验方案:_________________________________________________________________,干燥得到FePO4·2H2O。[实验中必须使用的试剂:盐酸、BaCl2溶液,Fe(OH)3开始沉淀的pH=2.7]
8. (2025·灌南中学高三月考)实验室以废旧锂电池正极材料(含LiCoO2及少量Al、Fe等)为原料制备Co3O4。
“沉钴”时,也可先制得CoCO3再制备Co3O4。CoCO3在空气中受热分解,测得剩余固体的质量与起始CoCO3的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。为获得较高产率的Co3O4,请补充实验方案:取反萃取后得到的水相,_________________________________________________________________________。
(可选用的试剂:0.1 mol·L-1 NH4HCO3溶液、空气、0.1 mol·L-1 HCl溶液、0.1 mol·L-1 BaCl2溶液)
第41练 实验方案设计
1. 边搅拌边向滤液中分批加入铁粉至不再产生气体,充分反应后过滤,将所得滤渣用蒸馏水洗涤至最后一次洗涤滤液中加入硝酸酸化的硝酸银溶液不再产生沉淀;将滤渣加入过量盐酸中,加热浓缩至表面有晶膜,在室温下冷却结晶,过滤,所得晶体用乙醚洗涤2~3次
2. 向混合溶液中边搅拌边加入20%H2O2溶液,直至取少量溶液滴加K3[Fe(CN)6]溶液不出现深蓝色沉淀为止,然后加入NaOH溶液调节pH约为2.5,出现大量白色沉淀,过滤,用蒸馏水洗涤,干燥
解析:由FeSO4·7H2O制备FePO4,需加入20%H2O2溶液,将FeSO4转化为Fe2(SO4)3,检验Fe2+是否完全被氧化为Fe3+,然后加入NaOH溶液,调节pH=2.5,将生成的沉淀洗涤、干燥。
3. 搅拌后静置过滤,向滤液中边搅拌边滴加NaOH溶液,至pH传感器显示pH值在4.7~6.3之间,静置过滤,向滤液中边搅拌边滴加NaF溶液,至F-浓度传感器显示c(F-)在4×10-3~8×10-3 mol·L-1,过滤,将滤液在HCl气体氛围中蒸发浓缩
4. 向溶液中通入CO2气体,用pH计测定溶液的pH,当pH在10.0时停止通入气体,过滤,将滤液加热浓缩至表面出现晶膜,停止加热,冷却结晶,过滤,用乙醇洗涤2~3次,干燥
解析:取步骤Ⅰ中获得的K2MnO4固体加水溶解,向溶液中通入CO2气体,用pH计测定溶液的pH,当pH在10.0时停止通入气体,过滤,将滤液加热浓缩至表面出现晶膜,停止加热,冷却结晶,过滤,用乙醇洗涤2~3次,干燥,得KMnO4固体。
5. 在搅拌下向足量稀盐酸中分批加入滤渣,待观察不到气泡产生后,过滤,向滤液中分批加入少量Ca(OH)2,用pH试纸测量溶液pH,当pH介于5~8.5时,过滤
解析:工业废渣主要含CaSO4·2H2O,还含有少量SiO2、Al2O3和Fe2O3,加入(NH4)2CO3溶液浸取,其中CaSO4与(NH4)2CO3反应生成CaCO3和(NH4)2SO4,SiO2、Al2O3和Fe2O3都不反应,过滤后所得滤渣中含CaCO3、SiO2、Al2O3和Fe2O3;若以水洗后的滤渣为原料制取CaCl2溶液,根据题给试剂,首先要加入足量盐酸将CaCO3完全转化为CaCl2,发生的反应为CaCO3+2HCl===CaCl2+H2O+CO2↑,与此同时发生反应Al2O3+6HCl===2AlCl3+3H2O、Fe2O3+6HCl===2FeCl3+3H2O,SiO2不反应,经过滤除去SiO2;得到的滤液中含CaCl2、AlCl3、FeCl3,根据“pH=5时Fe(OH)3和Al(OH)3沉淀完全,pH=8.5时Al(OH)3开始溶解”,为了将滤液中Al3+、Fe3+完全除去,应加入Ca(OH)2调节溶液的pH介于5~8.5[加入Ca(OH)2的过程中要边加边测定溶液的pH],然后过滤即可制得CaCl2溶液。
6. 向其中边搅拌边加入5%的H2O2溶液,直至取少许溶液加入K3[Fe(CN)6]溶液,不出现蓝色沉淀时停止加入,再向其中滴加2 mol·L-1氨水,调pH在4.7~6.6之间,过滤,向滤液中滴加1 mol·L-1的NH4F溶液直至静置后向上层清液中再滴加NH4F溶液无沉淀产生
解析:溶液浸出后,溶液中含有的阳离子是Na+、H+、Co2+、Fe2+、Fe3+、Al3+和Mg2+,题中信息已知Fe3+、Al3+与F-可生成配合物难以沉淀,因此Fe3+、Al3+要以氢氧化物形式除去,观察各杂质离子的沉淀pH可知,Fe2+和Co2+在转化为氢氧化物过程中的pH有重叠的部分,因此要先将Fe2+氧化为Fe3+,而后调节pH后除去Fe3+、Al3+,再根据题中所给信息CoF2可溶于水而MgF2难溶于水,因此需要加入NH4F除去,步骤为:向其中边加入5%的H2O2溶液,直至取少许溶液加入K3[Fe(CN)6]溶液,不出现蓝色沉淀时停止加入,再向其中滴加2 mol·L-1氨水,调pH在4.7~6.6之间,过滤,向滤液中滴加1 mol·L-1的NH4F溶液直至静置后至上层清液中再滴加NH4F溶液无沉淀产生。
7. 在搅拌下向Fe2(SO4)3溶液中缓慢加入Na2HPO4溶液,控制溶液的pH<2.7,充分反应后,向上层清液中继续加入Na2HPO4溶液不再产生沉淀,静置后过滤,用蒸馏水洗涤沉淀2~3次,取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不再出现白色沉淀
8. 向其中加入过量的0.1 mol·L-1 NH4HCO3溶液,然后过滤,洗涤滤渣,用0.1 mol·L-1 BaCl2检验滤渣洗涤干净后,将滤渣加热至400~600 ℃左右,当固体质量不再改变时,得到Co3O4
同课章节目录
