第46练 原电池综合应用 课时作业 (含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第46练 原电池综合应用 课时作业 (含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 712.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 22:19:43 | ||
图片预览



文档简介
第46练 原电池综合应用
一、 单项选择题
1. (2025·南通中学高三月考)盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是( )
A. 电池工作时,Pt电极是正极
B. 图2中,A为H+和e-,B为NH3OH+
C. 电池工作时,每消耗2.24 L NO(标准状况下),左室溶液质量增加3.3 g
D. 电池工作一段时间后,正、负极区溶液的pH均下降
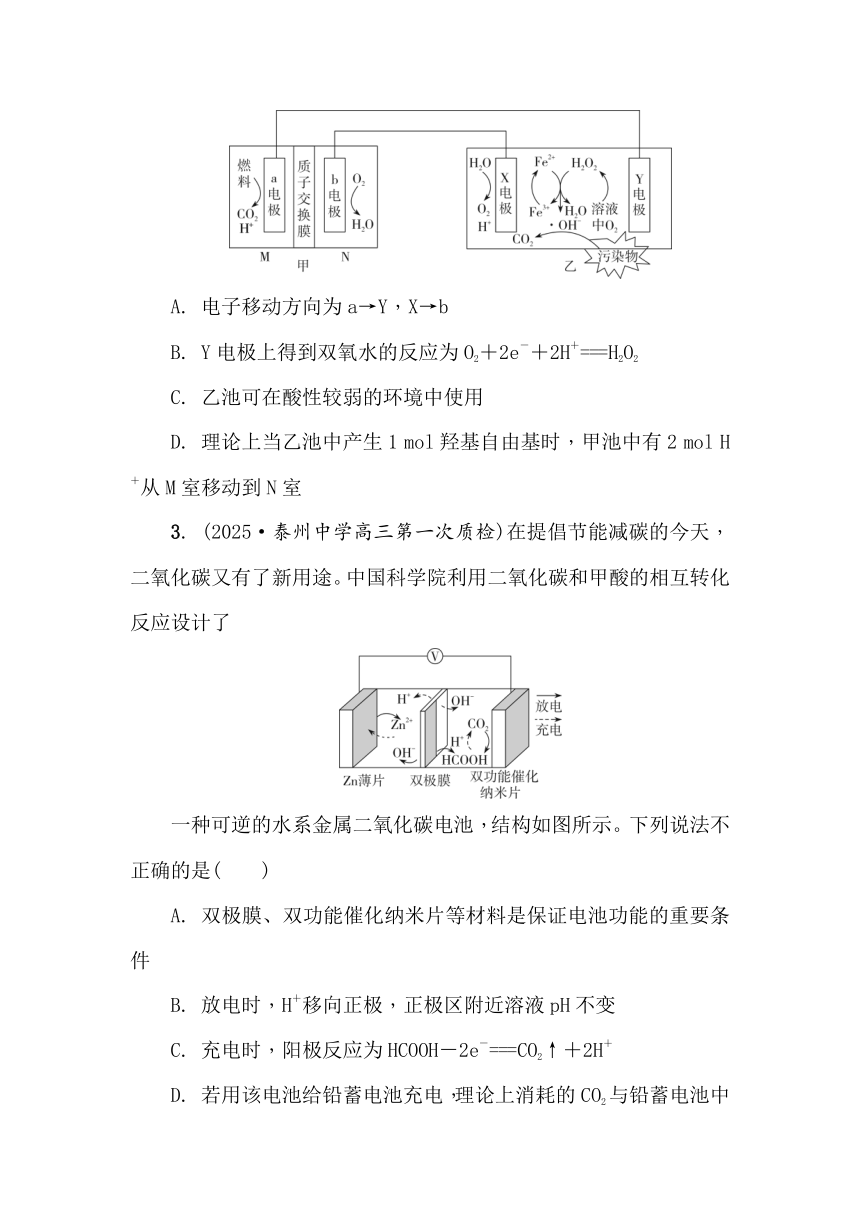
2. (2024·前黄中学高三上月考)MFC—电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如图,下列说法不正确的是 ( )
A. 电子移动方向为a→Y,X→b
B. Y电极上得到双氧水的反应为O2+2e-+2H+===H2O2
C. 乙池可在酸性较弱的环境中使用
D. 理论上当乙池中产生1 mol羟基自由基时,甲池中有2 mol H+从M室移动到N室
3. (2025·泰州中学高三第一次质检)在提倡节能减碳的今天,二氧化碳又有了新用途。中国科学院利用二氧化碳和甲酸的相互转化反应设计了
一种可逆的水系金属二氧化碳电池,结构如图所示。下列说法不正确的是( )
A. 双极膜、双功能催化纳米片等材料是保证电池功能的重要条件
B. 放电时,H+移向正极,正极区附近溶液pH不变
C. 充电时,阳极反应为HCOOH-2e-===CO2↑+2H+
D. 若用该电池给铅蓄电池充电,理论上消耗的CO2与铅蓄电池中产生的H2SO4物质的量之比为1∶2
4. Mg—H2O2电池可用于驱动无人驾收的潜航器。该电池以海水为电解质资液,示意图如图,该电池工作时,下列说法不正确的是( )
A. Mg电极是该电池的负极
B. 溶液中Cl-向正极移动
C. 石墨电极附近溶液的pH增大
D. 若在石墨电极区加入一定量盐酸,则发生的电极反应式为:2H++H2O2+2e-===2H2O
5. 硼化钒(VB2)—空气电池是目前储电能力最高的电池,工作原理如图所示,该电池工作时反应为:4VB2+11O2===4B2O3+2V2O5。下列说法不正确的是( )
A. 电极a发生还原反应
B. 电流由电极a经负载流向VB2极
C. VB2极发生的电极反应为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O
D. 图中选择性透过膜允许阳离子选择性透过
6.
微生物脱盐池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以氯化钠溶液模拟海水,采用情性电极,用下图的装置处理有机废水(以含CH3COO-的溶液为例),下列说法正确的是( )
A. 负极的电极反应:CH3COO-+2H2O-8e-===2CO2↑+7H+
B. 该电池可在高温环境下工作
C. 每消耗2.24 L(标准状况)的空气,有0.4 mol电子转移
D. Y为阴离子选择性交换膜
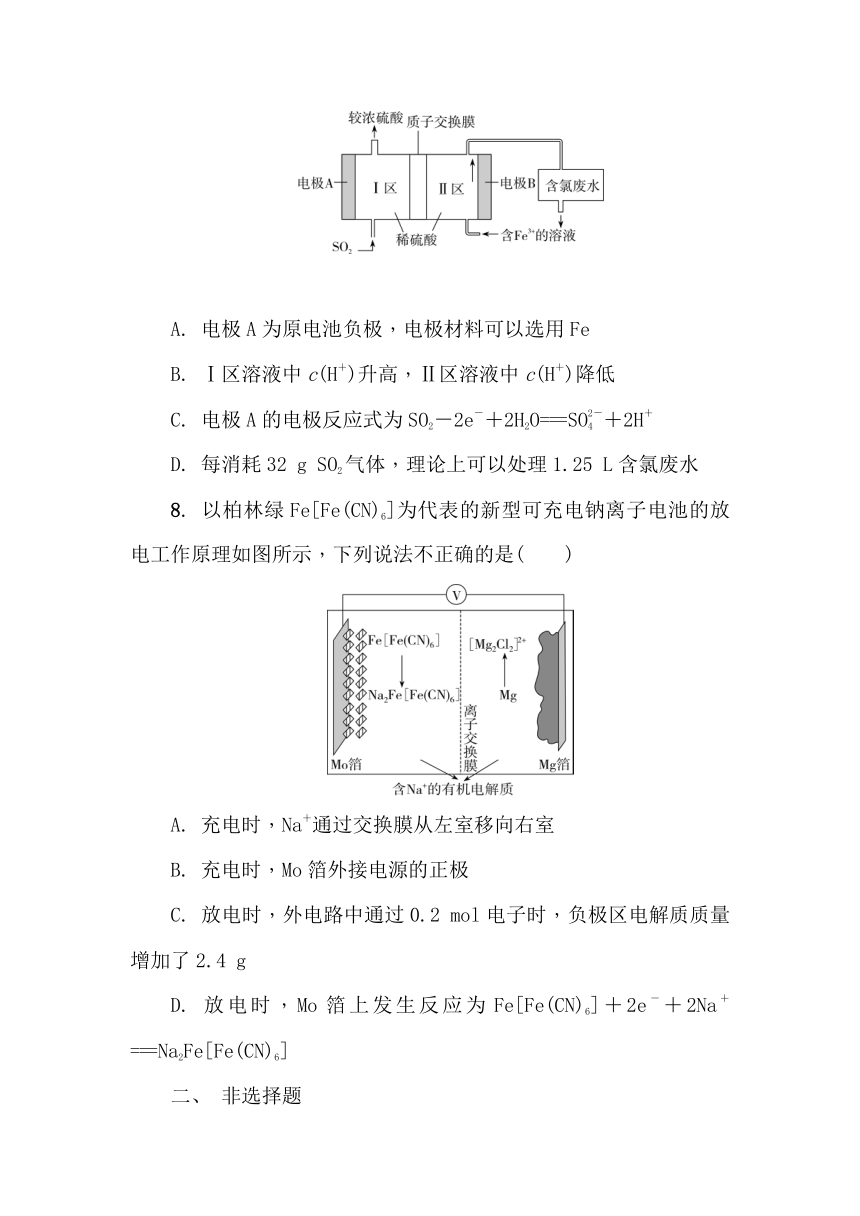
7. (2025·响水中学高三月考)某科研小组设计如图所示的原电池装置制取硫酸并处理含氯废水[c(ClO)=0.2 mol·L-1]。下列有关说法正确的是( )
A. 电极A为原电池负极,电极材料可以选用Fe
B. Ⅰ区溶液中c(H+)升高,Ⅱ区溶液中c(H+)降低
C. 电极A的电极反应式为SO2-2e-+2H2O===SO+2H+
D. 每消耗32 g SO2气体,理论上可以处理1.25 L含氯废水
8. 以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池的放电工作原理如图所示,下列说法不正确的是( )
A. 充电时,Na+通过交换膜从左室移向右室
B. 充电时,Mo箔外接电源的正极
C. 放电时,外电路中通过0.2 mol电子时,负极区电解质质量增加了2.4 g
D. 放电时,Mo箔上发生反应为Fe[Fe(CN)6]+2e-+2Na+===Na2Fe[Fe(CN)6]
二、 非选择题
9. (1)(2024·兴化高三模拟预测)含硫废渣(硫元素的主要存在形式为FeS2),可以回收处理并加以利用。沉积物—微生物酸性燃料电池工作原理如图所示。
碳棒b处S生成SO的电极反应式为______________________________________________。
(2)水体中的过量的硝态氮(主要以NO的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。相同条件下,向含有50 mg·L-1 NO的两份水样中分别加入纳米铁粉、纳米铁粉—活性炭—铜粉,水样中NO的去除速率差异如图所示,产生该差异的可能原因有____________________________________________。
(3)实验室利用铁基催化剂进行电催化硝酸盐还原合成氨的装置如图1所示。电解时,NO先吸附到催化剂表面放电产生NH。控制其他条件不变,NH的产率和法拉第效率(FE%)随pH变化如图2所示。FE%=×100%。其中,QX=F,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①写出电解生成NH的电极反应式__________________________________________________。
②pH从5变化到3时,NH的产率逐渐减小的原因可能为_____________________________________________。
第46练 原电池综合应用
1. C 解析:由图可知,Pt电极上H2―→H+,失去电子发生氧化反应,做负极,电极反应式:H2-2e-===2H+;含铁的催化电极为正极,其电极反应为:NO+3e-+4H++Cl-===NH3OHCl;Fe电极NO―→NH3OHCl,N元素化合价降低,做正极,Pt电极H2―→H+,H元素化合价升高,做负极,故A错误;根据题意可知,NH2OH具有类似NH3的弱碱性,可以和盐酸反应生成盐酸羟胺,所以缺少的一步为反应为:NH2OH+H+===NH3OH+,图2中,A为H+,B为NH3OH+,故B错误;含铁的催化电极为正极,其电极反应为:NO+3e-+4H++Cl-===NH3OHCl,4个氢离子中有1个是左侧溶液中HCl提供的,3个是右侧溶液迁移过来的;标况下消耗2.24 L NO的物质的量n===0.1 mol,则左室增加的质量为0.1 mol NO和0.3 mol H+的质量,即增加质量为3.3 g,故C正确;负极电极反应式:H2-2e-===2H+,H+浓度增大pH值减小,正极电极反应为:NO+3e-+4H++Cl-===NH3OHCl,正极区H+浓度减小,pH增大,故D错误。故选C。
2. C 解析:根据电极上的反应可知,甲为燃料电池,通入燃料的a电极为负极,通入氧气的b电极为正极,则乙为电解池,X电极为阳极,Y为阴极。串联装置中,电子由原电池负极流向电解池阴极,即a→Y,由电解池的阳极流向原电池正极,即X→b,A正确;据图可知溶液中O2在Y电极上得电子生成H2O2,根据电子守恒、元素守恒可得电极反应式为O2+2e-+2H+===H2O2,B正确;酸性较弱的环境中,Fe3+容易生成沉淀,无法正常工作,C错误;乙池中生成羟基自由基的反应为Fe2++H2O2===Fe3++OH-+·OH,所以产生1 mol羟基自由基时,消耗1 mol H2O2,根据电极反应可知转移2 mol电子,根据电荷守恒可知,甲池中有2 mol H+从M室(负极)移动到N室(正极),D正确;综上所述答案为C。
3. B 解析:放电时,锌薄片做负极,双功能催化纳米片做正极;充电时,锌薄片做阴极,双功能催化纳米片做阳极。双极膜、双功能催化纳米片等材料做正极,是保证电池功能的重要条件,A正确;放电时,H+移向正极,与二氧化碳反应生成甲酸,正极区附近溶液pH增加,B错误;充电时,甲酸在阳极失去电子生成二氧化碳,阳极反应为HCOOH-2e-===CO2↑+2H+,C正确;理论上,该电池放电时消耗1 mol CO2转移电子2 mol,对应铅蓄电池中转移电子2 mol产生的2 mol H2SO4,则用该电池给铅蓄电池充电,理论上消耗的CO2与铅蓄电池中产生的H2SO4物质的量之比为1∶2,D正确。故选B。
4. B 解析:组成的原电池的负极被氧化,镁为负极,A正确;原电池中溶液中的阴离子移动到负极,B错误;双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,电极反应为,H2O2+2e-===2OH-,故溶液pH值增大,C正确;加入盐酸,溶液中的H+移动到正极即石墨一极发生还原反应,2H++H2O2+2e-===2H2O,D正确。故选B。
5. D 解析:由图可知,空气通入电极a,则电极a为正极,发生还原反应,反应式为O2+2H2O+4e-===4OH-;硼化钒电极发生氧化反应,总反应式为4VB2+11O2===4B2O3+2V2O5,总反应式减去正极反应式得到负极反应式,负极反应方程式为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O。根据分析可知,电极a为正极,发生还原反应,A项正确;电流由正极到负极,即由电极a经过负载流向VB2极,B项正确;根据分析可知,VB2极的电极方程式为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O,C项正确;图中选择性透过膜允许阴离子选择性透过,D项错误。故选D。
6. A 解析:负极上CH3COO-失电子发生氧化反应生成二氧化碳,同时生成氢离子,电极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,A正确;该装置为微生物脱盐电池,温度过高会导致微生物死亡,海水淡化效果变差,B错误;标况下2.24 L空气中含有n(O2)=×20%=0.02 mol,每消耗1 mol氧气转移4 mol电子,据此计算消耗0.02 mol氧气转移电子物质的量=0.02 mol×4=0.08 mol,C错误;负极区生成氢离子,需要氯离子;正极区消耗氢离子,需要钠离子,所以Y是阳离子交换膜,D错误。故选A。
7. D 解析:SO2在负极上失去电子生成较浓硫酸,则电极A为原电池负极,Fe作负极时,Fe会失去电子,电极材料不可以选用Fe,A错误;电极A区,SO2失去电子生成较浓硫酸,溶液中c(H+)升高,电极B区:Fe3++e-===Fe2+,Ⅰ区溶液中的部分H+穿过质子交换膜进入Ⅱ区,Ⅱ区溶液中c(H+)也升高,B错误;电荷、原子均不守恒,C错误;每消耗32 g(即0.5 mol)SO2气体,转移电子的物质的量为1 mol,由得失电子守恒知,电极B(Fe3++e-===Fe2+)产生1 mol Fe2+,由反应:4Fe2++ClO+4H+===4Fe3++Cl-+2H2O知,1 mol Fe2+可以反应0.25 mol ClO,理论上可以处理=1.25 L含氯废水,D正确。
8. C 解析:由图可知,放电时右侧Mg→[Mg2Cl2]2+,电极镁失去电子发生氧化反应,为原电池负极,电极反应式为2Mg-4e-+2Cl-===[Mg2Cl2]2+,则左侧为原电池的正极,电极反应式为Fe[Fe(CN)6]+2e-+2Na+===Na2Fe[Fe(CN)6]。充电时该装置作电解池,左侧为阳极,右侧为阴极,则Na+通过交换膜从左室移向右室,A正确;据分析可知,放电时,Mo箔为电池的正极,则充电时,Mo箔外接电源的正极,B正确;放电时,外电路中通过0.2 mol电子时,由负极的反应可知,会消耗0.1 mol镁进入电解质溶液,质量增加2.4 g,同时会有0.2 mol Na+通过离子交换膜向正极移动,质量减少4.6 g,故负极区电解质质量减少2.2 g,C错误;由分析可知,放电时,Mo箔是正极,反应为Fe[Fe(CN)6]+2e-+2Na+===Na2Fe[Fe(CN)6],D正确。故选C。
9. (1)S-6e-+4H2O===SO+8H+
(2)形成Fe—Cu和Fe—C原电池,加快纳米铁粉去除NO的反应速率;炭粉有强吸附性,可以吸附NO
(3)①NO+8e-+10H+===NH+3H2O ②溶液中H+浓度增大,H+更多地得到电子生成H2,NO得到电子产生NH的量减少,NH的产率逐渐减小
解析:(1)根据光合菌产生的O2得电子结合H+得到H2O,碳棒a为正极,FeS2在硫氧化菌的作用下被氧化为S,S在硫氧化菌的作用下被氧化为硫酸根,碳棒b为负极,存在电极反应:S-6e-+4H2O===SO+8H+。
(2)根据图示可知:在含有NO的浓度50 mg·L-1的溶液中加入纳米铁粉、纳米铁粉—活性炭—铜粉,纳米铁粉还原反应速率相对较快,原因是加入纳米铁粉—活性炭—铜粉的形成Fe—Cu和Fe—C原电池,加快纳米铁粉去除NO的反应速率;炭粉有强吸附性,可以吸附NO;
(3)①电解时,NO先吸附到催化剂表面放电产生NH,氮元素化合价降低,得电子发生还原反应,电极反应式为NO+8e-+10H+===NH+3H2O;②pH从5变化到3时,酸性增强,溶液中H+浓度增大,H+得电子生成氢气,造成硝酸根离子得电子产生铵根离子的量减少。
一、 单项选择题
1. (2025·南通中学高三月考)盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是( )
A. 电池工作时,Pt电极是正极
B. 图2中,A为H+和e-,B为NH3OH+
C. 电池工作时,每消耗2.24 L NO(标准状况下),左室溶液质量增加3.3 g
D. 电池工作一段时间后,正、负极区溶液的pH均下降
2. (2024·前黄中学高三上月考)MFC—电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如图,下列说法不正确的是 ( )
A. 电子移动方向为a→Y,X→b
B. Y电极上得到双氧水的反应为O2+2e-+2H+===H2O2
C. 乙池可在酸性较弱的环境中使用
D. 理论上当乙池中产生1 mol羟基自由基时,甲池中有2 mol H+从M室移动到N室
3. (2025·泰州中学高三第一次质检)在提倡节能减碳的今天,二氧化碳又有了新用途。中国科学院利用二氧化碳和甲酸的相互转化反应设计了
一种可逆的水系金属二氧化碳电池,结构如图所示。下列说法不正确的是( )
A. 双极膜、双功能催化纳米片等材料是保证电池功能的重要条件
B. 放电时,H+移向正极,正极区附近溶液pH不变
C. 充电时,阳极反应为HCOOH-2e-===CO2↑+2H+
D. 若用该电池给铅蓄电池充电,理论上消耗的CO2与铅蓄电池中产生的H2SO4物质的量之比为1∶2
4. Mg—H2O2电池可用于驱动无人驾收的潜航器。该电池以海水为电解质资液,示意图如图,该电池工作时,下列说法不正确的是( )
A. Mg电极是该电池的负极
B. 溶液中Cl-向正极移动
C. 石墨电极附近溶液的pH增大
D. 若在石墨电极区加入一定量盐酸,则发生的电极反应式为:2H++H2O2+2e-===2H2O
5. 硼化钒(VB2)—空气电池是目前储电能力最高的电池,工作原理如图所示,该电池工作时反应为:4VB2+11O2===4B2O3+2V2O5。下列说法不正确的是( )
A. 电极a发生还原反应
B. 电流由电极a经负载流向VB2极
C. VB2极发生的电极反应为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O
D. 图中选择性透过膜允许阳离子选择性透过
6.
微生物脱盐池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以氯化钠溶液模拟海水,采用情性电极,用下图的装置处理有机废水(以含CH3COO-的溶液为例),下列说法正确的是( )
A. 负极的电极反应:CH3COO-+2H2O-8e-===2CO2↑+7H+
B. 该电池可在高温环境下工作
C. 每消耗2.24 L(标准状况)的空气,有0.4 mol电子转移
D. Y为阴离子选择性交换膜
7. (2025·响水中学高三月考)某科研小组设计如图所示的原电池装置制取硫酸并处理含氯废水[c(ClO)=0.2 mol·L-1]。下列有关说法正确的是( )
A. 电极A为原电池负极,电极材料可以选用Fe
B. Ⅰ区溶液中c(H+)升高,Ⅱ区溶液中c(H+)降低
C. 电极A的电极反应式为SO2-2e-+2H2O===SO+2H+
D. 每消耗32 g SO2气体,理论上可以处理1.25 L含氯废水
8. 以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池的放电工作原理如图所示,下列说法不正确的是( )
A. 充电时,Na+通过交换膜从左室移向右室
B. 充电时,Mo箔外接电源的正极
C. 放电时,外电路中通过0.2 mol电子时,负极区电解质质量增加了2.4 g
D. 放电时,Mo箔上发生反应为Fe[Fe(CN)6]+2e-+2Na+===Na2Fe[Fe(CN)6]
二、 非选择题
9. (1)(2024·兴化高三模拟预测)含硫废渣(硫元素的主要存在形式为FeS2),可以回收处理并加以利用。沉积物—微生物酸性燃料电池工作原理如图所示。
碳棒b处S生成SO的电极反应式为______________________________________________。
(2)水体中的过量的硝态氮(主要以NO的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。相同条件下,向含有50 mg·L-1 NO的两份水样中分别加入纳米铁粉、纳米铁粉—活性炭—铜粉,水样中NO的去除速率差异如图所示,产生该差异的可能原因有____________________________________________。
(3)实验室利用铁基催化剂进行电催化硝酸盐还原合成氨的装置如图1所示。电解时,NO先吸附到催化剂表面放电产生NH。控制其他条件不变,NH的产率和法拉第效率(FE%)随pH变化如图2所示。FE%=×100%。其中,QX=F,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①写出电解生成NH的电极反应式__________________________________________________。
②pH从5变化到3时,NH的产率逐渐减小的原因可能为_____________________________________________。
第46练 原电池综合应用
1. C 解析:由图可知,Pt电极上H2―→H+,失去电子发生氧化反应,做负极,电极反应式:H2-2e-===2H+;含铁的催化电极为正极,其电极反应为:NO+3e-+4H++Cl-===NH3OHCl;Fe电极NO―→NH3OHCl,N元素化合价降低,做正极,Pt电极H2―→H+,H元素化合价升高,做负极,故A错误;根据题意可知,NH2OH具有类似NH3的弱碱性,可以和盐酸反应生成盐酸羟胺,所以缺少的一步为反应为:NH2OH+H+===NH3OH+,图2中,A为H+,B为NH3OH+,故B错误;含铁的催化电极为正极,其电极反应为:NO+3e-+4H++Cl-===NH3OHCl,4个氢离子中有1个是左侧溶液中HCl提供的,3个是右侧溶液迁移过来的;标况下消耗2.24 L NO的物质的量n===0.1 mol,则左室增加的质量为0.1 mol NO和0.3 mol H+的质量,即增加质量为3.3 g,故C正确;负极电极反应式:H2-2e-===2H+,H+浓度增大pH值减小,正极电极反应为:NO+3e-+4H++Cl-===NH3OHCl,正极区H+浓度减小,pH增大,故D错误。故选C。
2. C 解析:根据电极上的反应可知,甲为燃料电池,通入燃料的a电极为负极,通入氧气的b电极为正极,则乙为电解池,X电极为阳极,Y为阴极。串联装置中,电子由原电池负极流向电解池阴极,即a→Y,由电解池的阳极流向原电池正极,即X→b,A正确;据图可知溶液中O2在Y电极上得电子生成H2O2,根据电子守恒、元素守恒可得电极反应式为O2+2e-+2H+===H2O2,B正确;酸性较弱的环境中,Fe3+容易生成沉淀,无法正常工作,C错误;乙池中生成羟基自由基的反应为Fe2++H2O2===Fe3++OH-+·OH,所以产生1 mol羟基自由基时,消耗1 mol H2O2,根据电极反应可知转移2 mol电子,根据电荷守恒可知,甲池中有2 mol H+从M室(负极)移动到N室(正极),D正确;综上所述答案为C。
3. B 解析:放电时,锌薄片做负极,双功能催化纳米片做正极;充电时,锌薄片做阴极,双功能催化纳米片做阳极。双极膜、双功能催化纳米片等材料做正极,是保证电池功能的重要条件,A正确;放电时,H+移向正极,与二氧化碳反应生成甲酸,正极区附近溶液pH增加,B错误;充电时,甲酸在阳极失去电子生成二氧化碳,阳极反应为HCOOH-2e-===CO2↑+2H+,C正确;理论上,该电池放电时消耗1 mol CO2转移电子2 mol,对应铅蓄电池中转移电子2 mol产生的2 mol H2SO4,则用该电池给铅蓄电池充电,理论上消耗的CO2与铅蓄电池中产生的H2SO4物质的量之比为1∶2,D正确。故选B。
4. B 解析:组成的原电池的负极被氧化,镁为负极,A正确;原电池中溶液中的阴离子移动到负极,B错误;双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,电极反应为,H2O2+2e-===2OH-,故溶液pH值增大,C正确;加入盐酸,溶液中的H+移动到正极即石墨一极发生还原反应,2H++H2O2+2e-===2H2O,D正确。故选B。
5. D 解析:由图可知,空气通入电极a,则电极a为正极,发生还原反应,反应式为O2+2H2O+4e-===4OH-;硼化钒电极发生氧化反应,总反应式为4VB2+11O2===4B2O3+2V2O5,总反应式减去正极反应式得到负极反应式,负极反应方程式为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O。根据分析可知,电极a为正极,发生还原反应,A项正确;电流由正极到负极,即由电极a经过负载流向VB2极,B项正确;根据分析可知,VB2极的电极方程式为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O,C项正确;图中选择性透过膜允许阴离子选择性透过,D项错误。故选D。
6. A 解析:负极上CH3COO-失电子发生氧化反应生成二氧化碳,同时生成氢离子,电极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,A正确;该装置为微生物脱盐电池,温度过高会导致微生物死亡,海水淡化效果变差,B错误;标况下2.24 L空气中含有n(O2)=×20%=0.02 mol,每消耗1 mol氧气转移4 mol电子,据此计算消耗0.02 mol氧气转移电子物质的量=0.02 mol×4=0.08 mol,C错误;负极区生成氢离子,需要氯离子;正极区消耗氢离子,需要钠离子,所以Y是阳离子交换膜,D错误。故选A。
7. D 解析:SO2在负极上失去电子生成较浓硫酸,则电极A为原电池负极,Fe作负极时,Fe会失去电子,电极材料不可以选用Fe,A错误;电极A区,SO2失去电子生成较浓硫酸,溶液中c(H+)升高,电极B区:Fe3++e-===Fe2+,Ⅰ区溶液中的部分H+穿过质子交换膜进入Ⅱ区,Ⅱ区溶液中c(H+)也升高,B错误;电荷、原子均不守恒,C错误;每消耗32 g(即0.5 mol)SO2气体,转移电子的物质的量为1 mol,由得失电子守恒知,电极B(Fe3++e-===Fe2+)产生1 mol Fe2+,由反应:4Fe2++ClO+4H+===4Fe3++Cl-+2H2O知,1 mol Fe2+可以反应0.25 mol ClO,理论上可以处理=1.25 L含氯废水,D正确。
8. C 解析:由图可知,放电时右侧Mg→[Mg2Cl2]2+,电极镁失去电子发生氧化反应,为原电池负极,电极反应式为2Mg-4e-+2Cl-===[Mg2Cl2]2+,则左侧为原电池的正极,电极反应式为Fe[Fe(CN)6]+2e-+2Na+===Na2Fe[Fe(CN)6]。充电时该装置作电解池,左侧为阳极,右侧为阴极,则Na+通过交换膜从左室移向右室,A正确;据分析可知,放电时,Mo箔为电池的正极,则充电时,Mo箔外接电源的正极,B正确;放电时,外电路中通过0.2 mol电子时,由负极的反应可知,会消耗0.1 mol镁进入电解质溶液,质量增加2.4 g,同时会有0.2 mol Na+通过离子交换膜向正极移动,质量减少4.6 g,故负极区电解质质量减少2.2 g,C错误;由分析可知,放电时,Mo箔是正极,反应为Fe[Fe(CN)6]+2e-+2Na+===Na2Fe[Fe(CN)6],D正确。故选C。
9. (1)S-6e-+4H2O===SO+8H+
(2)形成Fe—Cu和Fe—C原电池,加快纳米铁粉去除NO的反应速率;炭粉有强吸附性,可以吸附NO
(3)①NO+8e-+10H+===NH+3H2O ②溶液中H+浓度增大,H+更多地得到电子生成H2,NO得到电子产生NH的量减少,NH的产率逐渐减小
解析:(1)根据光合菌产生的O2得电子结合H+得到H2O,碳棒a为正极,FeS2在硫氧化菌的作用下被氧化为S,S在硫氧化菌的作用下被氧化为硫酸根,碳棒b为负极,存在电极反应:S-6e-+4H2O===SO+8H+。
(2)根据图示可知:在含有NO的浓度50 mg·L-1的溶液中加入纳米铁粉、纳米铁粉—活性炭—铜粉,纳米铁粉还原反应速率相对较快,原因是加入纳米铁粉—活性炭—铜粉的形成Fe—Cu和Fe—C原电池,加快纳米铁粉去除NO的反应速率;炭粉有强吸附性,可以吸附NO;
(3)①电解时,NO先吸附到催化剂表面放电产生NH,氮元素化合价降低,得电子发生还原反应,电极反应式为NO+8e-+10H+===NH+3H2O;②pH从5变化到3时,酸性增强,溶液中H+浓度增大,H+得电子生成氢气,造成硝酸根离子得电子产生铵根离子的量减少。
同课章节目录
