第47练 电解池原理 课时作业 (含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第47练 电解池原理 课时作业 (含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 700.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 22:18:17 | ||
图片预览




文档简介
第47练 电解池原理
一、 单项选择题
1. (2024·南京、盐城二模)一种电解法制备Na2FeO4的装置如图所示。下列说法正确的是( )
A. 电解时化学能转化为电能
B. 电解时应将铂电极与直流电源正极相连
C. 电解过程中转移2 mol e-,理论上可获得标准状况下的H2 11.2 L
D. 电解时铁电极反应式:Fe-6e-+8OH-===FeO+4H2O
2. 一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现CH3NO2COOHNO2COOHNH2。下列说法正确的是( )
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为Cr2O+14H++6e-===2Cr3++7H2O
C. “转化Ⅱ”发生的反应为COOHNO2+6Ti3++6H+===COOHNH2+6Ti4++2H2O
D. “转化Ⅰ”生成1 mol COOHNO2,理论上电路中通过3 mol e-
3. 下列说法正确的是( )
A. 用如图1所示装置在铁制品表面镀铜,能达到实验目的
B. 图2所示装置可用于粗铜的提纯
C. 电解精炼粗铜时,阴极减少的质量等于阳极增加的质量
D. 电解精炼粗铜后的电解液中存在:Cu2+、Zn2+、SO、Fe2+、Ag+
4. (2024·句容三中、海安实中高三上联考)为循环利用空间站航天员呼出的二氧化碳并为航天员提供氧气,我国科学家设计了一种装置(如图所示),实现了“太阳能→电能→化学能”的转化,总反应为2CO2===2CO+O2。下列说法正确的是( )
A. X电极连接的是太阳能电池的负极
B. Z离子是OH-,离子交换膜为阳离子交换膜
C. Y电极上的电极反应式为CO2+H2O+2e-===CO+2OH-
D. 为了保证电池在碱性条件下顺利工作,理论上应定期补充碱液
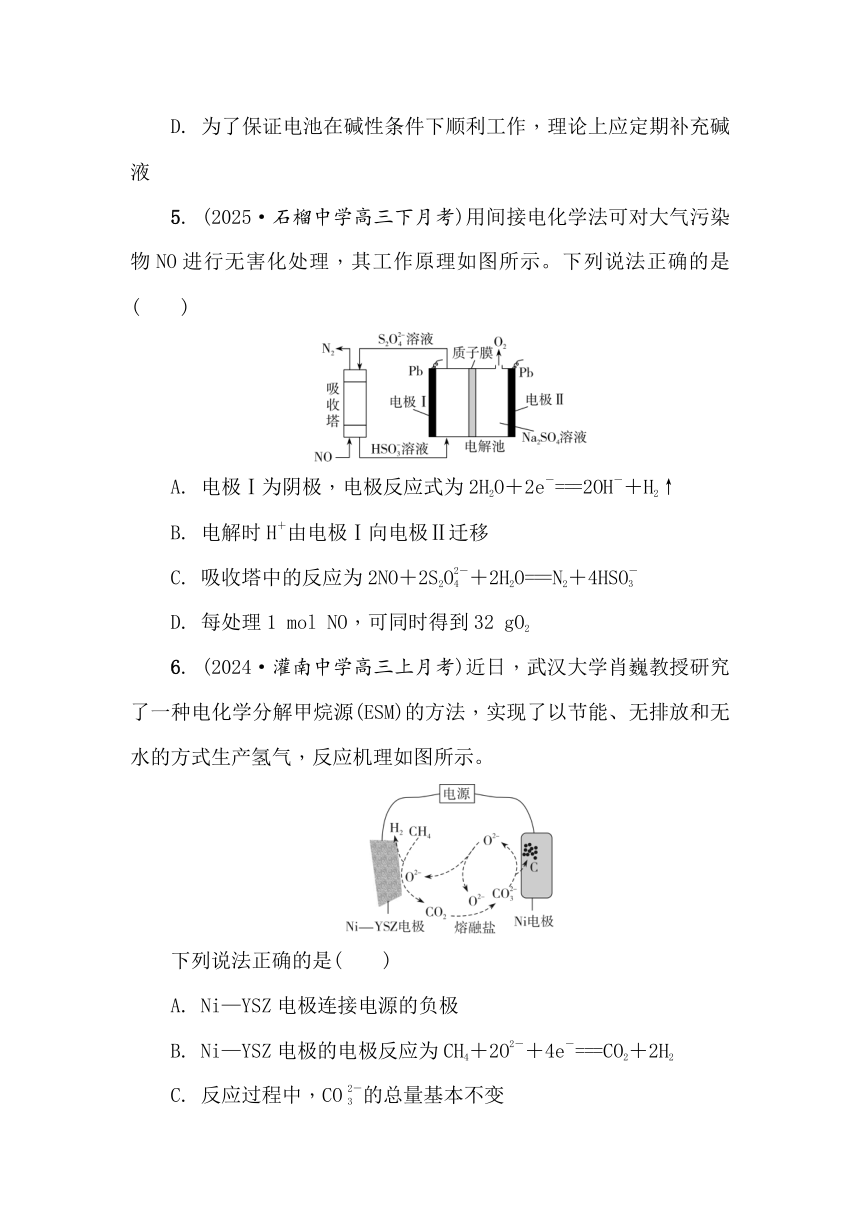
5. (2025·石榴中学高三下月考)用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。下列说法正确的是( )
A. 电极Ⅰ为阴极,电极反应式为2H2O+2e-===2OH-+H2↑
B. 电解时H+由电极Ⅰ向电极Ⅱ迁移
C. 吸收塔中的反应为2NO+2S2O+2H2O===N2+4HSO
D. 每处理1 mol NO,可同时得到32 gO2
6. (2024·灌南中学高三上月考)近日,武汉大学肖巍教授研究了一种电化学分解甲烷源(ESM)的方法,实现了以节能、无排放和无水的方式生产氢气,反应机理如图所示。
下列说法正确的是( )
A. Ni—YSZ电极连接电源的负极
B. Ni—YSZ电极的电极反应为CH4+2O2-+4e-===CO2+2H2
C. 反应过程中,CO的总量基本不变
D. 理论上每生产11.2 L H2,电路中转移2 mol e-
7. (2024·如皋二模)以甲苯为原料通过间接氧化法可以制取苯甲醛、苯甲酸等物质,反应原理如下图所示。下列说法正确的是( )
A. 电解时的阳极反应为:2Cr3++6e-+7H2O===Cr2O+14H+
B. 电解结束后,阴极区溶液pH升高
C. 1 mol甲苯氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2O
D. 甲苯、苯甲醛、苯甲酸的混合物可以通过分液的方法分离
8.
(2024·苏州高三下三模)利用电解产生的H2O2与Fe2+发生反应生成高活性的羟基自由基(·OH,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是( )
A. 电源的B极为负极
B. 生成羟基自由基的反应仅有一个
C. 利用羟基自由基来处理有机物,效率高、无污染
D. 电解池外电路转移2 mol电子,理论上可产生的·OH为2 mol
二、 非选择题
9. (1)(2024·连云港三模)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为____________________________________;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是______________________________。
(2)纯净碳酸锰溶于硫酸后再进行电解制备锰,装置如图所示,Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,该副反应的电极反应为________________________________________________。
(3)(2024·南通高三下期中)碱性条件下,电解偏硼酸钠(NaBO2)溶液可制备NaBH4。总反应式为NaBO2+2H2O===NaBH4+2O2↑。已知:电负性B<H。
①写出阴极的电极反应式:____________________________________________________。
②研究表明上述反应为间接还原反应,包括2步反应,请描述出这2步反应的合理假设:________________________________________。
(4)(2024·苏锡常镇一模)甲醛释氢对氢能源和含甲醛污水处理有重要意义。
HCHO电催化释氢。催化电解含较低浓度的HCHO、NaOH混合溶液,可获得H2与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
①电解时,电极b上同时产生H2与HCOO-的物质的量之比为1∶2,则电极b上的电极反应式为________________________________。
②电解过程中每产生1 mol H2,通过阴离子交换膜的OH-为__________ mol。
第47练 电解池原理
1. D 解析:电解法制备Na2FeO4,根据装置图,铁元素化合价由0价→+6价,化合价升高,根据电解原理,铁电极作阳极,铂电极为阴极,据此分析。该装置为电解池,将电能转化成化学能,故A错误;根据上述分析,铂电极为阴极,与电源的负极相连,故B错误;阴极反应式为2H2O+2e-===H2↑+2OH-,转移2 mol电子,生成1 mol氢气,则标准状况下,生成氢气体积为22.4 L,故C错误;制备高铁酸钠,铁元素化合价升高,根据电解原理,铁电极为阳极,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故D正确。故选D。
2. C 解析:根据氢离子在电解池中移动方向可知,a电极为阴极,b电极为阳极,阳极发生失电子的氧化反应,阴极发生得电子的还原反应,阳极反应:2Cr3+-6e-+7H2O===Cr2O+14H+,阴极反应:Ti4++e-===Ti3+,阳极生成Cr2O具有强氧化性,阴极生成Ti3+具有还原性,“转化Ⅰ”为氧化反应、可加入右室电解获得的电解液氧化实现,“转化Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现,COOHNO2+6Ti3++6H+===COOHNH2+6Ti4++2H2O。根据分析,“转化Ⅰ”为氧化反应,应加入氧化剂,左室电解液含Ti3+,右室电解液含Cr2O,所以实现“转化Ⅰ”需右室电解获得电解液,A错误;根据分析,右室发生的电极反应:2Cr3+-6e-+7H2O===Cr2O+14H+,B错误;“转化Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现,COOHNO2+6Ti3++6H+===COOHNH2+6Ti4++2H2O,C正确;“转化Ⅰ”为CH3NO2-6e-+2H2O===COOHNO2+6H+,根据得失电子守恒,生成1 mol COOHNO2理论上电路中通过6 mol e-,D错误。故选C。
3. A 解析:铜为镀层金属,与电源正极相连,铁制品为镀件,与电源负极相连,CuSO4溶液作电解质溶液,能达到实验目的,A项正确;粗铜提纯时,粗铜作阳极,精铜作阴极,B项错误;电解精炼粗铜时,粗铜为阳极,阳极为比Cu活泼的金属和Cu发生失电子的氧化反应,精铜为阴极,阴极电极反应为Cu2++2e-===Cu,一般情况下,电解精炼铜时,阳极减少的质量与阴极增加的质量不相等,C项错误;电解精炼粗铜,由于Cu比Ag活泼,Ag不会在阳极放电,故电解精炼粗铜后的电解液中一定没有Ag+,D项错误。故选A。
4. C 解析:根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,Y电极(阴极)上CO2得电子生成CO。根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,A错误;根据电池总反应可知Y电极(阴极)上CO2得电子生成CO,电极反应式为CO2+H2O+2e-===CO+2OH-,Y电极生成的OH-通过阴离子交换膜向X电极迁移,B错误;根据电池总反应可知Y电极(阴极)上CO2得电子生成CO,电极反应式为CO2+H2O+2e-===CO+2OH-,C正确;X电极的电极反应式为4OH--4e-===2H2O+O2↑,所以理论上不需要补充碱液,D错误。故选C。
5. C 解析:从图示中,可知在吸收塔中NO变成了N2,N的化合价降低,S2O变成了HSO,S的化合价从+3升高到了+4,化合价升高。在电解池中,HSO变成了S2O,S的化合价从+4降低到+3,得到电子,电极Ⅰ为阴极,而在电极Ⅱ附近有氧气生成,为H2O失去电子生成O2,为阳极。在电解池中,HSO变成了S2O,S的化合价从+4降低到+3,得到电子,电极Ⅰ为阴极,电极方程式为2HSO+2e-+2H+===S2O+2H2O,A项错误;电解时,阳离子向阴极移动,电极Ⅰ为阴极,H+由电极Ⅱ向电极Ⅰ移动,B项错误;吸收塔中NO变N2,S2O变成HSO,C中的离子方程式满足电子守恒、电荷守恒、原子守恒,C项正确;整个装置中转移的电子数相同,处理1 mol NO,N的化合价从+2降低到0,转移了2 mol电子。阳极2H2O-4e-===4H++O2↑,生成32 g O2即1 mol O2需要4 mol电子,D项错误;本题答案选C。
6. C 解析:由图可知,该装置为电解池,与直流电源正极相连的Ni—YSZ电极为阳极,甲烷在氧离子作用下放电生成氢气和二氧化碳,电极反应式为CH4-4e-+2O2-===CO2+2H2,二氧化碳与氧离子结合生成碳酸根离子,镍电极为阴极,碳酸根离子在阴极得到电子生成碳和氧离子,电极反应式为CO+4e-===C+O2-,电解的总反应为CH4C+2H2。由分析可知,与直流电源正极相连的Ni—YSZ电极为阳极,故A错误;由分析可知,与直流电源正极相连的Ni—YSZ电极为阳极,甲烷在氧离子作用下放电生成氢气和二氧化碳,电极反应式为CH4-4e-+2O2-===CO2+2H2,故B错误;由分析可知,电解的总反应为CH4C+2H2,则反应过程中,碳酸根离子的总量基本不变,故C正确;缺标准状况下,无法计算11.2 L氢气的物质的量和电路中转移电子的物质的量,故D错误。故选C。
7. C 解析:由图可知,左侧电极为阳极,水分子作用下铬离子在阳极失去电子发生氧化反应生成重铬酸根离子和氢离子,电极反应式为2Cr3+-6e-+7H2O===Cr2O+14H+,阳极槽外中重铬酸根离子与甲苯在酸性条件下反应生成苯甲醛或苯甲酸,反应的离子方程式为3C6H5—CH3+2Cr2O+16H+===3C6H5—CHO+4Cr3++11H2O,C6H5—CH3+Cr2O+8H+===C6H5—COOH+2Cr3++5H2O,电解时,氢离子通过阳离子交换膜由阳极区进入阴极区,右侧电极为电解池的阴极,阴极氢离子放电,电极反应为:2H++2e-===H2↑,据此作答。电解时的阳极发生氧化反应,电极反应为:2Cr3+-6e-+7H2O===Cr2O+14H+,A错误;阳极区产生的氢离子透过质子交换膜进入阴极区,阴极上氢离子放电,电极反应为:2H++2e-===H2↑,电极上每消耗2 mol H+,就有2 mol H+进入阴极区,故电极电解结束后,阴极区溶液pH不变,B错误;结合3C6H5—CH3+2Cr2O+16H+===3C6H5—CHO+4Cr3++11H2O,0.5 mol甲苯氧化为0.5 mol苯甲醛时消耗 mol Cr2O,根据C6H5—CH3+Cr2O+8H+===C6H5—COOH+2Cr3++5H2O,0.5 mol甲苯氧化为0.5 mol苯甲酸时消耗0.5 mol Cr2O,则1 mol甲苯氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2O,C正确;甲苯、苯甲醛、苯甲酸的混合物是互溶的液体,不可以通过分液的方法分离,D错误。故选C。
8. C 解析:该装置为电解池,其中与电源A极相连的左侧电极电极反应为Fe3++e-===Fe2+、O2+2H++2e-===H2O2,属于还原反应,该电极为阴极,A为电源负极,B为正极,电解池右侧电极为阳极。根据上述分析可知,左端电极发生得电子、还原反应,为电解池阴极,则A为电源负极,B为电源正极,A错误;电解生成羟基自由基的反应有两个,右侧阳极电极反应H2O-e-===H++·OH、H2O2+Fe2+===Fe(OH)2++·OH,B错误;羟基自由基有很强氧化性,降解有机物,效率高、无污染,C正确;根据生成羟基自由基的反应,电解池外电路转移2 mol电子,则阳极反应H2O-e-===H++·OH,有2 mol ·OH生成,假如阴极生成Fe2+与H2O2比例为1∶1,可生成的Fe2+与H2O2为 mol,H2O2+Fe2+===Fe(OH)2++·OH有0.67 mol ·OH生成,故理论上可产生的·OH大于2 mol,D错误。故选C。
9. (1)2CO2+2e-+2H+===H2C2O4 温度过高微生物催化能力降低或催化剂失活
(2)Mn2++2H2O-2e-===MnO2+4H+O
(3)①BO+6H2O+8e-===BH+8OH- ②第1步:H2O在阴极电解产生H2;第2步:生成的H2再与BO反应生成BH
(4)①2HCHO+4OH--2e-===2HCOO-+H2↑+2H2O ②1
解析:(1)由图可知,阴极区二氧化碳得到电子发生还原反应生成草酸,反应为2CO2+2e-+2H+===H2C2O4;温度过高微生物催化能力降低或催化剂失活,使得电极反应的速率反而迅速下降。
(2)根据装置图可知左侧为阳极,右侧为阴极,Mn2+进入阳极区发生氧化反应生成MnO2,电极反应为:Mn2++2H2O-2e-===MnO2+4H+。
(3)①阴极生成NaBH4,电极反应式:BO+6H2O+8e-===BH+8OH-;②研究表明上述反应为间接还原反应,包括2步反应,这2步反应的合理假设为:第1步:H2O在阴极电解产生H2;第2步:生成的H2再与BO反应生成BH。
(4)①电解时,电极b与电源正极相连,是电解池的阳极,HCHO失去电子同时产生H2与HCOO-的物质的量之比为1∶2,则电极b上的电极反应式为2HCHO+4OH--2e-===2HCOO-+H2↑+2H2O;②电极a是阴极,电极反应式为2H2O+2e-===H2↑+2OH-,电解过程中每产生1 mol H2,每个电极上各产生0.5 mol H2,故通过阴离子交换膜的OH-为1 mol。
一、 单项选择题
1. (2024·南京、盐城二模)一种电解法制备Na2FeO4的装置如图所示。下列说法正确的是( )
A. 电解时化学能转化为电能
B. 电解时应将铂电极与直流电源正极相连
C. 电解过程中转移2 mol e-,理论上可获得标准状况下的H2 11.2 L
D. 电解时铁电极反应式:Fe-6e-+8OH-===FeO+4H2O
2. 一种电解装置如图所示,电解时H+从右室移向左室。通过电解获得的电解液可实现CH3NO2COOHNO2COOHNH2。下列说法正确的是( )
A. 左室电解获得的电解液可用于实现“转化Ⅰ”
B. 右室发生的电极反应为Cr2O+14H++6e-===2Cr3++7H2O
C. “转化Ⅱ”发生的反应为COOHNO2+6Ti3++6H+===COOHNH2+6Ti4++2H2O
D. “转化Ⅰ”生成1 mol COOHNO2,理论上电路中通过3 mol e-
3. 下列说法正确的是( )
A. 用如图1所示装置在铁制品表面镀铜,能达到实验目的
B. 图2所示装置可用于粗铜的提纯
C. 电解精炼粗铜时,阴极减少的质量等于阳极增加的质量
D. 电解精炼粗铜后的电解液中存在:Cu2+、Zn2+、SO、Fe2+、Ag+
4. (2024·句容三中、海安实中高三上联考)为循环利用空间站航天员呼出的二氧化碳并为航天员提供氧气,我国科学家设计了一种装置(如图所示),实现了“太阳能→电能→化学能”的转化,总反应为2CO2===2CO+O2。下列说法正确的是( )
A. X电极连接的是太阳能电池的负极
B. Z离子是OH-,离子交换膜为阳离子交换膜
C. Y电极上的电极反应式为CO2+H2O+2e-===CO+2OH-
D. 为了保证电池在碱性条件下顺利工作,理论上应定期补充碱液
5. (2025·石榴中学高三下月考)用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。下列说法正确的是( )
A. 电极Ⅰ为阴极,电极反应式为2H2O+2e-===2OH-+H2↑
B. 电解时H+由电极Ⅰ向电极Ⅱ迁移
C. 吸收塔中的反应为2NO+2S2O+2H2O===N2+4HSO
D. 每处理1 mol NO,可同时得到32 gO2
6. (2024·灌南中学高三上月考)近日,武汉大学肖巍教授研究了一种电化学分解甲烷源(ESM)的方法,实现了以节能、无排放和无水的方式生产氢气,反应机理如图所示。
下列说法正确的是( )
A. Ni—YSZ电极连接电源的负极
B. Ni—YSZ电极的电极反应为CH4+2O2-+4e-===CO2+2H2
C. 反应过程中,CO的总量基本不变
D. 理论上每生产11.2 L H2,电路中转移2 mol e-
7. (2024·如皋二模)以甲苯为原料通过间接氧化法可以制取苯甲醛、苯甲酸等物质,反应原理如下图所示。下列说法正确的是( )
A. 电解时的阳极反应为:2Cr3++6e-+7H2O===Cr2O+14H+
B. 电解结束后,阴极区溶液pH升高
C. 1 mol甲苯氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2O
D. 甲苯、苯甲醛、苯甲酸的混合物可以通过分液的方法分离
8.
(2024·苏州高三下三模)利用电解产生的H2O2与Fe2+发生反应生成高活性的羟基自由基(·OH,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是( )
A. 电源的B极为负极
B. 生成羟基自由基的反应仅有一个
C. 利用羟基自由基来处理有机物,效率高、无污染
D. 电解池外电路转移2 mol电子,理论上可产生的·OH为2 mol
二、 非选择题
9. (1)(2024·连云港三模)利用电化学方法通过微生物电催化将CO2有效地转化为H2C2O4,装置如图1所示。阴极区电极反应式为____________________________________;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是______________________________。
(2)纯净碳酸锰溶于硫酸后再进行电解制备锰,装置如图所示,Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,该副反应的电极反应为________________________________________________。
(3)(2024·南通高三下期中)碱性条件下,电解偏硼酸钠(NaBO2)溶液可制备NaBH4。总反应式为NaBO2+2H2O===NaBH4+2O2↑。已知:电负性B<H。
①写出阴极的电极反应式:____________________________________________________。
②研究表明上述反应为间接还原反应,包括2步反应,请描述出这2步反应的合理假设:________________________________________。
(4)(2024·苏锡常镇一模)甲醛释氢对氢能源和含甲醛污水处理有重要意义。
HCHO电催化释氢。催化电解含较低浓度的HCHO、NaOH混合溶液,可获得H2与HCOONa(如图所示),其中电极b表面覆盖一种Mo与P形成的化合物(晶胞结构如图所示)作催化剂。
①电解时,电极b上同时产生H2与HCOO-的物质的量之比为1∶2,则电极b上的电极反应式为________________________________。
②电解过程中每产生1 mol H2,通过阴离子交换膜的OH-为__________ mol。
第47练 电解池原理
1. D 解析:电解法制备Na2FeO4,根据装置图,铁元素化合价由0价→+6价,化合价升高,根据电解原理,铁电极作阳极,铂电极为阴极,据此分析。该装置为电解池,将电能转化成化学能,故A错误;根据上述分析,铂电极为阴极,与电源的负极相连,故B错误;阴极反应式为2H2O+2e-===H2↑+2OH-,转移2 mol电子,生成1 mol氢气,则标准状况下,生成氢气体积为22.4 L,故C错误;制备高铁酸钠,铁元素化合价升高,根据电解原理,铁电极为阳极,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故D正确。故选D。
2. C 解析:根据氢离子在电解池中移动方向可知,a电极为阴极,b电极为阳极,阳极发生失电子的氧化反应,阴极发生得电子的还原反应,阳极反应:2Cr3+-6e-+7H2O===Cr2O+14H+,阴极反应:Ti4++e-===Ti3+,阳极生成Cr2O具有强氧化性,阴极生成Ti3+具有还原性,“转化Ⅰ”为氧化反应、可加入右室电解获得的电解液氧化实现,“转化Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现,COOHNO2+6Ti3++6H+===COOHNH2+6Ti4++2H2O。根据分析,“转化Ⅰ”为氧化反应,应加入氧化剂,左室电解液含Ti3+,右室电解液含Cr2O,所以实现“转化Ⅰ”需右室电解获得电解液,A错误;根据分析,右室发生的电极反应:2Cr3+-6e-+7H2O===Cr2O+14H+,B错误;“转化Ⅱ”为还原反应,可加入左室电解获得的电解液还原实现,COOHNO2+6Ti3++6H+===COOHNH2+6Ti4++2H2O,C正确;“转化Ⅰ”为CH3NO2-6e-+2H2O===COOHNO2+6H+,根据得失电子守恒,生成1 mol COOHNO2理论上电路中通过6 mol e-,D错误。故选C。
3. A 解析:铜为镀层金属,与电源正极相连,铁制品为镀件,与电源负极相连,CuSO4溶液作电解质溶液,能达到实验目的,A项正确;粗铜提纯时,粗铜作阳极,精铜作阴极,B项错误;电解精炼粗铜时,粗铜为阳极,阳极为比Cu活泼的金属和Cu发生失电子的氧化反应,精铜为阴极,阴极电极反应为Cu2++2e-===Cu,一般情况下,电解精炼铜时,阳极减少的质量与阴极增加的质量不相等,C项错误;电解精炼粗铜,由于Cu比Ag活泼,Ag不会在阳极放电,故电解精炼粗铜后的电解液中一定没有Ag+,D项错误。故选A。
4. C 解析:根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,Y电极(阴极)上CO2得电子生成CO。根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,A错误;根据电池总反应可知Y电极(阴极)上CO2得电子生成CO,电极反应式为CO2+H2O+2e-===CO+2OH-,Y电极生成的OH-通过阴离子交换膜向X电极迁移,B错误;根据电池总反应可知Y电极(阴极)上CO2得电子生成CO,电极反应式为CO2+H2O+2e-===CO+2OH-,C正确;X电极的电极反应式为4OH--4e-===2H2O+O2↑,所以理论上不需要补充碱液,D错误。故选C。
5. C 解析:从图示中,可知在吸收塔中NO变成了N2,N的化合价降低,S2O变成了HSO,S的化合价从+3升高到了+4,化合价升高。在电解池中,HSO变成了S2O,S的化合价从+4降低到+3,得到电子,电极Ⅰ为阴极,而在电极Ⅱ附近有氧气生成,为H2O失去电子生成O2,为阳极。在电解池中,HSO变成了S2O,S的化合价从+4降低到+3,得到电子,电极Ⅰ为阴极,电极方程式为2HSO+2e-+2H+===S2O+2H2O,A项错误;电解时,阳离子向阴极移动,电极Ⅰ为阴极,H+由电极Ⅱ向电极Ⅰ移动,B项错误;吸收塔中NO变N2,S2O变成HSO,C中的离子方程式满足电子守恒、电荷守恒、原子守恒,C项正确;整个装置中转移的电子数相同,处理1 mol NO,N的化合价从+2降低到0,转移了2 mol电子。阳极2H2O-4e-===4H++O2↑,生成32 g O2即1 mol O2需要4 mol电子,D项错误;本题答案选C。
6. C 解析:由图可知,该装置为电解池,与直流电源正极相连的Ni—YSZ电极为阳极,甲烷在氧离子作用下放电生成氢气和二氧化碳,电极反应式为CH4-4e-+2O2-===CO2+2H2,二氧化碳与氧离子结合生成碳酸根离子,镍电极为阴极,碳酸根离子在阴极得到电子生成碳和氧离子,电极反应式为CO+4e-===C+O2-,电解的总反应为CH4C+2H2。由分析可知,与直流电源正极相连的Ni—YSZ电极为阳极,故A错误;由分析可知,与直流电源正极相连的Ni—YSZ电极为阳极,甲烷在氧离子作用下放电生成氢气和二氧化碳,电极反应式为CH4-4e-+2O2-===CO2+2H2,故B错误;由分析可知,电解的总反应为CH4C+2H2,则反应过程中,碳酸根离子的总量基本不变,故C正确;缺标准状况下,无法计算11.2 L氢气的物质的量和电路中转移电子的物质的量,故D错误。故选C。
7. C 解析:由图可知,左侧电极为阳极,水分子作用下铬离子在阳极失去电子发生氧化反应生成重铬酸根离子和氢离子,电极反应式为2Cr3+-6e-+7H2O===Cr2O+14H+,阳极槽外中重铬酸根离子与甲苯在酸性条件下反应生成苯甲醛或苯甲酸,反应的离子方程式为3C6H5—CH3+2Cr2O+16H+===3C6H5—CHO+4Cr3++11H2O,C6H5—CH3+Cr2O+8H+===C6H5—COOH+2Cr3++5H2O,电解时,氢离子通过阳离子交换膜由阳极区进入阴极区,右侧电极为电解池的阴极,阴极氢离子放电,电极反应为:2H++2e-===H2↑,据此作答。电解时的阳极发生氧化反应,电极反应为:2Cr3+-6e-+7H2O===Cr2O+14H+,A错误;阳极区产生的氢离子透过质子交换膜进入阴极区,阴极上氢离子放电,电极反应为:2H++2e-===H2↑,电极上每消耗2 mol H+,就有2 mol H+进入阴极区,故电极电解结束后,阴极区溶液pH不变,B错误;结合3C6H5—CH3+2Cr2O+16H+===3C6H5—CHO+4Cr3++11H2O,0.5 mol甲苯氧化为0.5 mol苯甲醛时消耗 mol Cr2O,根据C6H5—CH3+Cr2O+8H+===C6H5—COOH+2Cr3++5H2O,0.5 mol甲苯氧化为0.5 mol苯甲酸时消耗0.5 mol Cr2O,则1 mol甲苯氧化为0.5 mol苯甲醛和0.5 mol苯甲酸时,共消耗 mol Cr2O,C正确;甲苯、苯甲醛、苯甲酸的混合物是互溶的液体,不可以通过分液的方法分离,D错误。故选C。
8. C 解析:该装置为电解池,其中与电源A极相连的左侧电极电极反应为Fe3++e-===Fe2+、O2+2H++2e-===H2O2,属于还原反应,该电极为阴极,A为电源负极,B为正极,电解池右侧电极为阳极。根据上述分析可知,左端电极发生得电子、还原反应,为电解池阴极,则A为电源负极,B为电源正极,A错误;电解生成羟基自由基的反应有两个,右侧阳极电极反应H2O-e-===H++·OH、H2O2+Fe2+===Fe(OH)2++·OH,B错误;羟基自由基有很强氧化性,降解有机物,效率高、无污染,C正确;根据生成羟基自由基的反应,电解池外电路转移2 mol电子,则阳极反应H2O-e-===H++·OH,有2 mol ·OH生成,假如阴极生成Fe2+与H2O2比例为1∶1,可生成的Fe2+与H2O2为 mol,H2O2+Fe2+===Fe(OH)2++·OH有0.67 mol ·OH生成,故理论上可产生的·OH大于2 mol,D错误。故选C。
9. (1)2CO2+2e-+2H+===H2C2O4 温度过高微生物催化能力降低或催化剂失活
(2)Mn2++2H2O-2e-===MnO2+4H+O
(3)①BO+6H2O+8e-===BH+8OH- ②第1步:H2O在阴极电解产生H2;第2步:生成的H2再与BO反应生成BH
(4)①2HCHO+4OH--2e-===2HCOO-+H2↑+2H2O ②1
解析:(1)由图可知,阴极区二氧化碳得到电子发生还原反应生成草酸,反应为2CO2+2e-+2H+===H2C2O4;温度过高微生物催化能力降低或催化剂失活,使得电极反应的速率反而迅速下降。
(2)根据装置图可知左侧为阳极,右侧为阴极,Mn2+进入阳极区发生氧化反应生成MnO2,电极反应为:Mn2++2H2O-2e-===MnO2+4H+。
(3)①阴极生成NaBH4,电极反应式:BO+6H2O+8e-===BH+8OH-;②研究表明上述反应为间接还原反应,包括2步反应,这2步反应的合理假设为:第1步:H2O在阴极电解产生H2;第2步:生成的H2再与BO反应生成BH。
(4)①电解时,电极b与电源正极相连,是电解池的阳极,HCHO失去电子同时产生H2与HCOO-的物质的量之比为1∶2,则电极b上的电极反应式为2HCHO+4OH--2e-===2HCOO-+H2↑+2H2O;②电极a是阴极,电极反应式为2H2O+2e-===H2↑+2OH-,电解过程中每产生1 mol H2,每个电极上各产生0.5 mol H2,故通过阴离子交换膜的OH-为1 mol。
同课章节目录
