第50练 化学反应速率与能量图 课时作业 (含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第50练 化学反应速率与能量图 课时作业 (含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 676.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 22:22:52 | ||
图片预览



文档简介
第50练 化学反应速率与能量图
1.
(2024·常州教育学会高三上期中监测)催化剂Ⅰ和Ⅱ均能催化反应R(g)?P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法正确的是( )
A. 使用Ⅰ或Ⅱ,反应历程都分2步进行
B. 达平衡后,若升高温度,P的浓度增大
C. 使用Ⅰ时,反应体系更快达到平衡状态
D. 使用Ⅱ时,反应过程中M所能达到的最高浓度更大
2. (2024·无锡高三上期末)反应物(X)转化为产物(Y)时的能量变化与反应进程的关系如图曲线①所示,在反应中仅改变一种外界条件,可得到如图曲线②。下列说法正确的是( )
A. 该条件的改变增大了单位体积内活化分子百分数
B. X·M为反应所加的催化剂
C. 改变该条件后,降低了反应的焓变
D. 该反应是吸热反应
(第2题图)
(第3题图)
3. H2与ICl的反应分两步完成,其能量曲线如图所示。
反应①:H2(g)+2ICl(g)===HCl(g)+HI(g)+ICl(g)
反应②:HCl(g)+HI(g)+ICl(g)===I2(g)+2HCl(g)
下列有关说法不正确的是( )
A. 反应①的能垒比反应②的大,所以总反应的反应速率取决于第②步反应
B. 反应①、②均是反应物总能量高于生成物总能量
C. H2(g)+2ICl(g)===I2(g)+2HCl(g) ΔH=-218 kJ·mol-1
D. 温度升高,活化分子百分数增大,反应碰撞概率增大,反应速率加快
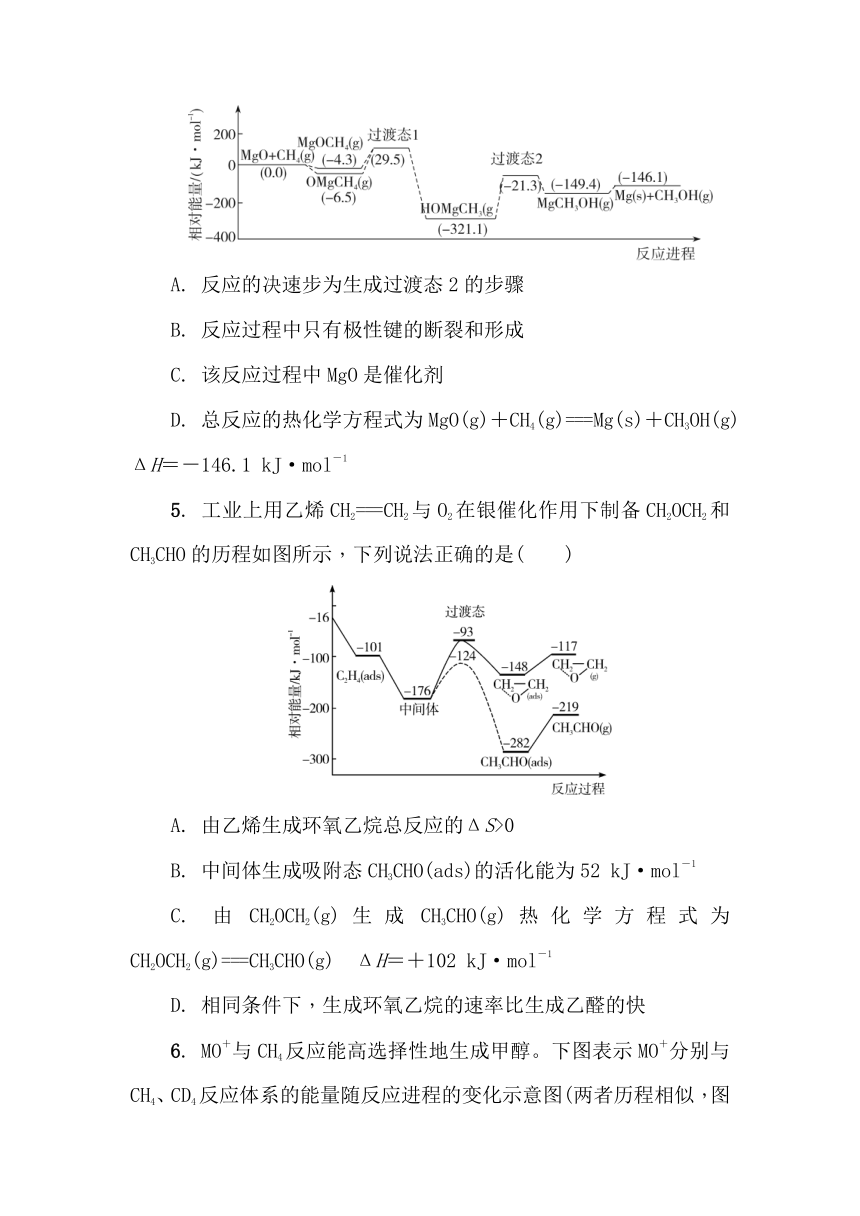
4. 如图所示是我国科研工作者研究CH4(g)氧化制甲醇CH3OH(g)的物质相对能量-反应进程曲线。下列叙述错误的是( )
A. 反应的决速步为生成过渡态2的步骤
B. 反应过程中只有极性键的断裂和形成
C. 该反应过程中MgO是催化剂
D. 总反应的热化学方程式为MgO(g)+CH4(g)===Mg(s)+CH3OH(g) ΔH=-146.1 kJ·mol-1
5. 工业上用乙烯CH2===CH2与O2在银催化作用下制备CH2OCH2和CH3CHO的历程如图所示,下列说法正确的是( )
A. 由乙烯生成环氧乙烷总反应的ΔS>0
B. 中间体生成吸附态CH3CHO(ads)的活化能为52 kJ·mol-1
C. 由CH2OCH2(g)生成CH3CHO(g)热化学方程式为CH2OCH2(g)===CH3CHO(g) ΔH=+102 kJ·mol-1
D. 相同条件下,生成环氧乙烷的速率比生成乙醛的快
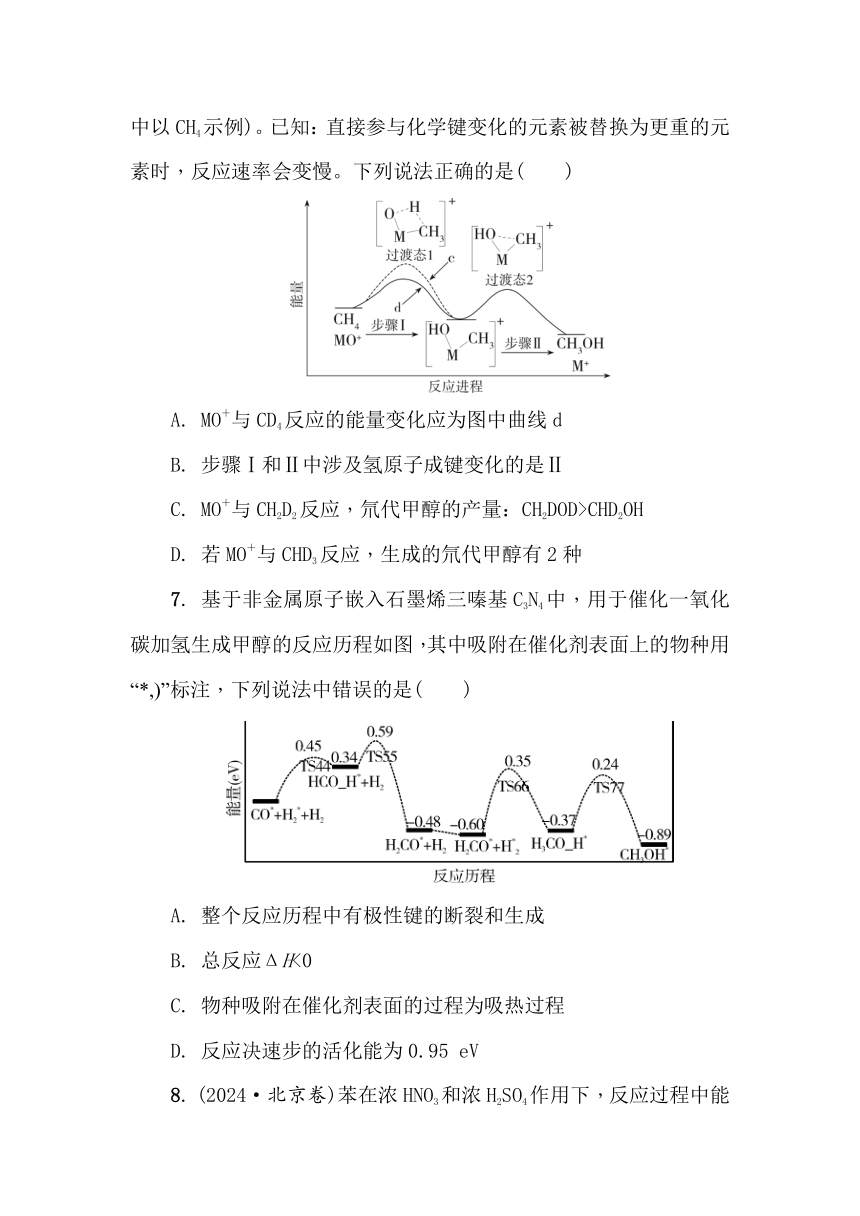
6. MO+与CH4反应能高选择性地生成甲醇。下图表示MO+分别与CH4、CD4反应体系的能量随反应进程的变化示意图(两者历程相似,图中以CH4示例)。已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢。下列说法正确的是( )
A. MO+与CD4反应的能量变化应为图中曲线d
B. 步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是Ⅱ
C. MO+与CH2D2反应,氘代甲醇的产量:CH2DOD>CHD2OH
D. 若MO+与CHD3反应,生成的氘代甲醇有2种
7. 基于非金属原子嵌入石墨烯三嗪基C3N4中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“*,)”标注,下列说法中错误的是( )
A. 整个反应历程中有极性键的断裂和生成
B. 总反应ΔH<0
C. 物种吸附在催化剂表面的过程为吸热过程
D. 反应决速步的活化能为0.95 eV
8. (2024·北京卷)苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不正确的是( )
A. 从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B. X为苯的加成产物,Y为苯的取代产物
C. 由苯得到M时,苯中的大π键没有变化
D. 对于生成Y的反应,浓H2SO4作催化剂
9. (2024·扬州高三上期中)基态碳原子C与H2S反应的过程如题图所示。下列说法正确的是( )
A. 反应SCH2(g)===HCS(g)+H(g) ΔH=-206 kJ·mol-1
B. 使用催化剂可以降低该反应的活化能和焓变
C. 断开1 mol HCSH(g)中的全部化学键生成气态原子吸收的能量比SCH2(g)的少
D. 相同条件下,CSH2(g)转化为HCSH(g)的速率比HCSH(g)转化为SCH2(g)的小
10. (2024·常州十校高三上12月联考)在Fe+催化作用下CO可将N2O转化为N2,反应的能量变化及反应历程如图所示:
①N2O+Fe+===N2+FeO+(慢)②FeO++CO===CO2+Fe+(快)
下列叙述不正确的是( )
A. 反应①为放热反应
B. FeO+为反应①的氧化产物,也是总反应的中间产物
C. 反应②的活化能Ea2比反应①的活化能Ea1要大
D. 每生成1 mol N2,转移电子数目为2×6.02×1023
第50练 化学反应速率与能量图
1. C 解析:由图可知两种催化剂均出现四个波峰,所以使用Ⅰ和Ⅱ,反应历程都分4步进行,A错误;由图可知该反应是放热反应,所以达平衡时,升高温度平衡向左移动,P的浓度减小,B错误;由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C正确;由图可知在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,使用Ⅱ时前两个历程中活化能较高反应速率较慢,后两个历程中使用Ⅱ活化能较低反应速率较快,反应过程中M所能达到的最高浓度更小,D错误。故选C。
2. A 解析:催化剂改变了反应的历程,降低了反应的活化能,增大了单位体积内活化分子百分数,加快了反应速率,A正确;X·M为反应的中间产物,不是所加的催化剂,B错误;改变该条件后,降低了反应的活化能,加快了反应速率,但是不改变反应焓变,C错误;该反应中生成物能量低于反应物能量,是放热反应,D错误。故选A。
3. A 解析:能垒越大,反应速率越慢,反应①的能垒比反应②的大,则总反应的反应速率主要由反应①决定,故A错误;由图象可知,反应①、②均为放热反应,其反应物总能量均高于生成物总能量,故B正确;反应①和②总的能量变化为218 kJ,根据盖斯定律,①+②得H2(g)+2ICl(g)===I2(g)+2HCl(g) ΔH=-218 kJ·mol-1,故C正确;温度升高,活化分子百分数增大,从而使反应碰撞概率增大,反应速率加快,故D正确。故选A。
4. C 解析:生成过渡态2的步骤活化能最大,因此反应的决速步为生成过渡态2的步骤,故A正确;反应过程中断裂的化学键都是异种原子之间的键,属于极性键,故B正确;反应最终态无MgO,则MgO不是该反应的催化剂,故C错误;根据反应起始态和终末态可知,该反应的热化学方程式为:MgO(g)+CH4(g)===Mg(s)+CH3OH(g) ΔH=-146.1 kJ·mol-1,故D正确。故选C。
5. B 解析:由题意可知,乙烯生成环氧乙烷的反应为2CH2===CH2(g)+O2(g)2(g),该反应是熵减的反应,反应熵变ΔS<0,故A错误;由图可知,中间体生成吸附态CH3CHO(ads)的活化能为(-124 kJ·mol-1)-(-176 kJ·mol-1)=52 kJ·mol-1,故B正确;由图可知,环氧乙烷的能量高于乙醛,则环氧乙烷转化为乙醛的反应为反应物总能量大于生成物的总能量,反应的ΔH=-[(-148 kJ·mol-1)-(-282 kJ·mol-1)]=-102 kJ·mol-1,故C错误;反应的活化能越大,反应速率越慢,由图可知,乙烯环氧乙烷的活化能大于乙烯生成乙醛的活化能,则生成环氧乙烷的速率比生成乙醛的慢,故D错误。故选B。
6. D 解析:步骤I涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,氧更容易和H而不是和D生成羟基,若MO+与CHD2反应,生成的氘代甲醇可能为CHD2OD或CD3OH。
已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢,MO+与CD4反应的能量变化应为图中曲线c,反应的活化能更大,故A错误;由图可知,步骤Ⅰ涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以涉及氢原子成键变化的是步骤Ⅰ,故B错误;直接参与化学键变化的元素被替换为更重的同位素时,反应速率会减慢,氧更容易和H而不是和D生成羟基,因此氘代甲醇的产量CH2DOD<CHD2OH,故C错误;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD或CD3OH,共两种,故D正确。故选D。
7. C 解析:由图可知,一氧化碳催化加氢生成甲醇的反应中有极性键的断裂和生成,故A正确;由图可知,总反应为放热反应,ΔH<0,故B正确;由图可知,吸附在催化剂表面的生成物总能量低于反应物的总能量,为放热过程,故C错误;反应的活化能越大,反应速率越慢,反应决速步为慢反应,由图可知,反应H2CO*,)+H*,)2===H3CO-H*,)的活化能最大,反应速率最慢,则反应决速步的活化能为0.35 eV-(-0.60 eV)=0.95 eV,故D正确。故选C。
8. C 解析:生成产物Ⅱ的反应的活化能更低,反应速率更快,且产物Ⅱ的能量更低即产物Ⅱ更稳定,以上2个角度均有利于产物Ⅱ,故A正确;根据前后结构对照,X为苯的加成产物,Y为苯的取代产物,故B正确;M的六元环中与—NO2相连的C为sp3杂化,苯中大π键发生改变,故C错误;苯的硝化反应中浓H2SO4作催化剂,故D正确。故选C。
9. C 解析:焓变等于生成物总能量减去反应物总能量,可知该反应ΔH=-183-(-76)=-107 kJ·mol-1,故A错误;改变催化剂能改变了反应过程,但不能改变了反应的焓变,故B错误;根据图中信息得到断开1 mol HCSH(g)中的全部化学键生成气态原子吸收的能量比SCH2(g)的少,故C正确;速率的大小与反应的活化能有关,通常活化能越高,反应速率越慢。根据图中信息,相同条件下,CSH2(g)转化为HCSH(g)的速率比HCSH(g)转化为SCH2(g)的大,故D错误。故选C。
10. C 解析:由图可知,Fe++N2O―→FeO++N2、FeO++CO―→Fe+CO2两步中均为反应物总能量大于生成物总能量,所以两个反应都是放热反应,故A正确;由反应可知,反应①中Fe+转化为FeO+,Fe的化合价升高,FeO+作氧化产物,同时FeO+是反应①的产物,也是反应②的反应物,在总反应中作中间产物,故B正确;由已知可知反应①为慢反应,而反应的活化能越大反应速率越慢,可知反应①的活化能大于反应②的活化能,故C错误;该过程总反应为:N2O+CO===CO2+N2,生成1 mol N2,转移2 mol电子,转移电子数目为:2×6.02×1023,故D正确。故选C。
1.
(2024·常州教育学会高三上期中监测)催化剂Ⅰ和Ⅱ均能催化反应R(g)?P(g)。反应历程(如图)中,M为中间产物。其它条件相同时,下列说法正确的是( )
A. 使用Ⅰ或Ⅱ,反应历程都分2步进行
B. 达平衡后,若升高温度,P的浓度增大
C. 使用Ⅰ时,反应体系更快达到平衡状态
D. 使用Ⅱ时,反应过程中M所能达到的最高浓度更大
2. (2024·无锡高三上期末)反应物(X)转化为产物(Y)时的能量变化与反应进程的关系如图曲线①所示,在反应中仅改变一种外界条件,可得到如图曲线②。下列说法正确的是( )
A. 该条件的改变增大了单位体积内活化分子百分数
B. X·M为反应所加的催化剂
C. 改变该条件后,降低了反应的焓变
D. 该反应是吸热反应
(第2题图)
(第3题图)
3. H2与ICl的反应分两步完成,其能量曲线如图所示。
反应①:H2(g)+2ICl(g)===HCl(g)+HI(g)+ICl(g)
反应②:HCl(g)+HI(g)+ICl(g)===I2(g)+2HCl(g)
下列有关说法不正确的是( )
A. 反应①的能垒比反应②的大,所以总反应的反应速率取决于第②步反应
B. 反应①、②均是反应物总能量高于生成物总能量
C. H2(g)+2ICl(g)===I2(g)+2HCl(g) ΔH=-218 kJ·mol-1
D. 温度升高,活化分子百分数增大,反应碰撞概率增大,反应速率加快
4. 如图所示是我国科研工作者研究CH4(g)氧化制甲醇CH3OH(g)的物质相对能量-反应进程曲线。下列叙述错误的是( )
A. 反应的决速步为生成过渡态2的步骤
B. 反应过程中只有极性键的断裂和形成
C. 该反应过程中MgO是催化剂
D. 总反应的热化学方程式为MgO(g)+CH4(g)===Mg(s)+CH3OH(g) ΔH=-146.1 kJ·mol-1
5. 工业上用乙烯CH2===CH2与O2在银催化作用下制备CH2OCH2和CH3CHO的历程如图所示,下列说法正确的是( )
A. 由乙烯生成环氧乙烷总反应的ΔS>0
B. 中间体生成吸附态CH3CHO(ads)的活化能为52 kJ·mol-1
C. 由CH2OCH2(g)生成CH3CHO(g)热化学方程式为CH2OCH2(g)===CH3CHO(g) ΔH=+102 kJ·mol-1
D. 相同条件下,生成环氧乙烷的速率比生成乙醛的快
6. MO+与CH4反应能高选择性地生成甲醇。下图表示MO+分别与CH4、CD4反应体系的能量随反应进程的变化示意图(两者历程相似,图中以CH4示例)。已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢。下列说法正确的是( )
A. MO+与CD4反应的能量变化应为图中曲线d
B. 步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是Ⅱ
C. MO+与CH2D2反应,氘代甲醇的产量:CH2DOD>CHD2OH
D. 若MO+与CHD3反应,生成的氘代甲醇有2种
7. 基于非金属原子嵌入石墨烯三嗪基C3N4中,用于催化一氧化碳加氢生成甲醇的反应历程如图,其中吸附在催化剂表面上的物种用“*,)”标注,下列说法中错误的是( )
A. 整个反应历程中有极性键的断裂和生成
B. 总反应ΔH<0
C. 物种吸附在催化剂表面的过程为吸热过程
D. 反应决速步的活化能为0.95 eV
8. (2024·北京卷)苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不正确的是( )
A. 从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B. X为苯的加成产物,Y为苯的取代产物
C. 由苯得到M时,苯中的大π键没有变化
D. 对于生成Y的反应,浓H2SO4作催化剂
9. (2024·扬州高三上期中)基态碳原子C与H2S反应的过程如题图所示。下列说法正确的是( )
A. 反应SCH2(g)===HCS(g)+H(g) ΔH=-206 kJ·mol-1
B. 使用催化剂可以降低该反应的活化能和焓变
C. 断开1 mol HCSH(g)中的全部化学键生成气态原子吸收的能量比SCH2(g)的少
D. 相同条件下,CSH2(g)转化为HCSH(g)的速率比HCSH(g)转化为SCH2(g)的小
10. (2024·常州十校高三上12月联考)在Fe+催化作用下CO可将N2O转化为N2,反应的能量变化及反应历程如图所示:
①N2O+Fe+===N2+FeO+(慢)②FeO++CO===CO2+Fe+(快)
下列叙述不正确的是( )
A. 反应①为放热反应
B. FeO+为反应①的氧化产物,也是总反应的中间产物
C. 反应②的活化能Ea2比反应①的活化能Ea1要大
D. 每生成1 mol N2,转移电子数目为2×6.02×1023
第50练 化学反应速率与能量图
1. C 解析:由图可知两种催化剂均出现四个波峰,所以使用Ⅰ和Ⅱ,反应历程都分4步进行,A错误;由图可知该反应是放热反应,所以达平衡时,升高温度平衡向左移动,P的浓度减小,B错误;由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C正确;由图可知在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,使用Ⅱ时前两个历程中活化能较高反应速率较慢,后两个历程中使用Ⅱ活化能较低反应速率较快,反应过程中M所能达到的最高浓度更小,D错误。故选C。
2. A 解析:催化剂改变了反应的历程,降低了反应的活化能,增大了单位体积内活化分子百分数,加快了反应速率,A正确;X·M为反应的中间产物,不是所加的催化剂,B错误;改变该条件后,降低了反应的活化能,加快了反应速率,但是不改变反应焓变,C错误;该反应中生成物能量低于反应物能量,是放热反应,D错误。故选A。
3. A 解析:能垒越大,反应速率越慢,反应①的能垒比反应②的大,则总反应的反应速率主要由反应①决定,故A错误;由图象可知,反应①、②均为放热反应,其反应物总能量均高于生成物总能量,故B正确;反应①和②总的能量变化为218 kJ,根据盖斯定律,①+②得H2(g)+2ICl(g)===I2(g)+2HCl(g) ΔH=-218 kJ·mol-1,故C正确;温度升高,活化分子百分数增大,从而使反应碰撞概率增大,反应速率加快,故D正确。故选A。
4. C 解析:生成过渡态2的步骤活化能最大,因此反应的决速步为生成过渡态2的步骤,故A正确;反应过程中断裂的化学键都是异种原子之间的键,属于极性键,故B正确;反应最终态无MgO,则MgO不是该反应的催化剂,故C错误;根据反应起始态和终末态可知,该反应的热化学方程式为:MgO(g)+CH4(g)===Mg(s)+CH3OH(g) ΔH=-146.1 kJ·mol-1,故D正确。故选C。
5. B 解析:由题意可知,乙烯生成环氧乙烷的反应为2CH2===CH2(g)+O2(g)2(g),该反应是熵减的反应,反应熵变ΔS<0,故A错误;由图可知,中间体生成吸附态CH3CHO(ads)的活化能为(-124 kJ·mol-1)-(-176 kJ·mol-1)=52 kJ·mol-1,故B正确;由图可知,环氧乙烷的能量高于乙醛,则环氧乙烷转化为乙醛的反应为反应物总能量大于生成物的总能量,反应的ΔH=-[(-148 kJ·mol-1)-(-282 kJ·mol-1)]=-102 kJ·mol-1,故C错误;反应的活化能越大,反应速率越慢,由图可知,乙烯环氧乙烷的活化能大于乙烯生成乙醛的活化能,则生成环氧乙烷的速率比生成乙醛的慢,故D错误。故选B。
6. D 解析:步骤I涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,氧更容易和H而不是和D生成羟基,若MO+与CHD2反应,生成的氘代甲醇可能为CHD2OD或CD3OH。
已知:直接参与化学键变化的元素被替换为更重的元素时,反应速率会变慢,MO+与CD4反应的能量变化应为图中曲线c,反应的活化能更大,故A错误;由图可知,步骤Ⅰ涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以涉及氢原子成键变化的是步骤Ⅰ,故B错误;直接参与化学键变化的元素被替换为更重的同位素时,反应速率会减慢,氧更容易和H而不是和D生成羟基,因此氘代甲醇的产量CH2DOD<CHD2OH,故C错误;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD或CD3OH,共两种,故D正确。故选D。
7. C 解析:由图可知,一氧化碳催化加氢生成甲醇的反应中有极性键的断裂和生成,故A正确;由图可知,总反应为放热反应,ΔH<0,故B正确;由图可知,吸附在催化剂表面的生成物总能量低于反应物的总能量,为放热过程,故C错误;反应的活化能越大,反应速率越慢,反应决速步为慢反应,由图可知,反应H2CO*,)+H*,)2===H3CO-H*,)的活化能最大,反应速率最慢,则反应决速步的活化能为0.35 eV-(-0.60 eV)=0.95 eV,故D正确。故选C。
8. C 解析:生成产物Ⅱ的反应的活化能更低,反应速率更快,且产物Ⅱ的能量更低即产物Ⅱ更稳定,以上2个角度均有利于产物Ⅱ,故A正确;根据前后结构对照,X为苯的加成产物,Y为苯的取代产物,故B正确;M的六元环中与—NO2相连的C为sp3杂化,苯中大π键发生改变,故C错误;苯的硝化反应中浓H2SO4作催化剂,故D正确。故选C。
9. C 解析:焓变等于生成物总能量减去反应物总能量,可知该反应ΔH=-183-(-76)=-107 kJ·mol-1,故A错误;改变催化剂能改变了反应过程,但不能改变了反应的焓变,故B错误;根据图中信息得到断开1 mol HCSH(g)中的全部化学键生成气态原子吸收的能量比SCH2(g)的少,故C正确;速率的大小与反应的活化能有关,通常活化能越高,反应速率越慢。根据图中信息,相同条件下,CSH2(g)转化为HCSH(g)的速率比HCSH(g)转化为SCH2(g)的大,故D错误。故选C。
10. C 解析:由图可知,Fe++N2O―→FeO++N2、FeO++CO―→Fe+CO2两步中均为反应物总能量大于生成物总能量,所以两个反应都是放热反应,故A正确;由反应可知,反应①中Fe+转化为FeO+,Fe的化合价升高,FeO+作氧化产物,同时FeO+是反应①的产物,也是反应②的反应物,在总反应中作中间产物,故B正确;由已知可知反应①为慢反应,而反应的活化能越大反应速率越慢,可知反应①的活化能大于反应②的活化能,故C错误;该过程总反应为:N2O+CO===CO2+N2,生成1 mol N2,转移2 mol电子,转移电子数目为:2×6.02×1023,故D正确。故选C。
同课章节目录
