3.2 离子键 离子晶体 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 3.2 离子键 离子晶体 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2 | 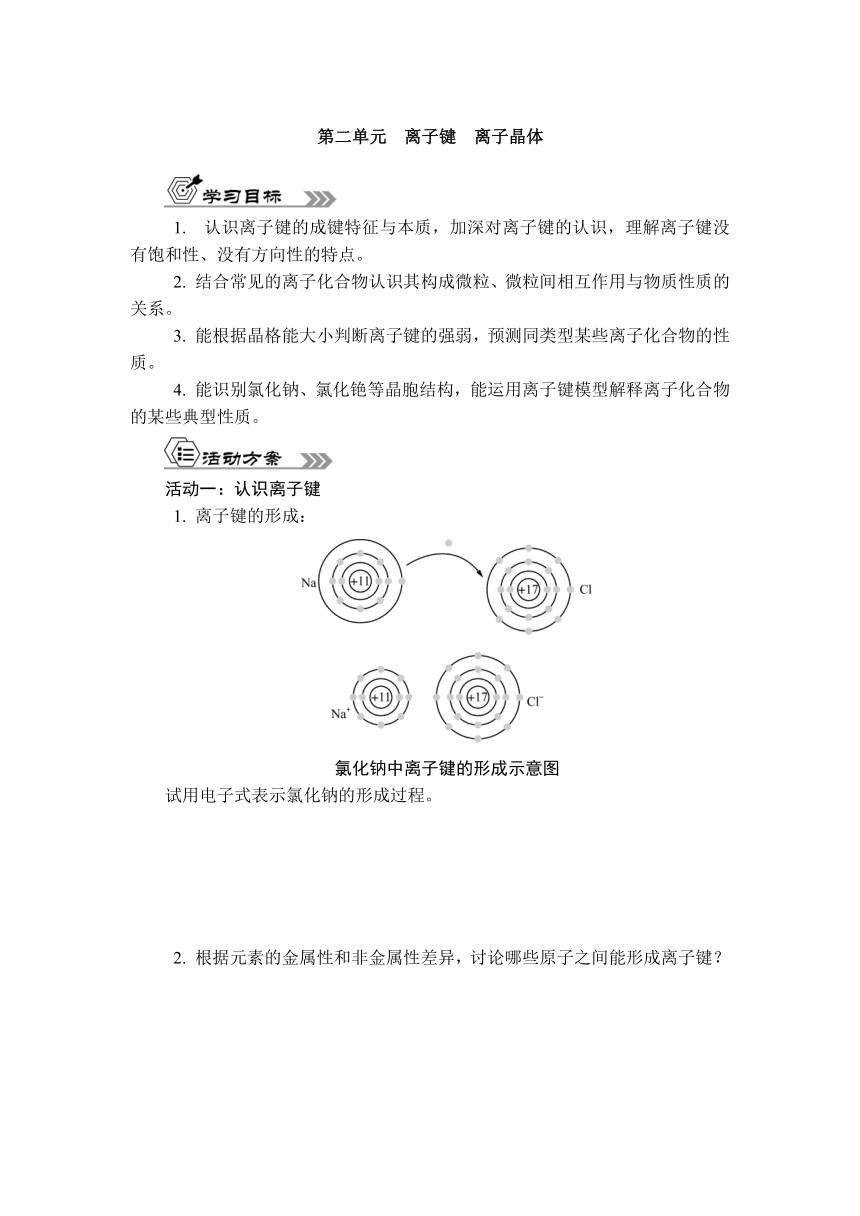 | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 14:01:24 | ||
图片预览




文档简介
第二单元 离子键 离子晶体
1. 认识离子键的成键特征与本质,加深对离子键的认识,理解离子键没有饱和性、没有方向性的特点。
2. 结合常见的离子化合物认识其构成微粒、微粒间相互作用与物质性质的关系。
3. 能根据晶格能大小判断离子键的强弱,预测同类型某些离子化合物的性质。
4. 能识别氯化钠、氯化铯等晶胞结构,能运用离子键模型解释离子化合物的某些典型性质。
1. 离子键的形成:
氯化钠中离子键的形成示意图
试用电子式表示氯化钠的形成过程。
2. 根据元素的金属性和非金属性差异,讨论哪些原子之间能形成离子键?
3. 书写下列离子或化合物的电子式。
(1) Mg2+_______________;OH-_______________;NH_______________;O________________。
(2) Na2O_______________;Na2O2_______________;Na3N_______________;MgCl2________________;NaOH________________;CaC2________________。
4. 阅读教材,阴、阳离子怎样才能形成稳定的离子键?结合电负性,讨论离子键的形成条件是什么?
5. 离子键成键有什么特征?
下图是一些离子晶体:
BaSO4 KAl(SO4)2·12H2O CaF2 CuSO4·5H2O
一些离子晶体
1. 什么是离子晶体?
2. 一般来说,离子晶体具有较高的熔点和一定的硬度,这些性质与离子晶体中离子间相互作用力的大小有关,如何衡量离子间相互作用的大小?什么是晶格能?
3. 晶格能大小与离子键的牢固性有什么关系?与熔点有什么关系?
4. 分析下表中的相关数据:
晶格能与离子化合物的物理性质
离子化合物 NaBr NaCl MgO
离子电荷数 1 1 2
核间距/pm 298 282 210
晶格能/(kJ/mol) 747 786 3 791
熔点/℃ 747 801 2 852
摩氏硬度 <2.5 2.5 6.5
讨论影响晶格能大小的因素有哪些?
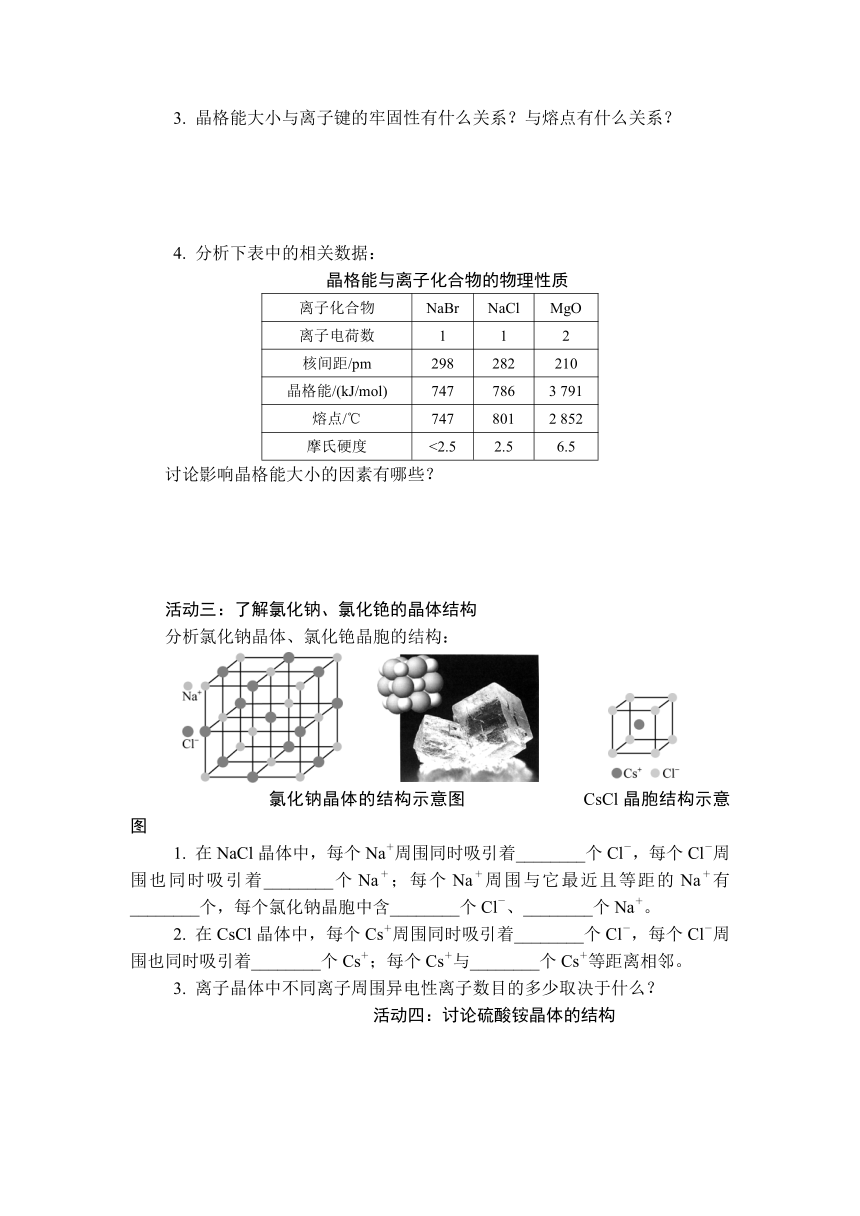
分析氯化钠晶体、氯化铯晶胞的结构:
氯化钠晶体的结构示意图 CsCl晶胞结构示意图
1. 在NaCl晶体中,每个Na+周围同时吸引着________个Cl-,每个Cl-周围也同时吸引着________个Na+;每个Na+周围与它最近且等距的Na+有________个,每个氯化钠晶胞中含________个Cl-、________个Na+。
2. 在CsCl晶体中,每个Cs+周围同时吸引着________个Cl-,每个Cl-周围也同时吸引着________个Cs+;每个Cs+与________个Cs+等距离相邻。
3. 离子晶体中不同离子周围异电性离子数目的多少取决于什么?
硫酸铵晶体的结构
阅读教材中视野拓展。NH与SO之间形成的是氢键还是离子键?
1. [2024苏州阶段练习]氟在自然界中常以CaF2的形式存在。下列有关CaF2的表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点比CaCl2低
C. CaF2的电子式为
D. CaF2中的化学键为离子键,故CaF2在熔融状态下能导电
2. 下列有关离子晶体的说法正确的是( )
A. 离子晶体中一定含有金属元素,含有金属元素的化合物一定是离子晶体
B. 离子键只存在于离子晶体中,离子晶体中一定含有离子键
C. 离子晶体中不可能含有共价键
D. 离子晶体受热熔化破坏化学键,吸收热量,属于化学变化
3. 氧化钙在2 973 K时熔化,而氯化钠在1 074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A. 氧化钙晶体中阴、阳离子所带的电荷数多
B. 氧化钙的晶格能比氯化钠的晶格能大
C. 氧化钙晶体在熔融状态下不导电
D. 在氧化钙与氯化钠的离子间距离和晶体结构类似的情况下,晶格能主要由阴、阳离子所带电荷数的多少决定
4. 下列叙述正确的是( )
A. 离子键有饱和性和方向性
B. 离子晶体只含有离子键
C. 有些离子晶体既含有离子键又含有共价键
D. 离子晶体中一定含有金属元素
5. 下列叙述错误的是( )
A. 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B. 在氯化钠晶体中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C. 任何离子键在形成的过程中必定有电子的得与失
D. 钠与氯气反应生成氯化钠后,体系能量降低
6. 下列每一组中的两种元素,形成离子化合物的倾向最强的是( )
A. H和Cl B. K和F C. Na和Cl D. K和I
7. [2024苏州震泽月考]有下列离子晶体的空间结构示意图,图中“”和化学式中M分别代表阳离子,图中“”和化学式中N分别代表阴离子,则化学式为MN3的晶体结构为( )
A B C D
8. ①NaF、②NaI、③MgO均为离子化合物,根据表中数据,推知这三种化合物的熔点高低顺序是( )
物质 ① ② ③
离子电荷数 1 1 2
键长/(10-10 m) 2.31 3.18 2.10
A. ①>②>③ B. ③>①>② C. ③>②>① D. ②>①>③
9. [2025 连云港阶段练习]下列性质中,可以证明某化合物中存在离子键的是( )
A. 可溶于水 B. 有较高的熔点
C. 水溶液能导电 D. 熔融状态下能导电
10. 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
A. 该晶体的阳离子与阴离子个数比为3∶1
B. 该晶体中Xn+离子中,n=1
C. 该晶体中每个N3-被6个等距离的Xn+包围
D. X元素的原子序数是19
11. [2025 无锡江阴期中]铁及其化合物在生活中有广泛应用。
(1) Fe在元素周期表中的位置是________________,位于元素周期表的________区。
(2) 铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图所示。储氢时,H2分子位于晶胞体心和棱的中心位置。该合金储满氢后所得晶体的化学式是________。
(3) FeBr2为只含有离子键的离子化合物,其晶胞结构如图,距离一个Fe2+最近的所有Br-(Br-为顶点)构成的几何形状为________。
12. 根据表格数据回答下列有关问题。
(1) 已知NaBr、NaCl、MgO三种离子晶体的核间距和晶格能如下表所示。
离子晶体 NaBr NaCl MgO
离子的核间距/pm 290 276 205
晶格能/(kJ/mol) 787 3 890
①NaBr晶体的晶格能比NaCl________(填“大”或“小”),主要原因是____
______________________________________________。
②MgO晶体的晶格能比NaCl大,主要原因是___________________________。
③NaBr、NaCl和MgO晶体中,熔点最高的是________。
(2) Mg是第3周期元素,该周期部分元素氟化物的熔点如下表所示。
氟化物 NaF MgF2 SiF4
熔点/K 1 266 1 534 183
解释表中氟化物熔点差异的原因:
①因为NaF与MgF2为离子晶体,SiF4为分子晶体(见本专题第四单元),所以NaF、MgF2的熔点远比SiF4高;
②____________________________________________________________________________________________________________。
第二单元 离子键 离子晶体
【活动方案】
活动一:
1.
2. 金属性较强的金属原子与非金属性较强的非金属原子之间易形成离子键,例如:ⅠA、ⅡA族元素与ⅥA、ⅦA族元素易形成离子键。
3. (1) Mg2+
(2)
4. 在离子化合物中,阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态。元素的电负性差值比较大。成键的两元素的电负性差用Δχ表示,一般情况下,当Δχ>1.7, 发生电子转移,形成离子键;当Δχ<1.7,不发生电子转移,形成共用电子对,原子间形成共价键。
5. 简单的阴、阳离子可以看成是球形对称的,电荷分布也是球形对称的,它们在空间各个方向上的静电作用相同,在各个方向上一个离子可同时吸引多个带相反电荷的离子,离子键没有方向性和饱和性。
活动二:
1. 由阴、阳离子按一定方式有规则地排列形成的晶体称为离子晶体。
2. 离子晶体中阴、阳离子间相互作用力的大小可用晶格能来衡量。晶格能是指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量。
3. 晶格能越大,离子键越牢固,晶体的熔点越高、硬度越大、稳定性越强。
4.
在离子晶体中,离子半径越小,离子所带的电荷数越多,则晶格能越大。晶格能越大,阴、阳离子间的离子键就越牢固,形成的离子晶体就越稳定,而且熔点越高,硬度越大。
活动三:
1. 6 6 12 4 4
2. 8 8 6
3. 取决于阴、阳离子的相对大小。
活动四:
氢键
【课堂反馈】
1. D Ca2+与F-间存在离子键,既存在静电吸引作用,又存在静电排斥作用,A错误;F-的离子半径小于Cl-,CaF2中所含离子键能大于CaCl2中所含离子键能,故CaF2的熔点比CaCl2高,B错误;书写电子式时,同种离子不能合并在一起书写,CaF2的电子式为 ,C错误;CaF2中的化学键为离子键,熔融时离子键被破坏,CaF2电离产生能自由移动的Ca2+和F-,CaF2在熔融状态下能导电,D正确。
2. B 离子晶体中不一定含有金属元素,含有金属元素的化合物不一定是离子晶体,A错误;含有离子键的化合物一定是离子晶体,离子晶体中可能含有共价键,B正确,C错误;离子晶体受热熔化时,虽然离子键被破坏,但没有生成新的物质,不属于化学变化,如氯化钠晶体熔化,D错误。
3. C 离子晶体熔、沸点与晶格能有关,晶格能与离子半径成反比、与电荷数成正比,二者离子间距离和晶体结构相似,氧化钙中氧离子所带电荷数大于氯离子、钙离子所带电荷数大于钠离子,故导致氧化钙熔点高于氯化钠,A正确;CaO中阴、阳离子电荷数均为2,NaCl中阴、阳离子电荷数均为1,故晶格能CaO>NaCl,B正确;CaO和NaCl都属于离子晶体,熔融状态下都可导电,C错误;二者熔点的高低可根据晶格能的大小判断,晶格能的大小与离子所带电荷数多少、离子间距离等因素有关,CaO和NaCl的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷数的多少决定,D正确。
4. C 离子键是带相反电荷的离子之间的相互作用,它是一种静电作用,没有方向性和饱和性,A错误;离子晶体有的只含有离子键,如NaCl等,有的既含有离子键又含有共价键,如NaOH等,B错误,C正确;离子晶体中不一定含有金属元素,如NH4Cl、NH4NO3等,D错误。
5. C 活泼的金属元素原子和活泼的非金属元素原子之间形成离子化合物,阳离子和阴离子均达到稳定结构,这样体系的能量降低,其结构的稳定性增强,A、D正确;在氯化钠晶体中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核等带同种电荷的粒子之间的排斥作用,B正确;离子键的形成只有阴、阳离子间的静电作用,并不一定发生电子的得与失,如Na+与OH-结合成NaOH,C错误。
6. B 活泼金属与活泼非金属之间最容易形成离子键,金属性越强,越容易失去电子,非金属性越强,越容易得到电子,因为同主族元素从上到下金属性依次增强,非金属性依次减弱,所以金属性K>Na,非金属性F>I,则K与F之间形成离子化合物的倾向最强,B符合题意。
7. B N(M)=8×=1,N(N)为1,则化学式为MN,A错误;N(M)=8×=1,N(N)=12×=3,则化学式为MN3,B正确;N(M)=4×=,N(N)=4×=,则化学式为MN,C错误;N(M)=8×+6×=4,N(N)=12×+1=4,则化学式为MN,D错误。
8. B 离子化合物的熔点高低主要取决于离子键的强弱(或晶格能的大小),离子所带电荷数越多、半径越小,则晶格能越大,B正确。
9. D 乙醇、硫酸等物质均易溶于水,但不含离子键,A不符合题意;二氧化硅、金刚石等物质的熔点很高,但不含离子键,B不符合题意;HCl的水溶液可以导电,但HCl中只含共价键,不含离子键,C不符合题意;化合物在熔融状态下能导电,说明其在熔融状态下能电离成离子,其组成中含有离子,存在离子键,D符合题意。
10. D 12个Xn+位于晶胞的棱上,其个数为12×=3,8个N3-位于晶胞的顶点,其个数为8×=1,故Xn+与N3-的个数比为3∶1,A正确;由晶体的化学式为X3N知,Xn+所带电荷数为1,B正确;N3-位于晶胞顶点,故其被6个X+在上、下、左、右、前、后包围,C正确;因为X+的K、L、M三个电子层全充满,每层电子数分别为2、8、18,所以X+为
Cu+,Cu的原子序数是29,D错误。
11. (1) 第4周期Ⅷ族 d
(2) Mg2FeH2
(3) 立方体(或正方体)
解析:(1) Fe是26号元素,位于元素周期表的第4周期Ⅷ族,在元素周期表中位于d区。(2) 晶胞中,Mg个数为8,N(Fe)=8×+6×=4,N(H2)=1+12×=4,N(Mg)∶N(Fe)∶N(H2)=8∶4∶4=2∶1∶1,晶体的化学式为Mg2FeH2。(3) FeBr2中,Fe2+与Br-的比值为1∶2,在晶胞中,大球个数为8,小球个数=8×+6×=4,故小球为Fe2+,大球为Br-,由晶胞图可知,距一个Fe2+最近的Br-有8个,构成的几何形状为立方体(或正方体)。
12. (1) ①小 NaBr晶体中离子的核间距比NaCl大 ②MgO晶体中阴、阳离子的电荷数多,并且离子的核间距小 ③MgO
(2) ②因为Mg2+的半径比Na+小且Mg2+所带电荷数较多,MgF2的离子键强度比NaF大,所以MgF2的熔点比NaF高
1. 认识离子键的成键特征与本质,加深对离子键的认识,理解离子键没有饱和性、没有方向性的特点。
2. 结合常见的离子化合物认识其构成微粒、微粒间相互作用与物质性质的关系。
3. 能根据晶格能大小判断离子键的强弱,预测同类型某些离子化合物的性质。
4. 能识别氯化钠、氯化铯等晶胞结构,能运用离子键模型解释离子化合物的某些典型性质。
1. 离子键的形成:
氯化钠中离子键的形成示意图
试用电子式表示氯化钠的形成过程。
2. 根据元素的金属性和非金属性差异,讨论哪些原子之间能形成离子键?
3. 书写下列离子或化合物的电子式。
(1) Mg2+_______________;OH-_______________;NH_______________;O________________。
(2) Na2O_______________;Na2O2_______________;Na3N_______________;MgCl2________________;NaOH________________;CaC2________________。
4. 阅读教材,阴、阳离子怎样才能形成稳定的离子键?结合电负性,讨论离子键的形成条件是什么?
5. 离子键成键有什么特征?
下图是一些离子晶体:
BaSO4 KAl(SO4)2·12H2O CaF2 CuSO4·5H2O
一些离子晶体
1. 什么是离子晶体?
2. 一般来说,离子晶体具有较高的熔点和一定的硬度,这些性质与离子晶体中离子间相互作用力的大小有关,如何衡量离子间相互作用的大小?什么是晶格能?
3. 晶格能大小与离子键的牢固性有什么关系?与熔点有什么关系?
4. 分析下表中的相关数据:
晶格能与离子化合物的物理性质
离子化合物 NaBr NaCl MgO
离子电荷数 1 1 2
核间距/pm 298 282 210
晶格能/(kJ/mol) 747 786 3 791
熔点/℃ 747 801 2 852
摩氏硬度 <2.5 2.5 6.5
讨论影响晶格能大小的因素有哪些?
分析氯化钠晶体、氯化铯晶胞的结构:
氯化钠晶体的结构示意图 CsCl晶胞结构示意图
1. 在NaCl晶体中,每个Na+周围同时吸引着________个Cl-,每个Cl-周围也同时吸引着________个Na+;每个Na+周围与它最近且等距的Na+有________个,每个氯化钠晶胞中含________个Cl-、________个Na+。
2. 在CsCl晶体中,每个Cs+周围同时吸引着________个Cl-,每个Cl-周围也同时吸引着________个Cs+;每个Cs+与________个Cs+等距离相邻。
3. 离子晶体中不同离子周围异电性离子数目的多少取决于什么?
硫酸铵晶体的结构
阅读教材中视野拓展。NH与SO之间形成的是氢键还是离子键?
1. [2024苏州阶段练习]氟在自然界中常以CaF2的形式存在。下列有关CaF2的表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点比CaCl2低
C. CaF2的电子式为
D. CaF2中的化学键为离子键,故CaF2在熔融状态下能导电
2. 下列有关离子晶体的说法正确的是( )
A. 离子晶体中一定含有金属元素,含有金属元素的化合物一定是离子晶体
B. 离子键只存在于离子晶体中,离子晶体中一定含有离子键
C. 离子晶体中不可能含有共价键
D. 离子晶体受热熔化破坏化学键,吸收热量,属于化学变化
3. 氧化钙在2 973 K时熔化,而氯化钠在1 074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A. 氧化钙晶体中阴、阳离子所带的电荷数多
B. 氧化钙的晶格能比氯化钠的晶格能大
C. 氧化钙晶体在熔融状态下不导电
D. 在氧化钙与氯化钠的离子间距离和晶体结构类似的情况下,晶格能主要由阴、阳离子所带电荷数的多少决定
4. 下列叙述正确的是( )
A. 离子键有饱和性和方向性
B. 离子晶体只含有离子键
C. 有些离子晶体既含有离子键又含有共价键
D. 离子晶体中一定含有金属元素
5. 下列叙述错误的是( )
A. 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B. 在氯化钠晶体中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C. 任何离子键在形成的过程中必定有电子的得与失
D. 钠与氯气反应生成氯化钠后,体系能量降低
6. 下列每一组中的两种元素,形成离子化合物的倾向最强的是( )
A. H和Cl B. K和F C. Na和Cl D. K和I
7. [2024苏州震泽月考]有下列离子晶体的空间结构示意图,图中“”和化学式中M分别代表阳离子,图中“”和化学式中N分别代表阴离子,则化学式为MN3的晶体结构为( )
A B C D
8. ①NaF、②NaI、③MgO均为离子化合物,根据表中数据,推知这三种化合物的熔点高低顺序是( )
物质 ① ② ③
离子电荷数 1 1 2
键长/(10-10 m) 2.31 3.18 2.10
A. ①>②>③ B. ③>①>② C. ③>②>① D. ②>①>③
9. [2025 连云港阶段练习]下列性质中,可以证明某化合物中存在离子键的是( )
A. 可溶于水 B. 有较高的熔点
C. 水溶液能导电 D. 熔融状态下能导电
10. 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
A. 该晶体的阳离子与阴离子个数比为3∶1
B. 该晶体中Xn+离子中,n=1
C. 该晶体中每个N3-被6个等距离的Xn+包围
D. X元素的原子序数是19
11. [2025 无锡江阴期中]铁及其化合物在生活中有广泛应用。
(1) Fe在元素周期表中的位置是________________,位于元素周期表的________区。
(2) 铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图所示。储氢时,H2分子位于晶胞体心和棱的中心位置。该合金储满氢后所得晶体的化学式是________。
(3) FeBr2为只含有离子键的离子化合物,其晶胞结构如图,距离一个Fe2+最近的所有Br-(Br-为顶点)构成的几何形状为________。
12. 根据表格数据回答下列有关问题。
(1) 已知NaBr、NaCl、MgO三种离子晶体的核间距和晶格能如下表所示。
离子晶体 NaBr NaCl MgO
离子的核间距/pm 290 276 205
晶格能/(kJ/mol) 787 3 890
①NaBr晶体的晶格能比NaCl________(填“大”或“小”),主要原因是____
______________________________________________。
②MgO晶体的晶格能比NaCl大,主要原因是___________________________。
③NaBr、NaCl和MgO晶体中,熔点最高的是________。
(2) Mg是第3周期元素,该周期部分元素氟化物的熔点如下表所示。
氟化物 NaF MgF2 SiF4
熔点/K 1 266 1 534 183
解释表中氟化物熔点差异的原因:
①因为NaF与MgF2为离子晶体,SiF4为分子晶体(见本专题第四单元),所以NaF、MgF2的熔点远比SiF4高;
②____________________________________________________________________________________________________________。
第二单元 离子键 离子晶体
【活动方案】
活动一:
1.
2. 金属性较强的金属原子与非金属性较强的非金属原子之间易形成离子键,例如:ⅠA、ⅡA族元素与ⅥA、ⅦA族元素易形成离子键。
3. (1) Mg2+
(2)
4. 在离子化合物中,阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴离子的核外电子与阳离子的核外电子之间、阴离子的原子核与阳离子的原子核之间的静电斥力使阴、阳离子相互排斥。当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量最低状态。元素的电负性差值比较大。成键的两元素的电负性差用Δχ表示,一般情况下,当Δχ>1.7, 发生电子转移,形成离子键;当Δχ<1.7,不发生电子转移,形成共用电子对,原子间形成共价键。
5. 简单的阴、阳离子可以看成是球形对称的,电荷分布也是球形对称的,它们在空间各个方向上的静电作用相同,在各个方向上一个离子可同时吸引多个带相反电荷的离子,离子键没有方向性和饱和性。
活动二:
1. 由阴、阳离子按一定方式有规则地排列形成的晶体称为离子晶体。
2. 离子晶体中阴、阳离子间相互作用力的大小可用晶格能来衡量。晶格能是指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量。
3. 晶格能越大,离子键越牢固,晶体的熔点越高、硬度越大、稳定性越强。
4.
在离子晶体中,离子半径越小,离子所带的电荷数越多,则晶格能越大。晶格能越大,阴、阳离子间的离子键就越牢固,形成的离子晶体就越稳定,而且熔点越高,硬度越大。
活动三:
1. 6 6 12 4 4
2. 8 8 6
3. 取决于阴、阳离子的相对大小。
活动四:
氢键
【课堂反馈】
1. D Ca2+与F-间存在离子键,既存在静电吸引作用,又存在静电排斥作用,A错误;F-的离子半径小于Cl-,CaF2中所含离子键能大于CaCl2中所含离子键能,故CaF2的熔点比CaCl2高,B错误;书写电子式时,同种离子不能合并在一起书写,CaF2的电子式为 ,C错误;CaF2中的化学键为离子键,熔融时离子键被破坏,CaF2电离产生能自由移动的Ca2+和F-,CaF2在熔融状态下能导电,D正确。
2. B 离子晶体中不一定含有金属元素,含有金属元素的化合物不一定是离子晶体,A错误;含有离子键的化合物一定是离子晶体,离子晶体中可能含有共价键,B正确,C错误;离子晶体受热熔化时,虽然离子键被破坏,但没有生成新的物质,不属于化学变化,如氯化钠晶体熔化,D错误。
3. C 离子晶体熔、沸点与晶格能有关,晶格能与离子半径成反比、与电荷数成正比,二者离子间距离和晶体结构相似,氧化钙中氧离子所带电荷数大于氯离子、钙离子所带电荷数大于钠离子,故导致氧化钙熔点高于氯化钠,A正确;CaO中阴、阳离子电荷数均为2,NaCl中阴、阳离子电荷数均为1,故晶格能CaO>NaCl,B正确;CaO和NaCl都属于离子晶体,熔融状态下都可导电,C错误;二者熔点的高低可根据晶格能的大小判断,晶格能的大小与离子所带电荷数多少、离子间距离等因素有关,CaO和NaCl的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷数的多少决定,D正确。
4. C 离子键是带相反电荷的离子之间的相互作用,它是一种静电作用,没有方向性和饱和性,A错误;离子晶体有的只含有离子键,如NaCl等,有的既含有离子键又含有共价键,如NaOH等,B错误,C正确;离子晶体中不一定含有金属元素,如NH4Cl、NH4NO3等,D错误。
5. C 活泼的金属元素原子和活泼的非金属元素原子之间形成离子化合物,阳离子和阴离子均达到稳定结构,这样体系的能量降低,其结构的稳定性增强,A、D正确;在氯化钠晶体中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核等带同种电荷的粒子之间的排斥作用,B正确;离子键的形成只有阴、阳离子间的静电作用,并不一定发生电子的得与失,如Na+与OH-结合成NaOH,C错误。
6. B 活泼金属与活泼非金属之间最容易形成离子键,金属性越强,越容易失去电子,非金属性越强,越容易得到电子,因为同主族元素从上到下金属性依次增强,非金属性依次减弱,所以金属性K>Na,非金属性F>I,则K与F之间形成离子化合物的倾向最强,B符合题意。
7. B N(M)=8×=1,N(N)为1,则化学式为MN,A错误;N(M)=8×=1,N(N)=12×=3,则化学式为MN3,B正确;N(M)=4×=,N(N)=4×=,则化学式为MN,C错误;N(M)=8×+6×=4,N(N)=12×+1=4,则化学式为MN,D错误。
8. B 离子化合物的熔点高低主要取决于离子键的强弱(或晶格能的大小),离子所带电荷数越多、半径越小,则晶格能越大,B正确。
9. D 乙醇、硫酸等物质均易溶于水,但不含离子键,A不符合题意;二氧化硅、金刚石等物质的熔点很高,但不含离子键,B不符合题意;HCl的水溶液可以导电,但HCl中只含共价键,不含离子键,C不符合题意;化合物在熔融状态下能导电,说明其在熔融状态下能电离成离子,其组成中含有离子,存在离子键,D符合题意。
10. D 12个Xn+位于晶胞的棱上,其个数为12×=3,8个N3-位于晶胞的顶点,其个数为8×=1,故Xn+与N3-的个数比为3∶1,A正确;由晶体的化学式为X3N知,Xn+所带电荷数为1,B正确;N3-位于晶胞顶点,故其被6个X+在上、下、左、右、前、后包围,C正确;因为X+的K、L、M三个电子层全充满,每层电子数分别为2、8、18,所以X+为
Cu+,Cu的原子序数是29,D错误。
11. (1) 第4周期Ⅷ族 d
(2) Mg2FeH2
(3) 立方体(或正方体)
解析:(1) Fe是26号元素,位于元素周期表的第4周期Ⅷ族,在元素周期表中位于d区。(2) 晶胞中,Mg个数为8,N(Fe)=8×+6×=4,N(H2)=1+12×=4,N(Mg)∶N(Fe)∶N(H2)=8∶4∶4=2∶1∶1,晶体的化学式为Mg2FeH2。(3) FeBr2中,Fe2+与Br-的比值为1∶2,在晶胞中,大球个数为8,小球个数=8×+6×=4,故小球为Fe2+,大球为Br-,由晶胞图可知,距一个Fe2+最近的Br-有8个,构成的几何形状为立方体(或正方体)。
12. (1) ①小 NaBr晶体中离子的核间距比NaCl大 ②MgO晶体中阴、阳离子的电荷数多,并且离子的核间距小 ③MgO
(2) ②因为Mg2+的半径比Na+小且Mg2+所带电荷数较多,MgF2的离子键强度比NaF大,所以MgF2的熔点比NaF高
