3.4 课时1 范德华力 氢键 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 3.4 课时1 范德华力 氢键 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 14:01:43 | ||
图片预览




文档简介
课时1 范德华力 氢键
1. 了解范德华力的类型,初步认识影响范德华力的主要因素,认识范德华力对物质性质的影响。
2. 了解氢键的本质,能从微观角度理解氢键的特征、表示方法及形成条件。
3. 了解氢键对物质性质的影响。
1. 下表是卤素单质的相对分子质量和熔、沸点:
卤素单质的相对分子质量和熔、沸点
化学式 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.8
I2 254 113.5 184.4
(1) 卤素单质的熔、沸点有怎样的变化规律?
(2) 导致卤素单质熔、沸点规律变化的原因是什么?它与卤素单质相对分子质量的变化规律有怎样的关系?
2. 阅读教材,什么是范德华力?结合下表,讨论范德华力与共价键有什么不同?范德华力有什么特点?
卤化氢分子的范德华力和化学键的比较
分子 范德华力/(kJ/mol) 键能/(kJ/mol)
HCl 21.14 432
HBr 23.11 366
HI 26.00 298
3. 范德华力大小与哪些因素有关?卤素的氢化物的分子间范德华力和分子内的共价键的强弱变化规律是否相同?
1. 如图是卤素单质的熔、沸点与相对分子质量关系图,你能得出什么结论?烷烃的熔、沸点随着相对分子质量的增大而增大的原因是什么?
卤素单质的熔、沸点与
相对分子质量的关系
2. 范德华力对物质的溶解度也有影响。
(1) 阅读教材,范德华力对物质的溶解度有什么影响?
(2) 甲烷为什么难溶于水,而氯化氢易溶于水?
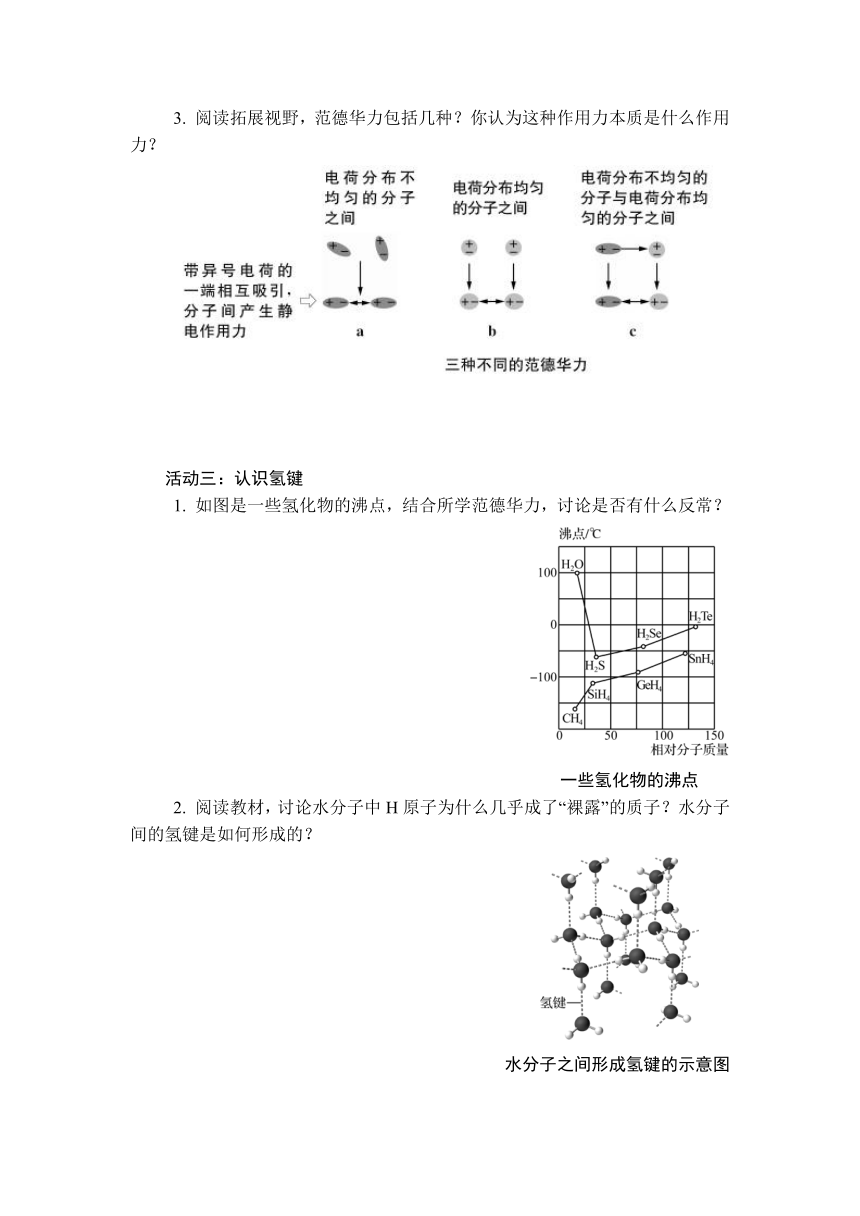
3. 阅读拓展视野,范德华力包括几种?你认为这种作用力本质是什么作用力?
1. 如图是一些氢化物的沸点,结合所学范德华力,讨论是否有什么反常?
一些氢化物的沸点
2. 阅读教材,讨论水分子中H原子为什么几乎成了“裸露”的质子?水分子间的氢键是如何形成的?
水分子之间形成氢键的示意图
3. 阅读教材的方法导引,了解氢键的形成、表示方法和氢键的作用力大小。
(1) 氢键有哪几种类型?氢键的作用力大小如何?
(2) 氢键是如何形成的?如何表示氢键?哪些原子间易形成氢键?
(3) 讨论氢键是否属于化学键?是否有饱和性和方向性?
4. 讨论氢键的存在和对物质性质的影响。
(1) 阅读教材,你认为氢键只是物质在液态时形成吗?氢键是否会对物质的聚集状态产生影响?
(2) 分子间氢键对熔、沸点产生怎样的影响?水的沸点为什么高于硫化氢?
(3) 含有氢键的液体一般黏度较大,如甘油、浓硫酸等。氢键的存在对物质在水中的溶解度有什么影响?举例说明。
(4) 虽然HF分子间氢键比H2O分子间氢键更强,但液体氟化氢的蒸发热却比水的蒸发热低,试解释其原因。
1. 讨论氢键的类别有哪些?哪些分子存在分子内氢键?
2. 讨论:分子间氢键和分子内氢键对物质在水中的溶解性影响是否相同?为什么对羟基苯甲醛的熔点高于邻羟基苯甲醛?
3. 醋酸、硝酸是相对分子质量相近的两种分子,但这两种物质的熔点和沸点相差较大。醋酸的熔点为16.6 ℃,在温度低于16.6 ℃时即凝结成冰块状的固体;常温下硝酸是一种具有挥发性的液体。试根据上述两种物质熔、沸点差异较大的事实,分析它们可能含有的氢键,并查阅文献加以证实。
醋酸(a)、硝酸(b)的结构式
4. 氢键对物质密度也存在影响,使冰的密度比水小,冰浮在水上面,为什么?
水分子间的氢键
5. 阅读教材,了解氢键的存在和在生活、生产中的应用。
纸张、衣物、皮革、煤炭、润滑油脂以及棉花等纤维素类材料中,蛋白质和核酸中都有氢键存在,肌肉的运动也与氢键的形成与断裂有关。色谱技术、极谱分析法以及吸附等方法与氢键有关。煤中的氢键对煤的性质、结构及转化等都有重要的影响,通过煤中氢键的调控可以实现煤的优化和高效转化。
6. 比较化学键、范德华力、氢键,填写下表。
作用力 化学键 范德华力 氢键
概念
大小/(kJ/mol) 120~800 几至十几个 几至数十个
性质影响
大小关系
7. 阅读教材中的学科提炼,了解弱作用力的“强作用”。
(1) 微粒间作用力中哪些作用力是较强的作用力,哪些作用力是弱作用力?
(2) 蛋白质和酶等大分子的生物功能与它们的构象密切相关,而这些令人叹为观止的、高度有序的三维结构是依靠什么作用力建立起来的?
(3) 超分子化学中的万能相互作用是什么?
1. 下列关于范德华力的叙述正确的是( )
A. 是一种较弱的化学键
B. 分子间存在的较强的相互作用
C. 直接影响所有物质的熔、沸点
D. 稀有气体的分子间存在范德华力
2. 下列物质的性质可用氢键来解释的是( )
A. HF、HCl、HBr、HI的热稳定性依次减弱
B. F2、Cl2、Br2、I2的熔、沸点依次升高
C. 苯酚、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱
D. CH3—O—CH3、C2H5OH的沸点依次升高
3. [2024南通海安阶段练习]下列说法正确的是( )
A. 金刚石与石墨烯中的C—C—C夹角都为120°
B. ⅣA族元素氧化物的晶体类型相同
C. 沸点:SiCl4>GeCl4
D. SiH4、SiCl4都是由极性键构成的非极性分子
4. 二甘醇可作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是 ( )
A. 符合通式CnH2nO3
B. 分子间能形成氢键
C. 分子间不存在范德华力
D. 能溶于水,不溶于乙醇
5. [2024苏州昆山期末]下列说法正确的是( )
A. Cl2、Br2、I2的沸点逐渐升高,是因为共价键键能越来越大
B. N2、CCl4、P4三种分子中,每个原子的最外层都具有8电子稳定结构
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 石英晶体和干冰晶体熔、沸点不同,是因为所含化学键类型不同
6. [2024宿迁期末]下列变化过程克服了分子间作用力的是( )
A. KNO3熔化 B. NaCl溶解
C. 干冰升华 D. NH3分解
7. 氨气极易溶于水的原因之一与氢键有关。请判断NH3溶于水后,形成的NH3·H2O的合理结构是( )
A. B.
C. D.
8. 正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3通过氢键相连(如图所示)。下列有关说法正确的是( )
A. 正硼酸晶体属于离子晶体,熔点很高
B. H3BO3的化学性质主要与氢键有关
C. 1 mol H3BO3晶体中有6 mol氢键
D. 分子中硼原子最外层不是8电子稳定结构
9. [2024无锡期末]我国深海开采可燃冰技术世界领先。可燃冰的部分结构如图所示(图中忽略了原子的相对大小),其结构可以看作是水分子构建的笼子中锁住了甲烷。下列有关说法正确的是( )
A. CH4和H2O之间通过共价键结合
B. H2O和H2O分子之间存在氢键
C. CH4和H2O分子之间存在氢键
D. 可燃冰气化时破坏了化学键
10. 下列两组说法中,Ⅱ组中说法正确,且能用Ⅰ组中的说法加以解释的是( )
选项 Ⅰ组 Ⅱ组
A 相对分子质量:HCl>HF 沸点:HCl高于HF
B 键能:H—O>H—S 沸点:H2O高于H2S
C 分子间作用力:H2O>H2S 稳定性:H2O强于H2S
D 相对分子质量:HI>HCl 沸点:HI高于HCl
11. (1) 能以任意比与水混溶,原因是___________________________
_________________________________。
(2) 相同条件下, 的沸点比 的高,其主要原因是______________________________________________________________。
(3) 噻吩()、吡咯()是类似于苯的芳香族化合物,环中的五个原子形成了大π键。噻吩难溶于水,吡咯能溶于水,原因是_______________________
____________________________________。
(4) 比较对硝基苯酚()与对氨基苯酚(),熔点较高的是 (填名称),原因是_____________________________________。
课时1 范德华力 氢键
【活动方案】
活动一:
1. (1) 从F2到I2,卤素单质的熔、沸点依次增大。
(2) 从F2到I2,卤素单质的熔、沸点增大,说明不同的卤素单质分子间存在的作用力的大小不同,这种作用力决定单质的物理性质,如熔、沸点。随着相对分子质量的增大,这种分子间的作用力依次增大。
2. 范德华力是一种普遍存在于固体、液体和气体中分子之间的作用力。与共价键不同,范德华力比较小,且一般没有饱和性和方向性。只要分子周围空间允许,当气体分子凝聚时,它总是尽可能多地吸引其他分子。
3. 影响范德华力的因素很多,如分子的大小、分子的空间结构以及分子中电荷分布是否均匀等。对于组成和结构相似的分子(如卤素单质) ,其范德华力一般随着相对分子质量的增大而增大。卤素的氢化物的分子间范德华力和分子的共价键的强弱变化规律不相同。卤素的氢化物的分子间范德华力依次增强,而分子内的共价键依次减弱。
活动二:
1. 随着相对分子质量的增大,范德华力增大,卤素单质的熔、沸点也相应升高。烷烃的熔、沸点随着相对分子质量的增大而增大是因为范德华力随着相对分子质量增大而增大。
2. (1) 分子间范德华力越大,物质的溶解度越大。
(2) 溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大。甲烷和氯化氢的溶解性差异是因为分子结构和分子中电荷分布不同,使CH4与H2O范德华力很小,所以CH4几乎不溶于水,HCl与H2O范德华力较大,HCl极易溶于水中。
3. 范德华力包括三种。本质上也是分子之间的静电作用力。
活动三:
1. 水分子的相对分子质量小于硫化氢,理论上硫化氢的沸点应高于水,实际水的沸点高于硫化氢,出现反常。
2. 水分子中的O—H键是极性共价键,氧原子与氢原子共用的电子对强烈地偏向氧原子,使H原子几乎成了“裸露”的质子。这样,一个水分子中相对显正电性的氢原子,就能与另一个水分子中相对显负电性的氧原子的孤电子对接近并产生相互作用,这种相互作用叫作氢键(hydrogen bond)。
3. (1) 氢键有分子内氢键和分子间氢键两种,氢键比化学键弱,比范德华力强。
(2) H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y的孤电子对接近并产生相互作用,即形成氢键,通常用X—H…Y表示。其中X、Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮原子。
(3) 氢键不属于化学键,但有方向性和饱和性。
4. (1) 氢键一般是物质在液态时形成,但有时也存在于某些晶体和气态物质中,如HF在三种状态中均存在氢键。分子间氢键的形成,对物质的聚集状态会产生影响,使其物理性质发生明显的变化。
(2) 当分子间存在氢键时,若要使相应的物质熔化或汽化,破坏分子间的氢键需要消耗很多的能量,所以这些物质有较高的熔点和沸点。图中H2O、HF、NH3的分子之间既存在范德华力,又存在氢键,冰融化或水汽化不仅要破坏范德华力,还必须提供额外的能量破坏分子间的氢键。
(3) 氢键存在可以使溶质在水中的溶解度增大,如NH3极易溶解于水,主要是由于氨分子和水分子之间形成了氢键,彼此互相缔合,因而加大溶解。
(4) 因为1个H2O平均可以形成2个氢键,1个HF平均只形成1个氢键,所以总的作用力,H2O分子间的氢键高,所以其蒸发热高。
活动四:
1. 氢键包括分子间氢键和分子内氢键。邻羟基苯甲醛()、HNO3均存在分子内氢键。
2. 不同,因为分子内氢键减少了溶质分子与水分子形成氢键的机会,从而阻碍溶解,降低溶解性;分子间氢键能提升溶解性。邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键。当对羟基苯甲醛熔融时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲醛的熔点高于邻羟基苯甲醛。
3. 醋酸存在分子间氢键使其熔点升高,而硝酸分子存在分子内氢键使其熔点降低,硝酸熔融后分子内氢键被破坏,所以也易挥发。
4. 大多数物质在固态时的密度要比液态时大,而水是一个例外。冰中所有水分子中的氢原子都参与形成氢键,使水分子之间的间隙增大,由此形成一个有很多“孔洞”的结构,使冰的密度小于水,所以冰浮于水上。
6. 相邻的两个或多个原子之间强烈的相互作用 物质的分子间存在的微弱的相互作用 已经与电负性很大的原子形成共价键的氢原子与另一个分子中电负性很大的原子之间的作用力 主要影响物质的化学性质 主要影响物质的物理性质 主要影响物质的物理性质 化学键>氢键>范德华力
7. (1) 化学键(离子键、共价键、金属键)是发生在原子或离子之间的作用力,属于较强的作用力。分子与分子之间存在的相互作用力(范德华力、氢键等),比化学键要弱得多,属于弱作用力。
(2) 蛋白质和酶等大分子的三维结构是依靠范德华力和氢键建立起来的。
(3) 氢键是超分子化学中的万能相互作用。
【课堂反馈】
1. D 范德华力是分子间存在的较弱的相互作用,它不是化学键,A错误;范德华力比化学键弱得多,是分子间存在的较弱的相互作用, B错误;范德华力只能影响由分子构成的物质的熔、沸点,C错误;稀有气体为单原子分子,分子之间存在范德华力,D正确。
2. D HF、HCl、HBr、HI都是共价化合物,热稳定性与共价键强弱有关,与氢键无关,A不符合题意;F2、Cl2、Br2、I2的熔、沸点与范德华力有关,B不符合题意;—OH上氢原子的活泼性与和—OH相连的原子或基团的吸电子能力有关,与氢键无关,C不符合题意;CH3—O—CH3、C2H5OH的沸点依次升高是因为乙醇分子间能形成氢键,D符合题意。
3. D 金刚石中的碳原子为正四面体结构,C—C—C夹角为109°28′,A错误;CO2为分子晶体,SiO2为共价晶体,B错误;SiCl4与GeCl4均为分子晶体,GeCl4的相对分子质量大,范德华力大,熔、沸点较高,沸点GeCl4>SiCl4,C错误;SiH4中的Si—H为极性键,为正四面体,正、负电荷重心重合,为非极性分子,SiCl4中的Si—Cl为极性键,为正四面体,正、负电荷重心重合,为非极性分子,D正确。
4. B 二甘醇的分子式为C4H10O3,不符合通式CnH2nO3,A错误;羟基上的氢原子与另一个羟基上的氧原子可以形成分子间氢键,B正确;二甘醇属于分子晶体,存在范德华力,C错误;二甘醇与乙醇能形成分子间氢键,因此二甘醇能溶于乙醇,D错误。
5. B Cl2、Br2、I2均为分子晶体,分子间只存在分子间作用力,其相对分子质量逐渐增加,故其分子间作用力逐渐增强,其沸点逐渐升高,与共价键键能无关,A错误;N2中N原子的最外层电子数为5,形成3个共用电子对,故每个原子的最外层都具有8电子稳定结构,CCl4中每个原子的最外层都具有8电子稳定结构, P4分子中,每个P原子的最外层电子数为5,形成3个共价键,都具有8电子稳定结构,B正确;氢键是一种较强的分子间作用力,主要影响物质的熔沸点、密度、溶解度等物理性质,而分子的稳定性由共价键的强弱决定,HF的稳定性很强,是因为H—F的键能较大,与氢键无关,C错误;石英(SiO2)晶体为共价晶体,晶体内只含有共价键,干冰(CO2)为分子晶体,晶体内只存在分子间作用力,共价晶体熔化时,晶体内共价键会发生断裂,而分子晶体熔化时,仅需要克服分子间作用力,故一般共价晶体的熔、沸点高于分子晶体,D错误。
6. C KNO3是离子晶体,K+、NO间的作用力是离子键,KNO3熔化破坏了离子键,A错误;NaCl是离子晶体,NaCl溶解电离出Na+和Cl-,破坏了离子键,B错误;干冰升华,克服的是分子间作用力,C正确;NH3分解产生N2和H2,破坏的是共价键,D错误。
7. B NH3溶于水后形成NH3·H2O,NH3·H2O的电离方程式为NH3·H2O NH+OH-,可知其结构中含有铵根离子和氢氧根离子。故选B。
8. D 层内的H3BO3通过氢键相连,正硼酸晶体属于分子晶体,熔点低,A错误;H3BO3的化学性质主要与分子内共价键有关,与氢键无关,B错误;1分子H3BO3参与形成6个氢键,每个氢键被2分子H3BO3共享,则1 mol H3BO3晶体中有3 mol氢键,C错误;分子中硼原子最外层只有6个电子,不是8电子稳定结构,D正确。
9. B CH4和H2O之间通过范德华力结合,A错误;氧元素的电负性比较大,与另一水分子中的氢元素形成氢键,H2O和H2O分子之间存在氢键,B正确;CH4和H2O分子之间不存在氢键,C错误;可燃冰气化时破坏了分子间作用力,D错误。
10. D 由于相对分子质量HCl>HF,所以范德华力HCl>HF,但HF分子间存在氢键,而HCl分子间不存在氢键,所以HCl的沸点低于HF,说法Ⅱ不正确,A错误;由于原子半径OH—S,但沸点与共价键的键能无关,H2O分子间存在氢键,所以H2O的沸点高于H2S,说法Ⅰ不能解释说法Ⅱ,B错误;由于相对分子质量H2S>H2O,所以范德华力H2S>H2O,但H2O分子间存在氢键,所以分子间作用力H2O>H2S,由于键能H—O>H—S,所以H2O的稳定性强于H2S,分子的稳定性与分子间作用力无关,说法Ⅰ不能解释说法Ⅱ,C错误;由于相对分子质量HI>HCl,所以范德华力HI>HCl,HI的沸点高于HCl,说法Ⅰ能解释说法Ⅱ,D正确。
11. (1) 为极性分子,并且能与水形成分子间氢键
(2) 分子间存在氢键
(3) 吡咯能与水形成分子间氢键,而噻吩不能
(4) 对氨基苯酚 对氨基苯酚可形成更多的分子间氢键,熔点较高
1. 了解范德华力的类型,初步认识影响范德华力的主要因素,认识范德华力对物质性质的影响。
2. 了解氢键的本质,能从微观角度理解氢键的特征、表示方法及形成条件。
3. 了解氢键对物质性质的影响。
1. 下表是卤素单质的相对分子质量和熔、沸点:
卤素单质的相对分子质量和熔、沸点
化学式 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.8
I2 254 113.5 184.4
(1) 卤素单质的熔、沸点有怎样的变化规律?
(2) 导致卤素单质熔、沸点规律变化的原因是什么?它与卤素单质相对分子质量的变化规律有怎样的关系?
2. 阅读教材,什么是范德华力?结合下表,讨论范德华力与共价键有什么不同?范德华力有什么特点?
卤化氢分子的范德华力和化学键的比较
分子 范德华力/(kJ/mol) 键能/(kJ/mol)
HCl 21.14 432
HBr 23.11 366
HI 26.00 298
3. 范德华力大小与哪些因素有关?卤素的氢化物的分子间范德华力和分子内的共价键的强弱变化规律是否相同?
1. 如图是卤素单质的熔、沸点与相对分子质量关系图,你能得出什么结论?烷烃的熔、沸点随着相对分子质量的增大而增大的原因是什么?
卤素单质的熔、沸点与
相对分子质量的关系
2. 范德华力对物质的溶解度也有影响。
(1) 阅读教材,范德华力对物质的溶解度有什么影响?
(2) 甲烷为什么难溶于水,而氯化氢易溶于水?
3. 阅读拓展视野,范德华力包括几种?你认为这种作用力本质是什么作用力?
1. 如图是一些氢化物的沸点,结合所学范德华力,讨论是否有什么反常?
一些氢化物的沸点
2. 阅读教材,讨论水分子中H原子为什么几乎成了“裸露”的质子?水分子间的氢键是如何形成的?
水分子之间形成氢键的示意图
3. 阅读教材的方法导引,了解氢键的形成、表示方法和氢键的作用力大小。
(1) 氢键有哪几种类型?氢键的作用力大小如何?
(2) 氢键是如何形成的?如何表示氢键?哪些原子间易形成氢键?
(3) 讨论氢键是否属于化学键?是否有饱和性和方向性?
4. 讨论氢键的存在和对物质性质的影响。
(1) 阅读教材,你认为氢键只是物质在液态时形成吗?氢键是否会对物质的聚集状态产生影响?
(2) 分子间氢键对熔、沸点产生怎样的影响?水的沸点为什么高于硫化氢?
(3) 含有氢键的液体一般黏度较大,如甘油、浓硫酸等。氢键的存在对物质在水中的溶解度有什么影响?举例说明。
(4) 虽然HF分子间氢键比H2O分子间氢键更强,但液体氟化氢的蒸发热却比水的蒸发热低,试解释其原因。
1. 讨论氢键的类别有哪些?哪些分子存在分子内氢键?
2. 讨论:分子间氢键和分子内氢键对物质在水中的溶解性影响是否相同?为什么对羟基苯甲醛的熔点高于邻羟基苯甲醛?
3. 醋酸、硝酸是相对分子质量相近的两种分子,但这两种物质的熔点和沸点相差较大。醋酸的熔点为16.6 ℃,在温度低于16.6 ℃时即凝结成冰块状的固体;常温下硝酸是一种具有挥发性的液体。试根据上述两种物质熔、沸点差异较大的事实,分析它们可能含有的氢键,并查阅文献加以证实。
醋酸(a)、硝酸(b)的结构式
4. 氢键对物质密度也存在影响,使冰的密度比水小,冰浮在水上面,为什么?
水分子间的氢键
5. 阅读教材,了解氢键的存在和在生活、生产中的应用。
纸张、衣物、皮革、煤炭、润滑油脂以及棉花等纤维素类材料中,蛋白质和核酸中都有氢键存在,肌肉的运动也与氢键的形成与断裂有关。色谱技术、极谱分析法以及吸附等方法与氢键有关。煤中的氢键对煤的性质、结构及转化等都有重要的影响,通过煤中氢键的调控可以实现煤的优化和高效转化。
6. 比较化学键、范德华力、氢键,填写下表。
作用力 化学键 范德华力 氢键
概念
大小/(kJ/mol) 120~800 几至十几个 几至数十个
性质影响
大小关系
7. 阅读教材中的学科提炼,了解弱作用力的“强作用”。
(1) 微粒间作用力中哪些作用力是较强的作用力,哪些作用力是弱作用力?
(2) 蛋白质和酶等大分子的生物功能与它们的构象密切相关,而这些令人叹为观止的、高度有序的三维结构是依靠什么作用力建立起来的?
(3) 超分子化学中的万能相互作用是什么?
1. 下列关于范德华力的叙述正确的是( )
A. 是一种较弱的化学键
B. 分子间存在的较强的相互作用
C. 直接影响所有物质的熔、沸点
D. 稀有气体的分子间存在范德华力
2. 下列物质的性质可用氢键来解释的是( )
A. HF、HCl、HBr、HI的热稳定性依次减弱
B. F2、Cl2、Br2、I2的熔、沸点依次升高
C. 苯酚、H—O—H、C2H5—OH中—OH上氢原子的活泼性依次减弱
D. CH3—O—CH3、C2H5OH的沸点依次升高
3. [2024南通海安阶段练习]下列说法正确的是( )
A. 金刚石与石墨烯中的C—C—C夹角都为120°
B. ⅣA族元素氧化物的晶体类型相同
C. 沸点:SiCl4>GeCl4
D. SiH4、SiCl4都是由极性键构成的非极性分子
4. 二甘醇可作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HO—CH2CH2—O—CH2CH2—OH。下列有关二甘醇的叙述正确的是 ( )
A. 符合通式CnH2nO3
B. 分子间能形成氢键
C. 分子间不存在范德华力
D. 能溶于水,不溶于乙醇
5. [2024苏州昆山期末]下列说法正确的是( )
A. Cl2、Br2、I2的沸点逐渐升高,是因为共价键键能越来越大
B. N2、CCl4、P4三种分子中,每个原子的最外层都具有8电子稳定结构
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 石英晶体和干冰晶体熔、沸点不同,是因为所含化学键类型不同
6. [2024宿迁期末]下列变化过程克服了分子间作用力的是( )
A. KNO3熔化 B. NaCl溶解
C. 干冰升华 D. NH3分解
7. 氨气极易溶于水的原因之一与氢键有关。请判断NH3溶于水后,形成的NH3·H2O的合理结构是( )
A. B.
C. D.
8. 正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3通过氢键相连(如图所示)。下列有关说法正确的是( )
A. 正硼酸晶体属于离子晶体,熔点很高
B. H3BO3的化学性质主要与氢键有关
C. 1 mol H3BO3晶体中有6 mol氢键
D. 分子中硼原子最外层不是8电子稳定结构
9. [2024无锡期末]我国深海开采可燃冰技术世界领先。可燃冰的部分结构如图所示(图中忽略了原子的相对大小),其结构可以看作是水分子构建的笼子中锁住了甲烷。下列有关说法正确的是( )
A. CH4和H2O之间通过共价键结合
B. H2O和H2O分子之间存在氢键
C. CH4和H2O分子之间存在氢键
D. 可燃冰气化时破坏了化学键
10. 下列两组说法中,Ⅱ组中说法正确,且能用Ⅰ组中的说法加以解释的是( )
选项 Ⅰ组 Ⅱ组
A 相对分子质量:HCl>HF 沸点:HCl高于HF
B 键能:H—O>H—S 沸点:H2O高于H2S
C 分子间作用力:H2O>H2S 稳定性:H2O强于H2S
D 相对分子质量:HI>HCl 沸点:HI高于HCl
11. (1) 能以任意比与水混溶,原因是___________________________
_________________________________。
(2) 相同条件下, 的沸点比 的高,其主要原因是______________________________________________________________。
(3) 噻吩()、吡咯()是类似于苯的芳香族化合物,环中的五个原子形成了大π键。噻吩难溶于水,吡咯能溶于水,原因是_______________________
____________________________________。
(4) 比较对硝基苯酚()与对氨基苯酚(),熔点较高的是 (填名称),原因是_____________________________________。
课时1 范德华力 氢键
【活动方案】
活动一:
1. (1) 从F2到I2,卤素单质的熔、沸点依次增大。
(2) 从F2到I2,卤素单质的熔、沸点增大,说明不同的卤素单质分子间存在的作用力的大小不同,这种作用力决定单质的物理性质,如熔、沸点。随着相对分子质量的增大,这种分子间的作用力依次增大。
2. 范德华力是一种普遍存在于固体、液体和气体中分子之间的作用力。与共价键不同,范德华力比较小,且一般没有饱和性和方向性。只要分子周围空间允许,当气体分子凝聚时,它总是尽可能多地吸引其他分子。
3. 影响范德华力的因素很多,如分子的大小、分子的空间结构以及分子中电荷分布是否均匀等。对于组成和结构相似的分子(如卤素单质) ,其范德华力一般随着相对分子质量的增大而增大。卤素的氢化物的分子间范德华力和分子的共价键的强弱变化规律不相同。卤素的氢化物的分子间范德华力依次增强,而分子内的共价键依次减弱。
活动二:
1. 随着相对分子质量的增大,范德华力增大,卤素单质的熔、沸点也相应升高。烷烃的熔、沸点随着相对分子质量的增大而增大是因为范德华力随着相对分子质量增大而增大。
2. (1) 分子间范德华力越大,物质的溶解度越大。
(2) 溶质分子与溶剂分子间的范德华力越大,则溶质分子的溶解度越大。甲烷和氯化氢的溶解性差异是因为分子结构和分子中电荷分布不同,使CH4与H2O范德华力很小,所以CH4几乎不溶于水,HCl与H2O范德华力较大,HCl极易溶于水中。
3. 范德华力包括三种。本质上也是分子之间的静电作用力。
活动三:
1. 水分子的相对分子质量小于硫化氢,理论上硫化氢的沸点应高于水,实际水的沸点高于硫化氢,出现反常。
2. 水分子中的O—H键是极性共价键,氧原子与氢原子共用的电子对强烈地偏向氧原子,使H原子几乎成了“裸露”的质子。这样,一个水分子中相对显正电性的氢原子,就能与另一个水分子中相对显负电性的氧原子的孤电子对接近并产生相互作用,这种相互作用叫作氢键(hydrogen bond)。
3. (1) 氢键有分子内氢键和分子间氢键两种,氢键比化学键弱,比范德华力强。
(2) H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y的孤电子对接近并产生相互作用,即形成氢键,通常用X—H…Y表示。其中X、Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮原子。
(3) 氢键不属于化学键,但有方向性和饱和性。
4. (1) 氢键一般是物质在液态时形成,但有时也存在于某些晶体和气态物质中,如HF在三种状态中均存在氢键。分子间氢键的形成,对物质的聚集状态会产生影响,使其物理性质发生明显的变化。
(2) 当分子间存在氢键时,若要使相应的物质熔化或汽化,破坏分子间的氢键需要消耗很多的能量,所以这些物质有较高的熔点和沸点。图中H2O、HF、NH3的分子之间既存在范德华力,又存在氢键,冰融化或水汽化不仅要破坏范德华力,还必须提供额外的能量破坏分子间的氢键。
(3) 氢键存在可以使溶质在水中的溶解度增大,如NH3极易溶解于水,主要是由于氨分子和水分子之间形成了氢键,彼此互相缔合,因而加大溶解。
(4) 因为1个H2O平均可以形成2个氢键,1个HF平均只形成1个氢键,所以总的作用力,H2O分子间的氢键高,所以其蒸发热高。
活动四:
1. 氢键包括分子间氢键和分子内氢键。邻羟基苯甲醛()、HNO3均存在分子内氢键。
2. 不同,因为分子内氢键减少了溶质分子与水分子形成氢键的机会,从而阻碍溶解,降低溶解性;分子间氢键能提升溶解性。邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键。当对羟基苯甲醛熔融时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲醛的熔点高于邻羟基苯甲醛。
3. 醋酸存在分子间氢键使其熔点升高,而硝酸分子存在分子内氢键使其熔点降低,硝酸熔融后分子内氢键被破坏,所以也易挥发。
4. 大多数物质在固态时的密度要比液态时大,而水是一个例外。冰中所有水分子中的氢原子都参与形成氢键,使水分子之间的间隙增大,由此形成一个有很多“孔洞”的结构,使冰的密度小于水,所以冰浮于水上。
6. 相邻的两个或多个原子之间强烈的相互作用 物质的分子间存在的微弱的相互作用 已经与电负性很大的原子形成共价键的氢原子与另一个分子中电负性很大的原子之间的作用力 主要影响物质的化学性质 主要影响物质的物理性质 主要影响物质的物理性质 化学键>氢键>范德华力
7. (1) 化学键(离子键、共价键、金属键)是发生在原子或离子之间的作用力,属于较强的作用力。分子与分子之间存在的相互作用力(范德华力、氢键等),比化学键要弱得多,属于弱作用力。
(2) 蛋白质和酶等大分子的三维结构是依靠范德华力和氢键建立起来的。
(3) 氢键是超分子化学中的万能相互作用。
【课堂反馈】
1. D 范德华力是分子间存在的较弱的相互作用,它不是化学键,A错误;范德华力比化学键弱得多,是分子间存在的较弱的相互作用, B错误;范德华力只能影响由分子构成的物质的熔、沸点,C错误;稀有气体为单原子分子,分子之间存在范德华力,D正确。
2. D HF、HCl、HBr、HI都是共价化合物,热稳定性与共价键强弱有关,与氢键无关,A不符合题意;F2、Cl2、Br2、I2的熔、沸点与范德华力有关,B不符合题意;—OH上氢原子的活泼性与和—OH相连的原子或基团的吸电子能力有关,与氢键无关,C不符合题意;CH3—O—CH3、C2H5OH的沸点依次升高是因为乙醇分子间能形成氢键,D符合题意。
3. D 金刚石中的碳原子为正四面体结构,C—C—C夹角为109°28′,A错误;CO2为分子晶体,SiO2为共价晶体,B错误;SiCl4与GeCl4均为分子晶体,GeCl4的相对分子质量大,范德华力大,熔、沸点较高,沸点GeCl4>SiCl4,C错误;SiH4中的Si—H为极性键,为正四面体,正、负电荷重心重合,为非极性分子,SiCl4中的Si—Cl为极性键,为正四面体,正、负电荷重心重合,为非极性分子,D正确。
4. B 二甘醇的分子式为C4H10O3,不符合通式CnH2nO3,A错误;羟基上的氢原子与另一个羟基上的氧原子可以形成分子间氢键,B正确;二甘醇属于分子晶体,存在范德华力,C错误;二甘醇与乙醇能形成分子间氢键,因此二甘醇能溶于乙醇,D错误。
5. B Cl2、Br2、I2均为分子晶体,分子间只存在分子间作用力,其相对分子质量逐渐增加,故其分子间作用力逐渐增强,其沸点逐渐升高,与共价键键能无关,A错误;N2中N原子的最外层电子数为5,形成3个共用电子对,故每个原子的最外层都具有8电子稳定结构,CCl4中每个原子的最外层都具有8电子稳定结构, P4分子中,每个P原子的最外层电子数为5,形成3个共价键,都具有8电子稳定结构,B正确;氢键是一种较强的分子间作用力,主要影响物质的熔沸点、密度、溶解度等物理性质,而分子的稳定性由共价键的强弱决定,HF的稳定性很强,是因为H—F的键能较大,与氢键无关,C错误;石英(SiO2)晶体为共价晶体,晶体内只含有共价键,干冰(CO2)为分子晶体,晶体内只存在分子间作用力,共价晶体熔化时,晶体内共价键会发生断裂,而分子晶体熔化时,仅需要克服分子间作用力,故一般共价晶体的熔、沸点高于分子晶体,D错误。
6. C KNO3是离子晶体,K+、NO间的作用力是离子键,KNO3熔化破坏了离子键,A错误;NaCl是离子晶体,NaCl溶解电离出Na+和Cl-,破坏了离子键,B错误;干冰升华,克服的是分子间作用力,C正确;NH3分解产生N2和H2,破坏的是共价键,D错误。
7. B NH3溶于水后形成NH3·H2O,NH3·H2O的电离方程式为NH3·H2O NH+OH-,可知其结构中含有铵根离子和氢氧根离子。故选B。
8. D 层内的H3BO3通过氢键相连,正硼酸晶体属于分子晶体,熔点低,A错误;H3BO3的化学性质主要与分子内共价键有关,与氢键无关,B错误;1分子H3BO3参与形成6个氢键,每个氢键被2分子H3BO3共享,则1 mol H3BO3晶体中有3 mol氢键,C错误;分子中硼原子最外层只有6个电子,不是8电子稳定结构,D正确。
9. B CH4和H2O之间通过范德华力结合,A错误;氧元素的电负性比较大,与另一水分子中的氢元素形成氢键,H2O和H2O分子之间存在氢键,B正确;CH4和H2O分子之间不存在氢键,C错误;可燃冰气化时破坏了分子间作用力,D错误。
10. D 由于相对分子质量HCl>HF,所以范德华力HCl>HF,但HF分子间存在氢键,而HCl分子间不存在氢键,所以HCl的沸点低于HF,说法Ⅱ不正确,A错误;由于原子半径O
11. (1) 为极性分子,并且能与水形成分子间氢键
(2) 分子间存在氢键
(3) 吡咯能与水形成分子间氢键,而噻吩不能
(4) 对氨基苯酚 对氨基苯酚可形成更多的分子间氢键,熔点较高
