3.4 课时2分子晶体 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 3.4 课时2分子晶体 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 00:00:00 | ||
图片预览



文档简介
课时2 分子晶体
1. 能辨识常见的分子晶体,了解分子晶体中构成微粒之间的作用。
2. 借助分子晶体等模型认识晶体的结构特点,并能利用均摊法对晶胞进行计算。
3. 知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
4. 了解石墨晶体的结构,会比较不同类型晶体的熔、沸点。
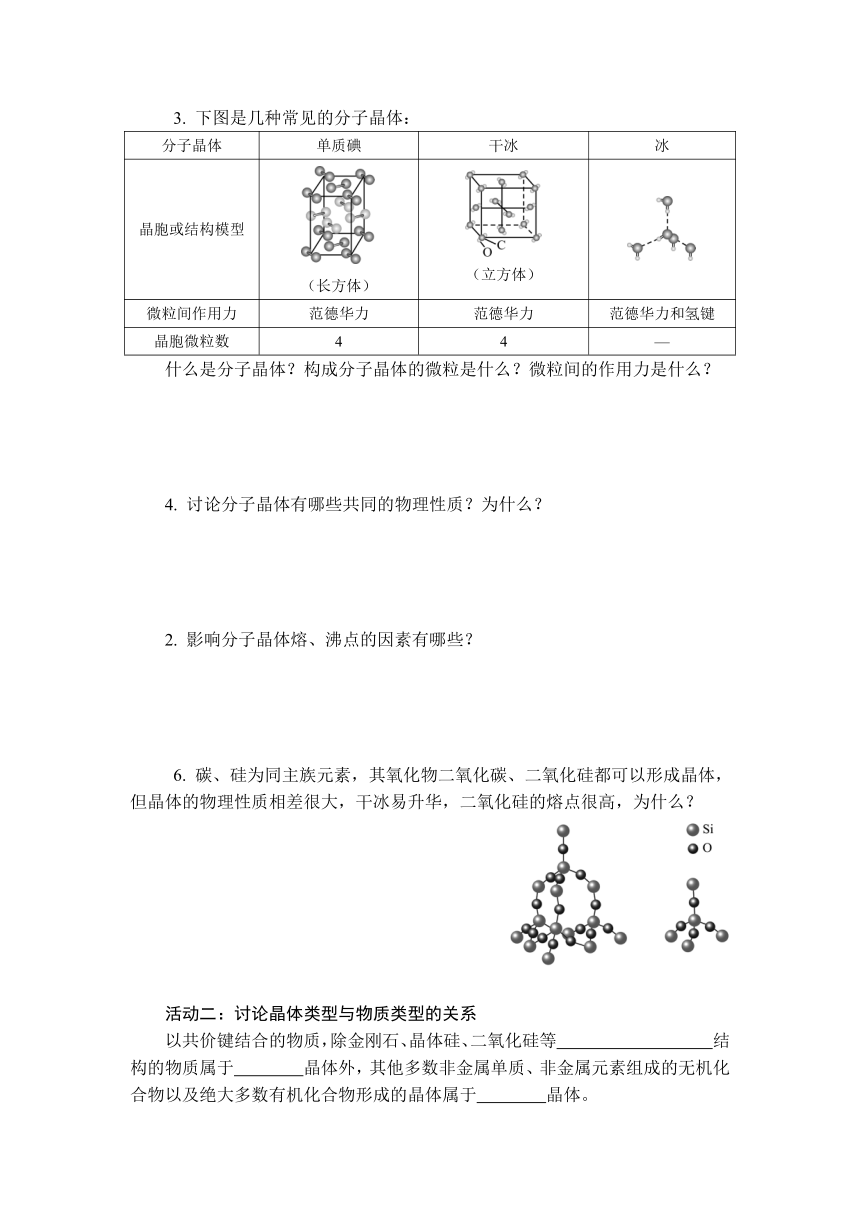
下图是干冰分子晶体的结构模型:
干冰分子晶体的结构模型
1. 构成分子晶体的微粒是什么?分子晶体中微粒间的作用力是什么?
2. 分析干冰晶体结构,每个干冰分子晶体的晶胞中,CO2分子周围离该分子最近且距离相等的CO2分子有几个?每个晶胞中有几个CO2分子?
3. 下图是几种常见的分子晶体:
分子晶体 单质碘 干冰 冰
晶胞或结构模型 (长方体) (立方体)
微粒间作用力 范德华力 范德华力 范德华力和氢键
晶胞微粒数 4 4 —
什么是分子晶体?构成分子晶体的微粒是什么?微粒间的作用力是什么?
4. 讨论分子晶体有哪些共同的物理性质?为什么?
影响分子晶体熔、沸点的因素有哪些?
6. 碳、硅为同主族元素,其氧化物二氧化碳、二氧化硅都可以形成晶体,但晶体的物理性质相差很大,干冰易升华,二氧化硅的熔点很高,为什么?
以共价键结合的物质,除金刚石、晶体硅、二氧化硅等 结构的物质属于 晶体外,其他多数非金属单质、非金属元素组成的无机化合物以及绝大多数有机化合物形成的晶体属于 晶体。
金刚石和石墨的结构模型
1. 分析上图,石墨晶体有什么结构特点?
2. 为什么石墨晶体是一种混合型晶体?
3. 阅读教材,分析石墨的结构特点,讨论石墨为什么能导电?导电为什么具有方向性?讨论石墨为什么有良好的润滑性?
关注共性与个性的结合,是研究各类晶体重要的思想方法。晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。研究晶体类型可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。不同晶体具有哪些共性?
1. 下列各组晶体中,化学键种类和晶体类型都相同的是 ( )
A. SO2与SiO2 B. NaCl与HCl C. CO2与H2O D. CCl4与KCl
2. [2024连云港期末]O、S、Se位于元素周期表中ⅥA族。下列说法正确的是 ( )
A. 原子半径:r(O)>r(S)>r(Se)
B. 第一电离能:I1(O)C. 沸点:H2O>H2S>H2Se
D. 固态氧单质、晶体硫、固态SO2均为分子晶体
3. [2025南京六校联合体期中]氮化硅(Si3N4)可通过反应:3SiO2+6C+2N2Si3N4+6CO制备。下列说法正确的是( )
A. 1 mol SiO2中含有2 mol Si—O B. N2的电子式为N N
C. CO是极性分子 D. Si3N4晶体属于分子晶体
4. 下表所列物质的晶体类型全部正确的一组是( )
选项 共价晶体 离子晶体 分子晶体
A 氮化硅 磷酸 单质硫
B 单晶硅 碳酸氢铵 水银
C 金刚石 烧碱 冰
D 铁 尿素 冰醋酸
5. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A. CO2、SiO2 B. C2H5OH、NaOH
C. NH4Cl、NaCl D. NO2、HNO3
6. [2024苏州张家港开学考试]天津大学马一太、田华教授团队在国家重点研发计划——科技冬奥专项支持下,通过校企合作,研发了国际先进的二氧化碳(R744)跨临界直冷制冰技术,满足不同项目对冰面的要求,被誉为是“最快的冰”。下列有关说法正确的是( )
A. CO2跨临界制冰过程破坏了碳氧共价键
B. CO2的电子式:
C. 冰属于分子晶体
D. H2O的空间结构为直线形
7. 某种新型导电材料将锂原子嵌入石墨烯层间,晶体结构如图所示。下列有关说法正确的是( )
A. 石墨单质片层间作用力较弱,故硬度和熔点都较低
B. 这种新型材料有望应用于水性锂离子电池中
C. 晶体的化学式为LiC6
D. 距离Li原子最近的Li原子有6个
8. 下表给出几种物质的熔点,对此有下列一些说法:①CaCl2属于离子晶体、②SiCl4是分子晶体、③一个SiO2分子由1个Si原子和2个O原子构成、④MgCl2在熔化状态不能导电,上述说法正确的组合是( )
物质 SiO2 MgCl2 CaCl2 SiCl4
熔点/℃ 1 723 712 782 -68
A. ①② B. ①③ C. ②④ D. ①②③
9. [2024盐城阶段练习]意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示。设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. N4分子中只含有共价键
B. 由N4分子形成的晶体可能属于离子晶体
C. 1 mol N4分子所含共价键数为4NA
D. N4的沸点比P4(白磷)高
10. 有关晶体的结构如图所示,下列说法正确的是( )
冰晶胞 SiO2晶体结构 金刚石晶胞 CO2晶胞
A. 冰中的每个水分子均摊4个氢键
B. SiO2中每个硅原子被4个最小环所共有
C. 如图所示的金刚石晶胞中有6个碳原子
D. 在CO2晶胞中,1个CO2分子周围有12个紧邻的CO2分子
11. [2024常州期中]中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题。
(1) 基态Fe原子的价电子排布式为 ,橄榄石中,各元素电负性大小顺序为 ,铁的化合价为 。
(2) 已知一些物质的熔点数据如表。Na与Si均为第3周期元素,NaCl熔点明显高于SiCl4,原因是_________________________________________________。
分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因:____________
______________________________________________________________________。
物质 NaCl SiCl4 GeCl4 SnCl4
熔点/℃ 800.7 -68.8 -51.5 -34.1
12. (1) 现有下列物质:①Cl2;②Na2O2;③NaOH;④HCl;⑤H2O2;⑥MgF2;⑦NH4Cl。请用序号填写下列空白。
A. 只由离子键构成的物质是 ;
B. 只由共价键构成的物质是 ;
C. 只由非金属元素组成的离子化合物是 ;
D. 由离子键和共价键构成的物质是 ;
E. 属于离子化合物的物质是 ;
F. 属于共价化合物的物质是 。
(2) 现有八种晶体:①干冰;②碳化硅;③晶体硫;④晶体硅;⑤氧化钠;⑥四氯化硅;⑦氢氧化钾;⑧氖。请用序号填写下列空白。
A. 属于共价晶体的是 ;
B. 固态为分子晶体的是 ;
C. 含有共价键的离子晶体的是 ;
D. 熔融时需破坏化学键的是 。
课时2 分子晶体
【活动方案】
活动一:
1. 构成分子晶体的微粒是分子。分子晶体中微粒间的相互作用力是分子间作用力(范德华力)。
2. 每个CO2分子周围离该分子最近且距离相等的CO2分子有12个,每个晶胞中有4个CO2分子。
3. 分子晶体是分子通过分子间作用力构成的固态物质。构成分子晶体的微粒是分子。微粒间的作用力为分子间作用力(范德华力和氢键)。
4. 分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发。这是因为形成分子晶体的分子间作用力较弱。
5. (1) 分子晶体的熔、沸点取决于分子间作用力的大小。对于组成和结构相似的分子晶体,一般随相对分子质量的增大,范德华力也增大,熔、沸点升高,如熔、沸点I2>Br2>Cl2>F2。
(2) 有氢键的分子晶体,还要考虑氢键的强弱。例如H2O的沸点比H2S的高,因为H2O分子间有氢键,H2S分子间只有范德华力,而氢键比范德华力强。
6. 二氧化碳形成的晶体即干冰,属于分子晶体,升华时只破坏较弱的范德华力,而二氧化硅晶体属于共价晶体,熔化时需破坏较强的共价键,所以物理性质相差大。
活动二:
空间网状 共价 分子
活动三:
1. 石墨晶体是一种二维网状结构,在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。
2. 石墨晶体中,层内原子间通过共价键结合,层间为分子间作用力,所以属于混合型晶体。
3. 石墨晶体中层内存在大π键,其中的电子可在整个层内运动,当施加电场时,可以沿电场方向运动,因而石墨具有导电性。但由于相邻碳原子层之间相隔较远,电子不能从一层跳跃到另一层,因此石墨的导电性具有一定的方向性。由于石墨晶体层间是以分子间作用力相结合的,在外力的作用下,石墨晶体中层与层之间发生相对滑动而具有良好的润滑性。
活动四:
不同的晶体具有以下共性:(1) 晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等。(2) 晶体总能自发地形成多面体外形。(3) 晶体都具有确定的熔点。
【课堂反馈】
1. C SO2与SiO2中都只含极性共价键,但SO2为分子晶体而SiO2为共价晶体,A不符合题意;NaCl中只含离子键,NaCl为离子晶体,而HCl中只含共价键,HCl为分子晶体,B不符合题意;CO2与H2O中都只含极性共价键,都是分子晶体,C符合题意;CCl4中只含极性共价键,CCl4为分子晶体,而KCl中只含离子键,KCl为离子晶体,D不符合题意。
2. D 同一主族元素,从上往下原子半径依次增大,原子半径r(O)I1(S)>I1(Se),B错误;H2O分子间存在氢键,导致沸点异常升高,而H2S、H2Se均为分子晶体,且H2Se的相对分子质量比H2S大,沸点H2O>H2Se>H2S,C错误;氧单质、晶体硫、SO2均是由分子通过分子间作用力形成的晶体,为分子晶体,D正确。
3. C 1 mol SiO2中含有4 mol Si—O,A错误;N2的电子式为 ,B错误;CO是极性分子,C正确;Si3N4晶体属于共价晶体,D错误。
4. C 磷酸的构成微粒是分子,磷酸属于分子晶体,A错误;水银是金属晶体,金属晶体的构成微粒是金属阳离子和自由电子,B错误;铁是金属晶体,金属晶体构成微粒是金属阳离子和自由电子,尿素是分子晶体,分子晶体的构成微粒是分子,D错误。
5. D CO2只含共价键,是分子晶体,SiO2只含共价键,是共价晶体,A不符合题意;C2H5OH只含共价键,是分子晶体,NaOH既含离子键又含共价键,是离子晶体,B不符合题意;NH4Cl既含离子键又含共价键,是离子晶体,NaCl只含离子键,是离子晶体,C不符合题意;NO2和HNO3都只含极性共价键,都是分子晶体,D符合题意。
6. C CO2跨临界制冰过程发生物理变化,没有破坏碳氧共价键,A错误;CO2的电子式为,B错误;冰是水分子通过氢键形成的晶体,属于分子晶体,C正确;H2O中O原子采取sp3杂化,有2个孤电子对,空间结构为V形,D错误。
7. C 石墨单质片层内碳原子间通过共价键连接,故熔点较高,A错误;锂原子嵌入石墨烯层间无法阻隔水分子进入直接与Li反应,B错误;根据均摊法知,Li位于顶点,晶胞含有1个Li原子,有8个碳原子位于面上,有2个碳原子位于晶胞体内,晶胞中碳原子共有6个,晶体的化学式为 LiC6,C正确;因片层间嵌入石墨,且受石墨环大小影响,锂原子的配位数不再是6,D错误。
8. A 氯化钙熔点高,属于离子晶体,①正确;四氯化硅熔点很低,属于分子晶体,②正确;不存在二氧化硅分子,③错误;氯化镁是离子晶体,熔化时能导电,④错误。故选A。
9. A 同种非金属元素原子间形成的化学键为共价键,A正确;N4分子中只含有共价键,不可能是离子晶体,属于分子晶体,B错误;由N4分子结构可知,一个分子中含有6个共价键,1 mol N4分子所含共价键数为6NA,C错误;N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故白磷的沸点高,D错误。
10. D 根据图中信息,冰中每个水分子与周围4个水分子形成分子间氢键,每个氢键都为两个水分子所共有,因而每个水分子均摊氢键数=4×=2,A错误;每个硅原子周围有四条边,而每条边又被6个环所共有,同时由于每个环上有两条边是同一个硅原子周围的,所以每个硅原子被=12个最小环所共有,B错误;如图所示的金刚石晶胞中碳原子有8个在顶点,6个在面心,4个在体内,因此含有8×+6×+4=8个碳原子,C错误;根据CO2晶胞,以顶点的CO2分子为例,其与面心的CO2分子紧邻,1个CO2分子周围有12个紧邻的CO2分子,D正确。
11. (1) 3d64s2 O>Si>Fe>Mg +2
(2) 钠的电负性小于硅,氯化钠为离子晶体,其熔点较高;而SiCl4为分子晶体,其熔点较低 SiCl4、GeCl4、SnCl4均形成分子晶体,分子间作用力越大,则熔点越高;随着相对分子质量增大,分子间作用力依次增大,则熔点依次升高
解析:(1) Fe为26号元素,基态原子的价电子排布式为3d64s2。元素的金属性越强,其电负性越小,元素的非金属性越强,则其电负性越大,故橄榄石(MgxFe2-xSiO4)中,电负性O>Si>Fe>Mg;因为橄榄石中Mg、Si、O的化合价分别为+2、+4和-2,根据化合物中各元素化合价的代数和为0,可以确定铁的化合价为+2。
12. (1) ⑥ ①④⑤ ⑦ ②③⑦ ②③⑥⑦ ④⑤
(2) ②④ ①③⑥⑧ ⑦ ②④⑤⑦
1. 能辨识常见的分子晶体,了解分子晶体中构成微粒之间的作用。
2. 借助分子晶体等模型认识晶体的结构特点,并能利用均摊法对晶胞进行计算。
3. 知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
4. 了解石墨晶体的结构,会比较不同类型晶体的熔、沸点。
下图是干冰分子晶体的结构模型:
干冰分子晶体的结构模型
1. 构成分子晶体的微粒是什么?分子晶体中微粒间的作用力是什么?
2. 分析干冰晶体结构,每个干冰分子晶体的晶胞中,CO2分子周围离该分子最近且距离相等的CO2分子有几个?每个晶胞中有几个CO2分子?
3. 下图是几种常见的分子晶体:
分子晶体 单质碘 干冰 冰
晶胞或结构模型 (长方体) (立方体)
微粒间作用力 范德华力 范德华力 范德华力和氢键
晶胞微粒数 4 4 —
什么是分子晶体?构成分子晶体的微粒是什么?微粒间的作用力是什么?
4. 讨论分子晶体有哪些共同的物理性质?为什么?
影响分子晶体熔、沸点的因素有哪些?
6. 碳、硅为同主族元素,其氧化物二氧化碳、二氧化硅都可以形成晶体,但晶体的物理性质相差很大,干冰易升华,二氧化硅的熔点很高,为什么?
以共价键结合的物质,除金刚石、晶体硅、二氧化硅等 结构的物质属于 晶体外,其他多数非金属单质、非金属元素组成的无机化合物以及绝大多数有机化合物形成的晶体属于 晶体。
金刚石和石墨的结构模型
1. 分析上图,石墨晶体有什么结构特点?
2. 为什么石墨晶体是一种混合型晶体?
3. 阅读教材,分析石墨的结构特点,讨论石墨为什么能导电?导电为什么具有方向性?讨论石墨为什么有良好的润滑性?
关注共性与个性的结合,是研究各类晶体重要的思想方法。晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。研究晶体类型可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。不同晶体具有哪些共性?
1. 下列各组晶体中,化学键种类和晶体类型都相同的是 ( )
A. SO2与SiO2 B. NaCl与HCl C. CO2与H2O D. CCl4与KCl
2. [2024连云港期末]O、S、Se位于元素周期表中ⅥA族。下列说法正确的是 ( )
A. 原子半径:r(O)>r(S)>r(Se)
B. 第一电离能:I1(O)
D. 固态氧单质、晶体硫、固态SO2均为分子晶体
3. [2025南京六校联合体期中]氮化硅(Si3N4)可通过反应:3SiO2+6C+2N2Si3N4+6CO制备。下列说法正确的是( )
A. 1 mol SiO2中含有2 mol Si—O B. N2的电子式为N N
C. CO是极性分子 D. Si3N4晶体属于分子晶体
4. 下表所列物质的晶体类型全部正确的一组是( )
选项 共价晶体 离子晶体 分子晶体
A 氮化硅 磷酸 单质硫
B 单晶硅 碳酸氢铵 水银
C 金刚石 烧碱 冰
D 铁 尿素 冰醋酸
5. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A. CO2、SiO2 B. C2H5OH、NaOH
C. NH4Cl、NaCl D. NO2、HNO3
6. [2024苏州张家港开学考试]天津大学马一太、田华教授团队在国家重点研发计划——科技冬奥专项支持下,通过校企合作,研发了国际先进的二氧化碳(R744)跨临界直冷制冰技术,满足不同项目对冰面的要求,被誉为是“最快的冰”。下列有关说法正确的是( )
A. CO2跨临界制冰过程破坏了碳氧共价键
B. CO2的电子式:
C. 冰属于分子晶体
D. H2O的空间结构为直线形
7. 某种新型导电材料将锂原子嵌入石墨烯层间,晶体结构如图所示。下列有关说法正确的是( )
A. 石墨单质片层间作用力较弱,故硬度和熔点都较低
B. 这种新型材料有望应用于水性锂离子电池中
C. 晶体的化学式为LiC6
D. 距离Li原子最近的Li原子有6个
8. 下表给出几种物质的熔点,对此有下列一些说法:①CaCl2属于离子晶体、②SiCl4是分子晶体、③一个SiO2分子由1个Si原子和2个O原子构成、④MgCl2在熔化状态不能导电,上述说法正确的组合是( )
物质 SiO2 MgCl2 CaCl2 SiCl4
熔点/℃ 1 723 712 782 -68
A. ①② B. ①③ C. ②④ D. ①②③
9. [2024盐城阶段练习]意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示。设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. N4分子中只含有共价键
B. 由N4分子形成的晶体可能属于离子晶体
C. 1 mol N4分子所含共价键数为4NA
D. N4的沸点比P4(白磷)高
10. 有关晶体的结构如图所示,下列说法正确的是( )
冰晶胞 SiO2晶体结构 金刚石晶胞 CO2晶胞
A. 冰中的每个水分子均摊4个氢键
B. SiO2中每个硅原子被4个最小环所共有
C. 如图所示的金刚石晶胞中有6个碳原子
D. 在CO2晶胞中,1个CO2分子周围有12个紧邻的CO2分子
11. [2024常州期中]中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题。
(1) 基态Fe原子的价电子排布式为 ,橄榄石中,各元素电负性大小顺序为 ,铁的化合价为 。
(2) 已知一些物质的熔点数据如表。Na与Si均为第3周期元素,NaCl熔点明显高于SiCl4,原因是_________________________________________________。
分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因:____________
______________________________________________________________________。
物质 NaCl SiCl4 GeCl4 SnCl4
熔点/℃ 800.7 -68.8 -51.5 -34.1
12. (1) 现有下列物质:①Cl2;②Na2O2;③NaOH;④HCl;⑤H2O2;⑥MgF2;⑦NH4Cl。请用序号填写下列空白。
A. 只由离子键构成的物质是 ;
B. 只由共价键构成的物质是 ;
C. 只由非金属元素组成的离子化合物是 ;
D. 由离子键和共价键构成的物质是 ;
E. 属于离子化合物的物质是 ;
F. 属于共价化合物的物质是 。
(2) 现有八种晶体:①干冰;②碳化硅;③晶体硫;④晶体硅;⑤氧化钠;⑥四氯化硅;⑦氢氧化钾;⑧氖。请用序号填写下列空白。
A. 属于共价晶体的是 ;
B. 固态为分子晶体的是 ;
C. 含有共价键的离子晶体的是 ;
D. 熔融时需破坏化学键的是 。
课时2 分子晶体
【活动方案】
活动一:
1. 构成分子晶体的微粒是分子。分子晶体中微粒间的相互作用力是分子间作用力(范德华力)。
2. 每个CO2分子周围离该分子最近且距离相等的CO2分子有12个,每个晶胞中有4个CO2分子。
3. 分子晶体是分子通过分子间作用力构成的固态物质。构成分子晶体的微粒是分子。微粒间的作用力为分子间作用力(范德华力和氢键)。
4. 分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发。这是因为形成分子晶体的分子间作用力较弱。
5. (1) 分子晶体的熔、沸点取决于分子间作用力的大小。对于组成和结构相似的分子晶体,一般随相对分子质量的增大,范德华力也增大,熔、沸点升高,如熔、沸点I2>Br2>Cl2>F2。
(2) 有氢键的分子晶体,还要考虑氢键的强弱。例如H2O的沸点比H2S的高,因为H2O分子间有氢键,H2S分子间只有范德华力,而氢键比范德华力强。
6. 二氧化碳形成的晶体即干冰,属于分子晶体,升华时只破坏较弱的范德华力,而二氧化硅晶体属于共价晶体,熔化时需破坏较强的共价键,所以物理性质相差大。
活动二:
空间网状 共价 分子
活动三:
1. 石墨晶体是一种二维网状结构,在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。
2. 石墨晶体中,层内原子间通过共价键结合,层间为分子间作用力,所以属于混合型晶体。
3. 石墨晶体中层内存在大π键,其中的电子可在整个层内运动,当施加电场时,可以沿电场方向运动,因而石墨具有导电性。但由于相邻碳原子层之间相隔较远,电子不能从一层跳跃到另一层,因此石墨的导电性具有一定的方向性。由于石墨晶体层间是以分子间作用力相结合的,在外力的作用下,石墨晶体中层与层之间发生相对滑动而具有良好的润滑性。
活动四:
不同的晶体具有以下共性:(1) 晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等。(2) 晶体总能自发地形成多面体外形。(3) 晶体都具有确定的熔点。
【课堂反馈】
1. C SO2与SiO2中都只含极性共价键,但SO2为分子晶体而SiO2为共价晶体,A不符合题意;NaCl中只含离子键,NaCl为离子晶体,而HCl中只含共价键,HCl为分子晶体,B不符合题意;CO2与H2O中都只含极性共价键,都是分子晶体,C符合题意;CCl4中只含极性共价键,CCl4为分子晶体,而KCl中只含离子键,KCl为离子晶体,D不符合题意。
2. D 同一主族元素,从上往下原子半径依次增大,原子半径r(O)
3. C 1 mol SiO2中含有4 mol Si—O,A错误;N2的电子式为 ,B错误;CO是极性分子,C正确;Si3N4晶体属于共价晶体,D错误。
4. C 磷酸的构成微粒是分子,磷酸属于分子晶体,A错误;水银是金属晶体,金属晶体的构成微粒是金属阳离子和自由电子,B错误;铁是金属晶体,金属晶体构成微粒是金属阳离子和自由电子,尿素是分子晶体,分子晶体的构成微粒是分子,D错误。
5. D CO2只含共价键,是分子晶体,SiO2只含共价键,是共价晶体,A不符合题意;C2H5OH只含共价键,是分子晶体,NaOH既含离子键又含共价键,是离子晶体,B不符合题意;NH4Cl既含离子键又含共价键,是离子晶体,NaCl只含离子键,是离子晶体,C不符合题意;NO2和HNO3都只含极性共价键,都是分子晶体,D符合题意。
6. C CO2跨临界制冰过程发生物理变化,没有破坏碳氧共价键,A错误;CO2的电子式为,B错误;冰是水分子通过氢键形成的晶体,属于分子晶体,C正确;H2O中O原子采取sp3杂化,有2个孤电子对,空间结构为V形,D错误。
7. C 石墨单质片层内碳原子间通过共价键连接,故熔点较高,A错误;锂原子嵌入石墨烯层间无法阻隔水分子进入直接与Li反应,B错误;根据均摊法知,Li位于顶点,晶胞含有1个Li原子,有8个碳原子位于面上,有2个碳原子位于晶胞体内,晶胞中碳原子共有6个,晶体的化学式为 LiC6,C正确;因片层间嵌入石墨,且受石墨环大小影响,锂原子的配位数不再是6,D错误。
8. A 氯化钙熔点高,属于离子晶体,①正确;四氯化硅熔点很低,属于分子晶体,②正确;不存在二氧化硅分子,③错误;氯化镁是离子晶体,熔化时能导电,④错误。故选A。
9. A 同种非金属元素原子间形成的化学键为共价键,A正确;N4分子中只含有共价键,不可能是离子晶体,属于分子晶体,B错误;由N4分子结构可知,一个分子中含有6个共价键,1 mol N4分子所含共价键数为6NA,C错误;N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故白磷的沸点高,D错误。
10. D 根据图中信息,冰中每个水分子与周围4个水分子形成分子间氢键,每个氢键都为两个水分子所共有,因而每个水分子均摊氢键数=4×=2,A错误;每个硅原子周围有四条边,而每条边又被6个环所共有,同时由于每个环上有两条边是同一个硅原子周围的,所以每个硅原子被=12个最小环所共有,B错误;如图所示的金刚石晶胞中碳原子有8个在顶点,6个在面心,4个在体内,因此含有8×+6×+4=8个碳原子,C错误;根据CO2晶胞,以顶点的CO2分子为例,其与面心的CO2分子紧邻,1个CO2分子周围有12个紧邻的CO2分子,D正确。
11. (1) 3d64s2 O>Si>Fe>Mg +2
(2) 钠的电负性小于硅,氯化钠为离子晶体,其熔点较高;而SiCl4为分子晶体,其熔点较低 SiCl4、GeCl4、SnCl4均形成分子晶体,分子间作用力越大,则熔点越高;随着相对分子质量增大,分子间作用力依次增大,则熔点依次升高
解析:(1) Fe为26号元素,基态原子的价电子排布式为3d64s2。元素的金属性越强,其电负性越小,元素的非金属性越强,则其电负性越大,故橄榄石(MgxFe2-xSiO4)中,电负性O>Si>Fe>Mg;因为橄榄石中Mg、Si、O的化合价分别为+2、+4和-2,根据化合物中各元素化合价的代数和为0,可以确定铁的化合价为+2。
12. (1) ⑥ ①④⑤ ⑦ ②③⑦ ②③⑥⑦ ④⑤
(2) ②④ ①③⑥⑧ ⑦ ②④⑤⑦
