4.1 课时2价层电子对互斥模型 等电子原理 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 4.1 课时2价层电子对互斥模型 等电子原理 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 480.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 14:03:00 | ||
图片预览



文档简介
课时2 价层电子对互斥模型 等电子原理
1. 了解价层电子对互斥模型,通过对价层电子对互斥模型的探究,建立判断分子空间构型的思维模型。
2. 了解等电子体的概念及判断方法,能用等电子原理解释物质的结构和某些性质,结合实例说明“等电子原理”的应用。
分子 键长/pm 键角
CO2 116 180°
H2O 96 104°30′
NH3 101 107°18′
CH4 109 109°28′
1. 上述分子中的中心原子杂化方式是什么?
2. 结合相关数据和如图所示的分子结构,讨论键角有什么差异,其中可能的原因是什么?
CH4分子、NH3分子和H2O分子的结构示意图
3. 阅读教材,了解测定分子空间结构的方法有哪些?
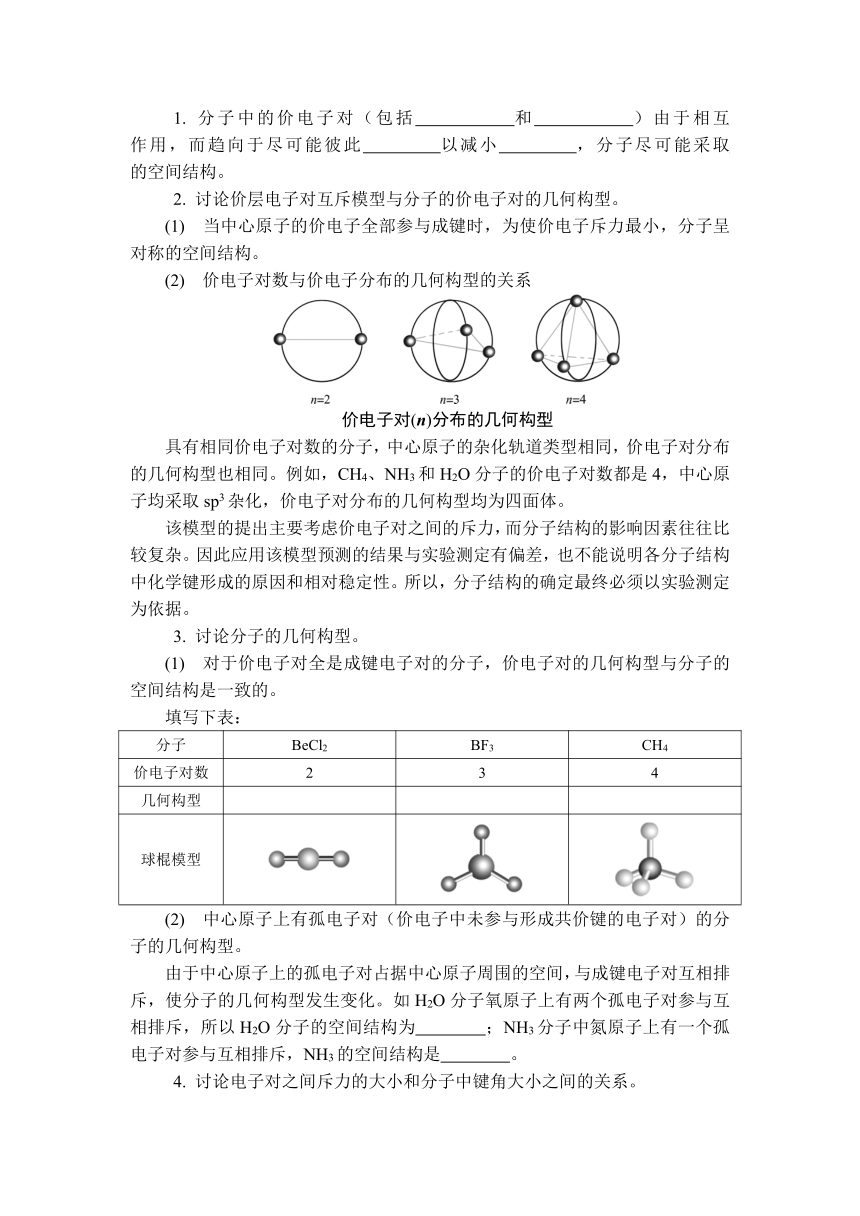
1. 分子中的价电子对(包括 和 )由于相互 作用,而趋向于尽可能彼此 以减小 ,分子尽可能采取 的空间结构。
2. 讨论价层电子对互斥模型与分子的价电子对的几何构型。
(1) 当中心原子的价电子全部参与成键时,为使价电子斥力最小,分子呈对称的空间结构。
(2) 价电子对数与价电子分布的几何构型的关系
价电子对(n)分布的几何构型
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对分布的几何构型也相同。例如,CH4、NH3和H2O分子的价电子对数都是4,中心原子均采取sp3杂化,价电子对分布的几何构型均为四面体。
该模型的提出主要考虑价电子对之间的斥力,而分子结构的影响因素往往比较复杂。因此应用该模型预测的结果与实验测定有偏差,也不能说明各分子结构中化学键形成的原因和相对稳定性。所以,分子结构的确定最终必须以实验测定为依据。
3. 讨论分子的几何构型。
(1) 对于价电子对全是成键电子对的分子,价电子对的几何构型与分子的空间结构是一致的。
填写下表:
分子 BeCl2 BF3 CH4
价电子对数 2 3 4
几何构型
球棍模型
(2) 中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子的几何构型。
由于中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的几何构型发生变化。如H2O分子氧原子上有两个孤电子对参与互相排斥,所以H2O分子的空间结构为 ;NH3分子中氮原子上有一个孤电子对参与互相排斥,NH3的空间结构是 。
4. 讨论电子对之间斥力的大小和分子中键角大小之间的关系。
(1) 不同的电子对之间的斥力大小顺序是什么?为什么会出现斥力不同?
(2) 为什么CH4、NH3和H2O分子中键角依次减小?
1. 对于ABm型分子(A是中心原子,B是配位原子)的价电子对数可以通过下式确定:
n=
中心原子的价层电子数等于中心原子的 ,卤素原子按提供 个电子计算,氧族元素的原子按提供 个电子计算;配位原子中卤素原子和H原子提供 个电子,氧族元素的原子提供 个电子。对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数,即:
价层电子对数=
计算电子对数时,若剩余1个电子,即出现奇数电子,也把这个单电子当作 电子处理。
2. 填写常见分子的价层电子对互斥模型和分子的空间结构。
σ键电子对数 孤电子对数 价电子对数 电子对的排列方式 价层电子对互斥模型名称 分子或离子的空间结构名称 实例
2 0 2 BeCl2、CO2
3 0 3 BF3、BCl3、SO3
2 1 SO2
4 0 4 CH4、CCl4
3 1 NH3
2 2 H2O
1. 具有相同 和相同 的分子或离子,具有相同的结构特征,这一原理称为“等电子原理”。原子总数相同、 相同的分子或离子互称为等电子体。
2. 利用等电子原理可判断简单分子或离子的空间结构,如NH3与H3O+互为 ,二者空间构型相同,均为 形。
3. 常见的等电子体。
类型 实例 空间结构
双原子10电子的等电子体 N2、CO、NO+、C、CN-
三原子16电子的等电子体 CO2、CS2、N2O NO、N、BeCl2(g)
三原子18电子的等电子体 NO、O3、SO2
四原子24电子的等电子体 NO、CO、BO、 CS、BF3、SO3(g)
五原子32电子的等电子体 SiF4、CCl4、BF、SO、PO
1. [2025无锡开学考试]下列分子或离子的中心原子采用sp3杂化,但具有V形结构的是( )
A. NH3 B. H2S C. BeCl2 D. NO
2. 水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不正确的是( )
A. 氧原子的杂化类型发生了改变 B. 微粒的形状发生了改变
C. 微粒的化学性质发生了改变 D. 微粒中的键角发生了改变
3. [2024徐州周测]下列说法不正确的是( )
A. N2O与CO2、CCl3F与CCl2F2互为等电子体
B. CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C. H2CO3与H3PO4的C、P杂化相同
D. 由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物是含有共价键的离子化合物
4. [2025南京开学考试]反应CaC2+2H2O===C2H2↑+Ca(OH)2可用于实验室制备乙炔气体。下列说法正确的是 ( )
A. OH-的电子式:
B. C2H2的结构式:H—C≡C—H
C. CaC2中只含离子键
D. H2O的空间结构为直线形
5. C2H5OH具有还原性,一种催化氧化乙醇的反应为2C2H5OH+O22CH3CHO+2H2O。下列有关叙述正确的是 ( )
A. 16O的中子数为16
B. H2O的空间结构是直线形
C. 分子中σ键和π键的数目之比为5∶2
D. C2H5OH与H2O互溶原因之一是C2H5OH与H2O可形成分子间氢键
6. [2024镇江阶段练习]下列说法正确的是( )
A. 基态F原子的核外电子排布式为2s22p5
B. KHF2中既含有离子键,又含有共价键
C. ClO、ClO和ClO中O—Cl—O键角依次逐渐减小
D. S2O的结构如图: ,其空间结构为正四面体形
7. 下列分子的空间结构模型正确的是( )
A B C D
CO2 H2O NH3 CH4
8. 氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是( )
A. 三角锥形、sp3 B. 平面三角形、sp3
C. 平面三角形、sp2 D. 三角锥形、sp2
9. CH、—CH3、CH都是重要的有机反应中间体。下列有关说法正确的是( )
A. CH、—CH3、CH互为等电子体,碳原子均采取sp2杂化
B. CH与NH3、H3O+互为等电子体,空间结构均为正四面体形
C. CH中的碳原子采取sp2杂化,所有原子均共平面
D. CH与OH-形成的化合物中含有离子键
10. [2024盐城阶段练习]已知:常温下,AsH3为无色气体,检验原理为2AsH3+12AgNO3+3H2O===As2O3↓+12HNO3+12Ag↓。下列说法正确的是( )
A. 基态As核外电子排布式为[Ar]4s24p3
B. 固态AsH3属于共价晶体
C. NO的空间结构为平面三角形
D. HNO3中既含离子键又含共价键
11. [2024南通阶段练习](1) CH3COO[Cu(NH3)2][醋酸二氨合铜(Ⅰ)]中C原子轨道的杂化类型是 。与NH3分子互为等电子体的阴离子为 。
(2) 乳酸分子()中C原子的杂化类型为 。与CO互为等电子体的一种分子化学式为 。
(3) ClO的空间结构为 (用文字描述);NaNT可由 (双聚氰胺)为原料制备。双聚氰胺中碳原子的杂化轨道类型为 。
(4) 草酸(HOOC—COOH)分子中碳原子轨道的杂化类型是 ;与SiF4互为等电子体的阴离子的化学式为 。
(5) NO中N原子轨道的杂化类型是 。与NO互为等电子体的一种分子为 (填化学式)。
12. (1) 写出与OH-互为等电子体的一种分子: 。
(2) 写出与NO互为等电子体的两种微粒: 。
(3) 写出与C2O互为等电子体的一种分子: 。
(4) 写出与NH互为等电子体的一种分子: 。
(5) 写出与NO互为等电子体的一种分子和一种离子: 。
(6) 写出与N2H互为等电子体的一种分子: 。
课时2 价层电子对互斥模型 等电子原理
【活动方案】
活动一:
1. 二氧化碳分子中碳原子为sp杂化,其余分子的中心原子均为sp3杂化。
2. 分子间的键角CH4(109°28′)>NH3(107°18′)>H2O(104°30′)。键角的大小除与杂化类型有关,还与分子中的孤电子对数目有关,孤电子对数目越多,键角越小。
3. 用实验的方法可以测定分子的空间结构,如红外光谱、晶体的X射线衍射、核磁共振等。
活动二:
1. 成键电子对 孤电子对 排斥 远离 斥力 对称
3. (1) 直线形 平面三角形 正四面体
(2) V形 三角锥形
4. (1) 价电子对之间的斥力大小顺序:孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力。
斥力大小不同的原因是孤电子对比成键电子对更靠近中心原子的原子核,与其他电子对之间的斥力更大。
(2) 孤电子对数目的增多,孤电子对对成键电子对的排斥作用增强,使得成键电子对与成键电子对之间的键角也被“压缩”而减小。如CH4分子中C原子的杂化轨道上没有孤电子对,NH3分子中N原子的杂化轨道上有1对孤电子对,H2O分子中O原子的杂化轨道上有2对孤电子对,因此CH4、NH3和H2O分子中键角依次减小。
活动三:
1. 最外层电子数 7 6 1 0 1对
2. 直线形 直线形 三角形 平面三角形 V形 四面体形 正四面体形 三角锥形 V形
活动四:
1. 价电子数 原子数 价电子总数
2. 等电子体 三角锥
3. 直线形 直线形 V形 平面三角形 正四面体形
【课堂反馈】
1. B 中心原子采用sp3杂化,但具有V形结构,说明分子或离子的中心原子有2个σ键电子对和2个孤电子对。NH3中有3个N—H σ键,NO中有3个N—O σ键,A、D不符合题意;BeCl2的中心原子Be的价层电子对数为2,孤电子对数为0,采用sp杂化,为直线形结构,C不符合题意。
2. A 水中氧原子的杂化类型为sp3,H3O+中氧原子的杂化类型为sp3,则氧原子的杂化类型没有改变,A错误;水分子为V形,H3O+为三角锥形,则微粒的形状发生了改变,B正确;化学式不同,则性质不同,微粒的化学性质发生了改变,C正确;水分子为V形,H3O+为三角锥形,微粒中的键角发生了改变,D正确。
3. C 原子数相同、价电子总数相同的分子互为等电子体,A正确;CCl2F2呈四面体结构,无同分异构体,中心原子碳采用sp3杂化,B正确;H2CO3的中心原子C采取sp2杂化,H3PO4的中心原子P采取sp3杂化,C错误;由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物是Na2O2,Na2O2由Na+和O构成,O中含有O—O共价键,故Na2O2是含有共价键的离子化合物,D正确。
4. B OH-的电子式为 ,A错误;CaC2由Ca2+和C构成,C中含有C≡C共价键,故CaC2是含有共价键的离子化合物,C错误;H2O的空间结构为V形,D错误。
5. D 16O的质子数为8,质量数为16,则中子数=16-8=8,A错误;H2O的空间结构是V形,B错误;单键为σ键,双键含有1个σ键、1个π键,故CH3CHO分子中含有6个σ键、1个π键,σ键和π键的数目之比为6∶1,C错误;C2H5OH与H2O互溶的原因之一是C2H5OH与H2O可形成分子间氢键,D正确。
6. B 基态F原子的核外电子排布式为1s22s22p5,A错误;KHF2由K+和HF构成,既含有离子键,又含有共价键,属于含有共价键的离子化合物,B正确;ClO、ClO和ClO的中心原子Cl均采取sp3杂化,孤电子对数依次为2、1、0,孤电子对数越多,键角越小,故ClO、ClO和ClO中O—Cl—O键角依次逐渐增大,C错误;的中心原子S采取sp3杂化,空间结构为四面体形,O—S和S—S的键长不同,故其空间结构不是正四面体形,D错误。
7. D CO2的空间结构是直线形,A错误;H2O的空间结构为V形,B错误;NH3的空间结构为三角锥形,C错误;CH4是正四面体结构,D正确。
8. A 根据价层电子对互斥模型确定微粒的空间结构,SOCl2中S原子形成2个S—Cl,1个S===O,价层电子对数==4,杂化轨道数是4,故S原子采取sp3杂化,中心原子上有一个孤电子对,分子空间结构为三角锥形,A正确。
9. C CH、—CH3、CH的价电子数不同,不互为等电子体,A错误;CH与NH3、H3O+的空间结构均为三角锥形,不是正四面体形,B错误;CH中的碳原子采取sp2杂化,所有原子均共平面,C正确;CH与OH-形成的化合物为CH3OH,只含共价键,不含离子键,D错误。
10. C 基态As核外电子排布式为[Ar]3d104s24p3,A错误;常温下,AsH3为无色气体,熔、沸点低,故固态AsH3属于分子晶体,B错误;NO的中心原子N价层电子对数为3,没有孤电子对,空间结构为平面三角形,C正确;HNO3中只含共价键,D错误。
11. (1) sp3、sp2 CH
(2) sp3、sp2 SO3
(3) 正四面体形 sp、sp2
(4) sp2 SO
(5) sp2 SO3
12. (1) HF、HCl等
(2) CO2、N2O、CNO-、SCN-、N等
(3) N2O4 (4) CH4、SiH4等
(5) SO3、BF3、CO、SiO等 (6) C2H6
1. 了解价层电子对互斥模型,通过对价层电子对互斥模型的探究,建立判断分子空间构型的思维模型。
2. 了解等电子体的概念及判断方法,能用等电子原理解释物质的结构和某些性质,结合实例说明“等电子原理”的应用。
分子 键长/pm 键角
CO2 116 180°
H2O 96 104°30′
NH3 101 107°18′
CH4 109 109°28′
1. 上述分子中的中心原子杂化方式是什么?
2. 结合相关数据和如图所示的分子结构,讨论键角有什么差异,其中可能的原因是什么?
CH4分子、NH3分子和H2O分子的结构示意图
3. 阅读教材,了解测定分子空间结构的方法有哪些?
1. 分子中的价电子对(包括 和 )由于相互 作用,而趋向于尽可能彼此 以减小 ,分子尽可能采取 的空间结构。
2. 讨论价层电子对互斥模型与分子的价电子对的几何构型。
(1) 当中心原子的价电子全部参与成键时,为使价电子斥力最小,分子呈对称的空间结构。
(2) 价电子对数与价电子分布的几何构型的关系
价电子对(n)分布的几何构型
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对分布的几何构型也相同。例如,CH4、NH3和H2O分子的价电子对数都是4,中心原子均采取sp3杂化,价电子对分布的几何构型均为四面体。
该模型的提出主要考虑价电子对之间的斥力,而分子结构的影响因素往往比较复杂。因此应用该模型预测的结果与实验测定有偏差,也不能说明各分子结构中化学键形成的原因和相对稳定性。所以,分子结构的确定最终必须以实验测定为依据。
3. 讨论分子的几何构型。
(1) 对于价电子对全是成键电子对的分子,价电子对的几何构型与分子的空间结构是一致的。
填写下表:
分子 BeCl2 BF3 CH4
价电子对数 2 3 4
几何构型
球棍模型
(2) 中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子的几何构型。
由于中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的几何构型发生变化。如H2O分子氧原子上有两个孤电子对参与互相排斥,所以H2O分子的空间结构为 ;NH3分子中氮原子上有一个孤电子对参与互相排斥,NH3的空间结构是 。
4. 讨论电子对之间斥力的大小和分子中键角大小之间的关系。
(1) 不同的电子对之间的斥力大小顺序是什么?为什么会出现斥力不同?
(2) 为什么CH4、NH3和H2O分子中键角依次减小?
1. 对于ABm型分子(A是中心原子,B是配位原子)的价电子对数可以通过下式确定:
n=
中心原子的价层电子数等于中心原子的 ,卤素原子按提供 个电子计算,氧族元素的原子按提供 个电子计算;配位原子中卤素原子和H原子提供 个电子,氧族元素的原子提供 个电子。对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数,即:
价层电子对数=
计算电子对数时,若剩余1个电子,即出现奇数电子,也把这个单电子当作 电子处理。
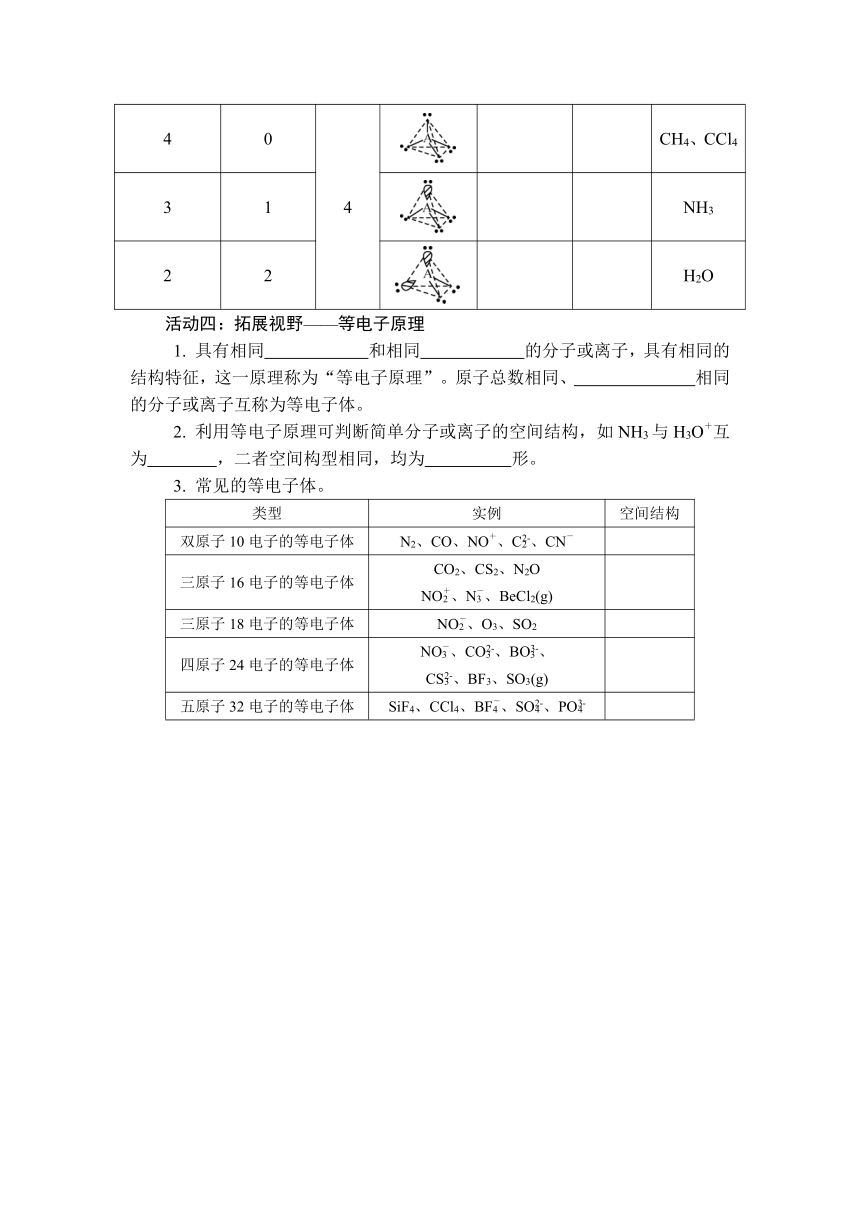
2. 填写常见分子的价层电子对互斥模型和分子的空间结构。
σ键电子对数 孤电子对数 价电子对数 电子对的排列方式 价层电子对互斥模型名称 分子或离子的空间结构名称 实例
2 0 2 BeCl2、CO2
3 0 3 BF3、BCl3、SO3
2 1 SO2
4 0 4 CH4、CCl4
3 1 NH3
2 2 H2O
1. 具有相同 和相同 的分子或离子,具有相同的结构特征,这一原理称为“等电子原理”。原子总数相同、 相同的分子或离子互称为等电子体。
2. 利用等电子原理可判断简单分子或离子的空间结构,如NH3与H3O+互为 ,二者空间构型相同,均为 形。
3. 常见的等电子体。
类型 实例 空间结构
双原子10电子的等电子体 N2、CO、NO+、C、CN-
三原子16电子的等电子体 CO2、CS2、N2O NO、N、BeCl2(g)
三原子18电子的等电子体 NO、O3、SO2
四原子24电子的等电子体 NO、CO、BO、 CS、BF3、SO3(g)
五原子32电子的等电子体 SiF4、CCl4、BF、SO、PO
1. [2025无锡开学考试]下列分子或离子的中心原子采用sp3杂化,但具有V形结构的是( )
A. NH3 B. H2S C. BeCl2 D. NO
2. 水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不正确的是( )
A. 氧原子的杂化类型发生了改变 B. 微粒的形状发生了改变
C. 微粒的化学性质发生了改变 D. 微粒中的键角发生了改变
3. [2024徐州周测]下列说法不正确的是( )
A. N2O与CO2、CCl3F与CCl2F2互为等电子体
B. CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C. H2CO3与H3PO4的C、P杂化相同
D. 由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物是含有共价键的离子化合物
4. [2025南京开学考试]反应CaC2+2H2O===C2H2↑+Ca(OH)2可用于实验室制备乙炔气体。下列说法正确的是 ( )
A. OH-的电子式:
B. C2H2的结构式:H—C≡C—H
C. CaC2中只含离子键
D. H2O的空间结构为直线形
5. C2H5OH具有还原性,一种催化氧化乙醇的反应为2C2H5OH+O22CH3CHO+2H2O。下列有关叙述正确的是 ( )
A. 16O的中子数为16
B. H2O的空间结构是直线形
C. 分子中σ键和π键的数目之比为5∶2
D. C2H5OH与H2O互溶原因之一是C2H5OH与H2O可形成分子间氢键
6. [2024镇江阶段练习]下列说法正确的是( )
A. 基态F原子的核外电子排布式为2s22p5
B. KHF2中既含有离子键,又含有共价键
C. ClO、ClO和ClO中O—Cl—O键角依次逐渐减小
D. S2O的结构如图: ,其空间结构为正四面体形
7. 下列分子的空间结构模型正确的是( )
A B C D
CO2 H2O NH3 CH4
8. 氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是( )
A. 三角锥形、sp3 B. 平面三角形、sp3
C. 平面三角形、sp2 D. 三角锥形、sp2
9. CH、—CH3、CH都是重要的有机反应中间体。下列有关说法正确的是( )
A. CH、—CH3、CH互为等电子体,碳原子均采取sp2杂化
B. CH与NH3、H3O+互为等电子体,空间结构均为正四面体形
C. CH中的碳原子采取sp2杂化,所有原子均共平面
D. CH与OH-形成的化合物中含有离子键
10. [2024盐城阶段练习]已知:常温下,AsH3为无色气体,检验原理为2AsH3+12AgNO3+3H2O===As2O3↓+12HNO3+12Ag↓。下列说法正确的是( )
A. 基态As核外电子排布式为[Ar]4s24p3
B. 固态AsH3属于共价晶体
C. NO的空间结构为平面三角形
D. HNO3中既含离子键又含共价键
11. [2024南通阶段练习](1) CH3COO[Cu(NH3)2][醋酸二氨合铜(Ⅰ)]中C原子轨道的杂化类型是 。与NH3分子互为等电子体的阴离子为 。
(2) 乳酸分子()中C原子的杂化类型为 。与CO互为等电子体的一种分子化学式为 。
(3) ClO的空间结构为 (用文字描述);NaNT可由 (双聚氰胺)为原料制备。双聚氰胺中碳原子的杂化轨道类型为 。
(4) 草酸(HOOC—COOH)分子中碳原子轨道的杂化类型是 ;与SiF4互为等电子体的阴离子的化学式为 。
(5) NO中N原子轨道的杂化类型是 。与NO互为等电子体的一种分子为 (填化学式)。
12. (1) 写出与OH-互为等电子体的一种分子: 。
(2) 写出与NO互为等电子体的两种微粒: 。
(3) 写出与C2O互为等电子体的一种分子: 。
(4) 写出与NH互为等电子体的一种分子: 。
(5) 写出与NO互为等电子体的一种分子和一种离子: 。
(6) 写出与N2H互为等电子体的一种分子: 。
课时2 价层电子对互斥模型 等电子原理
【活动方案】
活动一:
1. 二氧化碳分子中碳原子为sp杂化,其余分子的中心原子均为sp3杂化。
2. 分子间的键角CH4(109°28′)>NH3(107°18′)>H2O(104°30′)。键角的大小除与杂化类型有关,还与分子中的孤电子对数目有关,孤电子对数目越多,键角越小。
3. 用实验的方法可以测定分子的空间结构,如红外光谱、晶体的X射线衍射、核磁共振等。
活动二:
1. 成键电子对 孤电子对 排斥 远离 斥力 对称
3. (1) 直线形 平面三角形 正四面体
(2) V形 三角锥形
4. (1) 价电子对之间的斥力大小顺序:孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力。
斥力大小不同的原因是孤电子对比成键电子对更靠近中心原子的原子核,与其他电子对之间的斥力更大。
(2) 孤电子对数目的增多,孤电子对对成键电子对的排斥作用增强,使得成键电子对与成键电子对之间的键角也被“压缩”而减小。如CH4分子中C原子的杂化轨道上没有孤电子对,NH3分子中N原子的杂化轨道上有1对孤电子对,H2O分子中O原子的杂化轨道上有2对孤电子对,因此CH4、NH3和H2O分子中键角依次减小。
活动三:
1. 最外层电子数 7 6 1 0 1对
2. 直线形 直线形 三角形 平面三角形 V形 四面体形 正四面体形 三角锥形 V形
活动四:
1. 价电子数 原子数 价电子总数
2. 等电子体 三角锥
3. 直线形 直线形 V形 平面三角形 正四面体形
【课堂反馈】
1. B 中心原子采用sp3杂化,但具有V形结构,说明分子或离子的中心原子有2个σ键电子对和2个孤电子对。NH3中有3个N—H σ键,NO中有3个N—O σ键,A、D不符合题意;BeCl2的中心原子Be的价层电子对数为2,孤电子对数为0,采用sp杂化,为直线形结构,C不符合题意。
2. A 水中氧原子的杂化类型为sp3,H3O+中氧原子的杂化类型为sp3,则氧原子的杂化类型没有改变,A错误;水分子为V形,H3O+为三角锥形,则微粒的形状发生了改变,B正确;化学式不同,则性质不同,微粒的化学性质发生了改变,C正确;水分子为V形,H3O+为三角锥形,微粒中的键角发生了改变,D正确。
3. C 原子数相同、价电子总数相同的分子互为等电子体,A正确;CCl2F2呈四面体结构,无同分异构体,中心原子碳采用sp3杂化,B正确;H2CO3的中心原子C采取sp2杂化,H3PO4的中心原子P采取sp3杂化,C错误;由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物是Na2O2,Na2O2由Na+和O构成,O中含有O—O共价键,故Na2O2是含有共价键的离子化合物,D正确。
4. B OH-的电子式为 ,A错误;CaC2由Ca2+和C构成,C中含有C≡C共价键,故CaC2是含有共价键的离子化合物,C错误;H2O的空间结构为V形,D错误。
5. D 16O的质子数为8,质量数为16,则中子数=16-8=8,A错误;H2O的空间结构是V形,B错误;单键为σ键,双键含有1个σ键、1个π键,故CH3CHO分子中含有6个σ键、1个π键,σ键和π键的数目之比为6∶1,C错误;C2H5OH与H2O互溶的原因之一是C2H5OH与H2O可形成分子间氢键,D正确。
6. B 基态F原子的核外电子排布式为1s22s22p5,A错误;KHF2由K+和HF构成,既含有离子键,又含有共价键,属于含有共价键的离子化合物,B正确;ClO、ClO和ClO的中心原子Cl均采取sp3杂化,孤电子对数依次为2、1、0,孤电子对数越多,键角越小,故ClO、ClO和ClO中O—Cl—O键角依次逐渐增大,C错误;的中心原子S采取sp3杂化,空间结构为四面体形,O—S和S—S的键长不同,故其空间结构不是正四面体形,D错误。
7. D CO2的空间结构是直线形,A错误;H2O的空间结构为V形,B错误;NH3的空间结构为三角锥形,C错误;CH4是正四面体结构,D正确。
8. A 根据价层电子对互斥模型确定微粒的空间结构,SOCl2中S原子形成2个S—Cl,1个S===O,价层电子对数==4,杂化轨道数是4,故S原子采取sp3杂化,中心原子上有一个孤电子对,分子空间结构为三角锥形,A正确。
9. C CH、—CH3、CH的价电子数不同,不互为等电子体,A错误;CH与NH3、H3O+的空间结构均为三角锥形,不是正四面体形,B错误;CH中的碳原子采取sp2杂化,所有原子均共平面,C正确;CH与OH-形成的化合物为CH3OH,只含共价键,不含离子键,D错误。
10. C 基态As核外电子排布式为[Ar]3d104s24p3,A错误;常温下,AsH3为无色气体,熔、沸点低,故固态AsH3属于分子晶体,B错误;NO的中心原子N价层电子对数为3,没有孤电子对,空间结构为平面三角形,C正确;HNO3中只含共价键,D错误。
11. (1) sp3、sp2 CH
(2) sp3、sp2 SO3
(3) 正四面体形 sp、sp2
(4) sp2 SO
(5) sp2 SO3
12. (1) HF、HCl等
(2) CO2、N2O、CNO-、SCN-、N等
(3) N2O4 (4) CH4、SiH4等
(5) SO3、BF3、CO、SiO等 (6) C2H6
