4.1 课时1杂化轨道理论 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 4.1 课时1杂化轨道理论 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 14:03:18 | ||
图片预览


文档简介
课时1 杂化轨道理论
1. 了解杂化轨道理论。
2. 学会判断中心原子杂化轨道类型。
3. 建立分子空间构型分析的思维模型。
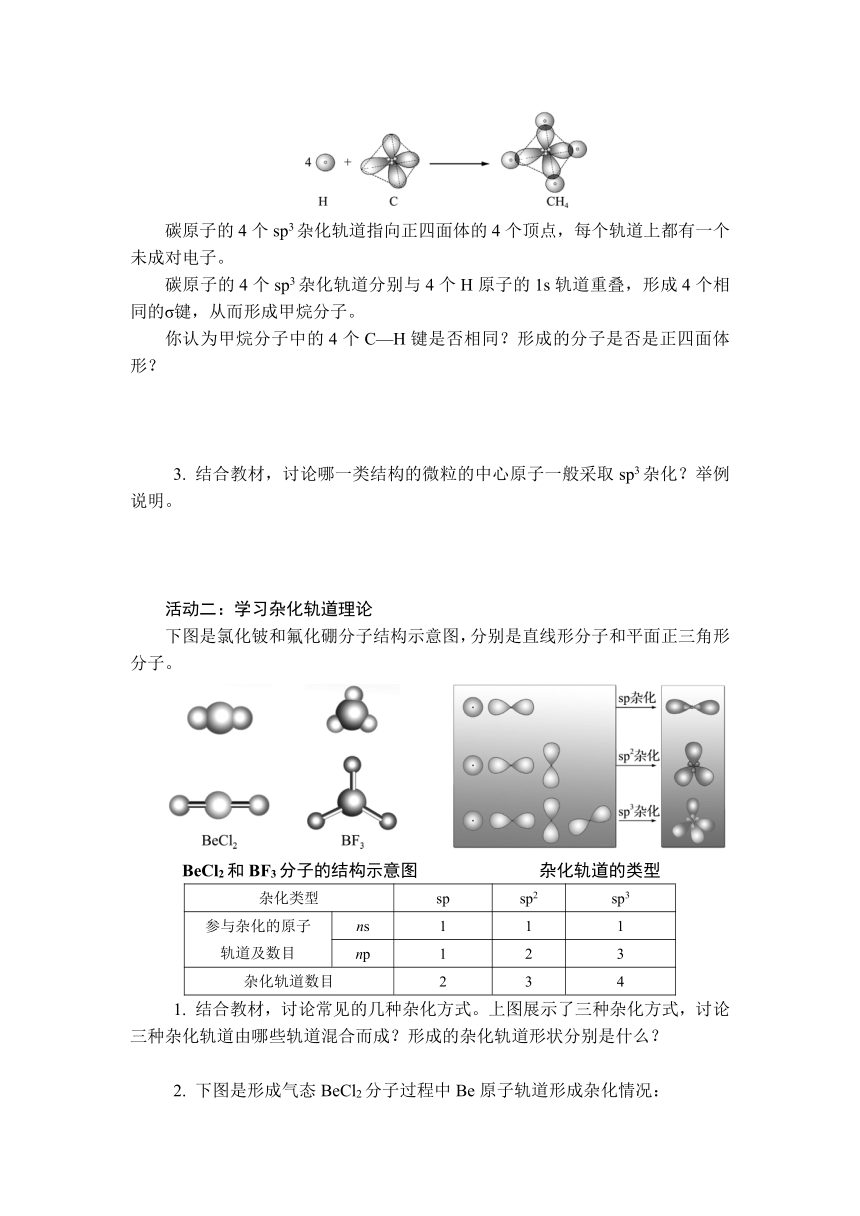
1. 下图是甲烷分子的结构模型。
CH4分子的结构模型
讨论甲烷的分子式为什么是CH4?如图为碳原子外围电子的轨道表示式,你能否解释甲烷分子为什么是正四面体结构?
2. 阅读教材,用杂化轨道理论解释甲烷分子的空间结构。
(1) 下图是碳原子杂化轨道的形成图:
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”起来,可表示为。
你认为形成的sp3杂化轨道的能量是否相等?成分是否相同?
(2) 下图是sp3杂化与H原子1s轨道形成共价键的过程:
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。
碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道重叠,形成4个相同的σ键,从而形成甲烷分子。
你认为甲烷分子中的4个C—H键是否相同?形成的分子是否是正四面体形?
3. 结合教材,讨论哪一类结构的微粒的中心原子一般采取sp3杂化?举例说明。
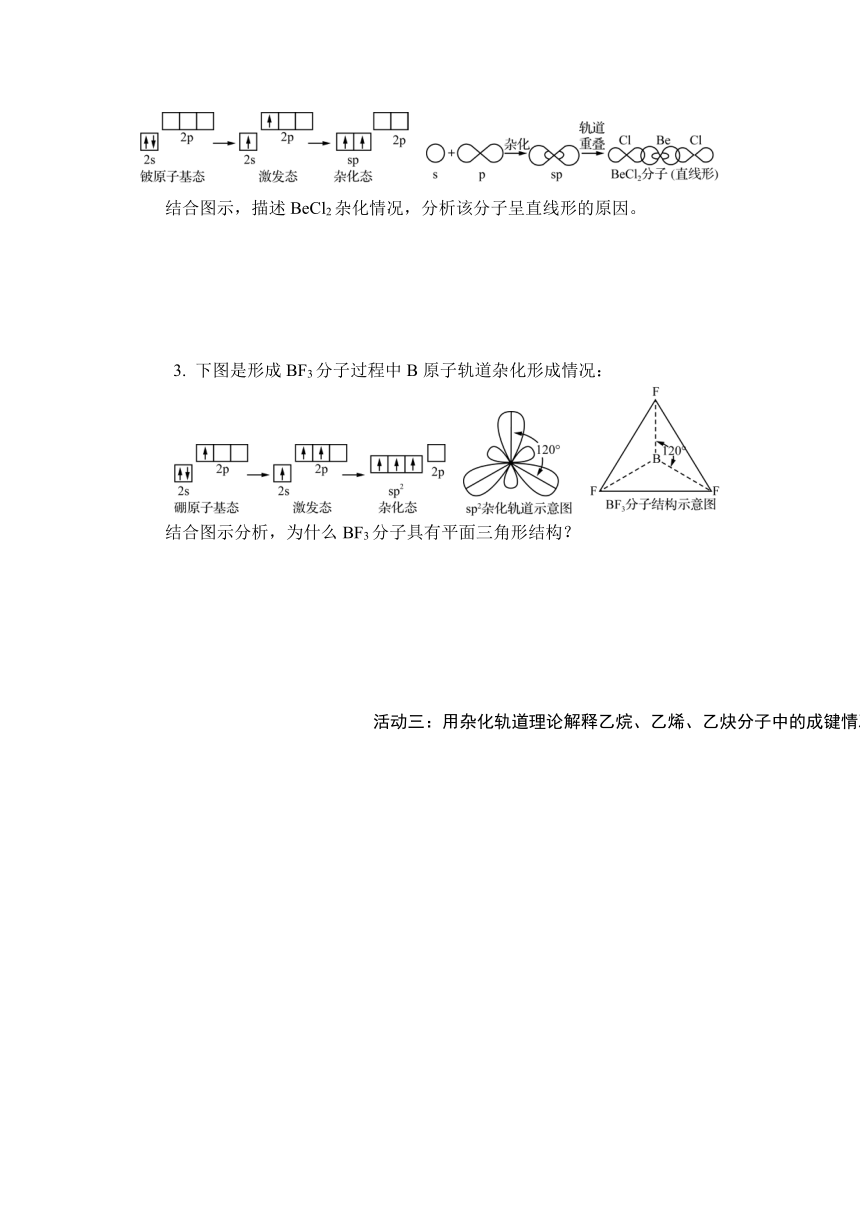
下图是氯化铍和氟化硼分子结构示意图,分别是直线形分子和平面正三角形分子。
BeCl2和BF3分子的结构示意图 杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原子 轨道及数目 ns 1 1 1
np 1 2 3
杂化轨道数目 2 3 4
1. 结合教材,讨论常见的几种杂化方式。上图展示了三种杂化方式,讨论三种杂化轨道由哪些轨道混合而成?形成的杂化轨道形状分别是什么?
2. 下图是形成气态BeCl2分子过程中Be原子轨道形成杂化情况:
结合图示,描述BeCl2杂化情况,分析该分子呈直线形的原因。
3. 下图是形成BF3分子过程中B原子轨道杂化形成情况:
结合图示分析,为什么BF3分子具有平面三角形结构?
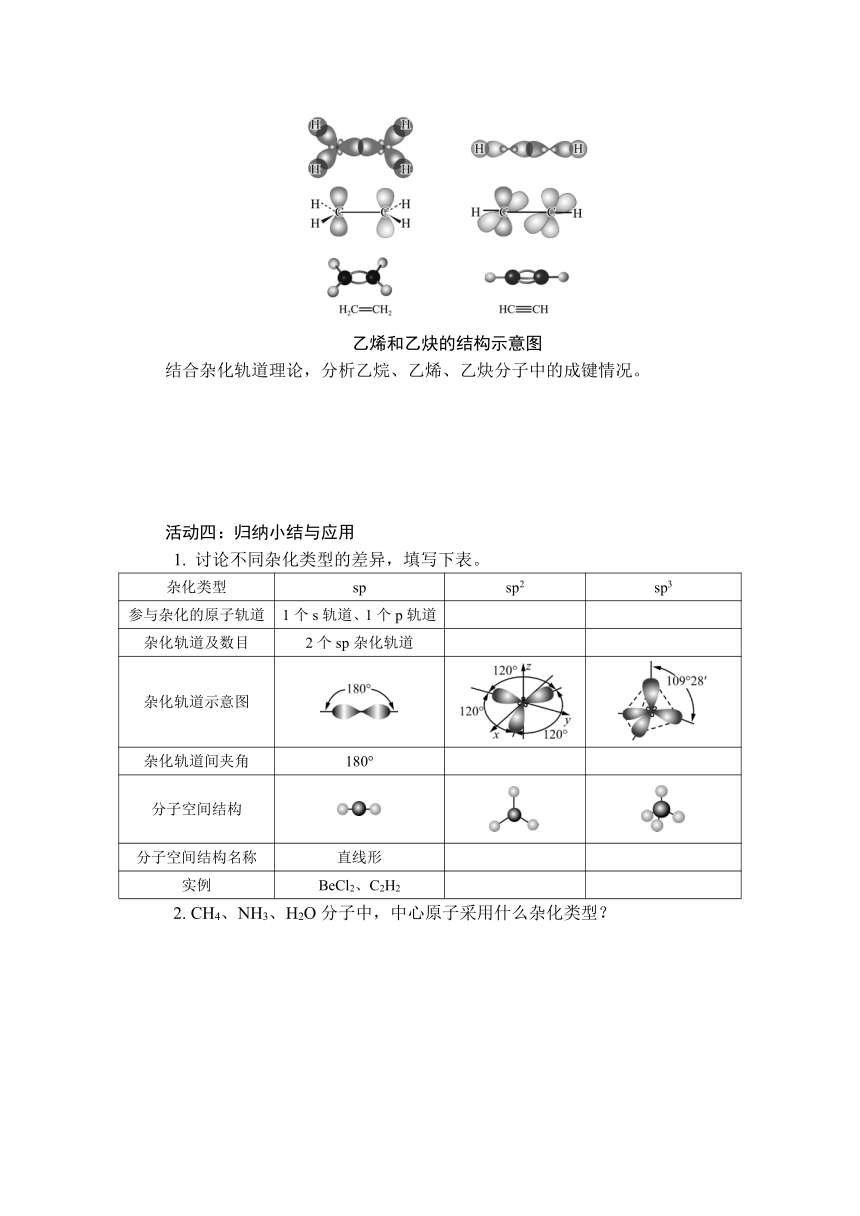
乙烯和乙炔的结构示意图
结合杂化轨道理论,分析乙烷、乙烯、乙炔分子中的成键情况。
1. 讨论不同杂化类型的差异,填写下表。
杂化类型 sp sp2 sp3
参与杂化的原子轨道 1个s轨道、1个p轨道
杂化轨道及数目 2个sp杂化轨道
杂化轨道示意图
杂化轨道间夹角 180°
分子空间结构
分子空间结构名称 直线形
实例 BeCl2、C2H2
2. CH4、NH3、H2O分子中,中心原子采用什么杂化类型?
1. 下列分子中的中心原子采用sp2杂化的是( )
A. NH3 B. CH4 C. BF3 D. H2O
2. [2025无锡阶段练习]下列叙述正确的是( )
A. 共价键只有方向性,没有饱和性
B. 乙烯与H2加成后,C—H的类型由sp2s转化为sp3s
C. 在共价化合物中,一定存在共价键,可能存在离子键
D. 多原子分子中,化学键的键角越大,分子越稳定
3. [2025苏州期中]下列有关尿素()的说法不正确的是( )
A. 尿素分子中碳原子的杂化方式为sp2
B. 尿素构成元素的第一电离能:I1(O)>I1(N)>I1(C)
C. 尿素晶体中存在分子间氢键
D. 尿素晶胞(见右图)中含有2个氧原子
4. 下列说法正确的是( )
图1 图2
A. 如图1所示,由能量相近的1个s轨道与2个p轨道杂化形成3个sp3轨道
B. 如图2所示,HCl分子由H原子的1s轨道和Cl原子的2p轨道重叠形成
C. 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
5. s轨道和p轨道杂化的类型不可能有( )
A. sp杂化 B. sp2杂化 C. sp3杂化 D. sp4杂化
6. 下列分子或离子的中心原子采用sp3杂化的是( )
①NF3 ②C2H4 ③C6H6 ④C2H2 ⑤NH
A. ①②④ B. ①⑤ C. ②③ D. ③⑤
7. [2025南京六校联合体期中]下列说法正确的是( )
A. NH3和N2H4分子中N原子杂化轨道类型不同
B. 液氨电离可表示为2NH3 NH+NH
C. N2H4的结构式为
D. Mg3N2中存在N≡N
8. 在中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A. sp2、sp2 B. sp3、sp3 C. sp2、sp3 D. sp、sp3
9. [2024连云港阶段练习]下列关于原子轨道的说法正确的是( )
A. 氨分子中有1个未参与杂化的孤电子对
B. 凡是AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
C. SF2和C2H6分子中的中心原子S和C都是通过sp3杂化轨道成键的
D. sp3杂化轨道是由能量相近的1个s轨道和3个p轨道重新组合形成的4个能量不同的sp3杂化轨道
10. [2024常州期末]物质的组成和结构决定着物质的性质与变化,下列有关结构和性质的说法正确的是( )
A. CO2分子中存在非极性共价键
B. 金属Li中的金属键比金属K强,故单质Li的还原性比单质K强
C. 邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,故前者的熔点高于后者
D. 乙烯分子中两个碳原子间以sp2杂化轨道形成的σ键较稳定,未杂化的2p轨道形成的π键易断裂,故易发生加成反应
11. [2025无锡阶段练习]有以下物质:①CO2;②NH3;③NH;④CH4;⑤C2H4;⑥C2H2;⑦P4;⑧H2O2。
(1) 上述微粒中,既含有极性键又含有非极性键的是 (填序号,下同)。
(2) 上述微粒中,既含有σ键又含有π键的是 。
(3) 上述微粒中,含有sp杂化的原子的微粒有 。
(4) 上述微粒中,为正四面体结构的有 。
12. 已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题。
(1) 写出基态碳原子的电子排布式: 。
(2) 氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是 、 、 。
(3) 一个三聚氰胺分子中有 个σ键。
(4) 三聚氰胺与三聚氰酸( )分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取 杂化。该分子的结构简式中,每个碳氧原子之间的共价键是 (填字母)。
A. 2个σ键 B. 2个π键 C. 1个σ键,1个π键
课时1 杂化轨道理论
【活动方案】
活动一:
1. 碳原子最外层为4个电子,跟4个氢原子形成4个共价键后,碳原子达到8电子稳定结构,所以甲烷的分子式为CH4。根据前面所学知识,不能解释甲烷分子为什么是正四面体结构。
2. (1) 4个sp3杂化轨道能量相等、成分相同。
(2) 甲烷分子中的4个C—H键是相同的,形成的分子是正四面体形。
3. 正四面体结构的分子或离子的中心原子,一般采用sp3杂化轨道形成共价键,如CCl4、NH等。金刚石的碳原子、晶体硅和石英(SiO2)晶体中的硅原子也是采用sp3杂化轨道形成共价键的。
活动二:
1. sp杂化轨道是由一个ns轨道和一个np轨道组合而成的,杂化轨道间的夹角为180°,呈直线形;sp2杂化轨道是由一个ns轨道和两个np轨道组合而成的,杂化轨道间的夹角为120°,呈平面三角形;sp3杂化轨道是由一个ns轨道和三个np轨道组合而成的,杂化轨道间的夹角为109°28′,空间结构为正四面体形。
2. 杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
3. B原子中的3个sp2杂化轨道间的夹角为120°,这3个sp2杂化轨道分别与F原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
活动三:
在C2H6分子中,C原子均采用sp3杂化,每个C原子的3个sp3轨道与3个H原子的1s轨道重叠形成3个C—H σ键;2个C原子各以1个sp3轨道发生重叠形成1个C—C σ键。
在C2H4分子中,C原子均采用sp2杂化,每个C原子的2个sp2轨道与2个H原子的1s轨道重叠形成2个C—H σ键;2个C原子各以1个sp2轨道发生重叠形成1个C—C σ键,各以1个未杂化的2p轨道发生重叠,形成1个π键。
在C2H2分子中,C原子均采用sp杂化,每个C原子的1个sp轨道与1个H原子的1s轨道重叠形成1个C—H σ键;2个C原子各以1个sp轨道发生重叠形成1个C—C σ键,各以2个未杂化的2p轨道发生重叠,形成2个π键。
活动四:
1. 1个s轨道、2个p轨道 1个s轨道、3个p轨道
3个sp2杂化轨道 4个sp3杂化轨道 120° 109°28′
平面三角形 正四面体形 BF3 CH4、CCl4
2. 均为sp3杂化。
【课堂反馈】
1. C NH3、CH4、H2O分子中的中心原子的杂化轨道数均为4,都是sp3杂化,A、B、D错误;BF3中的B原子的杂化轨道数为0+3=3,为sp2杂化,C正确。
2. B 共价键具有饱和性,A错误;乙烯与氢气反应会变成乙烷,乙烯分子中碳原子采用sp2杂化,乙烷分子中碳原子采用sp3杂化,则碳原子的杂化类型由sp2变为sp3,故乙烯与H2加成后,C—H的类型由sp2-s转化为sp3-s,B正确;共价化合物中一定不含离子键,C错误;分子的稳定性与共价键的键长、键能有关,键角决定分子空间结构,D错误。
3. B 尿素分子的结构为,碳原子的杂化方式为sp2,A正确;尿素的构成元素为H、C、N、O,H的第一电离能最小,C、N、O均为第2周期的元素,同周期主族元素,从左到右第一电离能呈增大趋势但ⅤA族反常地高,第一电离能I1(N)>I1(O)>I1(C),B错误;尿素晶体中含有N—H,存在分子间氢键,C正确;尿素晶胞中,氧原子数=尿素分子数=8×+2×=2,D正确。
4. C 由能量相近的1个s轨道与2个p轨道发生sp2杂化,形成3个sp2轨道,A错误;图2表示HCl分子由H原子的1s轨道和Cl原子的3p轨道重叠形成,B错误;杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,没有杂化的p轨道用于形成π键,C正确;AB3型的共价化合物,其中心原子A可能采用sp3杂化,也可能采用sp2杂化,如BF3中B原子采用sp2杂化,NH3中N采用sp3杂化,D错误。
5. D np轨道有三个:npx、npy、npz,当s轨道和p轨道杂化时只有三种类型:①sp杂化:即一个s轨道和一个p轨道的杂化;②sp2杂化:即一个s轨道和两个p轨道的杂化;③sp3杂化:即一个s轨道和三个p轨道的杂化。故选D。
6. B ①NF3分子中N原子采取sp3杂化;②C2H4分子中C原子采取sp2杂化;③C6H6分子中C原子采取sp2杂化;④C2H2分子中C原子采取sp杂化;⑤NH中N原子采取sp3杂化。故选B。
7. B NH3和N2H4分子中N原子的杂化轨道类型相同,均为sp3杂化,A错误;依据水的电离方程式可知,液氨的电离方程式可表示为2NH3 NH+NH,B正确;根据N原子的成键特点,N2H4的结构式为,C错误;Mg3N2为离子晶体,其中Mg2+与N3-之间为离子键,即不存在N≡N,D错误。
8. C 中间的碳原子采用的杂化方式是sp2;两边的碳原子采用的杂化方式是sp3,C正确。
9. C 氨分子的中心原子N采取sp3杂化,杂化轨道中有1个孤电子对,该对电子未参与成键,但参与了杂化,A错误;AB3型的共价化合物的中心原子A不一定均采用sp3杂化轨道成键,如BCl3的中心原子B采用sp2杂化轨道成键,B错误;sp3杂化轨道是由能量相近的1个s轨道和3个p轨道重新组合形成的4个能量相同的sp3杂化轨道,D错误。
10. D C、O元素的电负性不同,故CO2分子中存在极性共价键,A错误;金属Li中的金属键比金属K强,Li原子最外层电子不如K容易失去,故单质Li的还原性比K弱,B错误;邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,分子间氢键的形成增加了分子之间的吸引作用,使物质熔化、气化消耗的能量比较高,故前者的熔点低于后者,C错误。
11. (1) ⑤⑥⑧ (2) ①⑤⑥ (3) ①⑥ (4) ③④⑦
12. (1) 1s22s22p2 (2) sp sp2 sp3
(3) 15 (4) sp2 C
1. 了解杂化轨道理论。
2. 学会判断中心原子杂化轨道类型。
3. 建立分子空间构型分析的思维模型。
1. 下图是甲烷分子的结构模型。
CH4分子的结构模型
讨论甲烷的分子式为什么是CH4?如图为碳原子外围电子的轨道表示式,你能否解释甲烷分子为什么是正四面体结构?
2. 阅读教材,用杂化轨道理论解释甲烷分子的空间结构。
(1) 下图是碳原子杂化轨道的形成图:
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”起来,可表示为。
你认为形成的sp3杂化轨道的能量是否相等?成分是否相同?
(2) 下图是sp3杂化与H原子1s轨道形成共价键的过程:
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。
碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道重叠,形成4个相同的σ键,从而形成甲烷分子。
你认为甲烷分子中的4个C—H键是否相同?形成的分子是否是正四面体形?
3. 结合教材,讨论哪一类结构的微粒的中心原子一般采取sp3杂化?举例说明。
下图是氯化铍和氟化硼分子结构示意图,分别是直线形分子和平面正三角形分子。
BeCl2和BF3分子的结构示意图 杂化轨道的类型
杂化类型 sp sp2 sp3
参与杂化的原子 轨道及数目 ns 1 1 1
np 1 2 3
杂化轨道数目 2 3 4
1. 结合教材,讨论常见的几种杂化方式。上图展示了三种杂化方式,讨论三种杂化轨道由哪些轨道混合而成?形成的杂化轨道形状分别是什么?
2. 下图是形成气态BeCl2分子过程中Be原子轨道形成杂化情况:
结合图示,描述BeCl2杂化情况,分析该分子呈直线形的原因。
3. 下图是形成BF3分子过程中B原子轨道杂化形成情况:
结合图示分析,为什么BF3分子具有平面三角形结构?
乙烯和乙炔的结构示意图
结合杂化轨道理论,分析乙烷、乙烯、乙炔分子中的成键情况。
1. 讨论不同杂化类型的差异,填写下表。
杂化类型 sp sp2 sp3
参与杂化的原子轨道 1个s轨道、1个p轨道
杂化轨道及数目 2个sp杂化轨道
杂化轨道示意图
杂化轨道间夹角 180°
分子空间结构
分子空间结构名称 直线形
实例 BeCl2、C2H2
2. CH4、NH3、H2O分子中,中心原子采用什么杂化类型?
1. 下列分子中的中心原子采用sp2杂化的是( )
A. NH3 B. CH4 C. BF3 D. H2O
2. [2025无锡阶段练习]下列叙述正确的是( )
A. 共价键只有方向性,没有饱和性
B. 乙烯与H2加成后,C—H的类型由sp2s转化为sp3s
C. 在共价化合物中,一定存在共价键,可能存在离子键
D. 多原子分子中,化学键的键角越大,分子越稳定
3. [2025苏州期中]下列有关尿素()的说法不正确的是( )
A. 尿素分子中碳原子的杂化方式为sp2
B. 尿素构成元素的第一电离能:I1(O)>I1(N)>I1(C)
C. 尿素晶体中存在分子间氢键
D. 尿素晶胞(见右图)中含有2个氧原子
4. 下列说法正确的是( )
图1 图2
A. 如图1所示,由能量相近的1个s轨道与2个p轨道杂化形成3个sp3轨道
B. 如图2所示,HCl分子由H原子的1s轨道和Cl原子的2p轨道重叠形成
C. 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
5. s轨道和p轨道杂化的类型不可能有( )
A. sp杂化 B. sp2杂化 C. sp3杂化 D. sp4杂化
6. 下列分子或离子的中心原子采用sp3杂化的是( )
①NF3 ②C2H4 ③C6H6 ④C2H2 ⑤NH
A. ①②④ B. ①⑤ C. ②③ D. ③⑤
7. [2025南京六校联合体期中]下列说法正确的是( )
A. NH3和N2H4分子中N原子杂化轨道类型不同
B. 液氨电离可表示为2NH3 NH+NH
C. N2H4的结构式为
D. Mg3N2中存在N≡N
8. 在中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A. sp2、sp2 B. sp3、sp3 C. sp2、sp3 D. sp、sp3
9. [2024连云港阶段练习]下列关于原子轨道的说法正确的是( )
A. 氨分子中有1个未参与杂化的孤电子对
B. 凡是AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
C. SF2和C2H6分子中的中心原子S和C都是通过sp3杂化轨道成键的
D. sp3杂化轨道是由能量相近的1个s轨道和3个p轨道重新组合形成的4个能量不同的sp3杂化轨道
10. [2024常州期末]物质的组成和结构决定着物质的性质与变化,下列有关结构和性质的说法正确的是( )
A. CO2分子中存在非极性共价键
B. 金属Li中的金属键比金属K强,故单质Li的还原性比单质K强
C. 邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,故前者的熔点高于后者
D. 乙烯分子中两个碳原子间以sp2杂化轨道形成的σ键较稳定,未杂化的2p轨道形成的π键易断裂,故易发生加成反应
11. [2025无锡阶段练习]有以下物质:①CO2;②NH3;③NH;④CH4;⑤C2H4;⑥C2H2;⑦P4;⑧H2O2。
(1) 上述微粒中,既含有极性键又含有非极性键的是 (填序号,下同)。
(2) 上述微粒中,既含有σ键又含有π键的是 。
(3) 上述微粒中,含有sp杂化的原子的微粒有 。
(4) 上述微粒中,为正四面体结构的有 。
12. 已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题。
(1) 写出基态碳原子的电子排布式: 。
(2) 氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是 、 、 。
(3) 一个三聚氰胺分子中有 个σ键。
(4) 三聚氰胺与三聚氰酸( )分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取 杂化。该分子的结构简式中,每个碳氧原子之间的共价键是 (填字母)。
A. 2个σ键 B. 2个π键 C. 1个σ键,1个π键
课时1 杂化轨道理论
【活动方案】
活动一:
1. 碳原子最外层为4个电子,跟4个氢原子形成4个共价键后,碳原子达到8电子稳定结构,所以甲烷的分子式为CH4。根据前面所学知识,不能解释甲烷分子为什么是正四面体结构。
2. (1) 4个sp3杂化轨道能量相等、成分相同。
(2) 甲烷分子中的4个C—H键是相同的,形成的分子是正四面体形。
3. 正四面体结构的分子或离子的中心原子,一般采用sp3杂化轨道形成共价键,如CCl4、NH等。金刚石的碳原子、晶体硅和石英(SiO2)晶体中的硅原子也是采用sp3杂化轨道形成共价键的。
活动二:
1. sp杂化轨道是由一个ns轨道和一个np轨道组合而成的,杂化轨道间的夹角为180°,呈直线形;sp2杂化轨道是由一个ns轨道和两个np轨道组合而成的,杂化轨道间的夹角为120°,呈平面三角形;sp3杂化轨道是由一个ns轨道和三个np轨道组合而成的,杂化轨道间的夹角为109°28′,空间结构为正四面体形。
2. 杂化后的2个sp杂化轨道分别与氯原子的3p轨道发生重叠,形成2个σ键,构成直线形的BeCl2分子。
3. B原子中的3个sp2杂化轨道间的夹角为120°,这3个sp2杂化轨道分别与F原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
活动三:
在C2H6分子中,C原子均采用sp3杂化,每个C原子的3个sp3轨道与3个H原子的1s轨道重叠形成3个C—H σ键;2个C原子各以1个sp3轨道发生重叠形成1个C—C σ键。
在C2H4分子中,C原子均采用sp2杂化,每个C原子的2个sp2轨道与2个H原子的1s轨道重叠形成2个C—H σ键;2个C原子各以1个sp2轨道发生重叠形成1个C—C σ键,各以1个未杂化的2p轨道发生重叠,形成1个π键。
在C2H2分子中,C原子均采用sp杂化,每个C原子的1个sp轨道与1个H原子的1s轨道重叠形成1个C—H σ键;2个C原子各以1个sp轨道发生重叠形成1个C—C σ键,各以2个未杂化的2p轨道发生重叠,形成2个π键。
活动四:
1. 1个s轨道、2个p轨道 1个s轨道、3个p轨道
3个sp2杂化轨道 4个sp3杂化轨道 120° 109°28′
平面三角形 正四面体形 BF3 CH4、CCl4
2. 均为sp3杂化。
【课堂反馈】
1. C NH3、CH4、H2O分子中的中心原子的杂化轨道数均为4,都是sp3杂化,A、B、D错误;BF3中的B原子的杂化轨道数为0+3=3,为sp2杂化,C正确。
2. B 共价键具有饱和性,A错误;乙烯与氢气反应会变成乙烷,乙烯分子中碳原子采用sp2杂化,乙烷分子中碳原子采用sp3杂化,则碳原子的杂化类型由sp2变为sp3,故乙烯与H2加成后,C—H的类型由sp2-s转化为sp3-s,B正确;共价化合物中一定不含离子键,C错误;分子的稳定性与共价键的键长、键能有关,键角决定分子空间结构,D错误。
3. B 尿素分子的结构为,碳原子的杂化方式为sp2,A正确;尿素的构成元素为H、C、N、O,H的第一电离能最小,C、N、O均为第2周期的元素,同周期主族元素,从左到右第一电离能呈增大趋势但ⅤA族反常地高,第一电离能I1(N)>I1(O)>I1(C),B错误;尿素晶体中含有N—H,存在分子间氢键,C正确;尿素晶胞中,氧原子数=尿素分子数=8×+2×=2,D正确。
4. C 由能量相近的1个s轨道与2个p轨道发生sp2杂化,形成3个sp2轨道,A错误;图2表示HCl分子由H原子的1s轨道和Cl原子的3p轨道重叠形成,B错误;杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,没有杂化的p轨道用于形成π键,C正确;AB3型的共价化合物,其中心原子A可能采用sp3杂化,也可能采用sp2杂化,如BF3中B原子采用sp2杂化,NH3中N采用sp3杂化,D错误。
5. D np轨道有三个:npx、npy、npz,当s轨道和p轨道杂化时只有三种类型:①sp杂化:即一个s轨道和一个p轨道的杂化;②sp2杂化:即一个s轨道和两个p轨道的杂化;③sp3杂化:即一个s轨道和三个p轨道的杂化。故选D。
6. B ①NF3分子中N原子采取sp3杂化;②C2H4分子中C原子采取sp2杂化;③C6H6分子中C原子采取sp2杂化;④C2H2分子中C原子采取sp杂化;⑤NH中N原子采取sp3杂化。故选B。
7. B NH3和N2H4分子中N原子的杂化轨道类型相同,均为sp3杂化,A错误;依据水的电离方程式可知,液氨的电离方程式可表示为2NH3 NH+NH,B正确;根据N原子的成键特点,N2H4的结构式为,C错误;Mg3N2为离子晶体,其中Mg2+与N3-之间为离子键,即不存在N≡N,D错误。
8. C 中间的碳原子采用的杂化方式是sp2;两边的碳原子采用的杂化方式是sp3,C正确。
9. C 氨分子的中心原子N采取sp3杂化,杂化轨道中有1个孤电子对,该对电子未参与成键,但参与了杂化,A错误;AB3型的共价化合物的中心原子A不一定均采用sp3杂化轨道成键,如BCl3的中心原子B采用sp2杂化轨道成键,B错误;sp3杂化轨道是由能量相近的1个s轨道和3个p轨道重新组合形成的4个能量相同的sp3杂化轨道,D错误。
10. D C、O元素的电负性不同,故CO2分子中存在极性共价键,A错误;金属Li中的金属键比金属K强,Li原子最外层电子不如K容易失去,故单质Li的还原性比K弱,B错误;邻羟基苯甲醛能形成分子内氢键,而对羟基苯甲醛能形成分子间氢键,分子间氢键的形成增加了分子之间的吸引作用,使物质熔化、气化消耗的能量比较高,故前者的熔点低于后者,C错误。
11. (1) ⑤⑥⑧ (2) ①⑤⑥ (3) ①⑥ (4) ③④⑦
12. (1) 1s22s22p2 (2) sp sp2 sp3
(3) 15 (4) sp2 C
