4.1 课时3分子的极性 手性分子 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 4.1 课时3分子的极性 手性分子 同步学案(含答案)2024-2025学年高二化学苏教版(2020)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 14:03:13 | ||
图片预览




文档简介
课时3 分子的极性 手性分子
1. 了解分子的极性、手性分子等概念。
2. 认识分子空间构型与极性的关系,能运用有关理论预测分子的极性。
3. 结合实例初步认识分子的手性对其性质的影响。
【实验1】在培养皿中加入少量四氯化碳,用滴管滴一滴水(也可滴一滴加过红墨水的水)于培养皿中,将摩擦带电的玻璃棒或塑料棒接近水滴,观察水滴的运动。
【实验2】在盛有一小粒固体碘的试管中加2 mL水,振荡,观察其溶解情况。再向上述试管中加入1 mL 四氯化碳,振荡。比较碘在水中和在四氯化碳中的溶解情况。
1. 由上述实验1,可推出水分子带电吗?由实验2可得出什么结论,为什么?
2. 阅读教材,了解极性分子、非极性分子概念。
(1) 极性分子: 。
(2) 非极性分子: 。
1. 结合下表中的实例,结合极性分子、非极性分子的概念,判断对应分子的极性,填入下表。
类型 实例 键的极性 分子的极性 空间结构
X2 H2、N2 非极性键 直线形
XY HCl、NO 极性键 直线形
XY2(X2Y) CO2、CS2 极性键 直线形
SO2 极性键 V形
H2O、H2S 极性键 V形
XY3 BF3 极性键 平面三角形
NH3 极性键 三角锥形
XY4 CH4、CCl4 极性键 正四面体形
2. 结合教材中关于双原子分子和多原子分子的极性的分析:
双原子分子的极性取决于成键原子之间的共价键是否有极性,以极性键结合的双原子分子是极性分子,如HCl、CO、NO等;以非极性键结合的双原子分子是非极性分子,如H2、O2、N2等。同种原子形成的双原子分子都是非极性分子。
以极性键结合的多原子分子(ABm,A为中心原子,B为配位原子),分子是否有极性取决于分子的空间结构。如CO2、BF3、CH4等分子,虽然分子中的共价键都是极性键,但由于配位原子对称地分布在中心原子周围,整个分子的正、负电荷重心相重合,所以这些分子都是非极性分子。
(1) 双原子分子的极性取决于 。 的双原子分子是极性分子,如HCl、CO、NO等; 的双原子分子是非极性分子,如H2、O2、N2等。
(2) 判断多原子分子的极性,能否简单看分子中共价键的极性?如何分析多原子分子的极性?CO2、BF3、CH4为什么是非极性分子?
3. 讨论。
(1) 非极性分子中是否一定含有非极性键?
(2) 含有非极性键的分子是否一定为非极性分子?
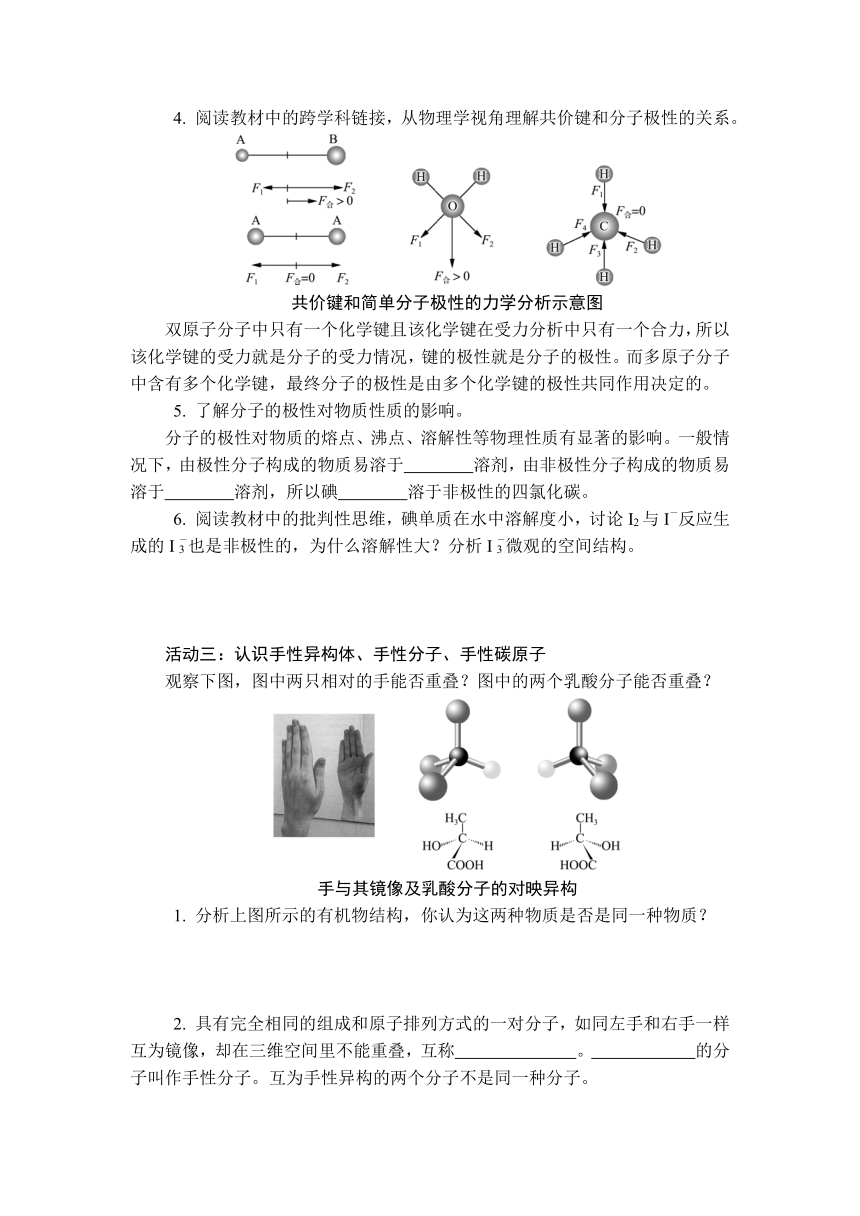
4. 阅读教材中的跨学科链接,从物理学视角理解共价键和分子极性的关系。
共价键和简单分子极性的力学分析示意图
双原子分子中只有一个化学键且该化学键在受力分析中只有一个合力,所以该化学键的受力就是分子的受力情况,键的极性就是分子的极性。而多原子分子中含有多个化学键,最终分子的极性是由多个化学键的极性共同作用决定的。
5. 了解分子的极性对物质性质的影响。
分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响。一般情况下,由极性分子构成的物质易溶于 溶剂,由非极性分子构成的物质易溶于 溶剂,所以碘 溶于非极性的四氯化碳。
6. 阅读教材中的批判性思维,碘单质在水中溶解度小,讨论I2与I-反应生成的I也是非极性的,为什么溶解性大?分析I微观的空间结构。
观察下图,图中两只相对的手能否重叠?图中的两个乳酸分子能否重叠?
手与其镜像及乳酸分子的对映异构
1. 分析上图所示的有机物结构,你认为这两种物质是否是同一种物质?
2. 具有完全相同的组成和原子排列方式的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称 。 的分子叫作手性分子。互为手性异构的两个分子不是同一种分子。
3. 连接四个不同的原子或基团的碳原子称为 。每个手性碳原子所连接的原子或基团在空间的排布相似但不能重叠。
4. 思考:不饱和碳原子有可能是手性碳原子吗?
1. 构成生命体的绝大多数分子为手性分子,两个手性分子的性质不同,且手性有机物中必含手性碳原子。
苧烯分子手性异构体的结构与存在
阅读教材,讨论一对手性分子的性质是否相似?
2. 阅读拓展视野,了解手性分子的应用。
人们把含有手性分子的药物称为手性药物,目前所用的很多药物都具有手性。
1. 下列有关氯气的说法不正确的是( )
A. Cl2是由共价键构成的非极性分子
B. 制备漂白粉的方法是用石灰水吸收Cl2
C. 利用湿润的淀粉-KI试纸可检验Cl2
D. 工业上可用电解饱和食盐水制得Cl2
2. [2025南通期中]工业合成尿素的反应原理为CO2+2NH3
CO(NH2)2+H2O。下列说法正确的是( )
A. CO2为极性分子
B. NH3的电子式为
C. CO(NH2)2中N元素的化合价为+3
D. H2O的空间结构为V形
3. 用短线“-”表示共用电子对,用“?”表示未成键孤对电子的式子叫路易斯结构式。下列路易斯结构式表示的分子属于极性分子的是( )
① ② ③ ④
A. ①②③④ B. ①②③
C. ②③④ D. ③④
4. [2024无锡阶段练习]下列现象不能用“相似相溶规则”解释的是( )
A. 甲烷难溶于水 B. 氯气易溶于NaOH溶液
C. 溴易溶于CCl4 D. 酒精易溶于水
5. 通常状态下,NCl3是一种油状液体,其分子空间结构与氨分子相似,下列对NCl3的有关描述正确的是( )
A. NCl3分子中N—Cl键长比CCl4分子中C—Cl键长长
B. NCl3分子中的所有原子均达到8电子稳定结构
C. NCl3分子是非极性分子,NCl3的沸点低于NH3的沸点
D. NBr3比NCl3易挥发
6. 下列说法错误的是( )
A. 存在对映异构现象
B. 、分子中均含有手性碳原子
C. 分子中含有2个手性碳原子
D. 与足量H2反应后的有机产物分子中含有3个手性碳原子
7. [2024徐州阶段练习]已知带静电的有机玻璃棒靠近纯水的细流,细流会发生偏转,则用带静电的有机玻璃棒靠近下列物质的细流时,细流也发生偏转的是( )
A. 苯 B. 二硫化碳 C. 双氧水 D. 四氯化碳
8. 已知H2O2分子的空间结构如图所示,下列有关H2O2的说法正确的是( )
A. H2O2分子中有3个σ键、1个π键
B. H2O2为非极性分子
C. H2O2中氧原子为sp杂化
D. H2O2的沸点高达158 ℃,可推测H2O2分子间可形成氢键
9. 下列有机物分子中属于手性分子的是( )
①乳酸[CH3CH(OH)COOH] ②2-丁醇 ③ ④丙三醇
A. 只有① B. ①和②
C. ①②③ D. ①②③④
10. 氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题。
(1) 写出基态铬原子的电子排布式: ,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 (填元素符号)。
(2) 常温下CrO2Cl2为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子。
(3) 在①乙烯、②SO、③BF3、④H2O、⑤CCl4、⑥SO3六种微粒中,中心原子采取sp2杂化的分子有 (填序号),写出一种与SO互为等电子体的阴离子: 。
11. [2025无锡阶段练习改编]已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的电子总数是其内层电子数的4倍;C是周期表1~18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4∶1,其d能级中有一对成对电子,E基态原子的内层轨道全部排满电子,且最外层电子数为2。
请回答下列问题。
(1) A与C形成的简单共价化合物的分子式是 ,中心原子杂化类型是 ,分子的空间结构是 。
(2) B与C比较,电负性较小的是 (填元素符号)。
(3) D位于元素周期表中 族,D2+的结构示意图是 。
(4) E位于元素周期表中 区,E2+的价层电子排布图是______________
______________________。
课时3 分子的极性 手性分子
【活动方案】
活动一:
1. 实验1:可以看到水滴会随着带电的玻璃棒或塑料棒运动,异种电荷相互吸引、同种电荷相互排斥,但水是中性的不带电的分子,所以只能推出水分子发生运动的原因是水分子出现正负两极,即水分子有极性。
实验2:可以看到碘在水中颜色较淡,在四氯化碳中颜色较深,可得出碘在四氯化碳中溶解度大,在水中溶解度小。
2. (1) 正电荷重心和负电荷重心不重合的分子
(2) 正电荷重心和负电荷重心重合的分子
活动二:
1. 非极性分子 极性分子 非极性分子 极性分子
极性分子 非极性分子 极性分子 非极性分子
2. (1) 成键原子之间的共价键是否有极性 以极性键结合的 以非极性键结合
(2) 不能。多原子分子的极性决定于分子的空间结构,不能简单看分子中共价键的极性。CO2、BF3、CH4等分子中的配位原子对称地分布在中心原子周围,整个分子的正、负电荷重心相重合,所以这些分子都是非极性分子。
3. (1) 非极性分子中不一定含有非极性键,例如CH4是非极性分子,只有极性键。
(2) 含有非极性键的分子不一定是非极性分子,如H2O2是含有非极性键的极性分子。
5. 极性 非极性 易
6. I2分子是非极性分子,水是极性分子,极性不相似,所以碘单质在水中溶解度小;I虽然也是非极性的,但该离子是带电的微粒,所以溶解性增大。根据价层电子对互斥模型,I的中心原子I的价电子对数为5,只有两个成键电子对,有3个孤电子对,VSEPR模型为 ,I的结构为直线形。
活动三:
均不能重叠。
1. 不属于同一种物质。
2. 手性异构体 有手性异构体
3. 手性碳原子
4. 手性碳原子是饱和碳原子,则不饱和碳原子一定不是手性碳原子。
活动四:
1. 一对手性异构体的物理性质(如沸点、熔点、密度等)基本相同,但它们的旋光性和生理作用往往不同。
【课堂反馈】
1. B Cl2含有非极性共价键,且属于非极性分子,A正确;工业上采用Cl2与石灰乳反应制备漂白粉,B错误;Cl2与KI反应生成I2,从而使湿润的淀粉KI试纸变蓝,故可用该方法检验Cl2,C正确;电解饱和食盐水又叫氯碱工业,可获得NaOH、H2、Cl2,D正确。
2. D CO2为非极性分子,A错误;NH3的电子式为,B错误;CO(NH2)2中C元素化合价为+4,O元素化合价为-2,氢元素化合价为+1,则N元素的化合价为-3,C错误。
3. D ①表示的分子呈直线形,分子中正、负电荷重心重合,属于非极性分子,不符合题意;②表示的分子呈平面三角形,分子中正、负电荷重心重合,属于非极性分子,不符合题意;③表示的是三角锥形分子,分子中正、负电荷重心不重合,属于极性分子,符合题意;④表示的是V形分子,分子中正、负电荷重心不重合,是极性分子,符合题意。故选D。
4. B 甲烷是非极性分子、水是极性分子,故甲烷难溶于水,能用“相似相溶规则”解释,A不符合题意;氯气易溶于NaOH溶液,是因为氯气能和NaOH反应,不能用“相似相溶规则”解释,B符合题意;溴、CCl4都是非极性分子,故溴易溶于CCl4,能用“相似相溶规则”解释,C不符合题意;酒精、水都是极性分子,故酒精易溶于水,能用“相似相溶规则”解释,D不符合题意。
5. B 共价键的键长是指相邻两原子之间的核间距,由于C原子的半径比N原子大,故NCl3分子中N—Cl键长比CCl4分子中C—Cl键长短,A错误;根据NCl3分子的电子式:可知,分子中的所有原子均达到8电子稳定结构,B正确;由于NCl3分子中N原子周围形成了3个σ键,孤电子对数为×(5-3×1)=1,故为三角锥形结构,是极性分子,由题干可知,通常状态下NCl3为无色液体,而NH3为无色气体,故NCl3的沸点高于NH3的沸点,C错误;根据等电子原理可知,NBr3与NCl3的结构相似,且NBr3的相对分子质量比NCl3大,故NBr3的分子间作用力比NCl3大,NBr3的沸点比NCl3高,故NBr3比NCl3更难挥发,D错误。
6. D 与羧基相连的碳原子为手性碳原子,分子中含有1个手性碳原子,该分子存在对映异构现象,A正确;两分子中,左边第2个碳原子均为手性碳原子,B正确;连接—Br和—COOCH3的碳原子均为手性碳原子,分子中含有2个手性碳原子,C正确;与足量H2反应后的有机产物为(标“*”碳原子为手性碳原子),产物分子中含有4个手性碳原子,D错误。
7. C 苯的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近苯的细流时,细流不发生偏转,A错误;二硫化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近二硫化碳的细流时,细流不发生偏转,B错误;双氧水的结构不对称,为极性分子,电荷分布不均匀,用带静电的有机玻璃棒靠近双氧水的细流时,细流会发生偏转,C正确;四氯化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近四氯化碳的细流时,细流不发生偏转,D错误。
8. D H2O2的电子式为,该物质中不含π键,A错误;根据题中结构知,该分子正电荷重心与负电荷重心不重合,为极性分子,B错误;H2O2中氧原子为sp3杂化,C错误;H2O2的沸点较高,推测H2O2分子间可形成氢键,D正确。
9. C 含有不对称碳原子的分子为手性分子。各分子的结构简式如下:
①②③分子中存在手性碳原子(用“*”标记),而④分子中不存在手性碳原子,C正确。
10. (1) 1s22s22p63s23p63d54s1或[Ar]3d54s1 K、Cu (2) 非极性
(3) ①③⑥ ClO、PO等
解析:(1) 已知铬为24号元素,故基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其在第4周期,最外层上有1个电子,即最外层排布为4s1,故与铬同周期的所有元素中,基态原子最外层电子数与铬原子相同的有K、Cu。(2) 已知CCl4、CS2为非极性分子,根据“相似相溶规则”可知,CrO2Cl2是非极性分子。(3) ①在乙烯中C原子周围只形成了3个σ键,无孤电子对,故为sp2杂化;②SO中S原子周围形成了3个σ键,价层电子对数为4,故为sp3杂化;③BF3中B原子周围形成了3个σ键,价层电子对数为3,故为sp2杂化;④H2O中O原子周围形成了2个σ键,价层电子对数为4,故为sp3杂化;⑤CCl4中C原子周围形成了4个σ键,价层电子对数为4,故为sp3杂化;⑥SO3中S周围形成了3个σ键,价层电子对数为3,故为sp2杂化。六种微粒中,中心原子采取sp2杂化的分子有①③⑥,等电子体是指原子总数相同,价电子总数相等的微粒,故与SO互为等电子体的阴离子有ClO、PO等。
11. (1) SiH4 sp3 正四面体形 (2) Si
(3) Ⅷ (4) ds
1. 了解分子的极性、手性分子等概念。
2. 认识分子空间构型与极性的关系,能运用有关理论预测分子的极性。
3. 结合实例初步认识分子的手性对其性质的影响。
【实验1】在培养皿中加入少量四氯化碳,用滴管滴一滴水(也可滴一滴加过红墨水的水)于培养皿中,将摩擦带电的玻璃棒或塑料棒接近水滴,观察水滴的运动。
【实验2】在盛有一小粒固体碘的试管中加2 mL水,振荡,观察其溶解情况。再向上述试管中加入1 mL 四氯化碳,振荡。比较碘在水中和在四氯化碳中的溶解情况。
1. 由上述实验1,可推出水分子带电吗?由实验2可得出什么结论,为什么?
2. 阅读教材,了解极性分子、非极性分子概念。
(1) 极性分子: 。
(2) 非极性分子: 。
1. 结合下表中的实例,结合极性分子、非极性分子的概念,判断对应分子的极性,填入下表。
类型 实例 键的极性 分子的极性 空间结构
X2 H2、N2 非极性键 直线形
XY HCl、NO 极性键 直线形
XY2(X2Y) CO2、CS2 极性键 直线形
SO2 极性键 V形
H2O、H2S 极性键 V形
XY3 BF3 极性键 平面三角形
NH3 极性键 三角锥形
XY4 CH4、CCl4 极性键 正四面体形
2. 结合教材中关于双原子分子和多原子分子的极性的分析:
双原子分子的极性取决于成键原子之间的共价键是否有极性,以极性键结合的双原子分子是极性分子,如HCl、CO、NO等;以非极性键结合的双原子分子是非极性分子,如H2、O2、N2等。同种原子形成的双原子分子都是非极性分子。
以极性键结合的多原子分子(ABm,A为中心原子,B为配位原子),分子是否有极性取决于分子的空间结构。如CO2、BF3、CH4等分子,虽然分子中的共价键都是极性键,但由于配位原子对称地分布在中心原子周围,整个分子的正、负电荷重心相重合,所以这些分子都是非极性分子。
(1) 双原子分子的极性取决于 。 的双原子分子是极性分子,如HCl、CO、NO等; 的双原子分子是非极性分子,如H2、O2、N2等。
(2) 判断多原子分子的极性,能否简单看分子中共价键的极性?如何分析多原子分子的极性?CO2、BF3、CH4为什么是非极性分子?
3. 讨论。
(1) 非极性分子中是否一定含有非极性键?
(2) 含有非极性键的分子是否一定为非极性分子?
4. 阅读教材中的跨学科链接,从物理学视角理解共价键和分子极性的关系。
共价键和简单分子极性的力学分析示意图
双原子分子中只有一个化学键且该化学键在受力分析中只有一个合力,所以该化学键的受力就是分子的受力情况,键的极性就是分子的极性。而多原子分子中含有多个化学键,最终分子的极性是由多个化学键的极性共同作用决定的。
5. 了解分子的极性对物质性质的影响。
分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响。一般情况下,由极性分子构成的物质易溶于 溶剂,由非极性分子构成的物质易溶于 溶剂,所以碘 溶于非极性的四氯化碳。
6. 阅读教材中的批判性思维,碘单质在水中溶解度小,讨论I2与I-反应生成的I也是非极性的,为什么溶解性大?分析I微观的空间结构。
观察下图,图中两只相对的手能否重叠?图中的两个乳酸分子能否重叠?
手与其镜像及乳酸分子的对映异构
1. 分析上图所示的有机物结构,你认为这两种物质是否是同一种物质?
2. 具有完全相同的组成和原子排列方式的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能重叠,互称 。 的分子叫作手性分子。互为手性异构的两个分子不是同一种分子。
3. 连接四个不同的原子或基团的碳原子称为 。每个手性碳原子所连接的原子或基团在空间的排布相似但不能重叠。
4. 思考:不饱和碳原子有可能是手性碳原子吗?
1. 构成生命体的绝大多数分子为手性分子,两个手性分子的性质不同,且手性有机物中必含手性碳原子。
苧烯分子手性异构体的结构与存在
阅读教材,讨论一对手性分子的性质是否相似?
2. 阅读拓展视野,了解手性分子的应用。
人们把含有手性分子的药物称为手性药物,目前所用的很多药物都具有手性。
1. 下列有关氯气的说法不正确的是( )
A. Cl2是由共价键构成的非极性分子
B. 制备漂白粉的方法是用石灰水吸收Cl2
C. 利用湿润的淀粉-KI试纸可检验Cl2
D. 工业上可用电解饱和食盐水制得Cl2
2. [2025南通期中]工业合成尿素的反应原理为CO2+2NH3
CO(NH2)2+H2O。下列说法正确的是( )
A. CO2为极性分子
B. NH3的电子式为
C. CO(NH2)2中N元素的化合价为+3
D. H2O的空间结构为V形
3. 用短线“-”表示共用电子对,用“?”表示未成键孤对电子的式子叫路易斯结构式。下列路易斯结构式表示的分子属于极性分子的是( )
① ② ③ ④
A. ①②③④ B. ①②③
C. ②③④ D. ③④
4. [2024无锡阶段练习]下列现象不能用“相似相溶规则”解释的是( )
A. 甲烷难溶于水 B. 氯气易溶于NaOH溶液
C. 溴易溶于CCl4 D. 酒精易溶于水
5. 通常状态下,NCl3是一种油状液体,其分子空间结构与氨分子相似,下列对NCl3的有关描述正确的是( )
A. NCl3分子中N—Cl键长比CCl4分子中C—Cl键长长
B. NCl3分子中的所有原子均达到8电子稳定结构
C. NCl3分子是非极性分子,NCl3的沸点低于NH3的沸点
D. NBr3比NCl3易挥发
6. 下列说法错误的是( )
A. 存在对映异构现象
B. 、分子中均含有手性碳原子
C. 分子中含有2个手性碳原子
D. 与足量H2反应后的有机产物分子中含有3个手性碳原子
7. [2024徐州阶段练习]已知带静电的有机玻璃棒靠近纯水的细流,细流会发生偏转,则用带静电的有机玻璃棒靠近下列物质的细流时,细流也发生偏转的是( )
A. 苯 B. 二硫化碳 C. 双氧水 D. 四氯化碳
8. 已知H2O2分子的空间结构如图所示,下列有关H2O2的说法正确的是( )
A. H2O2分子中有3个σ键、1个π键
B. H2O2为非极性分子
C. H2O2中氧原子为sp杂化
D. H2O2的沸点高达158 ℃,可推测H2O2分子间可形成氢键
9. 下列有机物分子中属于手性分子的是( )
①乳酸[CH3CH(OH)COOH] ②2-丁醇 ③ ④丙三醇
A. 只有① B. ①和②
C. ①②③ D. ①②③④
10. 氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题。
(1) 写出基态铬原子的电子排布式: ,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 (填元素符号)。
(2) 常温下CrO2Cl2为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子。
(3) 在①乙烯、②SO、③BF3、④H2O、⑤CCl4、⑥SO3六种微粒中,中心原子采取sp2杂化的分子有 (填序号),写出一种与SO互为等电子体的阴离子: 。
11. [2025无锡阶段练习改编]已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的电子总数是其内层电子数的4倍;C是周期表1~18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4∶1,其d能级中有一对成对电子,E基态原子的内层轨道全部排满电子,且最外层电子数为2。
请回答下列问题。
(1) A与C形成的简单共价化合物的分子式是 ,中心原子杂化类型是 ,分子的空间结构是 。
(2) B与C比较,电负性较小的是 (填元素符号)。
(3) D位于元素周期表中 族,D2+的结构示意图是 。
(4) E位于元素周期表中 区,E2+的价层电子排布图是______________
______________________。
课时3 分子的极性 手性分子
【活动方案】
活动一:
1. 实验1:可以看到水滴会随着带电的玻璃棒或塑料棒运动,异种电荷相互吸引、同种电荷相互排斥,但水是中性的不带电的分子,所以只能推出水分子发生运动的原因是水分子出现正负两极,即水分子有极性。
实验2:可以看到碘在水中颜色较淡,在四氯化碳中颜色较深,可得出碘在四氯化碳中溶解度大,在水中溶解度小。
2. (1) 正电荷重心和负电荷重心不重合的分子
(2) 正电荷重心和负电荷重心重合的分子
活动二:
1. 非极性分子 极性分子 非极性分子 极性分子
极性分子 非极性分子 极性分子 非极性分子
2. (1) 成键原子之间的共价键是否有极性 以极性键结合的 以非极性键结合
(2) 不能。多原子分子的极性决定于分子的空间结构,不能简单看分子中共价键的极性。CO2、BF3、CH4等分子中的配位原子对称地分布在中心原子周围,整个分子的正、负电荷重心相重合,所以这些分子都是非极性分子。
3. (1) 非极性分子中不一定含有非极性键,例如CH4是非极性分子,只有极性键。
(2) 含有非极性键的分子不一定是非极性分子,如H2O2是含有非极性键的极性分子。
5. 极性 非极性 易
6. I2分子是非极性分子,水是极性分子,极性不相似,所以碘单质在水中溶解度小;I虽然也是非极性的,但该离子是带电的微粒,所以溶解性增大。根据价层电子对互斥模型,I的中心原子I的价电子对数为5,只有两个成键电子对,有3个孤电子对,VSEPR模型为 ,I的结构为直线形。
活动三:
均不能重叠。
1. 不属于同一种物质。
2. 手性异构体 有手性异构体
3. 手性碳原子
4. 手性碳原子是饱和碳原子,则不饱和碳原子一定不是手性碳原子。
活动四:
1. 一对手性异构体的物理性质(如沸点、熔点、密度等)基本相同,但它们的旋光性和生理作用往往不同。
【课堂反馈】
1. B Cl2含有非极性共价键,且属于非极性分子,A正确;工业上采用Cl2与石灰乳反应制备漂白粉,B错误;Cl2与KI反应生成I2,从而使湿润的淀粉KI试纸变蓝,故可用该方法检验Cl2,C正确;电解饱和食盐水又叫氯碱工业,可获得NaOH、H2、Cl2,D正确。
2. D CO2为非极性分子,A错误;NH3的电子式为,B错误;CO(NH2)2中C元素化合价为+4,O元素化合价为-2,氢元素化合价为+1,则N元素的化合价为-3,C错误。
3. D ①表示的分子呈直线形,分子中正、负电荷重心重合,属于非极性分子,不符合题意;②表示的分子呈平面三角形,分子中正、负电荷重心重合,属于非极性分子,不符合题意;③表示的是三角锥形分子,分子中正、负电荷重心不重合,属于极性分子,符合题意;④表示的是V形分子,分子中正、负电荷重心不重合,是极性分子,符合题意。故选D。
4. B 甲烷是非极性分子、水是极性分子,故甲烷难溶于水,能用“相似相溶规则”解释,A不符合题意;氯气易溶于NaOH溶液,是因为氯气能和NaOH反应,不能用“相似相溶规则”解释,B符合题意;溴、CCl4都是非极性分子,故溴易溶于CCl4,能用“相似相溶规则”解释,C不符合题意;酒精、水都是极性分子,故酒精易溶于水,能用“相似相溶规则”解释,D不符合题意。
5. B 共价键的键长是指相邻两原子之间的核间距,由于C原子的半径比N原子大,故NCl3分子中N—Cl键长比CCl4分子中C—Cl键长短,A错误;根据NCl3分子的电子式:可知,分子中的所有原子均达到8电子稳定结构,B正确;由于NCl3分子中N原子周围形成了3个σ键,孤电子对数为×(5-3×1)=1,故为三角锥形结构,是极性分子,由题干可知,通常状态下NCl3为无色液体,而NH3为无色气体,故NCl3的沸点高于NH3的沸点,C错误;根据等电子原理可知,NBr3与NCl3的结构相似,且NBr3的相对分子质量比NCl3大,故NBr3的分子间作用力比NCl3大,NBr3的沸点比NCl3高,故NBr3比NCl3更难挥发,D错误。
6. D 与羧基相连的碳原子为手性碳原子,分子中含有1个手性碳原子,该分子存在对映异构现象,A正确;两分子中,左边第2个碳原子均为手性碳原子,B正确;连接—Br和—COOCH3的碳原子均为手性碳原子,分子中含有2个手性碳原子,C正确;与足量H2反应后的有机产物为(标“*”碳原子为手性碳原子),产物分子中含有4个手性碳原子,D错误。
7. C 苯的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近苯的细流时,细流不发生偏转,A错误;二硫化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近二硫化碳的细流时,细流不发生偏转,B错误;双氧水的结构不对称,为极性分子,电荷分布不均匀,用带静电的有机玻璃棒靠近双氧水的细流时,细流会发生偏转,C正确;四氯化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近四氯化碳的细流时,细流不发生偏转,D错误。
8. D H2O2的电子式为,该物质中不含π键,A错误;根据题中结构知,该分子正电荷重心与负电荷重心不重合,为极性分子,B错误;H2O2中氧原子为sp3杂化,C错误;H2O2的沸点较高,推测H2O2分子间可形成氢键,D正确。
9. C 含有不对称碳原子的分子为手性分子。各分子的结构简式如下:
①②③分子中存在手性碳原子(用“*”标记),而④分子中不存在手性碳原子,C正确。
10. (1) 1s22s22p63s23p63d54s1或[Ar]3d54s1 K、Cu (2) 非极性
(3) ①③⑥ ClO、PO等
解析:(1) 已知铬为24号元素,故基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其在第4周期,最外层上有1个电子,即最外层排布为4s1,故与铬同周期的所有元素中,基态原子最外层电子数与铬原子相同的有K、Cu。(2) 已知CCl4、CS2为非极性分子,根据“相似相溶规则”可知,CrO2Cl2是非极性分子。(3) ①在乙烯中C原子周围只形成了3个σ键,无孤电子对,故为sp2杂化;②SO中S原子周围形成了3个σ键,价层电子对数为4,故为sp3杂化;③BF3中B原子周围形成了3个σ键,价层电子对数为3,故为sp2杂化;④H2O中O原子周围形成了2个σ键,价层电子对数为4,故为sp3杂化;⑤CCl4中C原子周围形成了4个σ键,价层电子对数为4,故为sp3杂化;⑥SO3中S周围形成了3个σ键,价层电子对数为3,故为sp2杂化。六种微粒中,中心原子采取sp2杂化的分子有①③⑥,等电子体是指原子总数相同,价电子总数相等的微粒,故与SO互为等电子体的阴离子有ClO、PO等。
11. (1) SiH4 sp3 正四面体形 (2) Si
(3) Ⅷ (4) ds
