6.3 课题1 化学能转化为电能 同步学案(含答案)2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 6.3 课题1 化学能转化为电能 同步学案(含答案)2024-2025学年高一化学苏教版(2019)必修2 |
|
|
| 格式 | docx | ||
| 文件大小 | 579.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 00:00:00 | ||
图片预览

文档简介
课题1 化学能转化为电能
1. 知道化学反应可以实现化学能与其他能量形式的转化。
2. 以原电池为例认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。
3. 能辨识简单原电池的构成要素,并能分析简单原电池的工作原理。
1. 完成下列实验,将实验现象和得出的结论填入表格中:
步骤1:把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
步骤2:把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
步骤3:用导线把步骤2中的锌片和铜片连起来,观察实验现象。
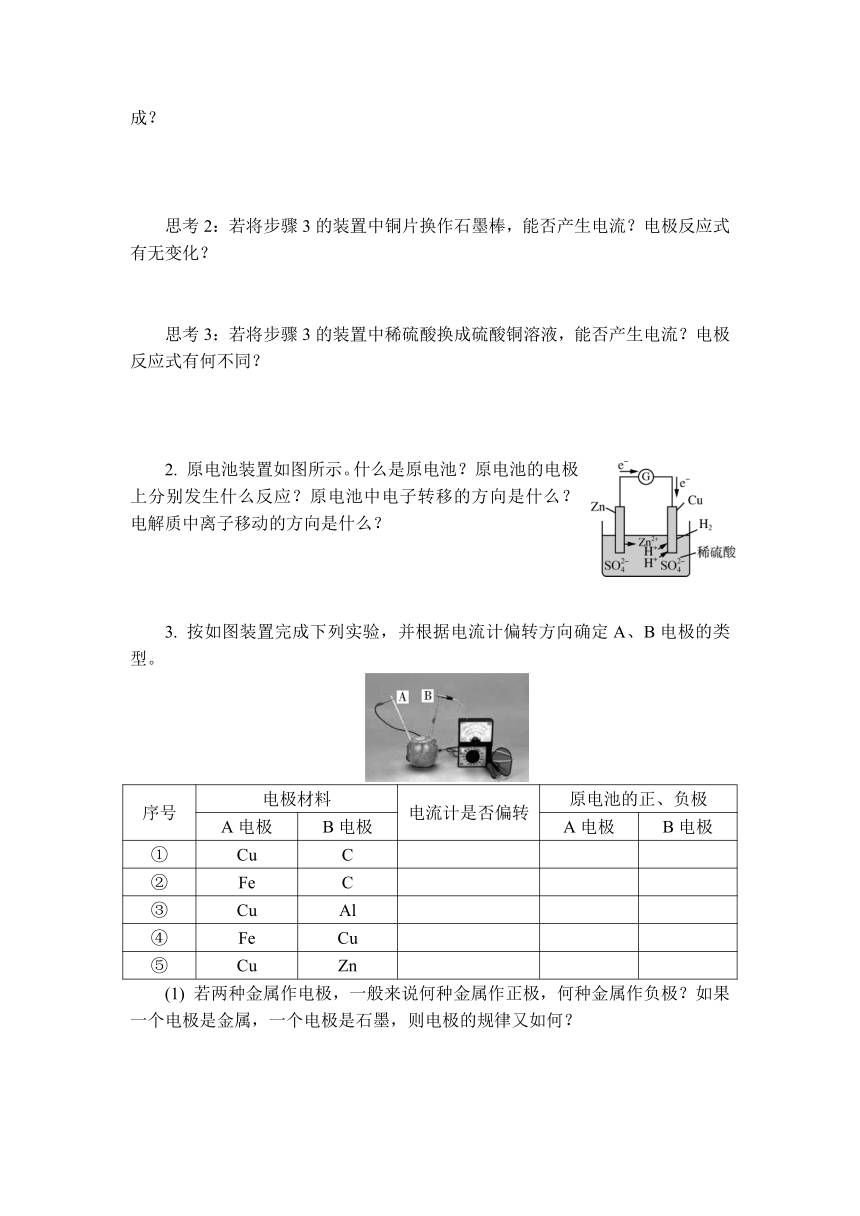
步骤4:在步骤3的导线中间连接一个灵敏电流计(如左下图所示),观察实验现象。
原电池示意图
实验步骤 实验现象 实验结论或解释
步骤1
步骤2
步骤3
步骤4
(1) 上述步骤3、4的装置中,________能转化为________能。这两个装置中发生反应的离子方程式为__________________________________________。
(2) 实验中,锌失去________,发生________反应,作原电池的________极,铜片为原电池的________极,溶液中________得到________,产生气体。
(3) 分别写出负极和正极的电极反应式,注明反应类型。
思考1:步骤3、4的装置中铜片不与稀硫酸反应,为什么铜上会有氢气生成?
思考2:若将步骤3的装置中铜片换作石墨棒,能否产生电流?电极反应式有无变化?
思考3:若将步骤3的装置中稀硫酸换成硫酸铜溶液,能否产生电流?电极反应式有何不同?
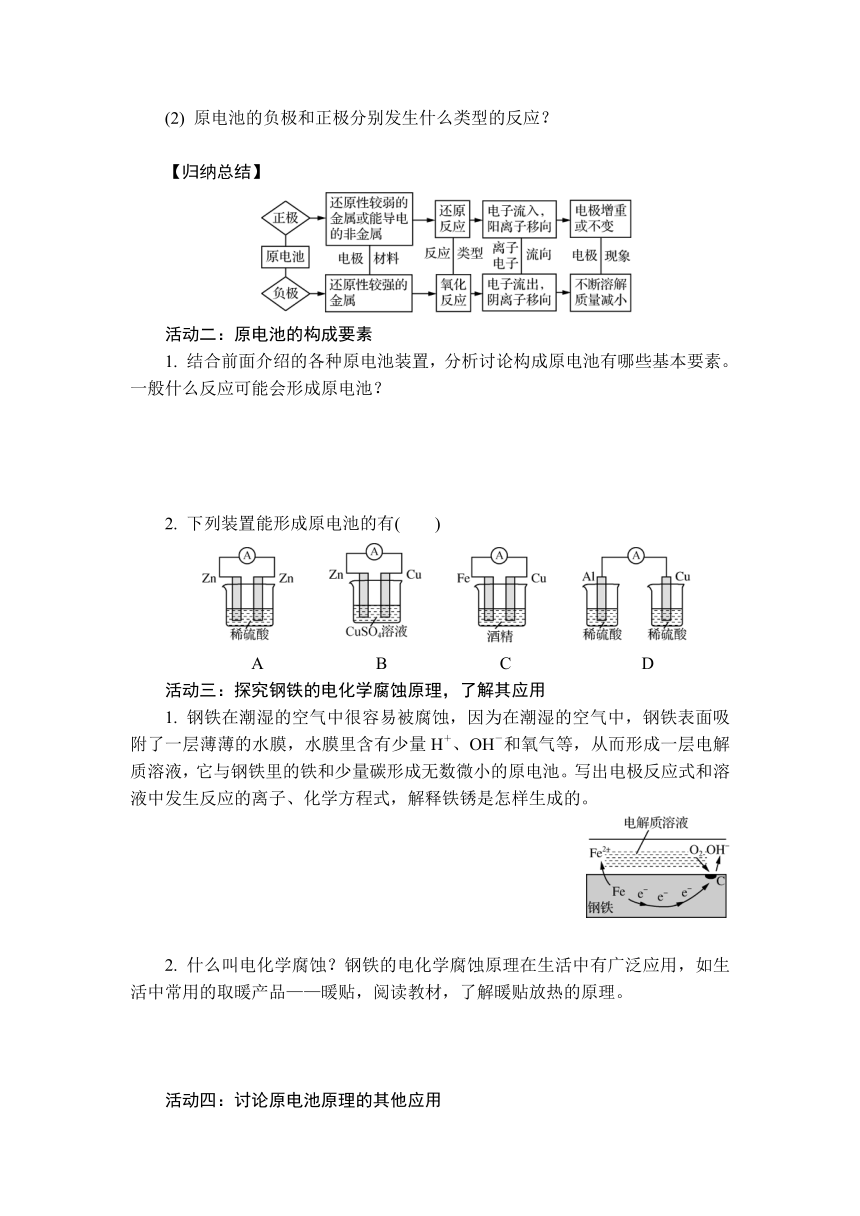
2. 原电池装置如图所示。什么是原电池?原电池的电极上分别发生什么反应?原电池中电子转移的方向是什么?电解质中离子移动的方向是什么?
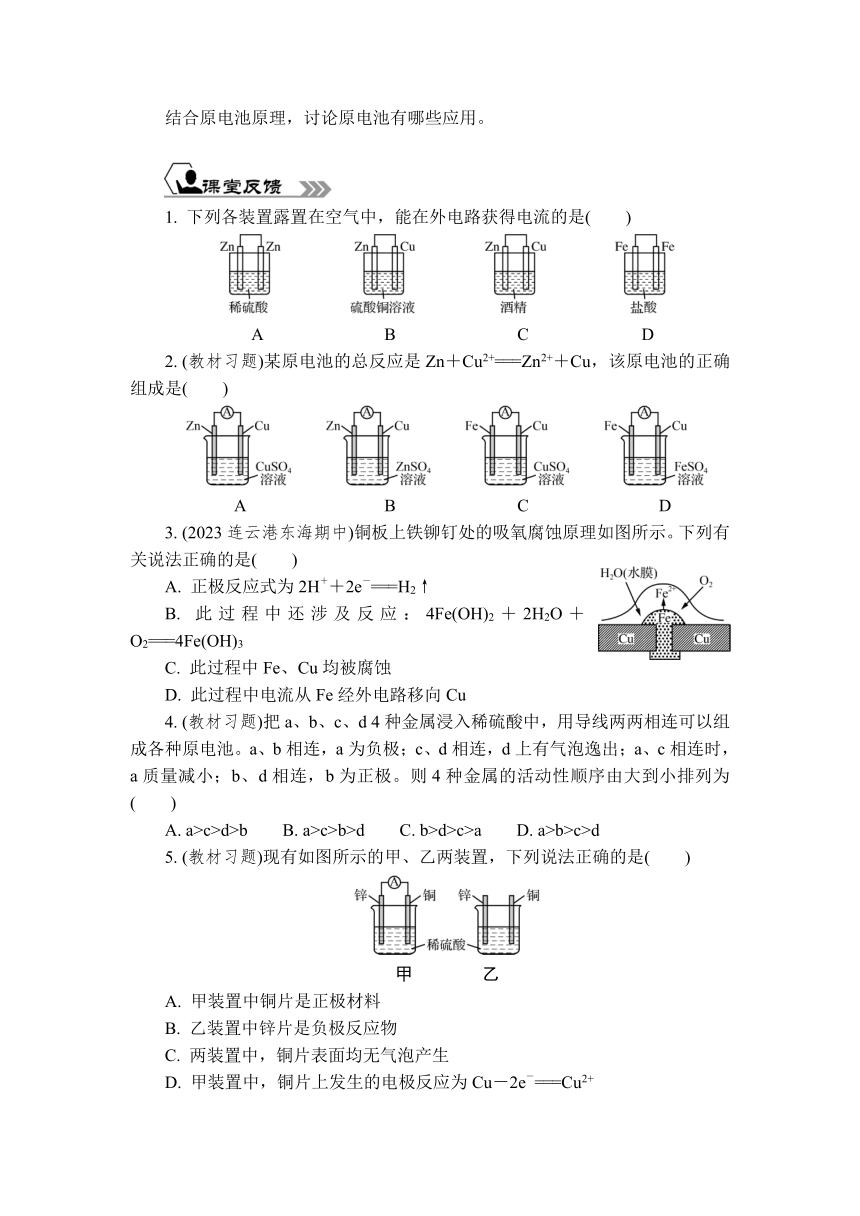
3. 按如图装置完成下列实验,并根据电流计偏转方向确定A、B电极的类型。
序号 电极材料 电流计是否偏转 原电池的正、负极
A电极 B电极 A电极 B电极
① Cu C
② Fe C
③ Cu Al
④ Fe Cu
⑤ Cu Zn
(1) 若两种金属作电极,一般来说何种金属作正极,何种金属作负极?如果一个电极是金属,一个电极是石墨,则电极的规律又如何?
(2) 原电池的负极和正极分别发生什么类型的反应?
【归纳总结】
1. 结合前面介绍的各种原电池装置,分析讨论构成原电池有哪些基本要素。一般什么反应可能会形成原电池?
2. 下列装置能形成原电池的有( )
A B C D
1. 钢铁在潮湿的空气中很容易被腐蚀,因为在潮湿的空气中,钢铁表面吸附了一层薄薄的水膜,水膜里含有少量H+、OH-和氧气等,从而形成一层电解质溶液,它与钢铁里的铁和少量碳形成无数微小的原电池。写出电极反应式和溶液中发生反应的离子、化学方程式,解释铁锈是怎样生成的。
2. 什么叫电化学腐蚀?钢铁的电化学腐蚀原理在生活中有广泛应用,如生活中常用的取暖产品——暖贴,阅读教材,了解暖贴放热的原理。
结合原电池原理,讨论原电池有哪些应用。
1. 下列各装置露置在空气中,能在外电路获得电流的是( )
A B C D
2. (教材习题)某原电池的总反应是Zn+Cu2+===Zn2++Cu,该原电池的正确组成是( )
A B C D
3. (2023连云港东海期中)铜板上铁铆钉处的吸氧腐蚀原理如图所示。下列有关说法正确的是( )
A. 正极反应式为2H++2e-===H2↑
B. 此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C. 此过程中Fe、Cu均被腐蚀
D. 此过程中电流从Fe经外电路移向Cu
4. (教材习题)把a、b、c、d 4种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。a、b相连,a为负极;c、d相连,d上有气泡逸出;a、c相连时,a质量减小;b、d相连,b为正极。则4种金属的活动性顺序由大到小排列为( )
A. a>c>d>b B. a>c>b>d C. b>d>c>a D. a>b>c>d
5. (教材习题)现有如图所示的甲、乙两装置,下列说法正确的是( )
甲 乙
A. 甲装置中铜片是正极材料
B. 乙装置中锌片是负极反应物
C. 两装置中,铜片表面均无气泡产生
D. 甲装置中,铜片上发生的电极反应为Cu-2e-===Cu2+
6. (2023广州真光中学月考)某电池的总反应式为Cu+2Ag+===Cu2++2Ag,该原电池的正确组合是( )
选项 A B C D
正极材料 Cu Ag Ag Cu
负极材料 Ag Cu Cu Ag
电解质溶液 AgNO3 AgNO3 CuSO4 CuSO4
7. 如图所示装置中,观察到M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )
选项 M N P
A 银 锌 硝酸银溶液
B 铜 铁 稀盐酸
C 锌 铜 稀硫酸溶液
D 锌 铁 硝酸铁溶液
8. Ⅰ.A、B、C、D四种金属按表中装置图进行实验。
装置 甲 乙 丙
现象 二价金属A不断溶解 C的质量增加 A上有气体产生
(1) 装置甲中负极反应式是________________________________。
(2) 装置乙中正极反应式是________________________________。
(3) 四种金属活动性由强到弱的顺序是______________________。
Ⅱ. 分别按装置甲、乙进行实验,图中两只烧杯中的溶液为相同浓度的稀硫酸。
(1) 下列叙述正确的是________(填字母)。
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片作正极,乙中铜片作负极
C. 两烧杯的溶液中的H+浓度均减小 甲 乙
D. 产生气泡的速率:甲<乙
(2) 装置甲中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是____________________________________________________________。
(3) 装置甲中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应式:_____________________________________________________________________。
课题1 化学能转化为电能
【活动方案】
活动一:
1.
实验步骤 实验现象 实验结论或解释
步骤1 锌片表面有气泡产生,逐渐溶解,铜片表面无明显现象 锌与稀硫酸反应,铜与稀硫酸不反应
步骤2 锌片表面有气泡产生,逐渐溶解,铜片表面无明显现象 锌与稀硫酸反应,铜与稀硫酸不反应
步骤3 铜片表面有气泡产生,锌片逐渐溶解 锌失去电子形成Zn2+进入溶液,氢离子在铜片上得到电子生成氢气
步骤4 铜片表面有气泡产生,锌片逐渐溶解,电流计指针发生偏转 该装置可以将化学能转化为电能
(1) 化学 电 Zn+2H+===Zn2++H2↑
(2) 电子 氧化 负 正 H+ 电子
(3) 负极:Zn-2e-===Zn2+(氧化反应)
正极:2H++2e-===H2↑(还原反应)
思考1:虽然铜不活泼,不能失去电子,但锌比铜活泼,锌与稀硫酸接触时,失去电子,这些电子沿着导线传递到铜的表面,被溶液中接近的氢离子获得后,生成了氢气。
思考2:改为石墨棒后,仍可构成原电池,产生电流。更换后锌作负极,石墨棒作正极,电极反应式与电池总反应均不变。
思考3:将稀硫酸换成硫酸铜溶液,同样能构成原电池,产生电流。Zn作负极,发生失电子的氧化反应,电极反应式为Zn-2e-===Zn2+;铜作正极,溶液中的Cu2+在铜电极上发生得电子的还原反应,电极反应式为Cu2++2e-===Cu,总反应式为Zn+Cu2+===Cu+Zn2+。
2. 原电池是将化学能转化为电能的装置。原电池的两个电极上分别发生氧化反应和还原反应。还原剂在负极发生氧化反应,失去电子;氧化剂在正极发生还原反应,得到电子。电子通过导线由原电池负极流向正极。溶液中阳离子向正极移动,阴离子向负极移动。
3. ①偏转 负极 正极 ②偏转 负极 正极 ③偏转 正极 负极 ④偏转 负极 正极 ⑤偏转 正极 负极
(1) 较活泼的金属作负极,较不活泼的金属作正极。金属电极作负极,石墨电极作正极。
(2) 负极发生氧化反应,正极发生还原反应。
活动二:
1. 构成原电池的要素:有两个活动性不同的电极、有电解质溶液、形成闭合电路。一般自发的氧化还原反应(放热)可能会形成原电池。
2. B
活动三:
1. 负极(铁):Fe-2e-===Fe2+
正极(碳):2H2O+O2+4e-===4OH-
铁失去电子被氧化,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe(OH)3在一定条件下发生脱水反应,生成红色的铁锈(主要成分为Fe2O3·xH2O)。
2. 不纯的金属与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化,这种腐蚀叫作电化学腐蚀。暖贴的内部含铁粉、活性炭、食盐、蛭石、木粉的混合物。铁粉、活性炭、食盐一旦与空气中的氧气和水蒸气接触就会构成原电池,木粉能够吸水并保持水分,蛭石能够保温。原电池的形成提高了铁被氧气氧化的速率,短时间内产生较多的热,供人们取暖。
活动四:
原电池原理可用于比较金属活动性,通常情况下活动性较强的金属作负极(有例外)。根据反应现象可以判断原电池的正、负极,一般析出金属或产生氢气的一极为原电池的正极。原电池可用于改变化学反应速率,如Zn和稀硫酸反应时,滴加少量CuSO4溶液,Zn置换出的铜与锌能构成原电池,从而提高Zn与稀硫酸反应的速率。利用原电池原理,设计保护金属的方法,如船体是钢铁材料,在海水中易被腐蚀,在船体外壳焊接上比铁活泼的金属(如Zn),构成原电池,比铁活泼的金属被氧化,船体得到保护。
【课堂反馈】
1. B A、D项,两极的材料相同,不能构成原电池;C项,酒精是非电解质,不能构成原电池。
2. A 由总反应:Zn+Cu2+===Zn2++Cu可知,锌为负极材料,电解质溶液中含有Cu2+,正极材料的活动性要弱于锌,故选A。
3. B 正极上O2得到电子转化为OH-,正极反应式为O2+2H2O+4e-===4OH-,A错误;电化学腐蚀过程中生成的Fe(OH)2易被氧化成Fe(OH)3,B正确;铜为正极,被保护,未被腐蚀,C错误;此过程中,电子从Fe经外电路移向Cu,电流从Cu经外电路移向Fe,D错误。
4. A a、b相连,a为负极,则金属活动性a>b,c、d相连,d上有气泡逸出,则d为正极,金属活动性c>d,a、c相连时,a质量减小,则a为负极,金属活动性a>c;b、d相连,b为正极,则金属活动性d>b;综上所述,金属活动性a>c>d>b。故选A。
5. A 甲装置中,锌为负极材料,铜为正极材料,A正确;装置乙没有构成原电池,不存在正、负极,B错误;甲装置中,铜片表面生成H2,C错误;甲装置中,铜片上发生的电极反应为2H++2e-===H2↑,D错误。
6. B 根据电池的总反应式Cu+2Ag+===Cu2++2Ag分析,Cu元素的化合价升高,Cu作负极,Ag元素的化合价降低,Ag+在正极上发生得电子的还原反应,电解质溶液是含Ag+的可溶性盐溶液,即硝酸银溶液,B符合题意。
7. A N棒变细,说明N棒是负极,金属溶解,N的金属性强于M,C、D不符合条件;M棒变粗,说明溶液中有金属阳离子在正极得电子,A符合条件,B不符合条件。
8. Ⅰ.(1) A-2e-===A2+
(2) Cu2++2e-===Cu (3) D>A>B>C
Ⅱ. (1) C (2) 锌片不纯,锌与杂质构成原电池
(3) Cu2++2e-===Cu
1. 知道化学反应可以实现化学能与其他能量形式的转化。
2. 以原电池为例认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。
3. 能辨识简单原电池的构成要素,并能分析简单原电池的工作原理。
1. 完成下列实验,将实验现象和得出的结论填入表格中:
步骤1:把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
步骤2:把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
步骤3:用导线把步骤2中的锌片和铜片连起来,观察实验现象。
步骤4:在步骤3的导线中间连接一个灵敏电流计(如左下图所示),观察实验现象。
原电池示意图
实验步骤 实验现象 实验结论或解释
步骤1
步骤2
步骤3
步骤4
(1) 上述步骤3、4的装置中,________能转化为________能。这两个装置中发生反应的离子方程式为__________________________________________。
(2) 实验中,锌失去________,发生________反应,作原电池的________极,铜片为原电池的________极,溶液中________得到________,产生气体。
(3) 分别写出负极和正极的电极反应式,注明反应类型。
思考1:步骤3、4的装置中铜片不与稀硫酸反应,为什么铜上会有氢气生成?
思考2:若将步骤3的装置中铜片换作石墨棒,能否产生电流?电极反应式有无变化?
思考3:若将步骤3的装置中稀硫酸换成硫酸铜溶液,能否产生电流?电极反应式有何不同?
2. 原电池装置如图所示。什么是原电池?原电池的电极上分别发生什么反应?原电池中电子转移的方向是什么?电解质中离子移动的方向是什么?
3. 按如图装置完成下列实验,并根据电流计偏转方向确定A、B电极的类型。
序号 电极材料 电流计是否偏转 原电池的正、负极
A电极 B电极 A电极 B电极
① Cu C
② Fe C
③ Cu Al
④ Fe Cu
⑤ Cu Zn
(1) 若两种金属作电极,一般来说何种金属作正极,何种金属作负极?如果一个电极是金属,一个电极是石墨,则电极的规律又如何?
(2) 原电池的负极和正极分别发生什么类型的反应?
【归纳总结】
1. 结合前面介绍的各种原电池装置,分析讨论构成原电池有哪些基本要素。一般什么反应可能会形成原电池?
2. 下列装置能形成原电池的有( )
A B C D
1. 钢铁在潮湿的空气中很容易被腐蚀,因为在潮湿的空气中,钢铁表面吸附了一层薄薄的水膜,水膜里含有少量H+、OH-和氧气等,从而形成一层电解质溶液,它与钢铁里的铁和少量碳形成无数微小的原电池。写出电极反应式和溶液中发生反应的离子、化学方程式,解释铁锈是怎样生成的。
2. 什么叫电化学腐蚀?钢铁的电化学腐蚀原理在生活中有广泛应用,如生活中常用的取暖产品——暖贴,阅读教材,了解暖贴放热的原理。
结合原电池原理,讨论原电池有哪些应用。
1. 下列各装置露置在空气中,能在外电路获得电流的是( )
A B C D
2. (教材习题)某原电池的总反应是Zn+Cu2+===Zn2++Cu,该原电池的正确组成是( )
A B C D
3. (2023连云港东海期中)铜板上铁铆钉处的吸氧腐蚀原理如图所示。下列有关说法正确的是( )
A. 正极反应式为2H++2e-===H2↑
B. 此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C. 此过程中Fe、Cu均被腐蚀
D. 此过程中电流从Fe经外电路移向Cu
4. (教材习题)把a、b、c、d 4种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。a、b相连,a为负极;c、d相连,d上有气泡逸出;a、c相连时,a质量减小;b、d相连,b为正极。则4种金属的活动性顺序由大到小排列为( )
A. a>c>d>b B. a>c>b>d C. b>d>c>a D. a>b>c>d
5. (教材习题)现有如图所示的甲、乙两装置,下列说法正确的是( )
甲 乙
A. 甲装置中铜片是正极材料
B. 乙装置中锌片是负极反应物
C. 两装置中,铜片表面均无气泡产生
D. 甲装置中,铜片上发生的电极反应为Cu-2e-===Cu2+
6. (2023广州真光中学月考)某电池的总反应式为Cu+2Ag+===Cu2++2Ag,该原电池的正确组合是( )
选项 A B C D
正极材料 Cu Ag Ag Cu
负极材料 Ag Cu Cu Ag
电解质溶液 AgNO3 AgNO3 CuSO4 CuSO4
7. 如图所示装置中,观察到M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )
选项 M N P
A 银 锌 硝酸银溶液
B 铜 铁 稀盐酸
C 锌 铜 稀硫酸溶液
D 锌 铁 硝酸铁溶液
8. Ⅰ.A、B、C、D四种金属按表中装置图进行实验。
装置 甲 乙 丙
现象 二价金属A不断溶解 C的质量增加 A上有气体产生
(1) 装置甲中负极反应式是________________________________。
(2) 装置乙中正极反应式是________________________________。
(3) 四种金属活动性由强到弱的顺序是______________________。
Ⅱ. 分别按装置甲、乙进行实验,图中两只烧杯中的溶液为相同浓度的稀硫酸。
(1) 下列叙述正确的是________(填字母)。
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片作正极,乙中铜片作负极
C. 两烧杯的溶液中的H+浓度均减小 甲 乙
D. 产生气泡的速率:甲<乙
(2) 装置甲中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是____________________________________________________________。
(3) 装置甲中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应式:_____________________________________________________________________。
课题1 化学能转化为电能
【活动方案】
活动一:
1.
实验步骤 实验现象 实验结论或解释
步骤1 锌片表面有气泡产生,逐渐溶解,铜片表面无明显现象 锌与稀硫酸反应,铜与稀硫酸不反应
步骤2 锌片表面有气泡产生,逐渐溶解,铜片表面无明显现象 锌与稀硫酸反应,铜与稀硫酸不反应
步骤3 铜片表面有气泡产生,锌片逐渐溶解 锌失去电子形成Zn2+进入溶液,氢离子在铜片上得到电子生成氢气
步骤4 铜片表面有气泡产生,锌片逐渐溶解,电流计指针发生偏转 该装置可以将化学能转化为电能
(1) 化学 电 Zn+2H+===Zn2++H2↑
(2) 电子 氧化 负 正 H+ 电子
(3) 负极:Zn-2e-===Zn2+(氧化反应)
正极:2H++2e-===H2↑(还原反应)
思考1:虽然铜不活泼,不能失去电子,但锌比铜活泼,锌与稀硫酸接触时,失去电子,这些电子沿着导线传递到铜的表面,被溶液中接近的氢离子获得后,生成了氢气。
思考2:改为石墨棒后,仍可构成原电池,产生电流。更换后锌作负极,石墨棒作正极,电极反应式与电池总反应均不变。
思考3:将稀硫酸换成硫酸铜溶液,同样能构成原电池,产生电流。Zn作负极,发生失电子的氧化反应,电极反应式为Zn-2e-===Zn2+;铜作正极,溶液中的Cu2+在铜电极上发生得电子的还原反应,电极反应式为Cu2++2e-===Cu,总反应式为Zn+Cu2+===Cu+Zn2+。
2. 原电池是将化学能转化为电能的装置。原电池的两个电极上分别发生氧化反应和还原反应。还原剂在负极发生氧化反应,失去电子;氧化剂在正极发生还原反应,得到电子。电子通过导线由原电池负极流向正极。溶液中阳离子向正极移动,阴离子向负极移动。
3. ①偏转 负极 正极 ②偏转 负极 正极 ③偏转 正极 负极 ④偏转 负极 正极 ⑤偏转 正极 负极
(1) 较活泼的金属作负极,较不活泼的金属作正极。金属电极作负极,石墨电极作正极。
(2) 负极发生氧化反应,正极发生还原反应。
活动二:
1. 构成原电池的要素:有两个活动性不同的电极、有电解质溶液、形成闭合电路。一般自发的氧化还原反应(放热)可能会形成原电池。
2. B
活动三:
1. 负极(铁):Fe-2e-===Fe2+
正极(碳):2H2O+O2+4e-===4OH-
铁失去电子被氧化,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe(OH)3在一定条件下发生脱水反应,生成红色的铁锈(主要成分为Fe2O3·xH2O)。
2. 不纯的金属与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化,这种腐蚀叫作电化学腐蚀。暖贴的内部含铁粉、活性炭、食盐、蛭石、木粉的混合物。铁粉、活性炭、食盐一旦与空气中的氧气和水蒸气接触就会构成原电池,木粉能够吸水并保持水分,蛭石能够保温。原电池的形成提高了铁被氧气氧化的速率,短时间内产生较多的热,供人们取暖。
活动四:
原电池原理可用于比较金属活动性,通常情况下活动性较强的金属作负极(有例外)。根据反应现象可以判断原电池的正、负极,一般析出金属或产生氢气的一极为原电池的正极。原电池可用于改变化学反应速率,如Zn和稀硫酸反应时,滴加少量CuSO4溶液,Zn置换出的铜与锌能构成原电池,从而提高Zn与稀硫酸反应的速率。利用原电池原理,设计保护金属的方法,如船体是钢铁材料,在海水中易被腐蚀,在船体外壳焊接上比铁活泼的金属(如Zn),构成原电池,比铁活泼的金属被氧化,船体得到保护。
【课堂反馈】
1. B A、D项,两极的材料相同,不能构成原电池;C项,酒精是非电解质,不能构成原电池。
2. A 由总反应:Zn+Cu2+===Zn2++Cu可知,锌为负极材料,电解质溶液中含有Cu2+,正极材料的活动性要弱于锌,故选A。
3. B 正极上O2得到电子转化为OH-,正极反应式为O2+2H2O+4e-===4OH-,A错误;电化学腐蚀过程中生成的Fe(OH)2易被氧化成Fe(OH)3,B正确;铜为正极,被保护,未被腐蚀,C错误;此过程中,电子从Fe经外电路移向Cu,电流从Cu经外电路移向Fe,D错误。
4. A a、b相连,a为负极,则金属活动性a>b,c、d相连,d上有气泡逸出,则d为正极,金属活动性c>d,a、c相连时,a质量减小,则a为负极,金属活动性a>c;b、d相连,b为正极,则金属活动性d>b;综上所述,金属活动性a>c>d>b。故选A。
5. A 甲装置中,锌为负极材料,铜为正极材料,A正确;装置乙没有构成原电池,不存在正、负极,B错误;甲装置中,铜片表面生成H2,C错误;甲装置中,铜片上发生的电极反应为2H++2e-===H2↑,D错误。
6. B 根据电池的总反应式Cu+2Ag+===Cu2++2Ag分析,Cu元素的化合价升高,Cu作负极,Ag元素的化合价降低,Ag+在正极上发生得电子的还原反应,电解质溶液是含Ag+的可溶性盐溶液,即硝酸银溶液,B符合题意。
7. A N棒变细,说明N棒是负极,金属溶解,N的金属性强于M,C、D不符合条件;M棒变粗,说明溶液中有金属阳离子在正极得电子,A符合条件,B不符合条件。
8. Ⅰ.(1) A-2e-===A2+
(2) Cu2++2e-===Cu (3) D>A>B>C
Ⅱ. (1) C (2) 锌片不纯,锌与杂质构成原电池
(3) Cu2++2e-===Cu
