2025年中考化学专题训练:计算题(含解析)
文档属性
| 名称 | 2025年中考化学专题训练:计算题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 602.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 23:17:54 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
2025年中考化学专题训练:计算题
1.欲测定一瓶标签破损的稀硫酸的溶质质量分数。取10g稀硫酸样品,将5%的NaOH溶液逐滴加入样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请你计算:
(1)恰好完全反应时,参加反应的氢氧化钠溶液的质量为 g。
(2)计算稀硫酸的溶质质量分数。(写出计算过程)
2.科学家研发出一种新型“人造树叶”,能利用阳光将吸收的二氧化碳转化为燃料乙醇(C2H5OH),发生反应的化学方程式为:2CO2+3H2OC2H5OH+3O2.研究显示,一升“人造树叶”每天可从空气中吸收968gCO2.
(1)“人造树叶”技术作为一种可持续能源解决方案,具有广阔的应用前景和巨大的发展潜力,其优点有 。
(2)一升“人造树叶”工作一天可得到乙醇的质量是多少?
3.取一定量NaCl和Na2CO3组成的固体样品放入烧杯中,然后将一定溶质质量分数的盐酸逐滴加入样品中,边加边搅拌,测得生成气体的质量与所加盐酸的质量关系如图所示。
请分析并计算:
(1)恰好完全反应时产生气体的质量是 。
(2)计算所加盐酸的溶质质量分数 。(写出计算过程)
4.为测定放置一段时间后的某医用过氧化氢溶液中溶质的质量分数,兴趣小组的同学进行了如下实验:取该过氧化氢溶液68g于烧杯中,加入3g二氧化锰,测得不同时刻烧杯内物质的总质量见表。
时间/分钟 0
烧杯内物质的总质量/g 71.0 70.5 70.3 70.2 70.2
请计算:
(1)产生的总质量为 g。其中二氧化锰在该反应中的作用是 。
(2)计算该医用过氧化氢溶液中溶质的质量分数。(要求完整写出计算过程)
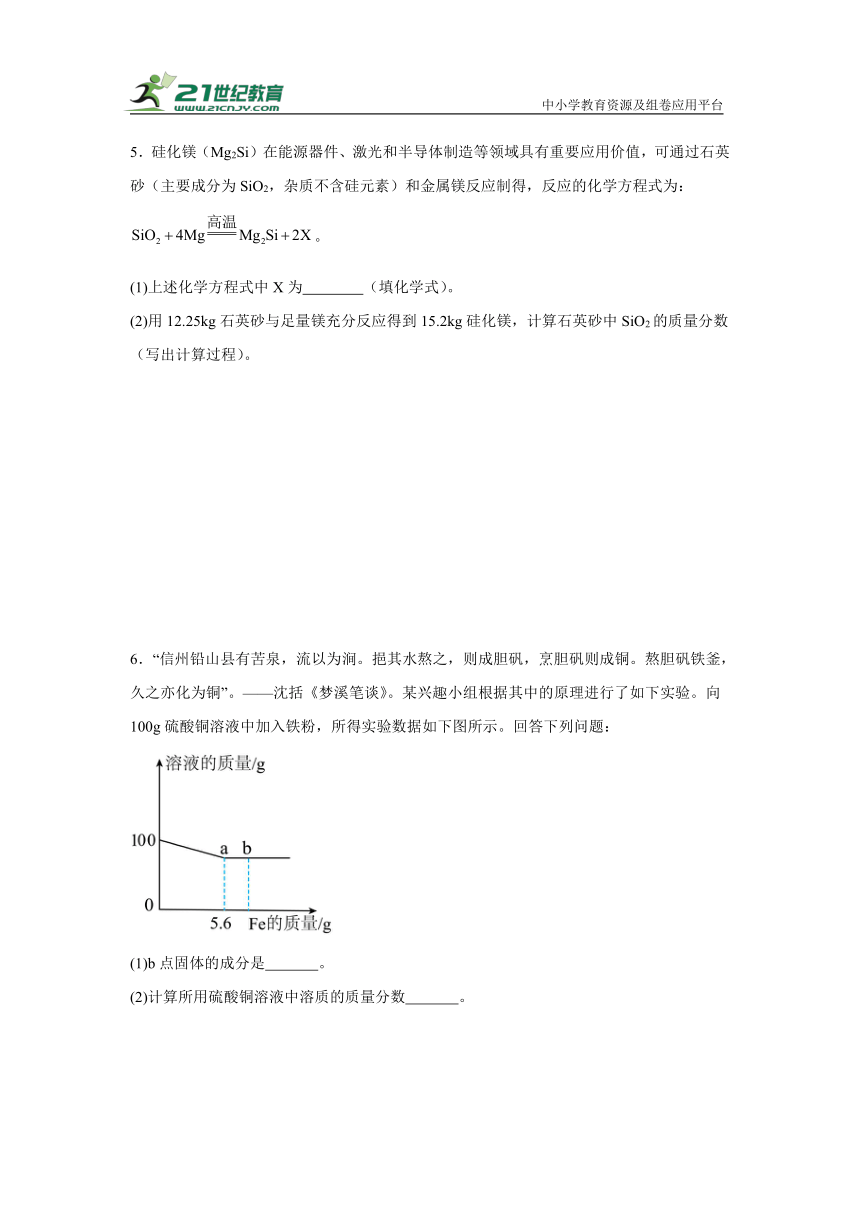
5.硅化镁(Mg2Si)在能源器件、激光和半导体制造等领域具有重要应用价值,可通过石英砂(主要成分为SiO2,杂质不含硅元素)和金属镁反应制得,反应的化学方程式为:。
(1)上述化学方程式中X为 (填化学式)。
(2)用12.25kg石英砂与足量镁充分反应得到15.2kg硅化镁,计算石英砂中SiO2的质量分数(写出计算过程)。
6.“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。——沈括《梦溪笔谈》。某兴趣小组根据其中的原理进行了如下实验。向100g硫酸铜溶液中加入铁粉,所得实验数据如下图所示。回答下列问题:
(1)b点固体的成分是 。
(2)计算所用硫酸铜溶液中溶质的质量分数 。
7.中国天宫空间站三名航天员每日需要O22.4kg,固体燃料氧气发生器制氧,是航天员安全可靠的供氧途径之一。向氧气发生器加入粉末状的铁粉和氯酸钠(NaClO3),点燃铁粉,铁粉剧烈燃烧,放出大量的热,NaClO3受热分解为NaCl和O2.
(1)写出氯酸钠受热分解的化学方程式
(2)三名航天员4天所需O2共9.6kg,则理论上至少需要加热分解NaClO3的质量为多少?(写出完整的计算过程)
8.电解法是工业制铜的重要方法,原理为:。重庆一中化学小组用溶质质量分数为的溶液充分电解(假定不发生其他反应),溶液减少。(相对分子质量:)
(1)生成固体和气体的质量最简比为 。
(2)反应后所得溶液的溶质质量分数。(写出计算过程,结果精确到)
(3)若将原溶液加水稀释到溶质质量分数为后再电解,理论上制得铜的质量 (填“不变”或“更多”或“更少”)。
9.疫情期间,84消毒液(有效成分是NaClO)广泛用于家庭和公共场所的消毒。工业上可以通过NaOH溶液与Cl2反应制得84消毒液,该反应的化学方程式为:2NaOH+Cl2=NaClO+NaCl+H2O
(1)配制20g溶质质量分数为10%的NaOH溶液,需要称取NaOH固体的质量是 g。
(2)从氢氧化钠的性质角度思考,用天平称量固体时,若称量时间过长,会导致溶质的质量分数 (填“偏大”“偏小”或“无影响”),原因是 。
(3)依据化学方程式计算,要制得149gNaClO,理论上需要NaOH的质量是多少?
10.钛和钛合金具有很多优良的性能,广泛用于火箭、航天飞机和卫星等。制造人造卫星常用到钛合金,工业制取钛(Ti)的一种方法为。
资料:①钠在空气中易被氧化 ②钛在高温下会与氧气反应
(1)用9.2kg钠通过上述方法,理论上可制取钛的质量是多少?(写出计算过程)
(2)工业上利用上述方法制取钛,通常要在氩气的环境中进行,原因是 。
11.我国致力于2060年前达成“碳中和”目标,即实现二氧化碳的相对“零排放”。推广氢能源汽车是减少二氧化碳排放的有效途径之一,氢化钙()是一种重要的制氢剂,氢化钙可与物质M反应生成氢气,反应的化学方程式为:CaH2+2M=Ca(OH)2+2H2↑
(1)M的化学式为 。
(2)若制取16kg氢气,计算理论上需要的质量(写出计算过程)。
12.工业上主要利用一氧化碳还原赤铁矿(主要成分为Fe2O3)冶炼金属铁。
(1)Fe2O3中铁元素的质量分数的计算式为 。
(2)要冶炼制得112tFe,计算理论上需要的CO的质量。(写出计算过程)
13.中国天宫空间站三名航天员每日需要O22.4kg,固体燃料氧气发生器制氧是航天员安全可靠的供氧途径之一。向氧气发生器加入粉末状的铁粉和氯酸钠(NaClO3),点燃铁粉,铁粉剧烈燃烧,放出大量的热,NaClO3受热分解为NaCl和O2。
(1)三名航天员4天所需O2为9.6kg,列式计算理论上至少需要加热分解NaClO3的质量为多少?
(2)在一定条件下,制取相同质量的O2,则加热分解 (选填“KClO3”或“NaClO3”)所需质量更少。
14.铜是人类最早使用的金属之一。我国铜冶炼技术具有悠久的历史。常见的方法为湿法炼铜和火法炼铜两种,方案如下:
方案一:
方案二:
(1)上述两种炼铜的方案中,对环境比较友好的是方案 。
(2)利用含的铜矿石作为原料进行火法炼铜,理论上可炼出铜的质量为多少?(结合化学方程式写出计算过程)
15.“中国高铁,世界第一”,高铁列车车体使用了含镍不锈钢材料,工业上火法炼镍的原理是C+2NiO2Ni+X↑,回答下列问题。
(1)X的化学式为 。
(2)生产5.9t镍,计算理论上需要氧化镍的质量。
16.消毒防腐药是用来杀灭病原微生物或抑制其生长的化学物质。碘、过氧化氢、乙醇等,在规定剂量和范围内可作为消毒防腐药。
(1)过氧化氢、碘和乙醇在化学性质和用途上各有特点,请任写一个 。
(2)计算分解34g10%的过氧化氢溶液,理论上可生成氧气的质量是多少?
17.含氯消毒液是家庭常用的消毒用品,有效成分为次氯酸钠(NaClO)。工业制备原理为Cl2+2NaOH=NaClO+NaCl+H2O。现向质量分数为10.0%的NaOH溶液中通入氯气,制得NaClO质量分数为5%的消毒液(溶质为NaCl、NaClO和NaOH)2980g,请回答下列问题:
提示:相对分子质量为NaCl58.5 NaClO74.5 NaOH40
(1)NaClO中钠和氯元素的质量比为 (最简整数比)。
(2)参加反应的氯气质量为 g。
(3)请通过反应方程式计算,制得的消毒液中NaOH的质量分数(计算结果精确至0.1%)。
18.鸡蛋壳的主要成分为碳酸钙。为测定鸡蛋壳中碳酸钙的质量分数,向盛有20g鸡蛋壳的烧杯中加入100g稀盐酸,恰好完全反应后测得烧杯内混合物的总质量为116.7g。(鸡蛋壳中其他成分不与稀盐酸反应放出气体)
(1)该反应中放出气体的质量为 。
(2)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
19.为测定某标签破损的稀硫酸的溶质质量分效,小强同学在烧杯中加入100g该稀硫酸,逐滴加入10%的氢氧化钠溶液,边加边搅拌,随着氢氧化钠溶液的滴入,溶液的温度变化情况如图所示。
请分析并计算:
(1)从能量角度看,该反应属于 (填“吸热”或“放热”)反应。
(2)从物质角度看,图中对应溶液中只含有一种溶质的点是 (填字母)。
(3)计算该稀硫酸的溶质质量分数。
20.为测定某硫酸铜溶液的溶质质量分数,取该溶液,向其中逐滴加入溶质质量分数为16%的溶液,当加入溶液时两者恰好完全反应。
(1)实验中能观察到的现象为 。
(2)当加入的溶液的质量为时,溶液中所含的溶质成分为 。
(3)计算该硫酸铜溶液的溶质质量分数。
21.化学兴趣小组为测定某品牌食用碱(主要成分是Na2CO3,含有少量NaCl)中的Na2CO3的质量分数。进行了如图实验:
请分析并计算:
(1)溶解时用玻璃棒搅拌的目的是 。
(2)滤渣的质量为 g。
(3)计算该食用碱中Na2CO3的质量分数。
22.饮用水常用高铁酸钠(Na2FeO4)作消毒剂,Na2FeO4可用电解法制取,反应的化学方程式为Fe+2NaOH+2H2ONa2FeO4+3H2↑。实验室取一块6g生铁与96.8gNaOH溶液进行电解,完全反应后获得0.4g碳和2.4g气体。(相对分子质量Na2FeO4166)
(1)2.4g气体中氢气和氧气的质量比为 (最简整数比)。
(2)计算所得溶液中Na2FeO4的质量分数。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
《2025年中考化学专题训练:计算题》参考答案
1.(1)16
(2)解:设稀硫酸的溶质质量为x
稀硫酸的溶质质量分数为:
答:稀硫酸的溶质质量分数为9.8%。
【详解】(1)当氢氧化钠与稀硫酸恰好完全反应时溶液显中性,pH=7,由图可知,恰好完全反应时,参加反应的氢氧化钠溶液的质量为16g;
(2)见答案。
2.(1)减少二氧化碳排放(减缓温室效应、有效缓解能源短缺)(合理即可)
(2)解:设可以得到乙醇的质量为x
答:一升“人造树叶”工作一天可得到506g乙醇。
【详解】(1)“人造树叶”利用太阳能将CO2转化为燃料,减少温室气体排放;以阳光为能源,CO2和水为原料,资源可持续;(合理即可)
(2)见答案。
3.(1)4.4g
(2)7.3%
解:设恰好完全时所加盐酸的溶质质量为x,
该盐酸的溶质质量分数为;
答:所加盐酸的溶质质量分数7.3%。
【详解】(1)由图像可知,加入100g盐酸时碳酸钠恰好完全反应,生成二氧化碳的质量为4.4g,故填:4.4g;
(2)见答案。
4.(1) 0.8 催化作用
(2)解:设该医用过氧化氢溶液中溶质的质量为x,
x=1.7g
该医用过氧化氢溶液中溶质的质量分数为,
答:该医用过氧化氢溶液中溶质的质量分数为2.5%。
【详解】(1)过氧化氢在二氧化锰的催化下分解生成氧气和水,根据质量守恒定律可得,产生O2的总质量为:71.0g-70.2g=0.8g;
其中二氧化锰作为过氧化氢分解的催化剂,在该反应中的作用是催化作用;
(2)见答案。
5.(1)MgO
(2)解:设石英砂中SiO2的质量分数为x
答:石英砂中SiO2的质量分数为98.0%。
【详解】(1)根据质量守恒定律,化学反应前后原子的种类和数目不变。反应前Si原子个数为1、O原子个数为2、Mg原子个数为4;反应后除2X外Si原子个数为1、Mg原子个数为2,则2X中应含有2个O原子和2个Mg原子,X中应含有1个O原子和1个Mg原子,所以X的化学式为MgO。
(2)根据硅化镁的质量计算,见答案。
6.(1)Fe、Cu
(2)解:设硫酸铜溶液中溶质的质量为。
则硫酸铜溶液中溶质的质量分数为
答:所用硫酸铜溶液中溶质的质量分数为16%。
【详解】(1)铁与硫酸铜反应生成铜和硫酸亚铁,根据化学方程式,每56份质量的铁置换出64份质量的铜,则反应后溶液质量逐渐减少,直至硫酸铜完全反应不再变化,故图中a点表示铁与硫酸铜恰好完全反应,b点时铁粉过量,则b点固体的成分是Fe、Cu;
(2)由第(1)小问分析可知,a点表示铁与硫酸铜恰好完全反应,则消耗铁的质量为5.6g,计算过程见答案。
7.(1)
(2)解:设至少需要NaClO3的质量为x
答:至少需要NaClO3的质量21.3kg。
【详解】(1)NaClO3受热分解为NaCl和O2,方程式为;
(2)见答案。
8.(1)4∶1
(2)解:溶液减少的质量即为反应生成的铜与氧气的总质量,设原硫酸铜溶液的质量为x,反应生成的H2SO4质量为y
、
x=200g、y=19.6g
答:反应后所得溶液的溶质质量分数为10.7%。
(3)不变
【详解】(1)根据,生成固体(Cu)和气体(O2)的质量最简比为。
(2)见答案。
(3)根据质量守恒定律,化学反应前后元素质量不变。稀释前后硫酸铜溶液中铜元素的质量不变,电解过程中铜元素全部转化为单质铜,所以理论上制得铜的质量不变。
9.(1)2
(2) 偏小 氢氧化钠易潮解,会使溶质质量偏小
(3)设需要NaOH的质量为x,则
解得x=160g
答:理论上需要NaOH的质量是160g。
【详解】(1)配制20g溶质质量分数为10%的NaOH溶液时,需要NaOH的质量为20g×10%=2g。
(2)氢氧化钠固体易潮解,会吸收空气中的水蒸气,则实际称量的溶质质量偏少,则导致溶质的质量分数偏小。
(3)见答案。
10.(1)解:设理论上可制取钛的质量为。
,
答:理论上可制取钛的质量为4.8kg。
(2)防止钠和钛被空气中的氧气氧化
【详解】(1)见答案
(2)钠非常活泼,可以和氧气反应,工业上利用上述方法制取钛,通常要在氩气的环境中进行,原因是防止钠和钛被空气中的氧气氧化,故填:防止钠和钛被空气中的氧气氧化。
11.(1)H2O
(2)解:设理论上需要CaH2的质量为x
x=168kg
答:若制取16kg氢气,理论上需要CaH2的质量为168kg。
【详解】(1)根据反应方程式可知,左边有1个钙原子,2个氢原子,右边有1个钙原子,2个氧原子,6个氢原子,化学反应前后原子的种类和数目不变。2M应含有2个氧原子和4个氢原子,所以M的化学式为 H2O;
(2)见答案。
12.(1)×100%
(2)解:设理论上需要的CO质量为x
x=84t
答:理论上需要的CO的质量是84t。
【详解】(1)氧化铁中铁元素的质量分数为:;
(2)见答案。
13.(1)设理论上至少需要加热分解NaClO3的质量为x。
=
x=21.3kg
答:理论上至少需要加热分解NaClO3的质量为21.3kg。
(2)NaClO3
【详解】(1)见答案;
(2)根据化学方程式,每213份质量的NaClO3能分解产生96份质量的O2,根据化学方程式,每245份质量的KClO3能分解产生96份质量的O2,则制取相同质量的O2,则加热份解NaClO3所需质量更少。
14.(1)一
(2)解:设理论上可炼铜的质量为x。
解得:
答:理论上可炼铜的质量为。
【详解】(1)方案一中没有污染物的生成,对环境比较友好,故填:一;
(2)详见答案。
15.(1)CO2
(2)解:设理论上需要氧化镍的质量为x
x =7.5t
答:理论上需要氧化镍的质量是7.5 t。
【详解】(1)根据质量守恒定律,化学反应前后原子的种类和数目不变,反应物中含C、Ni、O的个数分别是1、2、2,生成物中含C、Ni、O的个数分别是0、2、0,故生成物中还应含1个C、2个O,故X的化学式为:CO2;
(2)见答案。
16.(1)过氧化氢不稳定,受热易分解;乙醇具有可燃性;乙醇可作燃料等(合理即可)
(2)解:设理论上生成氧气的质量为x
x=1.6g
答:理论上生成氧气的质量为1.6g
【详解】(1)过氧化氢、碘和乙醇在化学性质和用途上各有特点,如过氧化氢不稳定,受热易分解,过氧化氢可用于制取氧气;乙醇具有可燃性,乙醇可用作燃料;碘能使淀粉变蓝,可用于检验淀粉等;
(2)见答案。
17.(1)46:71
(2)142
(3)解:设参加反应的氢氧化钠的质量为y
y=160g
根据质量守恒定律,化学反应前后物质的总质量不变,则氢氧化钠溶液的质量为:2980g-142g=2838g,则剩余氢氧化钠的质量为:,故制得的消毒液中NaOH的质量分数为:
答:制得的消毒液中NaOH的质量分数为4.2%
【详解】(1)NaClO中钠和氯元素的质量比为:23:35.5=46:71;
(2)解:设参加反应的氯气的质量为x
x=142g
答:参加反应的氯气的质量是142g;
(3)见答案。
18.(1)3.3g
(2)37.5%
解:设鸡蛋壳中碳酸钙的质量为x,
鸡蛋壳中碳酸钙的质量分数为;
答:鸡蛋壳中碳酸钙的质量分数37.5%。
【详解】(1)根据质量守恒定律,反应后减少的质量为生成气体的质量,则反应中放出气体的质量为20g+100g-116.7g=3.3g,故填:3.3g;
(2)见答案。
19.(1)放热
(2)B
(3)设参加反应的H2SO4质量为x,
x=4.9g,
该稀硫酸的溶质质量分数为×100%=4.9%,
答:该稀硫酸的溶质质量分数为4.9%。
【详解】(1)由图可知,反应过程中温度会升高,该反应属于放热反应;
(2)由于中和反应放热,所以B点表示氢氧化钠和硫酸恰好反应,对应溶液中只含有一种溶质(硫酸钠),A点时,硫酸过量,对应溶液中只含有两种溶质(硫酸和硫酸钠),C点时,氢氧化钠过量,对应溶液中只含有两种溶质(氢氧化钠和硫酸钠);
(3)见答案。
20.(1)产生蓝色沉淀,溶液由蓝色变为无色
(2)硫酸钠、硫酸铜/Na2SO4、CuSO4
(3)设50g硫酸铜溶液中硫酸铜的质量为x。
,
解得y=8g。
则该硫酸铜溶液的溶质质量分数为。
答:该硫酸铜溶液的溶质质量分数16%。
【详解】(1)硫酸铜溶液与氢氧化钠溶液反应会生成氢氧化铜蓝色沉淀和硫酸钠溶液,所以实验中能观察到的现象为产生蓝色沉淀,溶液由蓝色变为无色。
(2)硫酸铜溶液与氢氧化钠溶液反应会生成氢氧化铜蓝色沉淀和硫酸钠溶液,根据题意可知硫酸铜溶液与25g 16%的溶液恰好完全反应,当加入的溶液的质量为时,硫酸铜没有完全反应,溶液中所含的溶质成分为硫酸钠(Na2SO4)和硫酸铜(CuSO4);
(3)见答案。
21.(1)使食用碱加快溶解
(2)4
(3)解:设该食用碱中参加反应的Na2CO3质量为x。
解得:x=4.24g
该食用碱中Na2CO3的质量分数=
答:该食用碱中参加反应的Na2CO3质量为84.8%。
【详解】(1)溶解时用玻璃棒搅拌的目的是使食用碱加快溶解;
(2)由图可知,加入氯化钙溶液后,碳酸钠与氯化钙反应生成碳酸钙沉淀,经过滤、洗涤、干燥后得到的滤渣就是碳酸钙。根据质量守恒定律,滤渣的质量=5g+50g+100g-151g=4g;
(3)见答案。
22.(1)1:3
(2)解:设反应生成的Na2FeO4的质量为y。
y=16.6g
所得溶液中Na2FeO4的质量分数为。
答:所得溶液中Na2FeO4的质量分数为16.6%。
【详解】(1)解:参加反应的铁的质量=6g-0.4g=5.6g
设反应生成的氢气的质量为x。
x=0.6g
则产生氧气的质量为2.4g-0.6g=1.8g,则氢气和氧气的质量比为0.6g:1.8g=1:3;
(2)见答案。
中小学教育资源及组卷应用平台
2025年中考化学专题训练:计算题
1.欲测定一瓶标签破损的稀硫酸的溶质质量分数。取10g稀硫酸样品,将5%的NaOH溶液逐滴加入样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。请你计算:
(1)恰好完全反应时,参加反应的氢氧化钠溶液的质量为 g。
(2)计算稀硫酸的溶质质量分数。(写出计算过程)
2.科学家研发出一种新型“人造树叶”,能利用阳光将吸收的二氧化碳转化为燃料乙醇(C2H5OH),发生反应的化学方程式为:2CO2+3H2OC2H5OH+3O2.研究显示,一升“人造树叶”每天可从空气中吸收968gCO2.
(1)“人造树叶”技术作为一种可持续能源解决方案,具有广阔的应用前景和巨大的发展潜力,其优点有 。
(2)一升“人造树叶”工作一天可得到乙醇的质量是多少?
3.取一定量NaCl和Na2CO3组成的固体样品放入烧杯中,然后将一定溶质质量分数的盐酸逐滴加入样品中,边加边搅拌,测得生成气体的质量与所加盐酸的质量关系如图所示。
请分析并计算:
(1)恰好完全反应时产生气体的质量是 。
(2)计算所加盐酸的溶质质量分数 。(写出计算过程)
4.为测定放置一段时间后的某医用过氧化氢溶液中溶质的质量分数,兴趣小组的同学进行了如下实验:取该过氧化氢溶液68g于烧杯中,加入3g二氧化锰,测得不同时刻烧杯内物质的总质量见表。
时间/分钟 0
烧杯内物质的总质量/g 71.0 70.5 70.3 70.2 70.2
请计算:
(1)产生的总质量为 g。其中二氧化锰在该反应中的作用是 。
(2)计算该医用过氧化氢溶液中溶质的质量分数。(要求完整写出计算过程)
5.硅化镁(Mg2Si)在能源器件、激光和半导体制造等领域具有重要应用价值,可通过石英砂(主要成分为SiO2,杂质不含硅元素)和金属镁反应制得,反应的化学方程式为:。
(1)上述化学方程式中X为 (填化学式)。
(2)用12.25kg石英砂与足量镁充分反应得到15.2kg硅化镁,计算石英砂中SiO2的质量分数(写出计算过程)。
6.“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。——沈括《梦溪笔谈》。某兴趣小组根据其中的原理进行了如下实验。向100g硫酸铜溶液中加入铁粉,所得实验数据如下图所示。回答下列问题:
(1)b点固体的成分是 。
(2)计算所用硫酸铜溶液中溶质的质量分数 。
7.中国天宫空间站三名航天员每日需要O22.4kg,固体燃料氧气发生器制氧,是航天员安全可靠的供氧途径之一。向氧气发生器加入粉末状的铁粉和氯酸钠(NaClO3),点燃铁粉,铁粉剧烈燃烧,放出大量的热,NaClO3受热分解为NaCl和O2.
(1)写出氯酸钠受热分解的化学方程式
(2)三名航天员4天所需O2共9.6kg,则理论上至少需要加热分解NaClO3的质量为多少?(写出完整的计算过程)
8.电解法是工业制铜的重要方法,原理为:。重庆一中化学小组用溶质质量分数为的溶液充分电解(假定不发生其他反应),溶液减少。(相对分子质量:)
(1)生成固体和气体的质量最简比为 。
(2)反应后所得溶液的溶质质量分数。(写出计算过程,结果精确到)
(3)若将原溶液加水稀释到溶质质量分数为后再电解,理论上制得铜的质量 (填“不变”或“更多”或“更少”)。
9.疫情期间,84消毒液(有效成分是NaClO)广泛用于家庭和公共场所的消毒。工业上可以通过NaOH溶液与Cl2反应制得84消毒液,该反应的化学方程式为:2NaOH+Cl2=NaClO+NaCl+H2O
(1)配制20g溶质质量分数为10%的NaOH溶液,需要称取NaOH固体的质量是 g。
(2)从氢氧化钠的性质角度思考,用天平称量固体时,若称量时间过长,会导致溶质的质量分数 (填“偏大”“偏小”或“无影响”),原因是 。
(3)依据化学方程式计算,要制得149gNaClO,理论上需要NaOH的质量是多少?
10.钛和钛合金具有很多优良的性能,广泛用于火箭、航天飞机和卫星等。制造人造卫星常用到钛合金,工业制取钛(Ti)的一种方法为。
资料:①钠在空气中易被氧化 ②钛在高温下会与氧气反应
(1)用9.2kg钠通过上述方法,理论上可制取钛的质量是多少?(写出计算过程)
(2)工业上利用上述方法制取钛,通常要在氩气的环境中进行,原因是 。
11.我国致力于2060年前达成“碳中和”目标,即实现二氧化碳的相对“零排放”。推广氢能源汽车是减少二氧化碳排放的有效途径之一,氢化钙()是一种重要的制氢剂,氢化钙可与物质M反应生成氢气,反应的化学方程式为:CaH2+2M=Ca(OH)2+2H2↑
(1)M的化学式为 。
(2)若制取16kg氢气,计算理论上需要的质量(写出计算过程)。
12.工业上主要利用一氧化碳还原赤铁矿(主要成分为Fe2O3)冶炼金属铁。
(1)Fe2O3中铁元素的质量分数的计算式为 。
(2)要冶炼制得112tFe,计算理论上需要的CO的质量。(写出计算过程)
13.中国天宫空间站三名航天员每日需要O22.4kg,固体燃料氧气发生器制氧是航天员安全可靠的供氧途径之一。向氧气发生器加入粉末状的铁粉和氯酸钠(NaClO3),点燃铁粉,铁粉剧烈燃烧,放出大量的热,NaClO3受热分解为NaCl和O2。
(1)三名航天员4天所需O2为9.6kg,列式计算理论上至少需要加热分解NaClO3的质量为多少?
(2)在一定条件下,制取相同质量的O2,则加热分解 (选填“KClO3”或“NaClO3”)所需质量更少。
14.铜是人类最早使用的金属之一。我国铜冶炼技术具有悠久的历史。常见的方法为湿法炼铜和火法炼铜两种,方案如下:
方案一:
方案二:
(1)上述两种炼铜的方案中,对环境比较友好的是方案 。
(2)利用含的铜矿石作为原料进行火法炼铜,理论上可炼出铜的质量为多少?(结合化学方程式写出计算过程)
15.“中国高铁,世界第一”,高铁列车车体使用了含镍不锈钢材料,工业上火法炼镍的原理是C+2NiO2Ni+X↑,回答下列问题。
(1)X的化学式为 。
(2)生产5.9t镍,计算理论上需要氧化镍的质量。
16.消毒防腐药是用来杀灭病原微生物或抑制其生长的化学物质。碘、过氧化氢、乙醇等,在规定剂量和范围内可作为消毒防腐药。
(1)过氧化氢、碘和乙醇在化学性质和用途上各有特点,请任写一个 。
(2)计算分解34g10%的过氧化氢溶液,理论上可生成氧气的质量是多少?
17.含氯消毒液是家庭常用的消毒用品,有效成分为次氯酸钠(NaClO)。工业制备原理为Cl2+2NaOH=NaClO+NaCl+H2O。现向质量分数为10.0%的NaOH溶液中通入氯气,制得NaClO质量分数为5%的消毒液(溶质为NaCl、NaClO和NaOH)2980g,请回答下列问题:
提示:相对分子质量为NaCl58.5 NaClO74.5 NaOH40
(1)NaClO中钠和氯元素的质量比为 (最简整数比)。
(2)参加反应的氯气质量为 g。
(3)请通过反应方程式计算,制得的消毒液中NaOH的质量分数(计算结果精确至0.1%)。
18.鸡蛋壳的主要成分为碳酸钙。为测定鸡蛋壳中碳酸钙的质量分数,向盛有20g鸡蛋壳的烧杯中加入100g稀盐酸,恰好完全反应后测得烧杯内混合物的总质量为116.7g。(鸡蛋壳中其他成分不与稀盐酸反应放出气体)
(1)该反应中放出气体的质量为 。
(2)计算鸡蛋壳中碳酸钙的质量分数。(要求写出计算过程)
19.为测定某标签破损的稀硫酸的溶质质量分效,小强同学在烧杯中加入100g该稀硫酸,逐滴加入10%的氢氧化钠溶液,边加边搅拌,随着氢氧化钠溶液的滴入,溶液的温度变化情况如图所示。
请分析并计算:
(1)从能量角度看,该反应属于 (填“吸热”或“放热”)反应。
(2)从物质角度看,图中对应溶液中只含有一种溶质的点是 (填字母)。
(3)计算该稀硫酸的溶质质量分数。
20.为测定某硫酸铜溶液的溶质质量分数,取该溶液,向其中逐滴加入溶质质量分数为16%的溶液,当加入溶液时两者恰好完全反应。
(1)实验中能观察到的现象为 。
(2)当加入的溶液的质量为时,溶液中所含的溶质成分为 。
(3)计算该硫酸铜溶液的溶质质量分数。
21.化学兴趣小组为测定某品牌食用碱(主要成分是Na2CO3,含有少量NaCl)中的Na2CO3的质量分数。进行了如图实验:
请分析并计算:
(1)溶解时用玻璃棒搅拌的目的是 。
(2)滤渣的质量为 g。
(3)计算该食用碱中Na2CO3的质量分数。
22.饮用水常用高铁酸钠(Na2FeO4)作消毒剂,Na2FeO4可用电解法制取,反应的化学方程式为Fe+2NaOH+2H2ONa2FeO4+3H2↑。实验室取一块6g生铁与96.8gNaOH溶液进行电解,完全反应后获得0.4g碳和2.4g气体。(相对分子质量Na2FeO4166)
(1)2.4g气体中氢气和氧气的质量比为 (最简整数比)。
(2)计算所得溶液中Na2FeO4的质量分数。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
《2025年中考化学专题训练:计算题》参考答案
1.(1)16
(2)解:设稀硫酸的溶质质量为x
稀硫酸的溶质质量分数为:
答:稀硫酸的溶质质量分数为9.8%。
【详解】(1)当氢氧化钠与稀硫酸恰好完全反应时溶液显中性,pH=7,由图可知,恰好完全反应时,参加反应的氢氧化钠溶液的质量为16g;
(2)见答案。
2.(1)减少二氧化碳排放(减缓温室效应、有效缓解能源短缺)(合理即可)
(2)解:设可以得到乙醇的质量为x
答:一升“人造树叶”工作一天可得到506g乙醇。
【详解】(1)“人造树叶”利用太阳能将CO2转化为燃料,减少温室气体排放;以阳光为能源,CO2和水为原料,资源可持续;(合理即可)
(2)见答案。
3.(1)4.4g
(2)7.3%
解:设恰好完全时所加盐酸的溶质质量为x,
该盐酸的溶质质量分数为;
答:所加盐酸的溶质质量分数7.3%。
【详解】(1)由图像可知,加入100g盐酸时碳酸钠恰好完全反应,生成二氧化碳的质量为4.4g,故填:4.4g;
(2)见答案。
4.(1) 0.8 催化作用
(2)解:设该医用过氧化氢溶液中溶质的质量为x,
x=1.7g
该医用过氧化氢溶液中溶质的质量分数为,
答:该医用过氧化氢溶液中溶质的质量分数为2.5%。
【详解】(1)过氧化氢在二氧化锰的催化下分解生成氧气和水,根据质量守恒定律可得,产生O2的总质量为:71.0g-70.2g=0.8g;
其中二氧化锰作为过氧化氢分解的催化剂,在该反应中的作用是催化作用;
(2)见答案。
5.(1)MgO
(2)解:设石英砂中SiO2的质量分数为x
答:石英砂中SiO2的质量分数为98.0%。
【详解】(1)根据质量守恒定律,化学反应前后原子的种类和数目不变。反应前Si原子个数为1、O原子个数为2、Mg原子个数为4;反应后除2X外Si原子个数为1、Mg原子个数为2,则2X中应含有2个O原子和2个Mg原子,X中应含有1个O原子和1个Mg原子,所以X的化学式为MgO。
(2)根据硅化镁的质量计算,见答案。
6.(1)Fe、Cu
(2)解:设硫酸铜溶液中溶质的质量为。
则硫酸铜溶液中溶质的质量分数为
答:所用硫酸铜溶液中溶质的质量分数为16%。
【详解】(1)铁与硫酸铜反应生成铜和硫酸亚铁,根据化学方程式,每56份质量的铁置换出64份质量的铜,则反应后溶液质量逐渐减少,直至硫酸铜完全反应不再变化,故图中a点表示铁与硫酸铜恰好完全反应,b点时铁粉过量,则b点固体的成分是Fe、Cu;
(2)由第(1)小问分析可知,a点表示铁与硫酸铜恰好完全反应,则消耗铁的质量为5.6g,计算过程见答案。
7.(1)
(2)解:设至少需要NaClO3的质量为x
答:至少需要NaClO3的质量21.3kg。
【详解】(1)NaClO3受热分解为NaCl和O2,方程式为;
(2)见答案。
8.(1)4∶1
(2)解:溶液减少的质量即为反应生成的铜与氧气的总质量,设原硫酸铜溶液的质量为x,反应生成的H2SO4质量为y
、
x=200g、y=19.6g
答:反应后所得溶液的溶质质量分数为10.7%。
(3)不变
【详解】(1)根据,生成固体(Cu)和气体(O2)的质量最简比为。
(2)见答案。
(3)根据质量守恒定律,化学反应前后元素质量不变。稀释前后硫酸铜溶液中铜元素的质量不变,电解过程中铜元素全部转化为单质铜,所以理论上制得铜的质量不变。
9.(1)2
(2) 偏小 氢氧化钠易潮解,会使溶质质量偏小
(3)设需要NaOH的质量为x,则
解得x=160g
答:理论上需要NaOH的质量是160g。
【详解】(1)配制20g溶质质量分数为10%的NaOH溶液时,需要NaOH的质量为20g×10%=2g。
(2)氢氧化钠固体易潮解,会吸收空气中的水蒸气,则实际称量的溶质质量偏少,则导致溶质的质量分数偏小。
(3)见答案。
10.(1)解:设理论上可制取钛的质量为。
,
答:理论上可制取钛的质量为4.8kg。
(2)防止钠和钛被空气中的氧气氧化
【详解】(1)见答案
(2)钠非常活泼,可以和氧气反应,工业上利用上述方法制取钛,通常要在氩气的环境中进行,原因是防止钠和钛被空气中的氧气氧化,故填:防止钠和钛被空气中的氧气氧化。
11.(1)H2O
(2)解:设理论上需要CaH2的质量为x
x=168kg
答:若制取16kg氢气,理论上需要CaH2的质量为168kg。
【详解】(1)根据反应方程式可知,左边有1个钙原子,2个氢原子,右边有1个钙原子,2个氧原子,6个氢原子,化学反应前后原子的种类和数目不变。2M应含有2个氧原子和4个氢原子,所以M的化学式为 H2O;
(2)见答案。
12.(1)×100%
(2)解:设理论上需要的CO质量为x
x=84t
答:理论上需要的CO的质量是84t。
【详解】(1)氧化铁中铁元素的质量分数为:;
(2)见答案。
13.(1)设理论上至少需要加热分解NaClO3的质量为x。
=
x=21.3kg
答:理论上至少需要加热分解NaClO3的质量为21.3kg。
(2)NaClO3
【详解】(1)见答案;
(2)根据化学方程式,每213份质量的NaClO3能分解产生96份质量的O2,根据化学方程式,每245份质量的KClO3能分解产生96份质量的O2,则制取相同质量的O2,则加热份解NaClO3所需质量更少。
14.(1)一
(2)解:设理论上可炼铜的质量为x。
解得:
答:理论上可炼铜的质量为。
【详解】(1)方案一中没有污染物的生成,对环境比较友好,故填:一;
(2)详见答案。
15.(1)CO2
(2)解:设理论上需要氧化镍的质量为x
x =7.5t
答:理论上需要氧化镍的质量是7.5 t。
【详解】(1)根据质量守恒定律,化学反应前后原子的种类和数目不变,反应物中含C、Ni、O的个数分别是1、2、2,生成物中含C、Ni、O的个数分别是0、2、0,故生成物中还应含1个C、2个O,故X的化学式为:CO2;
(2)见答案。
16.(1)过氧化氢不稳定,受热易分解;乙醇具有可燃性;乙醇可作燃料等(合理即可)
(2)解:设理论上生成氧气的质量为x
x=1.6g
答:理论上生成氧气的质量为1.6g
【详解】(1)过氧化氢、碘和乙醇在化学性质和用途上各有特点,如过氧化氢不稳定,受热易分解,过氧化氢可用于制取氧气;乙醇具有可燃性,乙醇可用作燃料;碘能使淀粉变蓝,可用于检验淀粉等;
(2)见答案。
17.(1)46:71
(2)142
(3)解:设参加反应的氢氧化钠的质量为y
y=160g
根据质量守恒定律,化学反应前后物质的总质量不变,则氢氧化钠溶液的质量为:2980g-142g=2838g,则剩余氢氧化钠的质量为:,故制得的消毒液中NaOH的质量分数为:
答:制得的消毒液中NaOH的质量分数为4.2%
【详解】(1)NaClO中钠和氯元素的质量比为:23:35.5=46:71;
(2)解:设参加反应的氯气的质量为x
x=142g
答:参加反应的氯气的质量是142g;
(3)见答案。
18.(1)3.3g
(2)37.5%
解:设鸡蛋壳中碳酸钙的质量为x,
鸡蛋壳中碳酸钙的质量分数为;
答:鸡蛋壳中碳酸钙的质量分数37.5%。
【详解】(1)根据质量守恒定律,反应后减少的质量为生成气体的质量,则反应中放出气体的质量为20g+100g-116.7g=3.3g,故填:3.3g;
(2)见答案。
19.(1)放热
(2)B
(3)设参加反应的H2SO4质量为x,
x=4.9g,
该稀硫酸的溶质质量分数为×100%=4.9%,
答:该稀硫酸的溶质质量分数为4.9%。
【详解】(1)由图可知,反应过程中温度会升高,该反应属于放热反应;
(2)由于中和反应放热,所以B点表示氢氧化钠和硫酸恰好反应,对应溶液中只含有一种溶质(硫酸钠),A点时,硫酸过量,对应溶液中只含有两种溶质(硫酸和硫酸钠),C点时,氢氧化钠过量,对应溶液中只含有两种溶质(氢氧化钠和硫酸钠);
(3)见答案。
20.(1)产生蓝色沉淀,溶液由蓝色变为无色
(2)硫酸钠、硫酸铜/Na2SO4、CuSO4
(3)设50g硫酸铜溶液中硫酸铜的质量为x。
,
解得y=8g。
则该硫酸铜溶液的溶质质量分数为。
答:该硫酸铜溶液的溶质质量分数16%。
【详解】(1)硫酸铜溶液与氢氧化钠溶液反应会生成氢氧化铜蓝色沉淀和硫酸钠溶液,所以实验中能观察到的现象为产生蓝色沉淀,溶液由蓝色变为无色。
(2)硫酸铜溶液与氢氧化钠溶液反应会生成氢氧化铜蓝色沉淀和硫酸钠溶液,根据题意可知硫酸铜溶液与25g 16%的溶液恰好完全反应,当加入的溶液的质量为时,硫酸铜没有完全反应,溶液中所含的溶质成分为硫酸钠(Na2SO4)和硫酸铜(CuSO4);
(3)见答案。
21.(1)使食用碱加快溶解
(2)4
(3)解:设该食用碱中参加反应的Na2CO3质量为x。
解得:x=4.24g
该食用碱中Na2CO3的质量分数=
答:该食用碱中参加反应的Na2CO3质量为84.8%。
【详解】(1)溶解时用玻璃棒搅拌的目的是使食用碱加快溶解;
(2)由图可知,加入氯化钙溶液后,碳酸钠与氯化钙反应生成碳酸钙沉淀,经过滤、洗涤、干燥后得到的滤渣就是碳酸钙。根据质量守恒定律,滤渣的质量=5g+50g+100g-151g=4g;
(3)见答案。
22.(1)1:3
(2)解:设反应生成的Na2FeO4的质量为y。
y=16.6g
所得溶液中Na2FeO4的质量分数为。
答:所得溶液中Na2FeO4的质量分数为16.6%。
【详解】(1)解:参加反应的铁的质量=6g-0.4g=5.6g
设反应生成的氢气的质量为x。
x=0.6g
则产生氧气的质量为2.4g-0.6g=1.8g,则氢气和氧气的质量比为0.6g:1.8g=1:3;
(2)见答案。
同课章节目录
