湖南省岳阳市汨罗市第二中学2024-2025学年高三下学期4月月考 化学试题(含答案)
文档属性
| 名称 | 湖南省岳阳市汨罗市第二中学2024-2025学年高三下学期4月月考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 17:24:09 | ||
图片预览



文档简介
2025年高三下学期化学月考模拟试题
一、单选题(每题3分,共48分)
1.根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是
选项 材料 组成和结构变化 性能变化
A 天然橡胶 硫化使其结构由线型转变为网状 强度提升
B 聚乙炔 掺入 导电性增强
C 纤维素 接入带有强亲水基团的支链 吸水能力增强
D 生铁 减少含碳量 延展性减弱
A.A B.B C.C D.D
2.党的二十大报告指出“推动绿色发展,促进人与自然和谐共生”。下列做法不合理的是
A.研制可降解塑料,控制白色污染产生 B.研发新能源汽车,降低汽油柴油消耗
C.开发利用天然纤维,停止使用合成材料 D.研究开发生物农药,减少作物农药残留
3.反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法不正确的是
A.100 mL 1 mol L水溶液中含有的键数目为
B.0℃、101kPa时,22.4 L 中氯原子的数目为
C.常温常压下1.6 g 含有质子的数目为
D.通过上述反应除去0.5 mol ,转移电子的数目为
4.某同学检验海带中是否含有碘元素,进行了如下实验
步骤Ⅰ:灼烧干海带得到海带灰
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入足量10%溶液(硫酸酸化),溶液变为蓝色
步骤Ⅳ:将10%溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝
步骤Ⅴ:向步骤Ⅳ所得溶液中通入,溶液迅速变为蓝色
下列说法正确的是
A.步骤Ⅰ中,灼烧干海带在蒸发皿中进行
B.步骤Ⅲ中,反应的离子方程式:
C.步骤Ⅳ中溶液未变蓝色是因为氯水有漂白性
D.步骤Ⅴ中溶液迅速变为蓝色表现的还原性
5.下列物质的性质与用途均正确且具有对应关系的是
A.乙烯具有还原性,可以用作水果保存的抗氧化剂
B.溶液呈酸性,可以用作泳池的消毒剂
C.的熔点极高,可以用作耐高温涂层
D.密度比空气大,可用于人工降雨
6.某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是
气体 液体 固体粉末
A 饱和溶液
B 溶液
C 溶液
D
A.A B.B C.C D.D
7.过量与以下0.1的溶液反应,下列现象和相关反应错误的是
选项 溶液 现象 离子反应方程式
A 和淀粉溶液 溶液变蓝
B 溶液由棕黄色变浅绿色
C 溶液褪色,产生白色沉淀
D 产生淡黄色沉淀
A.A B.B C.C D.D
8.设为阿伏加德罗常数的值。下列说法正确的是
A.4.4g气体中含有键的数目为0.4
B.1LpH=3的溶液中含有的数目为
C.标准状况下,22.4L含有分子的数目为
D.1mol与过量充分反应产生的HI分子的数目为2
9.实验室中可通过香草胺与8-甲基壬酸为原料合成二氢辣椒素,下列有关说法不正确的是
A.香草胺中含有三种官能团
B.二氢辣椒素结构中具有一个手性碳原子
C.1 mol二氢辣椒素与过量NaOH溶液作用,最多可消耗2 mol NaOH
D.产物提纯后,可通过红外光谱检测酰胺基的存在,初步确定此合成是否成功
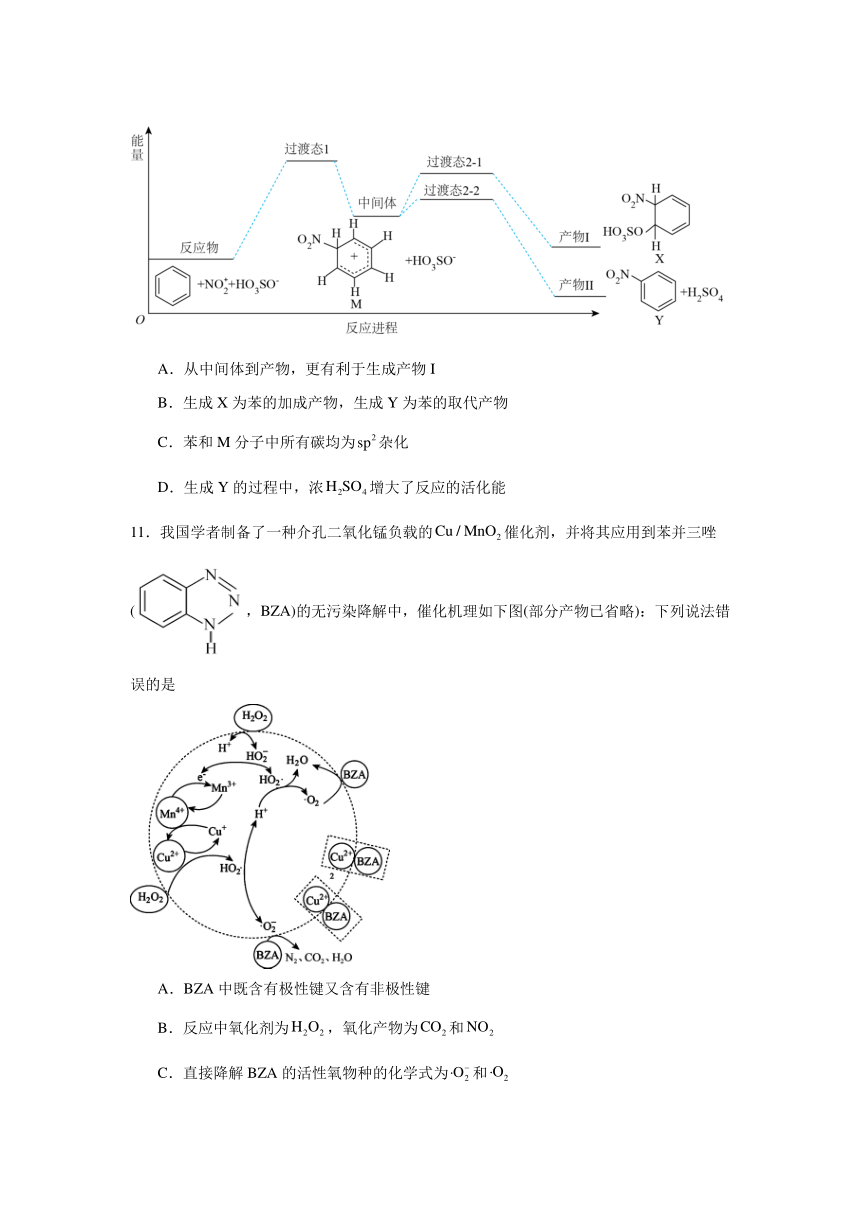
10.苯在浓和浓作用下,反应过程中能量变化示意图如下图所示。下列说法正确的是
A.从中间体到产物,更有利于生成产物I
B.生成X为苯的加成产物,生成Y为苯的取代产物
C.苯和M分子中所有碳均为杂化
D.生成Y的过程中,浓增大了反应的活化能
11.我国学者制备了一种介孔二氧化锰负载的催化剂,并将其应用到苯并三唑(,BZA)的无污染降解中,催化机理如下图(部分产物已省略):下列说法错误的是
A.BZA中既含有极性键又含有非极性键
B.反应中氧化剂为,氧化产物为和
C.直接降解BZA的活性氧物种的化学式为和
D.据机理图可知氧化性:
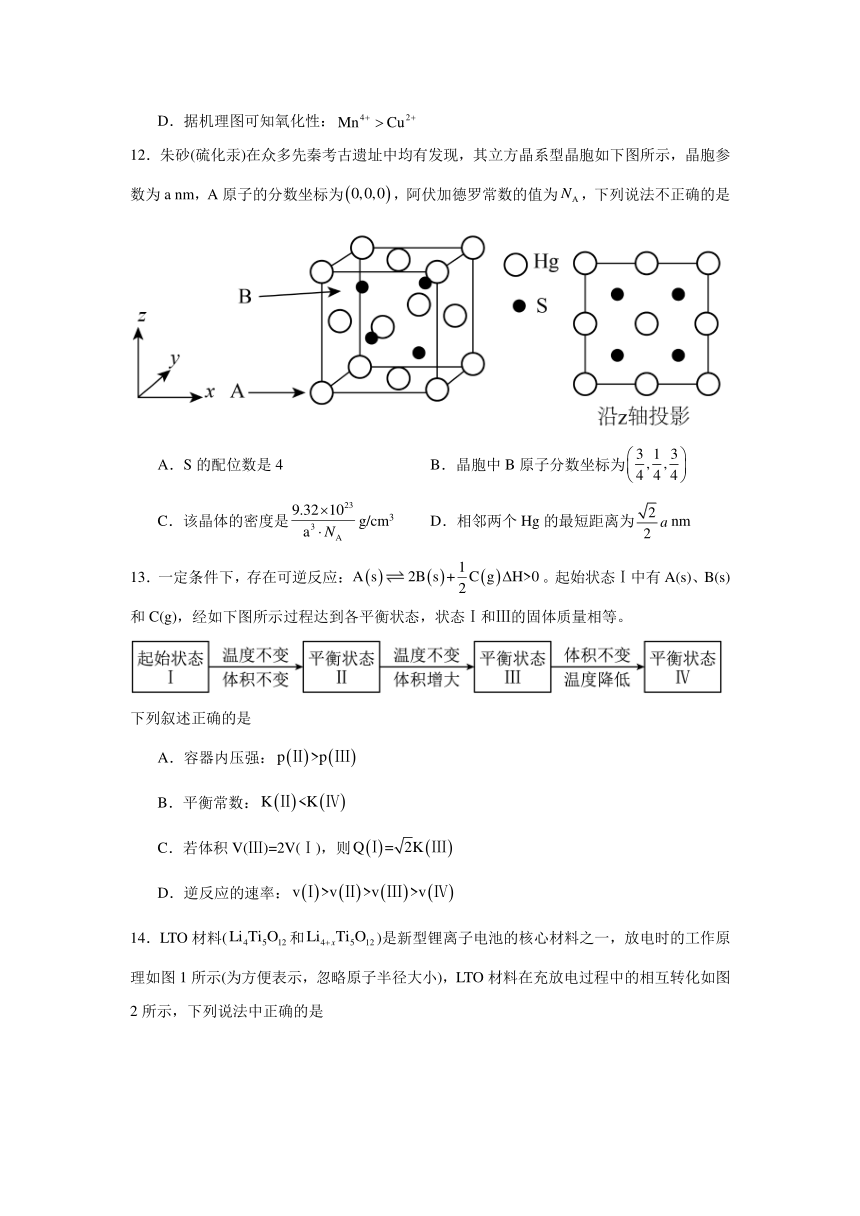
12.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为a nm,A原子的分数坐标为,阿伏加德罗常数的值为,下列说法不正确的是
A.S的配位数是4 B.晶胞中B原子分数坐标为
C.该晶体的密度是g/cm3 D.相邻两个Hg的最短距离为nm
13.一定条件下,存在可逆反应:。起始状态Ⅰ中有A(s)、B(s)和C(g),经如下图所示过程达到各平衡状态,状态Ⅰ和Ⅲ的固体质量相等。
下列叙述正确的是
A.容器内压强:
B.平衡常数:
C.若体积V(Ⅲ)=2V(Ⅰ),则
D.逆反应的速率:
14.LTO材料(和)是新型锂离子电池的核心材料之一,放电时的工作原理如图1所示(为方便表示,忽略原子半径大小),LTO材料在充放电过程中的相互转化如图2所示,下列说法中正确的是
A.KCl的有机溶液可以用KCl的水溶液代替
B.每转移1mol电子,正极材料质量减少7g
C.图2所示A→B的转化为放电时LTO材料中晶胞的变化
D.充电时,阳极的电极方程式为
15.室温下,向、均为的混合溶液中持续通入气体,始终保持饱和(的物质的量浓度为),通过调节使、分别沉淀,溶液中与的关系如下图所示。其中,c表示、、和的物质的量浓度的数值,。下列说法错误的是
A.①代表与的关系曲线 B.逐渐增大时,溶液中优先析出的沉淀为
C.的 D.的平衡常数
16.常温下,向10.0mL浓度均为0.1mol/L的和混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如 下图所示,测得a、b两点溶液的pH分别为3.2,4.5。已知:①;②常温下,,。
下列叙述错误的是
A.曲线Ⅰ代表
B.加入NaOH为时,与比值为
C.c点铁铝元素主要存在形式为和
D.的平衡常数K的数量级为
二、解答题(共52分)
17.(本题10分)以钛铁矿(主要成分为,还含有少量)为原料合成锂离子电池的电极材料钛酸锂()和磷酸亚铁锂()的工艺流程如下:
回答下列问题:
(1)“溶浸”前将钛铁矿粉碎的目的是 ;“溶浸”后溶液中的阳离子主要包括、 。
(2)加热条件下“水解”主要得到沉淀,该反应的离子方程式为 ;“水解”时间过长会导致富钛渣中三价铁元素含量升高,原因是 。
(3)“沉铁”步骤反应的化学方程式为 ,“沉铁”宜在40℃条件下进行,温度不宜过高的原因是 。
(4)“煅烧”制备过程中,和的理论投入量的物质的量之比为 。
(5)以和作电极组成电池,充电时发生反应:(018.(本题12分)以钒钼铅矿(主要成分为)、,还含有少量)为原料分离钒和钼的工艺流程如下:
已知:①随溶液pH变化,钒以、等形式存在;②。
回答下列问题:
(1)钒原子核外电子排布式 。
(2)“球磨破碎”的目的是 。
(3)“浸出”后,钒主要以形式存在,写出相应反应的离子方程式: 。
(4)“净化渣”的主要成分除外,还有 (填化学式)。
(5)“浸出”操作中,加入要适量,从保护环境的角度分析其原因: 。
(6)煅烧过程中发生反应的化学方程式为 。
(7)向10 mL 0.2 mol L的滤液中加入等体积的溶液,欲使沉淀完全,则溶液的最小浓度为 mol L(忽略混合过程中溶液的体积变化,当溶液中某离子的浓度mol L时,认为该离子沉淀完全)。
19.(本题10分)Ⅰ.293K,实验测得下列同位素交换反应的标准平衡常数如下:
(1)在293K,反应的 。
Ⅱ.利用和合成二甲醚,过程中发生的主副反应如下:
① ΔH<0
② ΔH<0
③ ΔH>0
(2)从提高的平衡产率来看,下列措施合理的是 (填序号)。
a.及时分离出 b.适当降温 c.使用合适的催化剂
(3)其他条件一定时,温度对反应的影响如下图所示:
已知:产物A的选择性。温度高于260℃,二甲醚的选择性显著降低并非反应③导致,理由是 。
(4)空速是指单位时间内、单位体积催化剂上通过的气体体积流量。其他条件一定,在一定空速范围内,的转化率随空速的增大而减小,但甲醇的选择性增大,可能的原因是 。
Ⅲ.库仑测硫仪可以测定待测气体中的含量,其工作原理如下图所示。检测前,溶液中为一定值,电解池不工作。通入待检气体aL后,电解池开始工作,一段时间后停止。
(5)通入待测气体后发生反应: 。
(6)电解池开始工作时,阳极电极反应式: 。
(7)测得电解过程转移电子b mol,则待测气体中的含量为 g/L。
20.(本题10分)CO2的资源化利用和转化已成为当今科学研究的热点。回答下列问题:
(1)325℃时,水在锰粉表面产生的H2可将CO2转化成甲酸,同时生成MnO。
①由H2O、Mn、CO2制备甲酸的化学方程式为 。
②直接将H2和CO2混合,在325℃条件下难以生成甲酸,而在锰粉表面可以较快生成甲酸的原因是 。
(2)由CO2和H2制备甲醇(CH3OH)的反应原理如下:
反应I. (a>0)
反应I. (b>0)
反应Ⅲ. △H3
恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图所示。其中:CH3OH的选择性=。
①△H3= kJ mol-1,据此判断反应Ⅲ在 (填“低温”“高温”或“任意温度”)条件下有利于自发进行。
②在上述条件下,结合图像分析,合成甲醇的最佳温度是 ,最佳催化剂是 。
③温度高于230℃,使用CZT催化剂时CH3OH产率随温度升高而下降的原因是 。
(3)模拟在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应)装置如图所示,装置中b电极为 (填“正”或“负”)极,X极上发生反应的电极反应式为 。
21.(本题10分)利喘贝是一种新的平喘药,其合成过程如下:
已知:
i.
ii.
(1)A属于芳香烃,则B的名称为 。
(2)D的官能团的名称是 ;D→E的反应类型是 。
(3)H与作用显色且能发生银镜反应,苯环上的一氯代物有两种。由H生成I反应的化学方程式为 。
(4)L的结构简式为 。
(5)比E少一个氧原子且含有苯环属于酰胺类的同分异构体有 种。
(6)J俗称香兰素,在食品行业中主要作为一种增香剂。香兰素的一种合成路线如下。
中间产物1和中间产物2的结构简式分别为 ; 。
题号 1 2 3 4 5 6 7 8 9 10
答案 D C A D C A A B B B
题号 11 12 13 14 15 16
答案 B B C C D B
17.(1) 加快反应速率,提高浸出率 、
(2) 反应时间过长导致被空气中的氧化成,加热促进水解生成沉淀
(3) 温度过高会导致受热分解
(4)1∶1
(5)
18.(1)或
(2)增大反应物的接触面积,加快反应速率,提高钒钼铅矿的浸出率
(3)+2S2-=+2PbS
(4)MgSiO3
(5)若Na2S过量,S2-会随着浸出液进入“沉钼”操作中,后与“沉钼”过程中加入的酸反应产生H2S气体污染环境
(6)
(7)
19.(1)24
(2)ab
(3)二甲醚选择性降低程度近似等于甲醇选择性升高程度
(4)空速增大,气体流速太快,反应气体与催化剂接触时间太短,导致气体与催化剂接触不充分;空速增大,反应②、③的速率降低太多,甲醇的选择性增大
(5)
(6)
(7)
20.(1) 该条件下,生成的H2与MnO反应生成Mn,因此Mn可以作为该反应的催化剂,降低活化能
(2) -(2a+b) 低温 230℃ CZ(Zr-1)T催化剂 温度升高,催化剂活性降低,反应I速率减慢
(3) 正
21.(1)邻硝基甲苯或2-硝基甲苯
(2) 酯基、硝基 还原反应
(3)
(4)
(5)5
(6)
一、单选题(每题3分,共48分)
1.根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是
选项 材料 组成和结构变化 性能变化
A 天然橡胶 硫化使其结构由线型转变为网状 强度提升
B 聚乙炔 掺入 导电性增强
C 纤维素 接入带有强亲水基团的支链 吸水能力增强
D 生铁 减少含碳量 延展性减弱
A.A B.B C.C D.D
2.党的二十大报告指出“推动绿色发展,促进人与自然和谐共生”。下列做法不合理的是
A.研制可降解塑料,控制白色污染产生 B.研发新能源汽车,降低汽油柴油消耗
C.开发利用天然纤维,停止使用合成材料 D.研究开发生物农药,减少作物农药残留
3.反应常被用于除去水中残余氯。为阿伏加德罗常数的值,下列说法不正确的是
A.100 mL 1 mol L水溶液中含有的键数目为
B.0℃、101kPa时,22.4 L 中氯原子的数目为
C.常温常压下1.6 g 含有质子的数目为
D.通过上述反应除去0.5 mol ,转移电子的数目为
4.某同学检验海带中是否含有碘元素,进行了如下实验
步骤Ⅰ:灼烧干海带得到海带灰
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入足量10%溶液(硫酸酸化),溶液变为蓝色
步骤Ⅳ:将10%溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝
步骤Ⅴ:向步骤Ⅳ所得溶液中通入,溶液迅速变为蓝色
下列说法正确的是
A.步骤Ⅰ中,灼烧干海带在蒸发皿中进行
B.步骤Ⅲ中,反应的离子方程式:
C.步骤Ⅳ中溶液未变蓝色是因为氯水有漂白性
D.步骤Ⅴ中溶液迅速变为蓝色表现的还原性
5.下列物质的性质与用途均正确且具有对应关系的是
A.乙烯具有还原性,可以用作水果保存的抗氧化剂
B.溶液呈酸性,可以用作泳池的消毒剂
C.的熔点极高,可以用作耐高温涂层
D.密度比空气大,可用于人工降雨
6.某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是
气体 液体 固体粉末
A 饱和溶液
B 溶液
C 溶液
D
A.A B.B C.C D.D
7.过量与以下0.1的溶液反应,下列现象和相关反应错误的是
选项 溶液 现象 离子反应方程式
A 和淀粉溶液 溶液变蓝
B 溶液由棕黄色变浅绿色
C 溶液褪色,产生白色沉淀
D 产生淡黄色沉淀
A.A B.B C.C D.D
8.设为阿伏加德罗常数的值。下列说法正确的是
A.4.4g气体中含有键的数目为0.4
B.1LpH=3的溶液中含有的数目为
C.标准状况下,22.4L含有分子的数目为
D.1mol与过量充分反应产生的HI分子的数目为2
9.实验室中可通过香草胺与8-甲基壬酸为原料合成二氢辣椒素,下列有关说法不正确的是
A.香草胺中含有三种官能团
B.二氢辣椒素结构中具有一个手性碳原子
C.1 mol二氢辣椒素与过量NaOH溶液作用,最多可消耗2 mol NaOH
D.产物提纯后,可通过红外光谱检测酰胺基的存在,初步确定此合成是否成功
10.苯在浓和浓作用下,反应过程中能量变化示意图如下图所示。下列说法正确的是
A.从中间体到产物,更有利于生成产物I
B.生成X为苯的加成产物,生成Y为苯的取代产物
C.苯和M分子中所有碳均为杂化
D.生成Y的过程中,浓增大了反应的活化能
11.我国学者制备了一种介孔二氧化锰负载的催化剂,并将其应用到苯并三唑(,BZA)的无污染降解中,催化机理如下图(部分产物已省略):下列说法错误的是
A.BZA中既含有极性键又含有非极性键
B.反应中氧化剂为,氧化产物为和
C.直接降解BZA的活性氧物种的化学式为和
D.据机理图可知氧化性:
12.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为a nm,A原子的分数坐标为,阿伏加德罗常数的值为,下列说法不正确的是
A.S的配位数是4 B.晶胞中B原子分数坐标为
C.该晶体的密度是g/cm3 D.相邻两个Hg的最短距离为nm
13.一定条件下,存在可逆反应:。起始状态Ⅰ中有A(s)、B(s)和C(g),经如下图所示过程达到各平衡状态,状态Ⅰ和Ⅲ的固体质量相等。
下列叙述正确的是
A.容器内压强:
B.平衡常数:
C.若体积V(Ⅲ)=2V(Ⅰ),则
D.逆反应的速率:
14.LTO材料(和)是新型锂离子电池的核心材料之一,放电时的工作原理如图1所示(为方便表示,忽略原子半径大小),LTO材料在充放电过程中的相互转化如图2所示,下列说法中正确的是
A.KCl的有机溶液可以用KCl的水溶液代替
B.每转移1mol电子,正极材料质量减少7g
C.图2所示A→B的转化为放电时LTO材料中晶胞的变化
D.充电时,阳极的电极方程式为
15.室温下,向、均为的混合溶液中持续通入气体,始终保持饱和(的物质的量浓度为),通过调节使、分别沉淀,溶液中与的关系如下图所示。其中,c表示、、和的物质的量浓度的数值,。下列说法错误的是
A.①代表与的关系曲线 B.逐渐增大时,溶液中优先析出的沉淀为
C.的 D.的平衡常数
16.常温下,向10.0mL浓度均为0.1mol/L的和混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如 下图所示,测得a、b两点溶液的pH分别为3.2,4.5。已知:①;②常温下,,。
下列叙述错误的是
A.曲线Ⅰ代表
B.加入NaOH为时,与比值为
C.c点铁铝元素主要存在形式为和
D.的平衡常数K的数量级为
二、解答题(共52分)
17.(本题10分)以钛铁矿(主要成分为,还含有少量)为原料合成锂离子电池的电极材料钛酸锂()和磷酸亚铁锂()的工艺流程如下:
回答下列问题:
(1)“溶浸”前将钛铁矿粉碎的目的是 ;“溶浸”后溶液中的阳离子主要包括、 。
(2)加热条件下“水解”主要得到沉淀,该反应的离子方程式为 ;“水解”时间过长会导致富钛渣中三价铁元素含量升高,原因是 。
(3)“沉铁”步骤反应的化学方程式为 ,“沉铁”宜在40℃条件下进行,温度不宜过高的原因是 。
(4)“煅烧”制备过程中,和的理论投入量的物质的量之比为 。
(5)以和作电极组成电池,充电时发生反应:(0
已知:①随溶液pH变化,钒以、等形式存在;②。
回答下列问题:
(1)钒原子核外电子排布式 。
(2)“球磨破碎”的目的是 。
(3)“浸出”后,钒主要以形式存在,写出相应反应的离子方程式: 。
(4)“净化渣”的主要成分除外,还有 (填化学式)。
(5)“浸出”操作中,加入要适量,从保护环境的角度分析其原因: 。
(6)煅烧过程中发生反应的化学方程式为 。
(7)向10 mL 0.2 mol L的滤液中加入等体积的溶液,欲使沉淀完全,则溶液的最小浓度为 mol L(忽略混合过程中溶液的体积变化,当溶液中某离子的浓度mol L时,认为该离子沉淀完全)。
19.(本题10分)Ⅰ.293K,实验测得下列同位素交换反应的标准平衡常数如下:
(1)在293K,反应的 。
Ⅱ.利用和合成二甲醚,过程中发生的主副反应如下:
① ΔH<0
② ΔH<0
③ ΔH>0
(2)从提高的平衡产率来看,下列措施合理的是 (填序号)。
a.及时分离出 b.适当降温 c.使用合适的催化剂
(3)其他条件一定时,温度对反应的影响如下图所示:
已知:产物A的选择性。温度高于260℃,二甲醚的选择性显著降低并非反应③导致,理由是 。
(4)空速是指单位时间内、单位体积催化剂上通过的气体体积流量。其他条件一定,在一定空速范围内,的转化率随空速的增大而减小,但甲醇的选择性增大,可能的原因是 。
Ⅲ.库仑测硫仪可以测定待测气体中的含量,其工作原理如下图所示。检测前,溶液中为一定值,电解池不工作。通入待检气体aL后,电解池开始工作,一段时间后停止。
(5)通入待测气体后发生反应: 。
(6)电解池开始工作时,阳极电极反应式: 。
(7)测得电解过程转移电子b mol,则待测气体中的含量为 g/L。
20.(本题10分)CO2的资源化利用和转化已成为当今科学研究的热点。回答下列问题:
(1)325℃时,水在锰粉表面产生的H2可将CO2转化成甲酸,同时生成MnO。
①由H2O、Mn、CO2制备甲酸的化学方程式为 。
②直接将H2和CO2混合,在325℃条件下难以生成甲酸,而在锰粉表面可以较快生成甲酸的原因是 。
(2)由CO2和H2制备甲醇(CH3OH)的反应原理如下:
反应I. (a>0)
反应I. (b>0)
反应Ⅲ. △H3
恒压下将CO2和H2按体积比1∶3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图所示。其中:CH3OH的选择性=。
①△H3= kJ mol-1,据此判断反应Ⅲ在 (填“低温”“高温”或“任意温度”)条件下有利于自发进行。
②在上述条件下,结合图像分析,合成甲醇的最佳温度是 ,最佳催化剂是 。
③温度高于230℃,使用CZT催化剂时CH3OH产率随温度升高而下降的原因是 。
(3)模拟在碱性环境中电催化还原CO2制乙烯(X、Y均为新型电极材料,可减少CO2和碱发生副反应)装置如图所示,装置中b电极为 (填“正”或“负”)极,X极上发生反应的电极反应式为 。
21.(本题10分)利喘贝是一种新的平喘药,其合成过程如下:
已知:
i.
ii.
(1)A属于芳香烃,则B的名称为 。
(2)D的官能团的名称是 ;D→E的反应类型是 。
(3)H与作用显色且能发生银镜反应,苯环上的一氯代物有两种。由H生成I反应的化学方程式为 。
(4)L的结构简式为 。
(5)比E少一个氧原子且含有苯环属于酰胺类的同分异构体有 种。
(6)J俗称香兰素,在食品行业中主要作为一种增香剂。香兰素的一种合成路线如下。
中间产物1和中间产物2的结构简式分别为 ; 。
题号 1 2 3 4 5 6 7 8 9 10
答案 D C A D C A A B B B
题号 11 12 13 14 15 16
答案 B B C C D B
17.(1) 加快反应速率,提高浸出率 、
(2) 反应时间过长导致被空气中的氧化成,加热促进水解生成沉淀
(3) 温度过高会导致受热分解
(4)1∶1
(5)
18.(1)或
(2)增大反应物的接触面积,加快反应速率,提高钒钼铅矿的浸出率
(3)+2S2-=+2PbS
(4)MgSiO3
(5)若Na2S过量,S2-会随着浸出液进入“沉钼”操作中,后与“沉钼”过程中加入的酸反应产生H2S气体污染环境
(6)
(7)
19.(1)24
(2)ab
(3)二甲醚选择性降低程度近似等于甲醇选择性升高程度
(4)空速增大,气体流速太快,反应气体与催化剂接触时间太短,导致气体与催化剂接触不充分;空速增大,反应②、③的速率降低太多,甲醇的选择性增大
(5)
(6)
(7)
20.(1) 该条件下,生成的H2与MnO反应生成Mn,因此Mn可以作为该反应的催化剂,降低活化能
(2) -(2a+b) 低温 230℃ CZ(Zr-1)T催化剂 温度升高,催化剂活性降低,反应I速率减慢
(3) 正
21.(1)邻硝基甲苯或2-硝基甲苯
(2) 酯基、硝基 还原反应
(3)
(4)
(5)5
(6)
同课章节目录
