湖南省岳阳市汨罗市第一中学2024-2025学年高三下学期4月月考 化学试题(含答案)
文档属性
| 名称 | 湖南省岳阳市汨罗市第一中学2024-2025学年高三下学期4月月考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 17:26:34 | ||
图片预览


文档简介
2025年高三下学期化学月考模拟试题
一、单选题(每题3分,共45分)
1.对于贵州这座城市的初印象,往往从地标建筑开始,不仅逼真地传递城市形象,也蕴藏着很多“黑科技”,下列说法正确的是
A.贵阳奥体中心场馆膜顶采用了耐腐蚀性能更好的PTFE(聚四氟乙烯)膜,该膜是一种合成有机高分子材料,也能使溴水褪色
B.石阡武陵山区崛起的新地标大顶山发电场,采用光伏发电技术绿色供电,这有利于实现低碳管理目标
C.黔南州平塘县的中国天眼FAST,制造大型抛物面天线的铝合金、玻璃钢均属于金属材料
D.铜仁大峡谷玻璃栈道依山势而造,是目前贵州最长的峡谷玻璃栈道,生产普通玻璃的主要原料是黏土和石灰石
2.已知反应,为阿伏加德罗常数的值。下列说法正确的是
A.的溶液中含有数目为
B.该反应中每生成转移电子数为
C.中含有孤电子对数目为
D.中含有的电子总数为
3.设为阿伏加德罗常数的值。下列说法正确的是
A.常温下,的溶液中,的数目为
B.常温常压下, 和混合气体中含有的氧原子数目为
C.电解精炼铜时,电路中每通过个电子时阳极溶解
D.重水比水多个质子
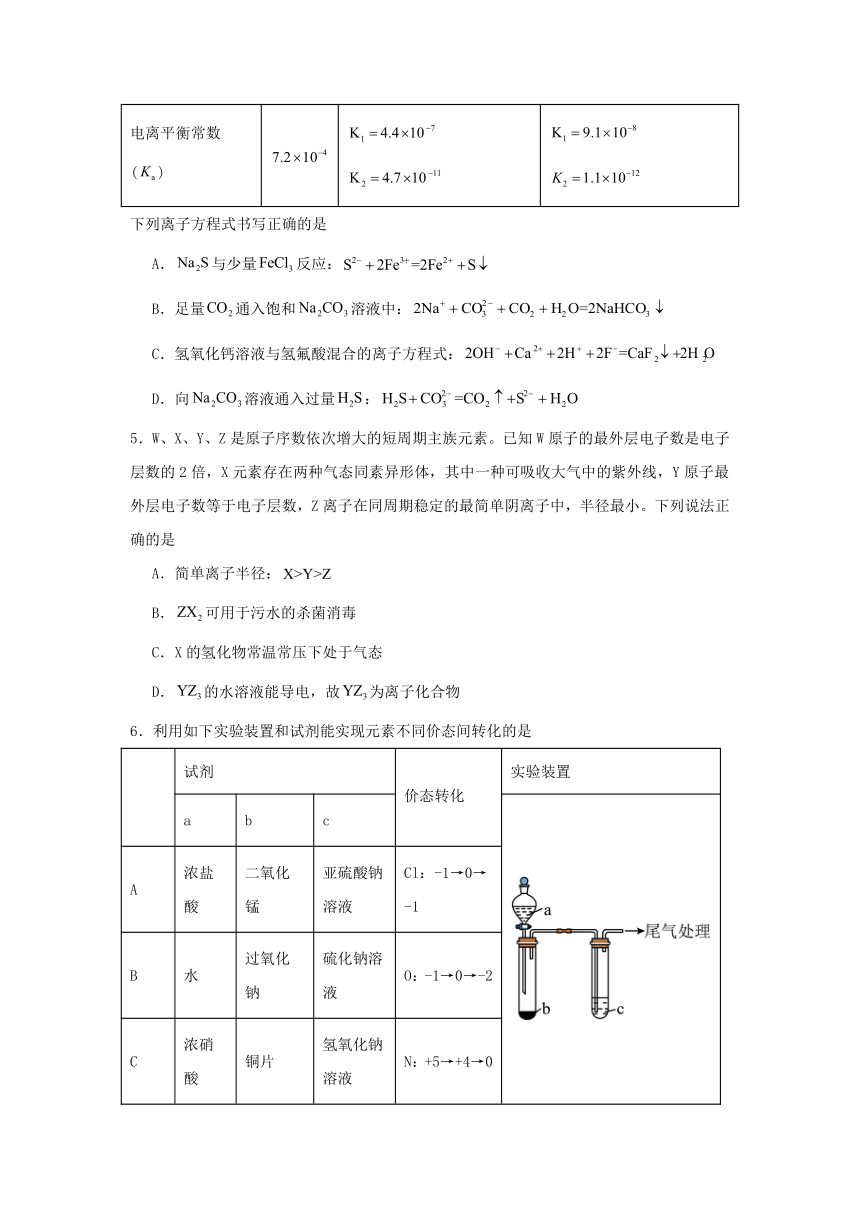
4.已知相关数据如下表:
化学式 HF
电离平衡常数()
下列离子方程式书写正确的是
A.与少量反应:
B.足量通入饱和溶液中:
C.氢氧化钙溶液与氢氟酸混合的离子方程式:
D.向溶液通入过量:
5.W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,X元素存在两种气态同素异形体,其中一种可吸收大气中的紫外线,Y原子最外层电子数等于电子层数,Z离子在同周期稳定的最简单阴离子中,半径最小。下列说法正确的是
A.简单离子半径:
B.可用于污水的杀菌消毒
C.X的氢化物常温常压下处于气态
D.的水溶液能导电,故为离子化合物
6.利用如下实验装置和试剂能实现元素不同价态间转化的是
试剂 价态转化 实验装置
a b c
A 浓盐酸 二氧化锰 亚硫酸钠溶液 Cl:-1→0→-1
B 水 过氧化钠 硫化钠溶液 O:-1→0→-2
C 浓硝酸 铜片 氢氧化钠溶液 N:+5→+4→0
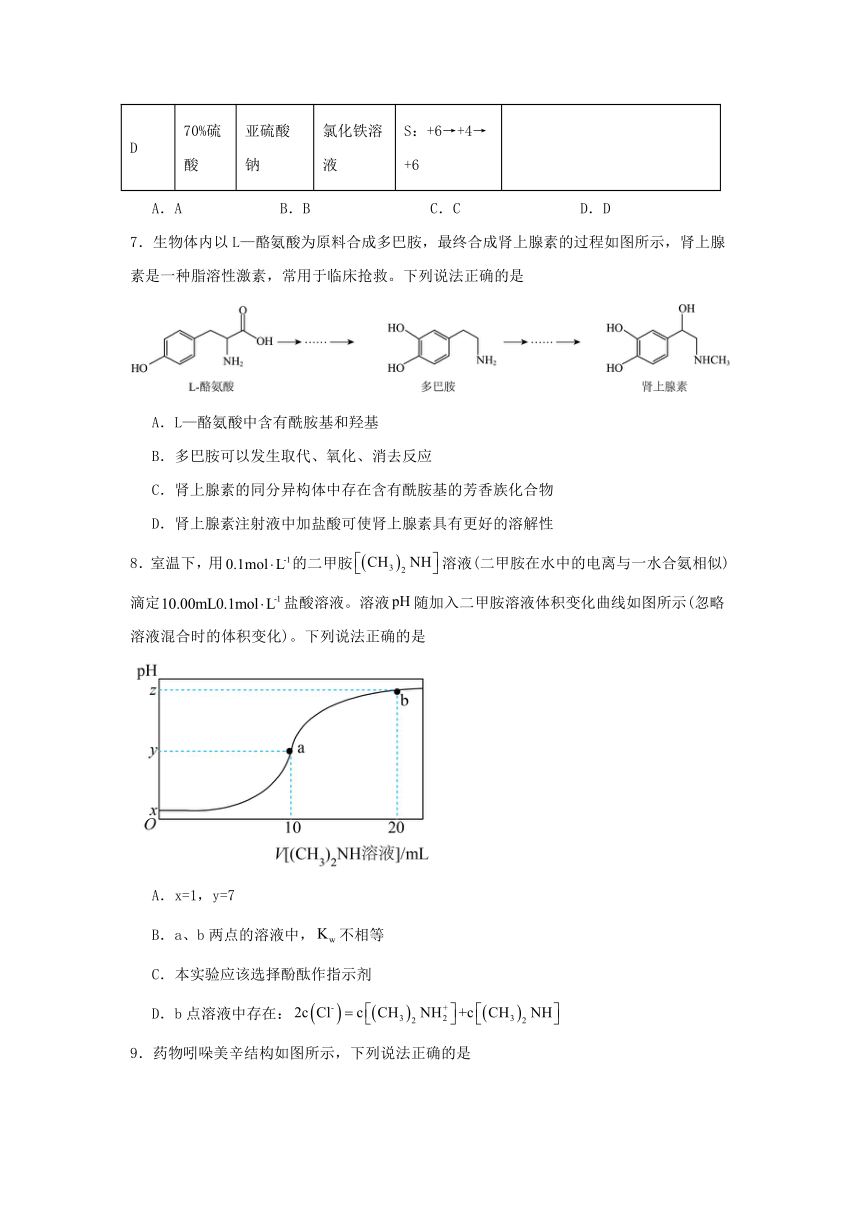
D 70%硫酸 亚硫酸钠 氯化铁溶液 S:+6→+4→+6
A.A B.B C.C D.D
7.生物体内以L—酪氨酸为原料合成多巴胺,最终合成肾上腺素的过程如图所示,肾上腺素是一种脂溶性激素,常用于临床抢救。下列说法正确的是
A.L—酪氨酸中含有酰胺基和羟基
B.多巴胺可以发生取代、氧化、消去反应
C.肾上腺素的同分异构体中存在含有酰胺基的芳香族化合物
D.肾上腺素注射液中加盐酸可使肾上腺素具有更好的溶解性
8.室温下,用的二甲胺溶液(二甲胺在水中的电离与一水合氨相似)滴定盐酸溶液。溶液随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
A.x=1,y=7
B.a、b两点的溶液中,不相等
C.本实验应该选择酚酞作指示剂
D.b点溶液中存在:
9.药物吲哚美辛结构如图所示,下列说法正确的是
A.分子式为
B.分子中所有碳原子均为杂化
C.分子中有种含氧官能团
D.该有机物能与过量反应,最多消耗
10.根据下列实验操作和现象,得出的相应结论正确的是
选项 实验操作 现象 结论
A 向两份等浓度、等体积的过氧化氢溶液中分别加入2滴等浓度的溶液和溶液 前者产生气泡较快 催化效率:
B 用pH试纸测定的和NaCl溶液的pH 前者的试纸颜色比后者深 非金属性:SC 向盛有2 mL鸡蛋清溶液的试管中加入5滴浓硝酸,加热 先有白色沉淀,加热后沉淀变黄 蛋白质能发生变性和显色反应
D 石蜡油加强热,将生成的气体通入的中 溶液由红棕色变成无色 气体中含有乙烯
A.A B.B C.C D.D
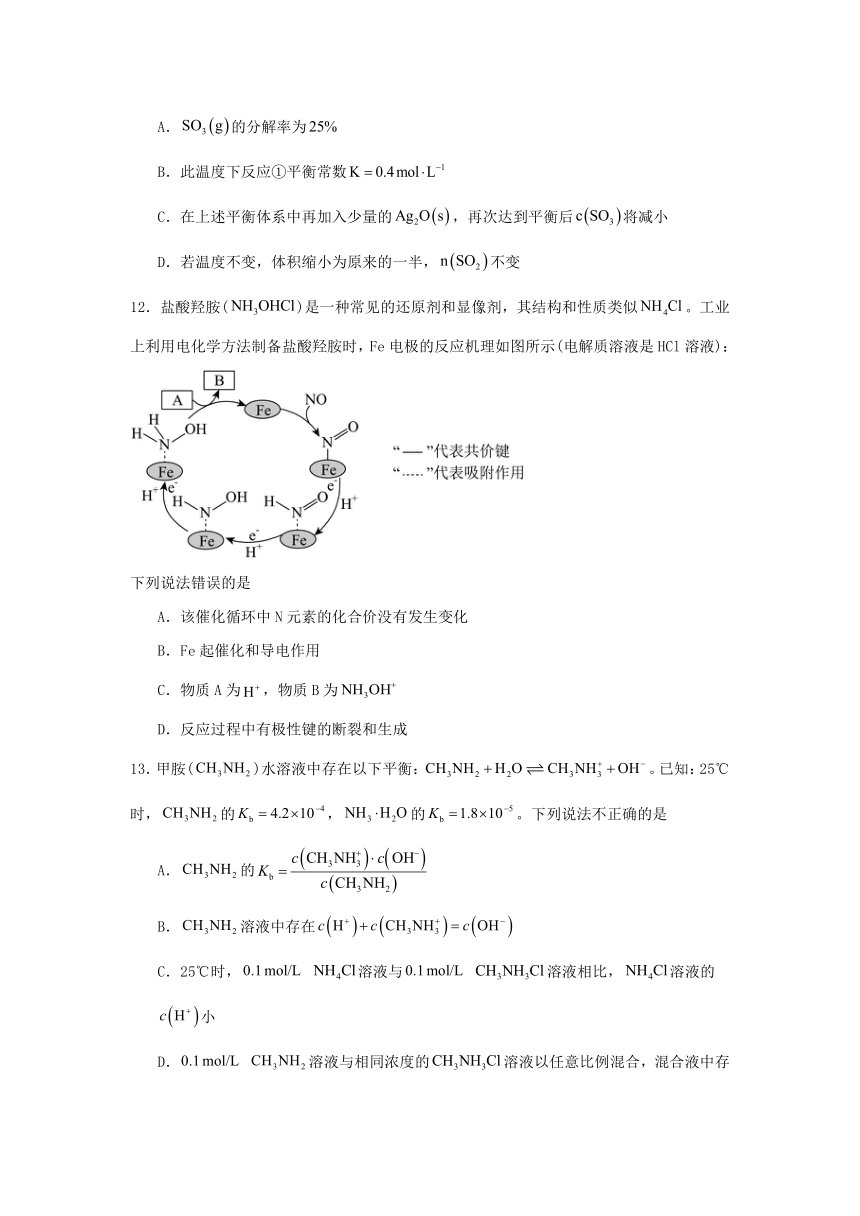
11.将一定量的固体置于容积不变的密闭容器中,在一定温度下加入催化剂后发生下列反应:①;②。反应经过后达到了平衡状态,测得,,下列说法正确的是
A.的分解率为
B.此温度下反应①平衡常数
C.在上述平衡体系中再加入少量的,再次达到平衡后将减小
D.若温度不变,体积缩小为原来的一半,不变
12.盐酸羟胺()是一种常见的还原剂和显像剂,其结构和性质类似。工业上利用电化学方法制备盐酸羟胺时,Fe电极的反应机理如图所示(电解质溶液是HCl溶液):
下列说法错误的是
A.该催化循环中N元素的化合价没有发生变化
B.Fe起催化和导电作用
C.物质A为,物质B为
D.反应过程中有极性键的断裂和生成
13.甲胺()水溶液中存在以下平衡:。已知:25℃时,的,的。下列说法不正确的是
A.的
B.溶液中存在
C.25℃时, 溶液与 溶液相比,溶液的小
D. 溶液与相同浓度的溶液以任意比例混合,混合液中存在
14.常温下,、分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断正确的是
A.
B.e点对应的含的分散系很稳定
C.加适量固体可使溶液由a点变到b点
D.c、d两点代表的溶液中与乘积相等
15.25℃时,向 溶液中不断通入气体(忽略溶液体积变化),浴液中、与的关系如图所示。下列说法不正确的是
A.该温度下,的
B.点所表示的溶液中:
C.向原溶液中不断通入 气体:
D.的溶液中:
二、解答题(共55分)
16.(本题12分)锰是生产各种合金的重要元素,工业上以菱锰矿(主要成分为,还含有铁、钴、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如图所示:
已知:①25℃时,部分金属离子开始沉淀与完全沉淀的如表所示:
金属离子
开始沉淀的
完全沉淀的
②25℃时,、、;
③“除铜”时,溶液中。
回答下列问题:
(1)菱锰矿经过富集、粉碎再进行酸浸,粉碎的目的是 ,“氧化”步骤发生反应的离子方程式为 。
(2)滤渣1的成分是 ,“除铜”时,当时,认为已完全沉淀,此时溶液中 (填“是”或“否”)开始沉淀。
(3)试剂是下列试剂中的一种,其中最合适的是 (填选项字母)。
A. B. C.
(4)“电解”时阴极上的电极反应式为 ,电解废液中有某种成分可循环应用,该成分是 (填化学式)。
17.(本题11分)铬酸铅[常温下,]又称铬黄,常用于染料或颜料,某同学在实验室以为原料制备,实验步骤如下:
步骤1:称取于的烧杯中,加入蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的的溶液;
步骤2:向上述溶液中逐滴滴入溶液,溶液由绿色变为黄色。加热煮沸,将多余的赶尽,此时溶液变为亮黄色。再逐滴滴入的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的为4.6;
步骤3:在煮沸条件下逐滴滴入的溶液,加入第一滴后先搅拌再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入溶液。继续煮沸,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬()在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在,为难溶于水的灰蓝色固体。回答下列问题:
(1)实验室在配制溶液时,下列仪器一定不需要的是___________(填字母)。
A. B. C. D.
(2)步骤1中加入稍微过量的的溶液过程中的现象是 ,溶液不能过量太多,其原因是 。
(3)步骤2溶液中逐滴滴入溶液,溶液由绿色变为黄色。发生反应的离子方程式为 。
(4)步骤2用硝酸调节,存在如下平衡:。已知随的变化如图所示。
①由图可知,溶液酸性增大,的平衡转化率 (填“增大”“减小”或“不变”)。
②升高温度,溶液中的平衡转化率减小,则该反应的 (填“>”或“<”)0。
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀
B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤
C.这种过滤方法可以避免沉淀堵塞滤纸小孔而影响过滤速度
D.该操作中玻璃棒的作用为引流
(6)对于步骤3,甲同学提出可用代替作为原料,乙同学认为难溶于水,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是 。
18.(本题10分)氢镍电池是目前使用最广的含镍电池,废旧电池的处理对环境保护和资源的再利用意义重大。一种对废旧氢镍电池负极材料(含有NiO、Ni和少量La、Fe、Mg、、等)进行湿法处理的流程如图1所示:
已知:①可形成;
②;
③第一步完全电离,。
回答下列问题:
(1)“酸浸”后浸渣的主要成分为 。
(2)若滤渣1的成分为,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图2所示。试分析pH<2.0时沉镧率降低的原因: 。
(3)“沉镁”后滤液3中c(F-)≥ mol/L(溶液中离子浓度≤1.0×10-5mol/L时认为该离子沉淀完全)。
(4)滤液3中锰以形式存在,中存在一个过氧键(—O—O—),“沉锰”反应的离子方程式为 。
(5)“沉镍”所用试剂不宜选用氨水的原因为 ;母液中可提取出的循环利用的物质为 (填化学式)。
(6)在一定条件下分解可得到NiO,其晶胞如图3所示。设阿伏加德罗常数的值为,距离最近的两个间距为a pm,NiO的摩尔质量为,则晶体的密度为 (列出计算式)。
19.(本题12分)硼(B)、钴()和锰()形成的物质在生产、生活中应用广泛。回答下列问题:
(1)基态原子核外电子排布式为 ,在第二周期中,第一电离能比N高的元素是 (填元素符号)。
(2)可用于织物漂白。的化学键除了共价键外,还存在 。
(3)工业制备中常用的催化剂,中阴离子的空间构型为 ;写出一种与其互为等电子体的分子式: 。
(4)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为 (以n表示硼原子的个数);
如图2表示的是一种五硼酸根离子,其中B原子的杂化方式为 。
(5)立方和立方均为共价晶体,结构相似,的熔点高于的原因是 。
(6)一种新型轻质储氢材料的晶胞结构如图所示,设阿伏加德罗常数的值为,该晶体的密度为 (用含a、的代数式表示)。
20.(本题10分)丹皮酚是从毛茛科植物牡丹的干燥根皮中提取出来的一种有效成分,具有镇痛、抗炎、解热的作用。有机物是丹皮酚的一种衍生物,其合成路线如图所示:
(1)中所含官能团的名称为 。
(2)的核磁共振氢谱的吸收峰有 组,的反应条件为 。
(3)的结构简式为 ,的反应类型为 。
(4)在的同分异构体中,同时满足下列条件的共有 种(不考虑立体异构)。
①与NaHCO3溶液反应放出CO2
②与FeCl3溶液反应显紫色
(5)根据上述合成路线,写出以苯和乙酸为主要原料(其他无机试剂任选),制备的合成路线 。
题号 1 2 3 4 5 6 7 8 9 10
答案 B B B B B B D D D C
题号 11 12 13 14 15
答案 B A C D B
16.(1) 增大接触面积,加快反应速率
(2) 、 否
(3)A
(4)
17.(1)AD
(2) 先出现灰蓝色沉淀,后沉淀溶解,得到绿色溶液 若加入过多,步骤2中需要过多的硝酸溶液调节pH
(3)
(4) 增大 <
(5)A
(6)由于存在溶解平衡:,悬浊液中有,煮沸条件下,与生成更难溶的,又因为生成的覆盖在表面,反应一段时间后会自动停止,故产量很低。
18.(1)
(2)与结合成而使的溶解平衡正向移动,降低沉镧率
(3)0.08
(4)
(5) 易形成配离子,即氨水用量不易控制
(6)
19.(1) 或 F、
(2)离子键、配位键
(3) 平面三角形 、BF3 (或其他合理答案)
(4) 或或 、
(5)B原子半径小于原子半径,键键长更短,键能更大
(6)
20.(1)氨基、羟基
(2) 5 Cu、O2、加热
(3) 还原反应
(4)13
(5)
一、单选题(每题3分,共45分)
1.对于贵州这座城市的初印象,往往从地标建筑开始,不仅逼真地传递城市形象,也蕴藏着很多“黑科技”,下列说法正确的是
A.贵阳奥体中心场馆膜顶采用了耐腐蚀性能更好的PTFE(聚四氟乙烯)膜,该膜是一种合成有机高分子材料,也能使溴水褪色
B.石阡武陵山区崛起的新地标大顶山发电场,采用光伏发电技术绿色供电,这有利于实现低碳管理目标
C.黔南州平塘县的中国天眼FAST,制造大型抛物面天线的铝合金、玻璃钢均属于金属材料
D.铜仁大峡谷玻璃栈道依山势而造,是目前贵州最长的峡谷玻璃栈道,生产普通玻璃的主要原料是黏土和石灰石
2.已知反应,为阿伏加德罗常数的值。下列说法正确的是
A.的溶液中含有数目为
B.该反应中每生成转移电子数为
C.中含有孤电子对数目为
D.中含有的电子总数为
3.设为阿伏加德罗常数的值。下列说法正确的是
A.常温下,的溶液中,的数目为
B.常温常压下, 和混合气体中含有的氧原子数目为
C.电解精炼铜时,电路中每通过个电子时阳极溶解
D.重水比水多个质子
4.已知相关数据如下表:
化学式 HF
电离平衡常数()
下列离子方程式书写正确的是
A.与少量反应:
B.足量通入饱和溶液中:
C.氢氧化钙溶液与氢氟酸混合的离子方程式:
D.向溶液通入过量:
5.W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,X元素存在两种气态同素异形体,其中一种可吸收大气中的紫外线,Y原子最外层电子数等于电子层数,Z离子在同周期稳定的最简单阴离子中,半径最小。下列说法正确的是
A.简单离子半径:
B.可用于污水的杀菌消毒
C.X的氢化物常温常压下处于气态
D.的水溶液能导电,故为离子化合物
6.利用如下实验装置和试剂能实现元素不同价态间转化的是
试剂 价态转化 实验装置
a b c
A 浓盐酸 二氧化锰 亚硫酸钠溶液 Cl:-1→0→-1
B 水 过氧化钠 硫化钠溶液 O:-1→0→-2
C 浓硝酸 铜片 氢氧化钠溶液 N:+5→+4→0
D 70%硫酸 亚硫酸钠 氯化铁溶液 S:+6→+4→+6
A.A B.B C.C D.D
7.生物体内以L—酪氨酸为原料合成多巴胺,最终合成肾上腺素的过程如图所示,肾上腺素是一种脂溶性激素,常用于临床抢救。下列说法正确的是
A.L—酪氨酸中含有酰胺基和羟基
B.多巴胺可以发生取代、氧化、消去反应
C.肾上腺素的同分异构体中存在含有酰胺基的芳香族化合物
D.肾上腺素注射液中加盐酸可使肾上腺素具有更好的溶解性
8.室温下,用的二甲胺溶液(二甲胺在水中的电离与一水合氨相似)滴定盐酸溶液。溶液随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
A.x=1,y=7
B.a、b两点的溶液中,不相等
C.本实验应该选择酚酞作指示剂
D.b点溶液中存在:
9.药物吲哚美辛结构如图所示,下列说法正确的是
A.分子式为
B.分子中所有碳原子均为杂化
C.分子中有种含氧官能团
D.该有机物能与过量反应,最多消耗
10.根据下列实验操作和现象,得出的相应结论正确的是
选项 实验操作 现象 结论
A 向两份等浓度、等体积的过氧化氢溶液中分别加入2滴等浓度的溶液和溶液 前者产生气泡较快 催化效率:
B 用pH试纸测定的和NaCl溶液的pH 前者的试纸颜色比后者深 非金属性:S
D 石蜡油加强热,将生成的气体通入的中 溶液由红棕色变成无色 气体中含有乙烯
A.A B.B C.C D.D
11.将一定量的固体置于容积不变的密闭容器中,在一定温度下加入催化剂后发生下列反应:①;②。反应经过后达到了平衡状态,测得,,下列说法正确的是
A.的分解率为
B.此温度下反应①平衡常数
C.在上述平衡体系中再加入少量的,再次达到平衡后将减小
D.若温度不变,体积缩小为原来的一半,不变
12.盐酸羟胺()是一种常见的还原剂和显像剂,其结构和性质类似。工业上利用电化学方法制备盐酸羟胺时,Fe电极的反应机理如图所示(电解质溶液是HCl溶液):
下列说法错误的是
A.该催化循环中N元素的化合价没有发生变化
B.Fe起催化和导电作用
C.物质A为,物质B为
D.反应过程中有极性键的断裂和生成
13.甲胺()水溶液中存在以下平衡:。已知:25℃时,的,的。下列说法不正确的是
A.的
B.溶液中存在
C.25℃时, 溶液与 溶液相比,溶液的小
D. 溶液与相同浓度的溶液以任意比例混合,混合液中存在
14.常温下,、分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断正确的是
A.
B.e点对应的含的分散系很稳定
C.加适量固体可使溶液由a点变到b点
D.c、d两点代表的溶液中与乘积相等
15.25℃时,向 溶液中不断通入气体(忽略溶液体积变化),浴液中、与的关系如图所示。下列说法不正确的是
A.该温度下,的
B.点所表示的溶液中:
C.向原溶液中不断通入 气体:
D.的溶液中:
二、解答题(共55分)
16.(本题12分)锰是生产各种合金的重要元素,工业上以菱锰矿(主要成分为,还含有铁、钴、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如图所示:
已知:①25℃时,部分金属离子开始沉淀与完全沉淀的如表所示:
金属离子
开始沉淀的
完全沉淀的
②25℃时,、、;
③“除铜”时,溶液中。
回答下列问题:
(1)菱锰矿经过富集、粉碎再进行酸浸,粉碎的目的是 ,“氧化”步骤发生反应的离子方程式为 。
(2)滤渣1的成分是 ,“除铜”时,当时,认为已完全沉淀,此时溶液中 (填“是”或“否”)开始沉淀。
(3)试剂是下列试剂中的一种,其中最合适的是 (填选项字母)。
A. B. C.
(4)“电解”时阴极上的电极反应式为 ,电解废液中有某种成分可循环应用,该成分是 (填化学式)。
17.(本题11分)铬酸铅[常温下,]又称铬黄,常用于染料或颜料,某同学在实验室以为原料制备,实验步骤如下:
步骤1:称取于的烧杯中,加入蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的的溶液;
步骤2:向上述溶液中逐滴滴入溶液,溶液由绿色变为黄色。加热煮沸,将多余的赶尽,此时溶液变为亮黄色。再逐滴滴入的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的为4.6;
步骤3:在煮沸条件下逐滴滴入的溶液,加入第一滴后先搅拌再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入溶液。继续煮沸,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬()在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在,为难溶于水的灰蓝色固体。回答下列问题:
(1)实验室在配制溶液时,下列仪器一定不需要的是___________(填字母)。
A. B. C. D.
(2)步骤1中加入稍微过量的的溶液过程中的现象是 ,溶液不能过量太多,其原因是 。
(3)步骤2溶液中逐滴滴入溶液,溶液由绿色变为黄色。发生反应的离子方程式为 。
(4)步骤2用硝酸调节,存在如下平衡:。已知随的变化如图所示。
①由图可知,溶液酸性增大,的平衡转化率 (填“增大”“减小”或“不变”)。
②升高温度,溶液中的平衡转化率减小,则该反应的 (填“>”或“<”)0。
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀
B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤
C.这种过滤方法可以避免沉淀堵塞滤纸小孔而影响过滤速度
D.该操作中玻璃棒的作用为引流
(6)对于步骤3,甲同学提出可用代替作为原料,乙同学认为难溶于水,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是 。
18.(本题10分)氢镍电池是目前使用最广的含镍电池,废旧电池的处理对环境保护和资源的再利用意义重大。一种对废旧氢镍电池负极材料(含有NiO、Ni和少量La、Fe、Mg、、等)进行湿法处理的流程如图1所示:
已知:①可形成;
②;
③第一步完全电离,。
回答下列问题:
(1)“酸浸”后浸渣的主要成分为 。
(2)若滤渣1的成分为,已知“沉镧”过程中溶液的pH与沉镧率的变化关系如图2所示。试分析pH<2.0时沉镧率降低的原因: 。
(3)“沉镁”后滤液3中c(F-)≥ mol/L(溶液中离子浓度≤1.0×10-5mol/L时认为该离子沉淀完全)。
(4)滤液3中锰以形式存在,中存在一个过氧键(—O—O—),“沉锰”反应的离子方程式为 。
(5)“沉镍”所用试剂不宜选用氨水的原因为 ;母液中可提取出的循环利用的物质为 (填化学式)。
(6)在一定条件下分解可得到NiO,其晶胞如图3所示。设阿伏加德罗常数的值为,距离最近的两个间距为a pm,NiO的摩尔质量为,则晶体的密度为 (列出计算式)。
19.(本题12分)硼(B)、钴()和锰()形成的物质在生产、生活中应用广泛。回答下列问题:
(1)基态原子核外电子排布式为 ,在第二周期中,第一电离能比N高的元素是 (填元素符号)。
(2)可用于织物漂白。的化学键除了共价键外,还存在 。
(3)工业制备中常用的催化剂,中阴离子的空间构型为 ;写出一种与其互为等电子体的分子式: 。
(4)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为 (以n表示硼原子的个数);
如图2表示的是一种五硼酸根离子,其中B原子的杂化方式为 。
(5)立方和立方均为共价晶体,结构相似,的熔点高于的原因是 。
(6)一种新型轻质储氢材料的晶胞结构如图所示,设阿伏加德罗常数的值为,该晶体的密度为 (用含a、的代数式表示)。
20.(本题10分)丹皮酚是从毛茛科植物牡丹的干燥根皮中提取出来的一种有效成分,具有镇痛、抗炎、解热的作用。有机物是丹皮酚的一种衍生物,其合成路线如图所示:
(1)中所含官能团的名称为 。
(2)的核磁共振氢谱的吸收峰有 组,的反应条件为 。
(3)的结构简式为 ,的反应类型为 。
(4)在的同分异构体中,同时满足下列条件的共有 种(不考虑立体异构)。
①与NaHCO3溶液反应放出CO2
②与FeCl3溶液反应显紫色
(5)根据上述合成路线,写出以苯和乙酸为主要原料(其他无机试剂任选),制备的合成路线 。
题号 1 2 3 4 5 6 7 8 9 10
答案 B B B B B B D D D C
题号 11 12 13 14 15
答案 B A C D B
16.(1) 增大接触面积,加快反应速率
(2) 、 否
(3)A
(4)
17.(1)AD
(2) 先出现灰蓝色沉淀,后沉淀溶解,得到绿色溶液 若加入过多,步骤2中需要过多的硝酸溶液调节pH
(3)
(4) 增大 <
(5)A
(6)由于存在溶解平衡:,悬浊液中有,煮沸条件下,与生成更难溶的,又因为生成的覆盖在表面,反应一段时间后会自动停止,故产量很低。
18.(1)
(2)与结合成而使的溶解平衡正向移动,降低沉镧率
(3)0.08
(4)
(5) 易形成配离子,即氨水用量不易控制
(6)
19.(1) 或 F、
(2)离子键、配位键
(3) 平面三角形 、BF3 (或其他合理答案)
(4) 或或 、
(5)B原子半径小于原子半径,键键长更短,键能更大
(6)
20.(1)氨基、羟基
(2) 5 Cu、O2、加热
(3) 还原反应
(4)13
(5)
同课章节目录
