江苏省海安中学、金陵中学、宿迁中学三校2024-2025学年高三年级下学期4月联考测试 化学试卷(含答案)
文档属性
| 名称 | 江苏省海安中学、金陵中学、宿迁中学三校2024-2025学年高三年级下学期4月联考测试 化学试卷(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 714.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 17:32:27 | ||
图片预览




文档简介
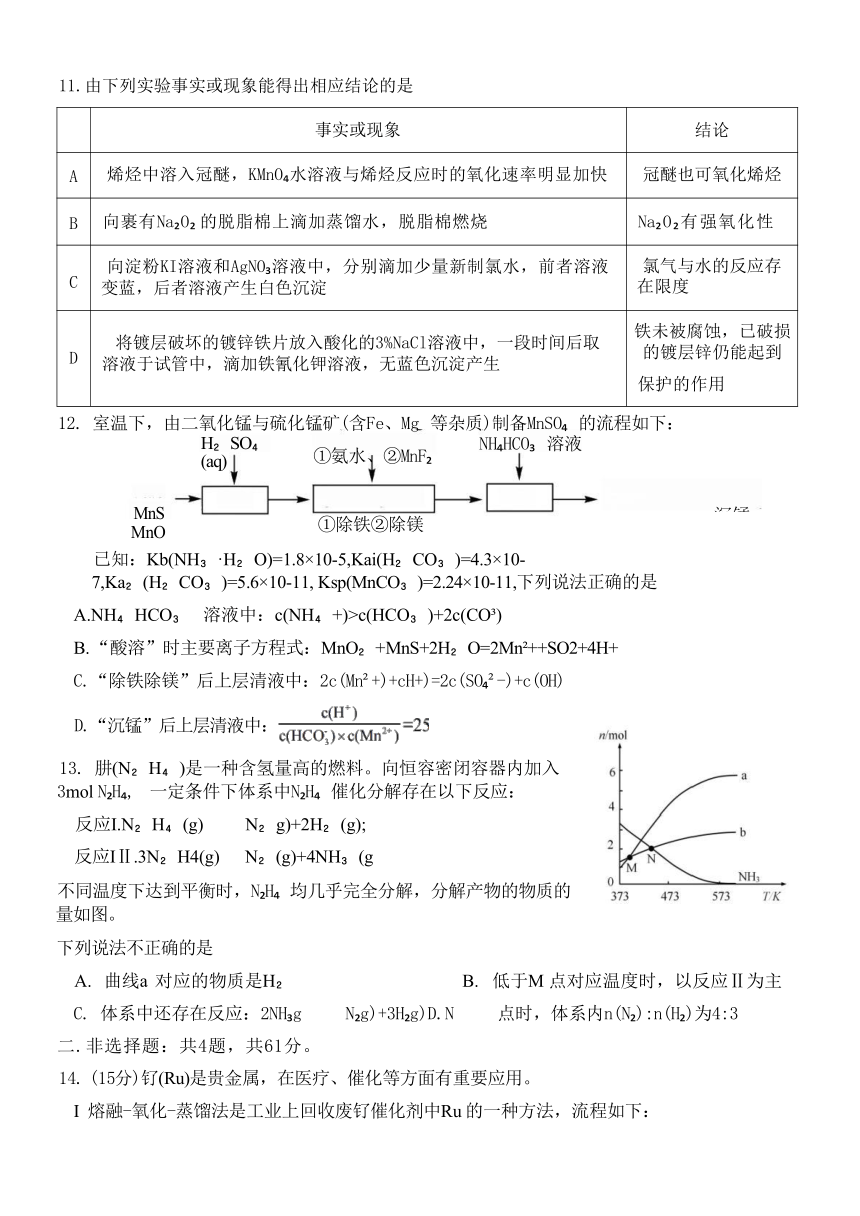
2025届高三年级4月份化学测试试卷
注意:本试卷共3页,满分为100分,考试时间75分钟。
可能用到的相对原子质量:H1 C12 N14016 Au197 S32 Cl35.5 Zn 65
一 .单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. 科技发展与化学密切相关。下列说法正确的是
A. 为卫星工作提供能量的是砷化镓太阳能电池板,砷化镓有良好的导电性
B. 光导纤维由高纯二氧化硅制成,能有效提高通信效率
C. 富勒烯用于制造高温超导材料的原料,其原料C60 、C 0等为共价晶体
D. 海水原位电解制氢技术的关键材料多孔聚四氟乙烯,其单体属于不饱和烃
2.BCl 水解反应方程式为:BCl +3H O=H BO +3HCl, 下列说法不正确的是
A.BCl 的电子式为: B.H O 的空间填充模型为
c.Cl 的原子结构示意图为+7387 D.H BO 能形成分子间氢键
3.实验室制取乙烯并验证其化学性质,下列装置或操作不正确的是
(
温度计
浓硫酸
沸石
无水乙醇
) NaOH溶液 Br 的CCl 溶液
A.制备乙烯 B.除去杂质 C.验证加成反应 D.收集乙烯
阅读下面材料,完成4~6题。
离子晶体的熔点,有的很高,如CaO 的熔点为2613℃;有的较低,如NH NO 、Ca(H PO4)2
的熔点分别为170℃、109℃。早在1914年就有人发现,引入有机基团可降低离子化合物的熔点, 如C H NH NO 的熔点只有12℃。大多数离子液体含有体积很大的阴、阳离子,常见的阴离子如 四氟铝酸根AlF4-、六氟磷酸根PF 、 四氟硼酸根BF - 等;常见的阳离子如季铵离子(R N+, 即 NH +
的H 被烃基R 取代)、带烃基侧链的咪唑 等有环状含氮结构的有机胺正离子等。 1-丁基-3-甲基咪唑六氟磷酸盐是常见的离子液体,其结构如图所示:
4. 下列说法不正确的是
A. 键角:NHC. 电负性: x(F)>x(P) D. 极性: BF 5. 有关1-丁基-3-甲基咪唑六氟磷酸盐的结构或性质,下列叙述正确的是
A. 已知咪唑环上所有原子共平面,则N 原子的杂化方式为sp 、sp B.1- 丁基-3-甲基咪唑六氟磷酸盐中存在配位键、离子键、共价键
C.1- 丁基-3-甲基咪唑六氟磷酸盐在水中的溶解度比在苯中小
D.PF - 的空间结构为正六面体
6. 下列有关离子液体的叙述,不正确的是
A. 咪唑有较强的碱性,一般通过2号氮原子体现
B. 四氟合硼酸四甲基铵[(CH )4N+BF -]的熔点小于四氟合铝酸四甲基铵[(CH ) N*AlF -]
C. 离子液体在常温下呈液体,是因为其阴、阳离子的体积大,离子键强度小
D. 离子液体熔点低,但难挥发,且具有良好的导电性,可用作原电池的电解质
7.铁的单质及许多化合物均具有重要用途。碱性条件下KCIO 氧化性大于K FeO ,K FeO 在水中 不稳定,会生成Fe(OH) 胶体。下列有关铁及其化合物的相关转化,在指定条件下能实现的是
8. 一定条件下,酸性KMnO 溶液与H C O 发生反应,Mn(II)起催化作用,过程中不同价态含Mn 粒子的浓度随时间变化如下图所示。下列说法正确的是
时间/min
A.Mn(III)不能氧化H C O
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下,Mn(II)和Mn(VII)不能大量共存
D. 总反应为:2MnO +5C O -+16H+==2Mn ++10CO ↑+8H O
9. 有机物M 在碱性条件下可发生的反应如右图所示。下列说法正确的是
A.M 分子中酮羰基邻位甲基的C-H 键极性 较弱,易断键
B.1mol N 最多与2mol H 发生加成反应
C.N 分子中含有3个手性碳原子
D. 该条件下还可能生成 10. 葡萄糖与NaClO 反应可制备自来水消毒剂ClO2。
反应方程式为:C H O +H SO +NaClO →CIO 个+CO 个+Na SO4+H O (未配平)。 下列说法不正确的是
A. 上述反应的△S>0
B.ClO 替换Cl 用于自来水消毒,能有效减少自来水中的残留氯
C. 上述反应中,还原剂与氧化剂的物质的量之比为1:6
D. 上述反应中,每生成1mol ClO 气体,转移电子数为6.02×10 3
11.由下列实验事实或现象能得出相应结论的是
事实或现象 结论
A 烯烃中溶入冠醚,KMnO 水溶液与烯烃反应时的氧化速率明显加快 冠醚也可氧化烯烃
B 向裹有Na O 的脱脂棉上滴加蒸馏水,脱脂棉燃烧 Na O 有强氧化性
C 向淀粉KI溶液和AgNO 溶液中,分别滴加少量新制氯水,前者溶液 变蓝,后者溶液产生白色沉淀 氯气与水的反应存 在限度
D 将镀层破坏的镀锌铁片放入酸化的3%NaCl溶液中,一段时间后取 溶液于试管中,滴加铁氰化钾溶液,无蓝色沉淀产生 铁未被腐蚀,已破损 的镀层锌仍能起到 保护的作用
(
H SO (aq)
酸溶
) (
NH
HCO
溶液
沉锰
MncO H SOMnSO
)12. 室温下,由二氧化锰与硫化锰矿(含Fe、Mg 等杂质)制备MnSO 的流程如下:
①氨水、②MnF
(
MnS
MnO
)
①除铁②除镁
已知:Kb(NH ·H O)=1.8×10-5,Kai(H CO )=4.3×10-7,Ka (H CO )=5.6×10-11, Ksp(MnCO )=2.24×10-11,下列说法正确的是
A.NH HCO 溶液中:c(NH +)>c(HCO )+2c(CO )
B. “酸溶”时主要离子方程式:MnO +MnS+2H O=2Mn ++SO2+4H+
C.“除铁除镁”后上层清液中:2c(Mn +)+cH+)=2c(SO -)+c(OH)
D.“沉锰”后上层清液中:
13. 肼(N H )是一种含氢量高的燃料。向恒容密闭容器内加入3mol N H , 一定条件下体系中N H 催化分解存在以下反应:
反应I.N H (g) N g)+2H (g);
反应IⅡ.3N H4(g) N (g)+4NH (g
不同温度下达到平衡时,N H 均几乎完全分解,分解产物的物质的 量如图。
下列说法不正确的是
A. 曲线a 对应的物质是H B. 低于M 点对应温度时,以反应Ⅱ为主
C. 体系中还存在反应:2NH g N g)+3H g)D.N 点时,体系内n(N ):n(H )为4:3
二.非选择题:共4题,共61分。
14. (15分)钌(Ru)是贵金属,在医疗、催化等方面有重要应用。
I 熔融-氧化-蒸馏法是工业上回收废钌催化剂中Ru 的一种方法,流程如下:
(
RuCl
操作A
RuCl ·3H O
溶液
晶体
废钌
催化剂
KOH
KNO
NaCIO
、硫酸
减压蒸馏
RuO
浓盐酸
蒸气
焙烧
650℃
碱熔渣
H
Ru
)
已知:RuO 易挥发,加热时容易分解成RuO 和O 。
(1)“焙烧”时废钌催化剂中 RuO 转化为K RuO4 并生成无污染的气体,该反应的化学方程式为_ ▲ 。
(
1
0
0
80
60
0
)(2)如题14图-1所示,蒸馏温度高于80°℃时,RuO 蒸馏收率随着 温度的升高而降低,可能的原因是 ▲ 。
(3)氧化-蒸馏时选用硫酸酸化而非盐酸,原因是 ▲ 。
(
0
60
)(4)浓盐酸吸收RuO 蒸气并生成Cl 的离子方程式为 ▲ 。 Ⅱ交替电解法可剥落旧电极表面的RuO 催化涂层。
(
70
80
90
100
温度℃
题14图-1
)已知:i. 电解时会生成Ru 、RuO 和 RuO , 新生成的含钌物质在 电极上的附着力弱。
ii.电解一段时间后,惰性阳极可能被部分氧化,导电能力降低。
(5)交替电解装置如题14图-1所示,每隔5~6分钟改变 一次电流方向。电解时两电极上均有少量气泡产生。刚 通电时,阳极的电极反应式为 ▲ 、 ▲ 。
(6)用交替电解法剥落RuO 涂层的效率较高,可能的原 因有 ▲ (填序号)。
a. 含钌物质可同时从a、b 两电极上脱落
b. 阴极上,全部电子均用于还原RuO
c. 电流变向后,部分氧化的阳极被还原,电阻减小
(
o
电
源
含
RuO,
涂
层的惰性
电极
b
H SO
溶液
含
RuO,
涂
层的惰性
电极
a
)
题14图-2
(
15.
(15分)沙美特罗是一种良好的抗哮喘药物
,其合成路线如下(部分反应条件和溶剂省略):
E
F
)
(1)A→B 的反应中经过A→X→B 的过程,A→X 的反应类型为 ▲ 。A→B的反应可生成分子 式为 C1oH OCl 的副产物Y,Y 的结构简式为 ▲ 。
(2)D 分子中的官能团为酯基、酮羰基、 ▲ 。
(3)已知:KBr 晶体中的离子键成分大于KI 。G→H 的反应中使用丙酮作溶剂,可促进反应 C Hs(CH )4O(CH ) Br+KI→C Hs(CH )4O(CH ) I+KBr 正向进行,原因是 ▲ 。
(4)写出同时满足下列条件的D 的一种同分异构体的结构简式: ▲ 。
酸性条件下水解后,生成X 和 Y 两种有机产物;X 分子属于芳香族化合物且能发生银镜反应; Y 分子含有一个手性碳原子;两种分子均含有3种化学环境不同的氢。
(5)已知:。写出 为原料制备
的合成路线流程图_ ▲ 。
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16. (16分)金溶胶在肿瘤治疗、生物成像等领域有着非常重要的应用价值。实验室制备过程如下:
(1)制备氯金酸溶液:制备装置如题16图-1所示(夹持、加热装置已省略),先向三颈烧瓶的金粉 中加入一定量的H O 溶液,保持装置C 的温度为40℃;再持续通入HCl, 一段时间后得到金黄色
氯金酸(HAuCl 强酸)溶液。
题16图-1
题16图-2
①装置A 中,试剂1、2分别为“浓盐酸”和“浓硫酸”,仪器a 的名称为 ▲ ,所装试剂1 为 △ 。
②装置A 中,毛细管的作用是_ ▲ 。
③装置C 中发生反应的离子方程式为 △ 。
④不采用向C 中直接加浓盐酸,而是持续通入 HCl 的目的是 ▲ 。
(2)制备金溶胶
已知:I.不同尺寸金颗粒制备条件
平均尺寸 0.01%HAuCl 1%柠檬酸钠 0.075%NaBH 反应温度
5nm 100mL 1.0mL 0.6mL 25℃
25nm 100mL 3.2mL 1.6mL 100℃
45nm 100mL 2.0mL 1.6mL 100℃
Ⅱ.硼氢化钠具有较强还原性,与水可发生较缓慢的反应释放出氢气。
Ⅲ.柠檬酸钠是一种稳定剂,控制金颗粒的尺寸和形状,不参与氯金酸的还原。
①制备金溶胶的实验装置如题16图-2所示,硼氢化钠还原氯金酸时仅生成一种单质,同时有 H BO3 生成,写出化学方程式_ △ 。
②补充完整制备25nm 金溶胶的实验方案:室温下向三颈烧瓶A 中加入100.0mL 0.01%氯金酸 溶液_ ▲ ,蒸馏水洗涤产品,将制得的金颗粒分散在蒸馏水中,即得到酒红色的金溶胶。
[实验中须使用的试剂和设备:1%柠檬酸钠溶液,0.075%硼氢化钠溶液,NaOH 溶液,离心分离机]
17. (15分)甲醇是实现碳中和的重要载体。通过甲醇的催化重整可以获得氢能,还可以获得其他化 工产品。
(1)一种利用等离子体和双金属催化剂xZnO ·yZrO 催化CO 和 H O 反应生成CH OH 的反应机理 如如题17图-1所示;Zr 的常见化合价有+2、+3和+4,过程中Zr 的化合价发生变化。
已知:图中 的Ⅲ 表示ZnO,| 表示ZrO , 四表示氧空位;“一”表示化学键,“---”表示 吸附作用。
①步骤(iv)中 ,Zr 元素化合价变化为 ▲ 。
②增大反应电流,等离子体会释放出数量更多、能量更大的带负电的高能粒子。随着反应电流的 增加,CH OH 的产量增大。等离子体在反应中的作用是_ ▲ 。
(2)CH OH 与H O 催化重整制氢反应为:
主反应I: CH OH(g)+H O(g) 一 CO (g)+3H (g)
副反应IⅡ:H (g)+CO (g) CO(g)+H O(g)
△H =49.5kJ mol-
△H =41.2 kJ mol-
温度在300℃以上, CH OH 可裂解制氢:CH OH(g) 一 CO(g)+2H (g) △H
CH OH 与 H O 催化重整制氢气的体系中,平衡时甲醇的转化率、CO 物质的量分数与反应温度 (T) 以及初始加入的水醇比(SM) 的关系如题17图-2所示。如:曲线M 表示甲醇的平衡转化率均 为80%时,所对应的反应温度以及初始加入的水醇比(S/M)。
①AH = ▲
②其他条件相同,图示温度范围内,随着温度升高,平衡体系中CO 的物质的量分数增大,其可
能原因是 ▲ 。
(
-
M
) (
0.5%
) (
1.80k
1.60.
1.40
60%,
1.20
1.00
200
)——平衡时CH OH 的转化率
(
80%
)99.9% 1%
-----平衡时CO的
(
3%
)物质的量的分数
(
250
)300
T/℃
题17图-2
③氢能源汽车对氢气中的CO 有严格的要求,CO 平衡物质的量分数必须小于0.5%。催化重整制 氢气用于汽车时,减少CO 平衡物质的量分数的方法有 △ 。
A. 升温 B. 增大水醇比 C. 加少量CaO D. 应I选择性更高的催化剂
(3)工业上以CH OH 作反应物和溶剂,电解碳酸1,2-丙二酯 、甲乙基碘化铵(TEAI, 提
I:10 mL CH OH+0.117mol-L- 碳酸1,2-丙二酯+0.1 mol·L- TEAI, 蒸 馏 ,DMC 产率7 . 5%;
IⅡ:10mL CH OH+0.117mol-L- 碳酸1,2-丙二酯+0.1 mol-L- TEAI 为阴极液,Cu 为阴极、石墨
为阳极。通电后,阴极区DMC 产率为82 . 3%,并产生H 。
电催化酯交换法合成碳酸一甲酯的机理如题17图-3.
(
题17图-3
)①X 的结构简式为 △ 。
②实验I 中 DMC 产率较低的可能原因为 o
高三化学参考答案
选择题:BADAB BCCDC DAD
14. (15分)
(1 (物质2分,配平条件1分,共3分)
(2)RuO 受热易分解(1分),生成HCIO 受热分解(1分) ( 共 2 分 )
(3)盐酸可还原NaCIO 及K RuO4, 降低产率(1分),生成Cl 污染环境(1分) ( 共 2 分 )
(4)2RuO +16H++10Cl-=2Ru ++5Cl ↑+8H O (物质1分,配平1分,共2分)
(5)2H O-4e-=O ↑+4H+(2
(6)ac
15. (15分)
(1)加成反应(2分)
(2)碳溴键
(3)丙酮是非极性分子,KBr
分 )RuO -4e-+2H O=RuO +4H+ (2 分,共4分)
(2分 写一个1分,有错0分)
(2分) (共4分)
( 1 分 )
难溶于丙酮,会从丙酮中沉淀出来,从而促进反应正向进行。
(2分)
(3分)
(5分)
16. (16分)
(1)①恒压滴液漏斗(1分) 浓盐酸(1分) (共2分)
②控制盐酸滴加速率,使溶液充分混合,避免混合时剧烈放热 (2分)
(物质1分配平条件1分 共 2 分 )
④持续向C 中通入HCl, 可以保持盐酸浓度较高,促进金粉反应。 (2分)
(2)①3NaBH +8HAuCl +9H O=8Au+3H BO +29HCl+3NaCl
(物质2分,配平1分,共3分)
②加入3.2mL1% 柠檬酸钠溶液(1分),加热至100℃(1分),边搅拌边缓慢加入1.6mL 0.075%硼氢化钠溶液(1分),充分反应体系变为酒红色(1分),用离心分离机分离出Au(1 分),将产生的气体通入NaOH 溶液中(1分)。
(先加热也可以;温度不对熔断,加入顺序错误熔断;柠檬酸钠体积错误熔断;没有缓 慢滴加表达扣1分不熔断;无终点现象扣1分不熔断。 共5分)
17. (15分)
(1)①+4价变为+3价 (2分)
②还原水分子生成H 原子(1分);使催化剂中的ZrO 表面形成氧空位(1分,共2分)
(2)①90.7kJ·mol- (2分单位1分)
②反应I和反应Ⅱ均吸热(1分),随着温度升高,反应I和反应Ⅱ的平衡正向进行程度均 增大(1分),且温度升高对反应Ⅱ的影响大于对反应I的影响(1分)。(答成“反应Ⅲ的 平衡正向移动,CO 的物质的量分数增大”得0分) (共3分)
③BC (2分写一个1分,有错0分)
(3)①CH O- ( 2 分 )
②甲醇中甲基为推电子基团,使H-O 极性弱(1分),难断键提供CH O-(1 分)。(共2分)
注意:本试卷共3页,满分为100分,考试时间75分钟。
可能用到的相对原子质量:H1 C12 N14016 Au197 S32 Cl35.5 Zn 65
一 .单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. 科技发展与化学密切相关。下列说法正确的是
A. 为卫星工作提供能量的是砷化镓太阳能电池板,砷化镓有良好的导电性
B. 光导纤维由高纯二氧化硅制成,能有效提高通信效率
C. 富勒烯用于制造高温超导材料的原料,其原料C60 、C 0等为共价晶体
D. 海水原位电解制氢技术的关键材料多孔聚四氟乙烯,其单体属于不饱和烃
2.BCl 水解反应方程式为:BCl +3H O=H BO +3HCl, 下列说法不正确的是
A.BCl 的电子式为: B.H O 的空间填充模型为
c.Cl 的原子结构示意图为+7387 D.H BO 能形成分子间氢键
3.实验室制取乙烯并验证其化学性质,下列装置或操作不正确的是
(
温度计
浓硫酸
沸石
无水乙醇
) NaOH溶液 Br 的CCl 溶液
A.制备乙烯 B.除去杂质 C.验证加成反应 D.收集乙烯
阅读下面材料,完成4~6题。
离子晶体的熔点,有的很高,如CaO 的熔点为2613℃;有的较低,如NH NO 、Ca(H PO4)2
的熔点分别为170℃、109℃。早在1914年就有人发现,引入有机基团可降低离子化合物的熔点, 如C H NH NO 的熔点只有12℃。大多数离子液体含有体积很大的阴、阳离子,常见的阴离子如 四氟铝酸根AlF4-、六氟磷酸根PF 、 四氟硼酸根BF - 等;常见的阳离子如季铵离子(R N+, 即 NH +
的H 被烃基R 取代)、带烃基侧链的咪唑 等有环状含氮结构的有机胺正离子等。 1-丁基-3-甲基咪唑六氟磷酸盐是常见的离子液体,其结构如图所示:
4. 下列说法不正确的是
A. 键角:NH
A. 已知咪唑环上所有原子共平面,则N 原子的杂化方式为sp 、sp B.1- 丁基-3-甲基咪唑六氟磷酸盐中存在配位键、离子键、共价键
C.1- 丁基-3-甲基咪唑六氟磷酸盐在水中的溶解度比在苯中小
D.PF - 的空间结构为正六面体
6. 下列有关离子液体的叙述,不正确的是
A. 咪唑有较强的碱性,一般通过2号氮原子体现
B. 四氟合硼酸四甲基铵[(CH )4N+BF -]的熔点小于四氟合铝酸四甲基铵[(CH ) N*AlF -]
C. 离子液体在常温下呈液体,是因为其阴、阳离子的体积大,离子键强度小
D. 离子液体熔点低,但难挥发,且具有良好的导电性,可用作原电池的电解质
7.铁的单质及许多化合物均具有重要用途。碱性条件下KCIO 氧化性大于K FeO ,K FeO 在水中 不稳定,会生成Fe(OH) 胶体。下列有关铁及其化合物的相关转化,在指定条件下能实现的是
8. 一定条件下,酸性KMnO 溶液与H C O 发生反应,Mn(II)起催化作用,过程中不同价态含Mn 粒子的浓度随时间变化如下图所示。下列说法正确的是
时间/min
A.Mn(III)不能氧化H C O
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下,Mn(II)和Mn(VII)不能大量共存
D. 总反应为:2MnO +5C O -+16H+==2Mn ++10CO ↑+8H O
9. 有机物M 在碱性条件下可发生的反应如右图所示。下列说法正确的是
A.M 分子中酮羰基邻位甲基的C-H 键极性 较弱,易断键
B.1mol N 最多与2mol H 发生加成反应
C.N 分子中含有3个手性碳原子
D. 该条件下还可能生成 10. 葡萄糖与NaClO 反应可制备自来水消毒剂ClO2。
反应方程式为:C H O +H SO +NaClO →CIO 个+CO 个+Na SO4+H O (未配平)。 下列说法不正确的是
A. 上述反应的△S>0
B.ClO 替换Cl 用于自来水消毒,能有效减少自来水中的残留氯
C. 上述反应中,还原剂与氧化剂的物质的量之比为1:6
D. 上述反应中,每生成1mol ClO 气体,转移电子数为6.02×10 3
11.由下列实验事实或现象能得出相应结论的是
事实或现象 结论
A 烯烃中溶入冠醚,KMnO 水溶液与烯烃反应时的氧化速率明显加快 冠醚也可氧化烯烃
B 向裹有Na O 的脱脂棉上滴加蒸馏水,脱脂棉燃烧 Na O 有强氧化性
C 向淀粉KI溶液和AgNO 溶液中,分别滴加少量新制氯水,前者溶液 变蓝,后者溶液产生白色沉淀 氯气与水的反应存 在限度
D 将镀层破坏的镀锌铁片放入酸化的3%NaCl溶液中,一段时间后取 溶液于试管中,滴加铁氰化钾溶液,无蓝色沉淀产生 铁未被腐蚀,已破损 的镀层锌仍能起到 保护的作用
(
H SO (aq)
酸溶
) (
NH
HCO
溶液
沉锰
MncO H SOMnSO
)12. 室温下,由二氧化锰与硫化锰矿(含Fe、Mg 等杂质)制备MnSO 的流程如下:
①氨水、②MnF
(
MnS
MnO
)
①除铁②除镁
已知:Kb(NH ·H O)=1.8×10-5,Kai(H CO )=4.3×10-7,Ka (H CO )=5.6×10-11, Ksp(MnCO )=2.24×10-11,下列说法正确的是
A.NH HCO 溶液中:c(NH +)>c(HCO )+2c(CO )
B. “酸溶”时主要离子方程式:MnO +MnS+2H O=2Mn ++SO2+4H+
C.“除铁除镁”后上层清液中:2c(Mn +)+cH+)=2c(SO -)+c(OH)
D.“沉锰”后上层清液中:
13. 肼(N H )是一种含氢量高的燃料。向恒容密闭容器内加入3mol N H , 一定条件下体系中N H 催化分解存在以下反应:
反应I.N H (g) N g)+2H (g);
反应IⅡ.3N H4(g) N (g)+4NH (g
不同温度下达到平衡时,N H 均几乎完全分解,分解产物的物质的 量如图。
下列说法不正确的是
A. 曲线a 对应的物质是H B. 低于M 点对应温度时,以反应Ⅱ为主
C. 体系中还存在反应:2NH g N g)+3H g)D.N 点时,体系内n(N ):n(H )为4:3
二.非选择题:共4题,共61分。
14. (15分)钌(Ru)是贵金属,在医疗、催化等方面有重要应用。
I 熔融-氧化-蒸馏法是工业上回收废钌催化剂中Ru 的一种方法,流程如下:
(
RuCl
操作A
RuCl ·3H O
溶液
晶体
废钌
催化剂
KOH
KNO
NaCIO
、硫酸
减压蒸馏
RuO
浓盐酸
蒸气
焙烧
650℃
碱熔渣
H
Ru
)
已知:RuO 易挥发,加热时容易分解成RuO 和O 。
(1)“焙烧”时废钌催化剂中 RuO 转化为K RuO4 并生成无污染的气体,该反应的化学方程式为_ ▲ 。
(
1
0
0
80
60
0
)(2)如题14图-1所示,蒸馏温度高于80°℃时,RuO 蒸馏收率随着 温度的升高而降低,可能的原因是 ▲ 。
(3)氧化-蒸馏时选用硫酸酸化而非盐酸,原因是 ▲ 。
(
0
60
)(4)浓盐酸吸收RuO 蒸气并生成Cl 的离子方程式为 ▲ 。 Ⅱ交替电解法可剥落旧电极表面的RuO 催化涂层。
(
70
80
90
100
温度℃
题14图-1
)已知:i. 电解时会生成Ru 、RuO 和 RuO , 新生成的含钌物质在 电极上的附着力弱。
ii.电解一段时间后,惰性阳极可能被部分氧化,导电能力降低。
(5)交替电解装置如题14图-1所示,每隔5~6分钟改变 一次电流方向。电解时两电极上均有少量气泡产生。刚 通电时,阳极的电极反应式为 ▲ 、 ▲ 。
(6)用交替电解法剥落RuO 涂层的效率较高,可能的原 因有 ▲ (填序号)。
a. 含钌物质可同时从a、b 两电极上脱落
b. 阴极上,全部电子均用于还原RuO
c. 电流变向后,部分氧化的阳极被还原,电阻减小
(
o
电
源
含
RuO,
涂
层的惰性
电极
b
H SO
溶液
含
RuO,
涂
层的惰性
电极
a
)
题14图-2
(
15.
(15分)沙美特罗是一种良好的抗哮喘药物
,其合成路线如下(部分反应条件和溶剂省略):
E
F
)
(1)A→B 的反应中经过A→X→B 的过程,A→X 的反应类型为 ▲ 。A→B的反应可生成分子 式为 C1oH OCl 的副产物Y,Y 的结构简式为 ▲ 。
(2)D 分子中的官能团为酯基、酮羰基、 ▲ 。
(3)已知:KBr 晶体中的离子键成分大于KI 。G→H 的反应中使用丙酮作溶剂,可促进反应 C Hs(CH )4O(CH ) Br+KI→C Hs(CH )4O(CH ) I+KBr 正向进行,原因是 ▲ 。
(4)写出同时满足下列条件的D 的一种同分异构体的结构简式: ▲ 。
酸性条件下水解后,生成X 和 Y 两种有机产物;X 分子属于芳香族化合物且能发生银镜反应; Y 分子含有一个手性碳原子;两种分子均含有3种化学环境不同的氢。
(5)已知:。写出 为原料制备
的合成路线流程图_ ▲ 。
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16. (16分)金溶胶在肿瘤治疗、生物成像等领域有着非常重要的应用价值。实验室制备过程如下:
(1)制备氯金酸溶液:制备装置如题16图-1所示(夹持、加热装置已省略),先向三颈烧瓶的金粉 中加入一定量的H O 溶液,保持装置C 的温度为40℃;再持续通入HCl, 一段时间后得到金黄色
氯金酸(HAuCl 强酸)溶液。
题16图-1
题16图-2
①装置A 中,试剂1、2分别为“浓盐酸”和“浓硫酸”,仪器a 的名称为 ▲ ,所装试剂1 为 △ 。
②装置A 中,毛细管的作用是_ ▲ 。
③装置C 中发生反应的离子方程式为 △ 。
④不采用向C 中直接加浓盐酸,而是持续通入 HCl 的目的是 ▲ 。
(2)制备金溶胶
已知:I.不同尺寸金颗粒制备条件
平均尺寸 0.01%HAuCl 1%柠檬酸钠 0.075%NaBH 反应温度
5nm 100mL 1.0mL 0.6mL 25℃
25nm 100mL 3.2mL 1.6mL 100℃
45nm 100mL 2.0mL 1.6mL 100℃
Ⅱ.硼氢化钠具有较强还原性,与水可发生较缓慢的反应释放出氢气。
Ⅲ.柠檬酸钠是一种稳定剂,控制金颗粒的尺寸和形状,不参与氯金酸的还原。
①制备金溶胶的实验装置如题16图-2所示,硼氢化钠还原氯金酸时仅生成一种单质,同时有 H BO3 生成,写出化学方程式_ △ 。
②补充完整制备25nm 金溶胶的实验方案:室温下向三颈烧瓶A 中加入100.0mL 0.01%氯金酸 溶液_ ▲ ,蒸馏水洗涤产品,将制得的金颗粒分散在蒸馏水中,即得到酒红色的金溶胶。
[实验中须使用的试剂和设备:1%柠檬酸钠溶液,0.075%硼氢化钠溶液,NaOH 溶液,离心分离机]
17. (15分)甲醇是实现碳中和的重要载体。通过甲醇的催化重整可以获得氢能,还可以获得其他化 工产品。
(1)一种利用等离子体和双金属催化剂xZnO ·yZrO 催化CO 和 H O 反应生成CH OH 的反应机理 如如题17图-1所示;Zr 的常见化合价有+2、+3和+4,过程中Zr 的化合价发生变化。
已知:图中 的Ⅲ 表示ZnO,| 表示ZrO , 四表示氧空位;“一”表示化学键,“---”表示 吸附作用。
①步骤(iv)中 ,Zr 元素化合价变化为 ▲ 。
②增大反应电流,等离子体会释放出数量更多、能量更大的带负电的高能粒子。随着反应电流的 增加,CH OH 的产量增大。等离子体在反应中的作用是_ ▲ 。
(2)CH OH 与H O 催化重整制氢反应为:
主反应I: CH OH(g)+H O(g) 一 CO (g)+3H (g)
副反应IⅡ:H (g)+CO (g) CO(g)+H O(g)
△H =49.5kJ mol-
△H =41.2 kJ mol-
温度在300℃以上, CH OH 可裂解制氢:CH OH(g) 一 CO(g)+2H (g) △H
CH OH 与 H O 催化重整制氢气的体系中,平衡时甲醇的转化率、CO 物质的量分数与反应温度 (T) 以及初始加入的水醇比(SM) 的关系如题17图-2所示。如:曲线M 表示甲醇的平衡转化率均 为80%时,所对应的反应温度以及初始加入的水醇比(S/M)。
①AH = ▲
②其他条件相同,图示温度范围内,随着温度升高,平衡体系中CO 的物质的量分数增大,其可
能原因是 ▲ 。
(
-
M
) (
0.5%
) (
1.80k
1.60.
1.40
60%,
1.20
1.00
200
)——平衡时CH OH 的转化率
(
80%
)99.9% 1%
-----平衡时CO的
(
3%
)物质的量的分数
(
250
)300
T/℃
题17图-2
③氢能源汽车对氢气中的CO 有严格的要求,CO 平衡物质的量分数必须小于0.5%。催化重整制 氢气用于汽车时,减少CO 平衡物质的量分数的方法有 △ 。
A. 升温 B. 增大水醇比 C. 加少量CaO D. 应I选择性更高的催化剂
(3)工业上以CH OH 作反应物和溶剂,电解碳酸1,2-丙二酯 、甲乙基碘化铵(TEAI, 提
I:10 mL CH OH+0.117mol-L- 碳酸1,2-丙二酯+0.1 mol·L- TEAI, 蒸 馏 ,DMC 产率7 . 5%;
IⅡ:10mL CH OH+0.117mol-L- 碳酸1,2-丙二酯+0.1 mol-L- TEAI 为阴极液,Cu 为阴极、石墨
为阳极。通电后,阴极区DMC 产率为82 . 3%,并产生H 。
电催化酯交换法合成碳酸一甲酯的机理如题17图-3.
(
题17图-3
)①X 的结构简式为 △ 。
②实验I 中 DMC 产率较低的可能原因为 o
高三化学参考答案
选择题:BADAB BCCDC DAD
14. (15分)
(1 (物质2分,配平条件1分,共3分)
(2)RuO 受热易分解(1分),生成HCIO 受热分解(1分) ( 共 2 分 )
(3)盐酸可还原NaCIO 及K RuO4, 降低产率(1分),生成Cl 污染环境(1分) ( 共 2 分 )
(4)2RuO +16H++10Cl-=2Ru ++5Cl ↑+8H O (物质1分,配平1分,共2分)
(5)2H O-4e-=O ↑+4H+(2
(6)ac
15. (15分)
(1)加成反应(2分)
(2)碳溴键
(3)丙酮是非极性分子,KBr
分 )RuO -4e-+2H O=RuO +4H+ (2 分,共4分)
(2分 写一个1分,有错0分)
(2分) (共4分)
( 1 分 )
难溶于丙酮,会从丙酮中沉淀出来,从而促进反应正向进行。
(2分)
(3分)
(5分)
16. (16分)
(1)①恒压滴液漏斗(1分) 浓盐酸(1分) (共2分)
②控制盐酸滴加速率,使溶液充分混合,避免混合时剧烈放热 (2分)
(物质1分配平条件1分 共 2 分 )
④持续向C 中通入HCl, 可以保持盐酸浓度较高,促进金粉反应。 (2分)
(2)①3NaBH +8HAuCl +9H O=8Au+3H BO +29HCl+3NaCl
(物质2分,配平1分,共3分)
②加入3.2mL1% 柠檬酸钠溶液(1分),加热至100℃(1分),边搅拌边缓慢加入1.6mL 0.075%硼氢化钠溶液(1分),充分反应体系变为酒红色(1分),用离心分离机分离出Au(1 分),将产生的气体通入NaOH 溶液中(1分)。
(先加热也可以;温度不对熔断,加入顺序错误熔断;柠檬酸钠体积错误熔断;没有缓 慢滴加表达扣1分不熔断;无终点现象扣1分不熔断。 共5分)
17. (15分)
(1)①+4价变为+3价 (2分)
②还原水分子生成H 原子(1分);使催化剂中的ZrO 表面形成氧空位(1分,共2分)
(2)①90.7kJ·mol- (2分单位1分)
②反应I和反应Ⅱ均吸热(1分),随着温度升高,反应I和反应Ⅱ的平衡正向进行程度均 增大(1分),且温度升高对反应Ⅱ的影响大于对反应I的影响(1分)。(答成“反应Ⅲ的 平衡正向移动,CO 的物质的量分数增大”得0分) (共3分)
③BC (2分写一个1分,有错0分)
(3)①CH O- ( 2 分 )
②甲醇中甲基为推电子基团,使H-O 极性弱(1分),难断键提供CH O-(1 分)。(共2分)
同课章节目录
