2025年湖南省张家界市桑植县二模化学试卷(图片版,含解析)
文档属性
| 名称 | 2025年湖南省张家界市桑植县二模化学试卷(图片版,含解析) |  | |
| 格式 | |||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 20:21:01 | ||
图片预览




文档简介
2025年初中总复习模拟考试检测卷
化学试题卷(四)参考答案
1.D 【解析】A.铜做导线是利用了铜的导电性、延展性,这些属于物理性质;B.木材做成桌
椅,是利用了木材具有一定硬度的性质,这属于物理性质;C.黄金压成金箔是利用了黄金的
延展性,这属于物理性质;D.酒精用作燃料是利用了酒精的可燃性,可燃性需要通过化学变
化表现出来,属于化学性质,符合题意。
2.A 【解析】A.稀释浓硫酸时,要把浓硫酸慢慢地沿器壁注入水中,同时用玻璃棒不断搅拌,
以使热量及时扩散。一定不能把水注入浓硫酸中,以防止酸液飞溅,图中所示操作正确。
B.振荡试管的正确方法是用手指拿住试管,用手腕的力量左右振荡,而不是用手指堵住试
管口拿着试管上下振荡,图中所示操作错误。C.向试管中倾倒液体试剂时,瓶塞要倒放,标
签要对准手心,瓶口紧挨试管口。图中瓶塞没有倒放,图中所示操作错误。D.用pH试纸测
溶液的pH时,正确的操作方法为用洁净、干燥的玻璃棒蘸取少量待测液滴在干燥的pH试
纸上,把试纸显示的颜色与标准比色卡对比来确定pH。不能用湿润的pH试纸,稀盐酸呈
酸性,湿润的pH试纸稀释了待测盐酸,使盐酸的酸性减弱,测定结果偏大,图中所示操作错
误。故选A。
3.C 【解析】A.黑椒牛排中富含蛋白质;B.米饭中富含淀粉,淀粉属于糖类;C.苹果胡萝卜汁
中富含维生素,符合题意;D.熏鱼中富含蛋白质。
4.D 【解析】A.由图中信息可知,对该地空气质量影响最大的是TSP,说法正确;B.由图中信
息可知,该地冬季污染最严重,冬季需要燃烧化石燃料取暖,说法正确;C.SO2 和NO2 易形
成酸雨,酸雨的pH<5.6,说法正确;D.由图中信息可知,该地夏季时TSP、SO2、NO2 含量
最低,空气质量最好,说法不正确。
催化剂
5.A 【解析】由题图可得化学方程式:CO+H2O H2+CO2。A.由化学方程式可知,
参加反应的一氧化碳和水两种物质的粒子个数比为1∶1,正确;B.H2O中,氢元素为+1
价,H2 为单质,H2 中氢元素的化合价为0,该反应前后氢元素的化合价改变,错误;C.反应
后H2 为单质,反应前后有3种氧化物,即水、一氧化碳和二氧化碳,错误;D.由质量守恒定
律可知化学反应前后原子种类不变,错误。
6.C 【解析】A.1个叶黄素分子中有98个原子,错误;B.碳、氢元素质量比为(12×40)∶(1×
56)=480∶56=60∶7,错误;C.叶黄素由碳、氢、氧三种元素组成,正确;D.碳、氢、氧三种元
素的质量比为(12×40)∶(1×56)∶(16×2)=480∶56∶32=60∶7∶4,碳元素的质量分数
最大,错误。
7.D 【解析】A.a连接的是电源的负极,b连接的是正极,说法不正确。B.右侧注射器中收集
的气体是氧气,不能燃烧,说法不正确。C.电解水生成氢气和氧气,说明水由氢元素、氧元
素组成,说法不正确。D.用左侧注射器中收集的气体(氢气,氢气密度比空气的小)吹肥皂
泡,肥皂泡会上浮,说法正确。故选D。
— 1 —
8.B 【解析】A.活性炭能去除异味是因为活性炭有吸附性,说法正确;B.湿衣服晾干是因为分
子在不断地运动,说法错误;C.若家中燃气泄漏,应关掉进气总阀门,开窗通风,说法正确;
D.CO难溶于水,所以煤炉上放一盆水不能防止一氧化碳中毒,说法正确。
9.D 【解析】A.碘酒溶液中,酒精为溶剂,碘为溶质,说法错误;B.溶解度是在一定温度下,某
固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,搅拌不能增大物质的溶解度,说
法错误;C.均一、稳定的液体不一定是溶液,如水,说法错误;D.有的溶液具有颜色,如硫酸
铜溶液呈蓝色,说法正确。
10.C 【解析】A.氯化钠溶液呈中性,能使溴百里酚蓝溶液保持绿色。B.氢氧化钾溶液呈碱
性,能使溴百里酚蓝溶液变蓝色。C.醋酸溶液呈酸性,能使溴百里酚蓝溶液变黄色,符合
题意。D.氨水呈碱性,能使溴百里酚蓝溶液变蓝色。
11.A 【解析】K2SO4 含有氮、磷、钾中的钾元素,属于钾肥,故选A。
12.B 【解析】A.中和反应生成盐和水,但有盐和水生成的反应不一定是中和反应,如CO2+
2NaOH Na2CO3+H2O。B.波尔多液是一种农业上常用的杀菌剂,是由硫酸铜、生石
灰加水配制而成的,生石灰和水反应生成氢氧化钙,氢氧化钙和硫酸铜反应生成氢氧化铜
沉淀和硫酸钙,正确。C.草木灰呈碱性,与铵态氮肥混合施用,会产生氨气,降低肥效。D.
碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,其水溶液呈碱性。故选B。
13.C 【解析】A.生铁、不锈钢和青铜都属于合金,是金属材料。B.石油属于化石燃料,化石
燃料不能短时期内从自然界得到补充,属于不可再生能源。C.熟石灰是氢氧化钙的俗称,
氢氧化钙能与酸反应,因此可用熟石灰处理含酸量超标的污水,说法正确。D.缺乏碘元素
可能导致甲状腺肿大,所以为预防甲状腺肿大,应在食盐中添加少量碘元素,不能大量添
加,因为碘元素摄入过多也会导致甲状腺肿大。
14.B 【解析】A.碱溶液中均能解离出氢氧根离子,所以碱具有相似的化学性质。B.氧化物中
含有氧元素,但是含有氧元素的化合物不一定是氧化物,如高锰酸钾中含氧元素,但高锰酸
钾由K、Mn、O三种元素组成,不属于氧化物,说法错误。C.将温度传感器插入蜡烛火焰
中,可测出火焰的温度。D.可燃性气体中混有一定量的空气,遇到明火容易发生爆炸,加
油站、面粉厂的空气中含有大量的可燃性气体或粉尘,为防止发生爆炸,加油站、面粉厂等
要严禁烟火。
15.A 【解析】A.氢氧化钠变质是氢氧化钠与空气中的二氧化碳反应生成了碳酸钠,氢氧化
钠与碳酸钠溶液均呈碱性,所以无论是否变质都会使无色酚酞溶液变红,不能达到实验目
的。B.在盛有水的小烧杯中加入少量品红,液体变红,说明品红在静置的水中会扩散。
C.假黄金是铜锌合金,加入稀硫酸能反应放出气体。而真黄金不与稀硫酸反应,根据是否
产生气体,可以鉴别。D.羊毛的主要成分是蛋白质,灼烧有烧焦羽毛的气味;涤纶灼烧有
特殊的刺激性气味,现象不同,可以区分。故选A。
16.(1)天然 (2)增大压强,分子间间隔变小 (3)氦原子
【解析】(1)丝绸的主要成分为蚕丝,属于天然纤维。(2)液化石油气经加压后压缩到钢瓶
中,分子间有间隔,气体受压后,增大压强,分子间间隔变小。(3)氦气是稀有气体,构成粒
子是原子,构成氦气的微观粒子是氦原子。
— 2 —
17.(1)AC (2)铝在常温下能与空气中的氧气反应生成一层致密的氧化铝薄膜,阻止了铝进
一步被氧化 (3)有
【解析】(1)A.磁铁矿的主要成分是四氧化三铁,四氧化三铁含有铁元素和氧元素;B.铝土
矿的主要成分是氧化铝,氧化铝含有铝元素和氧元素;C.菱铁矿的主要成分是碳酸亚铁,
碳酸亚铁含有铁元素、碳元素和氧元素。故磁铁矿、铝土矿、菱铁矿中主要成分含相同金属
元素(铁元素)的是磁铁矿和菱铁矿。(2)铝在常温下能与空气中的氧气反应生成一层致密
的氧化铝薄膜,阻止了铝进一步被氧化,故金属铝及其合金在常温时抗腐蚀。(3)钛与盐酸
反应生成可燃性气体氢气,说明钛的金属活动性比氢强,而银的金属活动性比氢弱,因此钛
能与硝酸银反应生成银和硝酸钛,故把钛放入硝酸银溶液中有单质银析出。
18.(1)甲和乙 (2)160 (3)丙
【解析】(1)20℃时,溶解度相等的物质是甲和乙。(2)20℃时,乙物质的溶解度是60g,因
此把100g乙物质加入100g水中,所得溶液的质量为100g+60g=160g。(3)将20℃
的等质量的甲、乙、丙三种物质的饱和溶液升高温度至40℃,所得溶液中溶质的质量分数
最小的是丙,因为升温后甲和乙的质量分数不变,丙的质量分数变小,因此丙的质量分数还
是最小。
19.(1)+6 (2)黄色 (3)AC
【解析】(1)重铬酸钾中,钾元素为+1价,氧元素为-2价,设铬元素化合价为x,根据化合
物中各元素化合价代数和为0,则(+1)×2+2x+(-2)×7=0,解得:x=+6。(2)由表
可知,鉴别某白酒真伪的方法是:取5mL白酒样品于试管中,加入3mL40%的氢氧化钠
溶液,加热,观察溶液的变色情况,若溶液变为黄色,则是真酒。(3)A.由材料可知,蒸酒即
是蒸馏,而蒸馏是利用各物质的沸点不同将之分离,没有新物质产生,所以蒸酒过程中发生
的是物理变化,说法错误;B.用粮食酿造的白酒(主要成分是乙醇)中含有醛类物质,而由
乙醇(或甲醇)勾兑的假酒不含醛类物质,因此,可以通过对醛类物质的检验来鉴别真、假白
酒,说法正确;C.由表格可知,往真、假白酒中滴入1mL溶质质量分数为40%的NaOH溶
液,均不会变色,说法错误。
高温
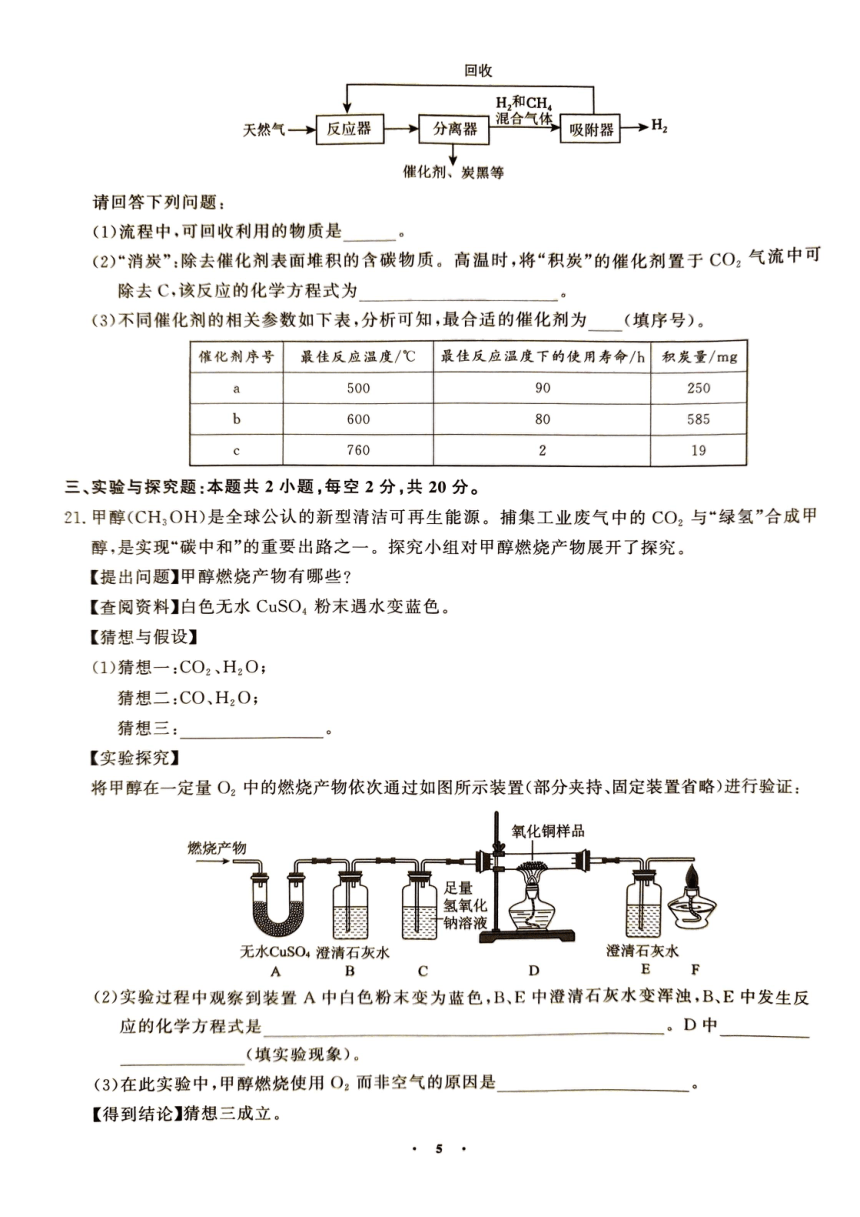
20.(1)CH4 (2)CO2+C 2CO (3)a
【解析】(1)由流程图可知,可回收利用的物质是CH4。(2)碳和二氧化碳在高温条件下反应
高温
生成一氧化碳,反应的化学方程式为CO2+C 2CO。(3)分析表中数据可知,催化剂a最
佳反应温度最低,最佳反应温度下的使用寿命最长,积炭量适中,属于最合适的催化剂。
21.(1)CO、CO2、H2O (2)Ca(OH)2+CO2 CaCO3↓+H2O 固体由黑色变为红色
(3)防止空气中的二氧化碳和水蒸气干扰实验
【解析】(1)根据猜想一:CO2、H2O;猜想二:CO、H2O;可得猜想三:CO、CO2、H2O。(2)装
置B、E中二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为Ca(OH)2+
CO2 CaCO3↓+H2O。猜想三成立,则一氧化碳与氧化铜反应生成铜和二氧化碳,所
以D中固体由黑色变为红色。(3)在此实验中,甲醇燃烧使用O2 而非空气的原因是空气
中含有二氧化碳和水蒸气,会对实验造成干扰。
— 3 —
22.(1)探究反应物浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同温
度) (2)1~2滴FeCl3 溶液 二氧化锰对 H2O2 分解的催化能力较强,反应速率较大,不
利于观察反应速率的变化,FeCl3 作催化剂反应速率适中,有利于观察反应速率的变化
(3)锥形瓶 产生20mL气体所需的时间
【解析】(1)实验①和②反应物的浓度不同,则该实验的目的为探究反应物浓度对化学反应
速率的影响;通常条件下H2O2 稳定,不易分解,为了便于比较,应在相同的条件下利用一
个变量来比较,可向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水
浴中,升高相同温度)。(2)进行实验②、③、④后,得出结论:MnO2 与FeCl3 均能加快
H2O2 的分解,且前者的催化效率更高。若继续用上述实验药品研究温度对 H2O2 分解快
慢的影响,变量是温度,其他条件保持相同,相同条件下,二氧化锰对 H2O2 分解的催化能
力较强,反应速率较大,不利于观察反应速率的变化。1~2滴FeCl3 溶液作催化剂反应速
率适中,便于观察速率变化,所以表中实验⑤选择的催化剂是氯化铁。(3)图中a仪器是锥
形瓶;设计题图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体
为准,则实验中需要测量的数据为测定产生20mL气体所需的时间。
23.(1)氢氧化钠和硫酸发生酸碱中和反应,A 点时pH=7,则两者恰好完全反应。
(2)解:设废液中硫酸的质量分数是x。
2NaOH+H2SO4 Na2SO4+2H2O
80 98
16g×10% 50g×x
80 16
= g
×10%
98 50g×x
x=3.92%
答:废液中硫酸的质量分数是3.92%。
— 4 —
化学试题卷(四)参考答案
1.D 【解析】A.铜做导线是利用了铜的导电性、延展性,这些属于物理性质;B.木材做成桌
椅,是利用了木材具有一定硬度的性质,这属于物理性质;C.黄金压成金箔是利用了黄金的
延展性,这属于物理性质;D.酒精用作燃料是利用了酒精的可燃性,可燃性需要通过化学变
化表现出来,属于化学性质,符合题意。
2.A 【解析】A.稀释浓硫酸时,要把浓硫酸慢慢地沿器壁注入水中,同时用玻璃棒不断搅拌,
以使热量及时扩散。一定不能把水注入浓硫酸中,以防止酸液飞溅,图中所示操作正确。
B.振荡试管的正确方法是用手指拿住试管,用手腕的力量左右振荡,而不是用手指堵住试
管口拿着试管上下振荡,图中所示操作错误。C.向试管中倾倒液体试剂时,瓶塞要倒放,标
签要对准手心,瓶口紧挨试管口。图中瓶塞没有倒放,图中所示操作错误。D.用pH试纸测
溶液的pH时,正确的操作方法为用洁净、干燥的玻璃棒蘸取少量待测液滴在干燥的pH试
纸上,把试纸显示的颜色与标准比色卡对比来确定pH。不能用湿润的pH试纸,稀盐酸呈
酸性,湿润的pH试纸稀释了待测盐酸,使盐酸的酸性减弱,测定结果偏大,图中所示操作错
误。故选A。
3.C 【解析】A.黑椒牛排中富含蛋白质;B.米饭中富含淀粉,淀粉属于糖类;C.苹果胡萝卜汁
中富含维生素,符合题意;D.熏鱼中富含蛋白质。
4.D 【解析】A.由图中信息可知,对该地空气质量影响最大的是TSP,说法正确;B.由图中信
息可知,该地冬季污染最严重,冬季需要燃烧化石燃料取暖,说法正确;C.SO2 和NO2 易形
成酸雨,酸雨的pH<5.6,说法正确;D.由图中信息可知,该地夏季时TSP、SO2、NO2 含量
最低,空气质量最好,说法不正确。
催化剂
5.A 【解析】由题图可得化学方程式:CO+H2O H2+CO2。A.由化学方程式可知,
参加反应的一氧化碳和水两种物质的粒子个数比为1∶1,正确;B.H2O中,氢元素为+1
价,H2 为单质,H2 中氢元素的化合价为0,该反应前后氢元素的化合价改变,错误;C.反应
后H2 为单质,反应前后有3种氧化物,即水、一氧化碳和二氧化碳,错误;D.由质量守恒定
律可知化学反应前后原子种类不变,错误。
6.C 【解析】A.1个叶黄素分子中有98个原子,错误;B.碳、氢元素质量比为(12×40)∶(1×
56)=480∶56=60∶7,错误;C.叶黄素由碳、氢、氧三种元素组成,正确;D.碳、氢、氧三种元
素的质量比为(12×40)∶(1×56)∶(16×2)=480∶56∶32=60∶7∶4,碳元素的质量分数
最大,错误。
7.D 【解析】A.a连接的是电源的负极,b连接的是正极,说法不正确。B.右侧注射器中收集
的气体是氧气,不能燃烧,说法不正确。C.电解水生成氢气和氧气,说明水由氢元素、氧元
素组成,说法不正确。D.用左侧注射器中收集的气体(氢气,氢气密度比空气的小)吹肥皂
泡,肥皂泡会上浮,说法正确。故选D。
— 1 —
8.B 【解析】A.活性炭能去除异味是因为活性炭有吸附性,说法正确;B.湿衣服晾干是因为分
子在不断地运动,说法错误;C.若家中燃气泄漏,应关掉进气总阀门,开窗通风,说法正确;
D.CO难溶于水,所以煤炉上放一盆水不能防止一氧化碳中毒,说法正确。
9.D 【解析】A.碘酒溶液中,酒精为溶剂,碘为溶质,说法错误;B.溶解度是在一定温度下,某
固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,搅拌不能增大物质的溶解度,说
法错误;C.均一、稳定的液体不一定是溶液,如水,说法错误;D.有的溶液具有颜色,如硫酸
铜溶液呈蓝色,说法正确。
10.C 【解析】A.氯化钠溶液呈中性,能使溴百里酚蓝溶液保持绿色。B.氢氧化钾溶液呈碱
性,能使溴百里酚蓝溶液变蓝色。C.醋酸溶液呈酸性,能使溴百里酚蓝溶液变黄色,符合
题意。D.氨水呈碱性,能使溴百里酚蓝溶液变蓝色。
11.A 【解析】K2SO4 含有氮、磷、钾中的钾元素,属于钾肥,故选A。
12.B 【解析】A.中和反应生成盐和水,但有盐和水生成的反应不一定是中和反应,如CO2+
2NaOH Na2CO3+H2O。B.波尔多液是一种农业上常用的杀菌剂,是由硫酸铜、生石
灰加水配制而成的,生石灰和水反应生成氢氧化钙,氢氧化钙和硫酸铜反应生成氢氧化铜
沉淀和硫酸钙,正确。C.草木灰呈碱性,与铵态氮肥混合施用,会产生氨气,降低肥效。D.
碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,其水溶液呈碱性。故选B。
13.C 【解析】A.生铁、不锈钢和青铜都属于合金,是金属材料。B.石油属于化石燃料,化石
燃料不能短时期内从自然界得到补充,属于不可再生能源。C.熟石灰是氢氧化钙的俗称,
氢氧化钙能与酸反应,因此可用熟石灰处理含酸量超标的污水,说法正确。D.缺乏碘元素
可能导致甲状腺肿大,所以为预防甲状腺肿大,应在食盐中添加少量碘元素,不能大量添
加,因为碘元素摄入过多也会导致甲状腺肿大。
14.B 【解析】A.碱溶液中均能解离出氢氧根离子,所以碱具有相似的化学性质。B.氧化物中
含有氧元素,但是含有氧元素的化合物不一定是氧化物,如高锰酸钾中含氧元素,但高锰酸
钾由K、Mn、O三种元素组成,不属于氧化物,说法错误。C.将温度传感器插入蜡烛火焰
中,可测出火焰的温度。D.可燃性气体中混有一定量的空气,遇到明火容易发生爆炸,加
油站、面粉厂的空气中含有大量的可燃性气体或粉尘,为防止发生爆炸,加油站、面粉厂等
要严禁烟火。
15.A 【解析】A.氢氧化钠变质是氢氧化钠与空气中的二氧化碳反应生成了碳酸钠,氢氧化
钠与碳酸钠溶液均呈碱性,所以无论是否变质都会使无色酚酞溶液变红,不能达到实验目
的。B.在盛有水的小烧杯中加入少量品红,液体变红,说明品红在静置的水中会扩散。
C.假黄金是铜锌合金,加入稀硫酸能反应放出气体。而真黄金不与稀硫酸反应,根据是否
产生气体,可以鉴别。D.羊毛的主要成分是蛋白质,灼烧有烧焦羽毛的气味;涤纶灼烧有
特殊的刺激性气味,现象不同,可以区分。故选A。
16.(1)天然 (2)增大压强,分子间间隔变小 (3)氦原子
【解析】(1)丝绸的主要成分为蚕丝,属于天然纤维。(2)液化石油气经加压后压缩到钢瓶
中,分子间有间隔,气体受压后,增大压强,分子间间隔变小。(3)氦气是稀有气体,构成粒
子是原子,构成氦气的微观粒子是氦原子。
— 2 —
17.(1)AC (2)铝在常温下能与空气中的氧气反应生成一层致密的氧化铝薄膜,阻止了铝进
一步被氧化 (3)有
【解析】(1)A.磁铁矿的主要成分是四氧化三铁,四氧化三铁含有铁元素和氧元素;B.铝土
矿的主要成分是氧化铝,氧化铝含有铝元素和氧元素;C.菱铁矿的主要成分是碳酸亚铁,
碳酸亚铁含有铁元素、碳元素和氧元素。故磁铁矿、铝土矿、菱铁矿中主要成分含相同金属
元素(铁元素)的是磁铁矿和菱铁矿。(2)铝在常温下能与空气中的氧气反应生成一层致密
的氧化铝薄膜,阻止了铝进一步被氧化,故金属铝及其合金在常温时抗腐蚀。(3)钛与盐酸
反应生成可燃性气体氢气,说明钛的金属活动性比氢强,而银的金属活动性比氢弱,因此钛
能与硝酸银反应生成银和硝酸钛,故把钛放入硝酸银溶液中有单质银析出。
18.(1)甲和乙 (2)160 (3)丙
【解析】(1)20℃时,溶解度相等的物质是甲和乙。(2)20℃时,乙物质的溶解度是60g,因
此把100g乙物质加入100g水中,所得溶液的质量为100g+60g=160g。(3)将20℃
的等质量的甲、乙、丙三种物质的饱和溶液升高温度至40℃,所得溶液中溶质的质量分数
最小的是丙,因为升温后甲和乙的质量分数不变,丙的质量分数变小,因此丙的质量分数还
是最小。
19.(1)+6 (2)黄色 (3)AC
【解析】(1)重铬酸钾中,钾元素为+1价,氧元素为-2价,设铬元素化合价为x,根据化合
物中各元素化合价代数和为0,则(+1)×2+2x+(-2)×7=0,解得:x=+6。(2)由表
可知,鉴别某白酒真伪的方法是:取5mL白酒样品于试管中,加入3mL40%的氢氧化钠
溶液,加热,观察溶液的变色情况,若溶液变为黄色,则是真酒。(3)A.由材料可知,蒸酒即
是蒸馏,而蒸馏是利用各物质的沸点不同将之分离,没有新物质产生,所以蒸酒过程中发生
的是物理变化,说法错误;B.用粮食酿造的白酒(主要成分是乙醇)中含有醛类物质,而由
乙醇(或甲醇)勾兑的假酒不含醛类物质,因此,可以通过对醛类物质的检验来鉴别真、假白
酒,说法正确;C.由表格可知,往真、假白酒中滴入1mL溶质质量分数为40%的NaOH溶
液,均不会变色,说法错误。
高温
20.(1)CH4 (2)CO2+C 2CO (3)a
【解析】(1)由流程图可知,可回收利用的物质是CH4。(2)碳和二氧化碳在高温条件下反应
高温
生成一氧化碳,反应的化学方程式为CO2+C 2CO。(3)分析表中数据可知,催化剂a最
佳反应温度最低,最佳反应温度下的使用寿命最长,积炭量适中,属于最合适的催化剂。
21.(1)CO、CO2、H2O (2)Ca(OH)2+CO2 CaCO3↓+H2O 固体由黑色变为红色
(3)防止空气中的二氧化碳和水蒸气干扰实验
【解析】(1)根据猜想一:CO2、H2O;猜想二:CO、H2O;可得猜想三:CO、CO2、H2O。(2)装
置B、E中二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为Ca(OH)2+
CO2 CaCO3↓+H2O。猜想三成立,则一氧化碳与氧化铜反应生成铜和二氧化碳,所
以D中固体由黑色变为红色。(3)在此实验中,甲醇燃烧使用O2 而非空气的原因是空气
中含有二氧化碳和水蒸气,会对实验造成干扰。
— 3 —
22.(1)探究反应物浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同温
度) (2)1~2滴FeCl3 溶液 二氧化锰对 H2O2 分解的催化能力较强,反应速率较大,不
利于观察反应速率的变化,FeCl3 作催化剂反应速率适中,有利于观察反应速率的变化
(3)锥形瓶 产生20mL气体所需的时间
【解析】(1)实验①和②反应物的浓度不同,则该实验的目的为探究反应物浓度对化学反应
速率的影响;通常条件下H2O2 稳定,不易分解,为了便于比较,应在相同的条件下利用一
个变量来比较,可向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水
浴中,升高相同温度)。(2)进行实验②、③、④后,得出结论:MnO2 与FeCl3 均能加快
H2O2 的分解,且前者的催化效率更高。若继续用上述实验药品研究温度对 H2O2 分解快
慢的影响,变量是温度,其他条件保持相同,相同条件下,二氧化锰对 H2O2 分解的催化能
力较强,反应速率较大,不利于观察反应速率的变化。1~2滴FeCl3 溶液作催化剂反应速
率适中,便于观察速率变化,所以表中实验⑤选择的催化剂是氯化铁。(3)图中a仪器是锥
形瓶;设计题图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20mL气体
为准,则实验中需要测量的数据为测定产生20mL气体所需的时间。
23.(1)氢氧化钠和硫酸发生酸碱中和反应,A 点时pH=7,则两者恰好完全反应。
(2)解:设废液中硫酸的质量分数是x。
2NaOH+H2SO4 Na2SO4+2H2O
80 98
16g×10% 50g×x
80 16
= g
×10%
98 50g×x
x=3.92%
答:废液中硫酸的质量分数是3.92%。
— 4 —
同课章节目录
