2.1 课时2原子核外电子的排布 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 2.1 课时2原子核外电子的排布 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 635.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 11:12:14 | ||
图片预览


文档简介
课时2 原子核外电子的排布
1 下列现象中与电子跃迁无关的是( )
A. 节日燃放的焰火 B. 舞台LED灯光 C. 广州塔霓虹灯光 D. 虎英公园水中倒影
2 下列电子排布式能正确表示基态原子电子排布的是( )
A. 1s22s22p63s13p3
B. 1s22s22p63s23p63d104s14p1
C. 1s22s22p63s23p63d24s1
D. 1s22s22p63s23p63d104s24p1
3 [2024江苏阶段练习]下列轨道表示式能表示基态硫原子最外层电子排布的是( )
A. B.
C. D.
4 [2025连云港赣榆期末]下列表示错误的是( )
A. Cu的简化电子排布式:[Ar]3d104s1
B. px轨道电子云轮廓图:
C. 核外电子按能量分为不同的能层:如1s、2s、2p、3d等
D. 氧的基态原子的轨道表示式:
5 [2024苏州昆山期中]下列关于基态Fe或Fe3+的说法错误的是( )
A. 基态Fe3+的单电子数目为5
B. 基态Fe有7种能量不同的电子
C. 基态Fe的价电子的原子轨道有6种伸展方向
D. 原子核外有26种不同运动状态的电子
6 下列各组指定的元素,不能形成AB2型化合物的是( )
A. [He]2s22p2和[He]2s22p4
B. [Ne]3s23p4和[He]2s22p4
C. [Ne]3s2和[He]2s22p5
D. [Ne]3s1和[Ne]3s23p4
7 “六六六”(如图所示)等有机氯杀虫剂揭开了人类施用有机合成农药的新篇章。其有较高的杀虫活性,对人体的急性毒性较低,还有容易生产、价格低廉等优点。下列说法正确的是( )
A. 原子半径:H>C>Cl
B. 气态氢化物的热稳定性:CH4>HCl
C. 氯原子的原子轨道能量高低:3px<3py
D. 基态氯原子中,未成对电子数与成对电子数之比为1∶16
8 [2024镇江句容期中]下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Cr的价电子排布图为
C. 基态Ni2+的电子排布式为[Ar]3d10
D. 基态Cu的价电子排布式为3d94s2
9 下列说法正确的是( )
A. 多电子原子不同能级能量高低:4s>3d>3p
B. 某元素基态原子的最外层电子数是次外层电子数的1.5倍,则该元素基态原子的核外电子排布式为1s22s22p1
C. 基态K原子的核外电子的空间运动状态共有19种
D. 根据洪特规则可知,1s22s22p2的价层电子的轨道表示式为
10 下列有关电子排布式或轨道表示式的结论错误的是( )
选项 电子排布式或轨道表示式 结论
A 1s22s22p2p 违背洪特规则
B 某激发态硼原子的轨道表示式
C O的轨道表示式: 违背泡利原理
D 1s22s22p63s23p63d54s1 书写正确
11 [2025无锡江阴月考]已知Mn的核电荷数为25,下列有关基态Mn的电子排布正确的是( )
A. 基态Mn的价电子排布图为
B. 基态Mn的电子在各轨道上排布时,先排满4s轨道,再排3d轨道
C. 基态Mn失去电子形成Mn2+时,应失去3d轨道上的电子
D. 基态Mn的2p和3p轨道的形状、能量均相同
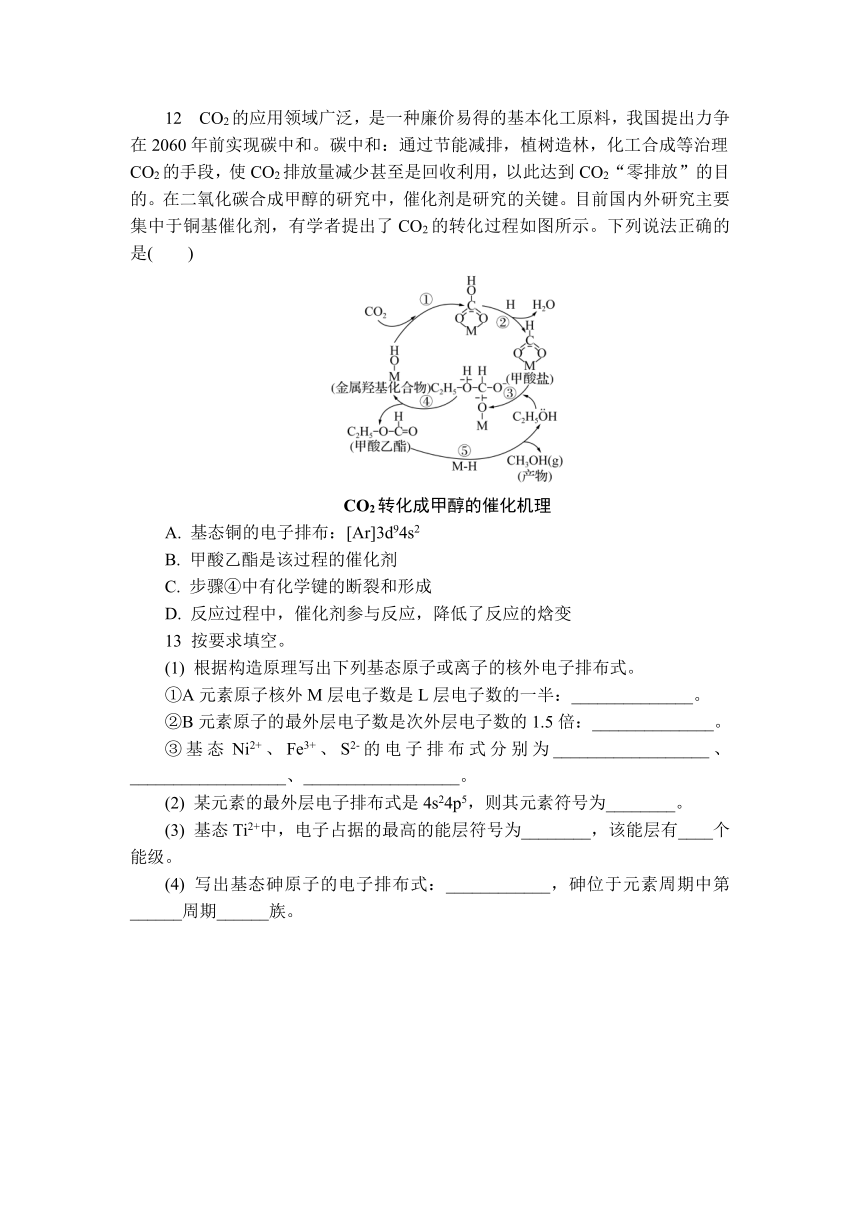
12 CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在2060年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理CO2的手段,使CO2排放量减少甚至是回收利用,以此达到CO2“零排放”的目的。在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了CO2的转化过程如图所示。下列说法正确的是( )
CO2转化成甲醇的催化机理
A. 基态铜的电子排布:[Ar]3d94s2
B. 甲酸乙酯是该过程的催化剂
C. 步骤④中有化学键的断裂和形成
D. 反应过程中,催化剂参与反应,降低了反应的焓变
13 按要求填空。
(1) 根据构造原理写出下列基态原子或离子的核外电子排布式。
①A元素原子核外M层电子数是L层电子数的一半:______________。
②B元素原子的最外层电子数是次外层电子数的1.5倍:______________。
③基态Ni2+、Fe3+、S2-的电子排布式分别为__________________、__________________、__________________。
(2) 某元素的最外层电子排布式是4s24p5,则其元素符号为________。
(3) 基态Ti2+中,电子占据的最高的能层符号为________,该能层有____个能级。
(4) 写出基态砷原子的电子排布式:____________,砷位于元素周期中第______周期______族。
14 (1) 下列Li原子的电子排布图表示的状态中,能量最低和最高的分别为________、________(填字母)。
A.
B.
C.
D.
(2) 基态Fe原子价电子的电子排布图(或轨道表示式)为__________________
_______________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(3) 基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________。
(4) 基态Co原子核外电子排布式为______________。元素Mn与O中,基态原子核外未成对电子数较多的是________。
15 [2025南通阶段练习]现有部分元素的性质与原子(或分子)结构如下表:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下,单质为双原子分子,分子中含有3个共用电子对
Y M层比K层少1个电子
Z 第3周期元素的简单离子中半径最小
(1) 元素T在元素周期表中的位置是___________________。
(2) 元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填字母)。
a. Y单质的熔点比Z单质低
b. Y的化合价比Z低
c. Y单质与水反应比Z单质剧烈
d. Y最高价氧化物的水化物的碱性比Z强
(3) 元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压下),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:______________________________。
16 原子序数依次增大的A、B、C、D、E、F、G七种元素。其中A的原子有5种不同运动状态的电子;B的基态原子有3个不同的能级,各能级中的电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;E为它所在周期中原子半径最大的主族元素;F和D位于同一主族,G的原子序数为29。
(1) 基态G原子的价电子排布式为________。
(2) 元素B、C的简单气态氢化物的沸点较高的是______(填化学式)。
(3) GD在加热条件下容易转化为G2D,从原子结构的角度解释原因:________
____________________________________________________________________________________________________________________________________________。
(4) G与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸盐,为将生成的两种气体(气体相对分子质量均小于50)完全转化为最高价含氧酸盐,消耗了1 mol O2 和1 L 2.2 mol/L NaOH溶液。则两种气体的分子式及物质的量分别为___________________,生成硫酸铜的物质的量为________。
课时2 原子核外电子的排布
1. D 水中倒影是光线反射的结果,与电子跃迁无关,故选D。
2. D 基态核外电子排布应该是1s22s22p63s23p2,A错误;基态核外电子排布应该是1s22s22p63s23p63d104s2,B错误;基态核外电子排布应该是1s22s22p63s23p63d14s2,C错误; 1s22s22p63s23p63d104s24p1符合原子核外电子排布规律,D正确。
3. C 基态硫原子最外层电子排布式为3s23p4,基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,其轨道表示式为。故选C。
4. C 能层可表示为K、L、M、N等,能级才用s、p、d等来表示,C错误。
5. C 基态Fe3+的电子排布式为[Ar]3d5,有5个单电子,A正确;处于不同能级上的电子的能量不同,基态Fe有1s、2s、2p、3s、3p、3d、4s 7个不同能级,故基态Fe有7种不同能量的电子,B正确;基态Fe的价电子排布为3d64s2,4s能级是球形,无伸展方向,3d能级有5个轨道,有5种伸展方向,C错误;铁有26个电子,原子核外有26种不同运动状态的电子,D正确。
6. D 核外电子排布式为[He]2s22p2的元素为C,核外电子排布式为[He]2s22p4的元素为O,二者可形成CO2,A不符合题意;核外电子排布式为[Ne]3s23p4的元素为S,核外电子排布式为[He]2s22p4的元素为O,二者可形成SO2,B不符合题意;核外电子排布式为[Ne]3s2的元素为Mg,核外电子排布式为[He]2s22p5 的元素为F,二者可形成MgF2,C不符合题意;核外电子排布式为[Ne]3s1的元素为Na,核外电子排布式为[Ne]3s23p4 的元素为S,二者可形成Na2S,不能形成AB2型化合物,D符合题意。
7. D 电子层数越多,原子半径越大,则原子半径Cl>C>H,A错误;非金属性Cl>C,非金属性越强,其气态氢化物的热稳定性越强,则热稳定性HCl>CH4,B错误;同一能级上简并轨道的能量相同,则氯原子的原子轨道能量3px=3py,C错误;基态Cl原子的核外电子排布式为1s22s22p63s23p5,未成对电子数为1,成对电子数为16,二者的个数之比为1∶16,D正确。
8. B 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量,如电子能量2p<3s,A错误;根据洪特规则,基态Cr原子的价电子排布图为,B正确;基态Ni2+的电子排布式为[Ar]3d8,C错误;根据洪特规则,基态Cu的价电子排布式为3d104s1,D错误。
9. B 根据构造原理可知,多电子原子不同能级能量高低3d>4s>3p,A错误;已知最外电子层上不超过8个电子,当某元素基态原子的最外层电子数是次外层电子数的1.5倍时,该元素基态原子的核外电子排布式为1s22s22p1,B正确;已知K是19号元素,基态K原子的核外电子排布式为1s22s22p63s23p64s1,共占据10个原子轨道,即其核外电子的空间运动状态共有10种,C错误;根据洪特规则可知,1s22s22p2的价层电子的轨道表示式为,D错误。
10. B 基态原子中,填入能量相同轨道的电子总是优先单独分占,且自旋平行,故2p能级上电子排布式违背了洪特规则,A正确;硼为5号元素,基态电子排布式为1s22s22p1,图示为基态硼原子的电子排布图,B错误;当电子排布在同一轨道时,每个轨道最多容纳2个电子,且自旋方向相反,该排布图违背了泡利原理,C正确;1s22s22p63s23p63d54s1的电子排布是半充满的,比较稳定,符合构造原理和洪特规则特例,书写正确,D正确。
11. B 基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,基态Mn的价电子排布图为,A错误;基态Mn失去电子形成Mn2+时,应失去4s轨道上的电子,C错误;基态Mn的2p和3p轨道的能量不同,2p轨道的能量低于3p,D错误。
12. C 电子排布为半充满时,原子的能量最低,较稳定,所以基态铜(Cu)的电子排布式为[Ar]3d104s1,A错误;甲酸乙酯先生成后消耗,是中间产物,不是催化剂,B错误;由图可知,步骤④中的C—O和H—O均发生了断裂,生成了金属羟基化合物(H—O—M)和甲酸乙酯,C正确;催化剂可以增大反应速率,降低反应的活化能,改变反应历程,但不改变反应的焓变,D错误。
13. (1) ①1s22s22p63s23p2 ②1s22s22p1 ③1s22s22p63s23p63d8或[Ar]3d8 1s22s22p63s23p63d5或[Ar]3d5 1s22s22p63s23p6或[Ne]3s23p6 (2) Br
(3) M 3 (4) [Ar]3d104s24p3 4 ⅤA
14. (1) D C
(2) 纺锤
(3) N 球形
(4) 1s22s22p63s23p63d74s2或[Ar]3d74s2 Mn
15. (1) 第2周期ⅥA族 (2) Na cd
(3) N2H4+2H2O2===N2↑+4H2O
16. (1) 3d104s1 (2) NH3
(3) Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,故Cu2O更稳定
(4) 0.9 mol NO、1.3 mol NO2 2 mol
解析:由题给信息推知,A、B、C、D、E、F、G依次为B、C、N、O、Na、S、Cu。(1) G为Cu,基态铜原子的核外电子排布式为[Ar]3d104s1,则价电子排布式为3d104s1。(2) 元素B、C分别为C元素和N元素,简单气态氢化物分别为CH4和NH3,由于NH3分子之间存在氢键,所以NH3的沸点较高。(3) Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,故Cu2O更稳定,CuO在加热条件下容易转化为Cu2O。(4) 同时产生两种气体,气体相对分子质量均小于50,则气体为NO、NO2,根据原子守恒可知,生成的n(NaNO3)=2.2 mol,则n(NO)+n(NO2)=2.2 mol,根据得失电子守恒可知3n(NO)+n(NO2)=4n(O2)=4 mol,联立解得n(NO)=0.9 mol,n(NO2)=1.3 mol,根据原子守恒及得失电子守恒可知,n(CuSO4)=n(Cu)=2n(O2)=2 mol。
1 下列现象中与电子跃迁无关的是( )
A. 节日燃放的焰火 B. 舞台LED灯光 C. 广州塔霓虹灯光 D. 虎英公园水中倒影
2 下列电子排布式能正确表示基态原子电子排布的是( )
A. 1s22s22p63s13p3
B. 1s22s22p63s23p63d104s14p1
C. 1s22s22p63s23p63d24s1
D. 1s22s22p63s23p63d104s24p1
3 [2024江苏阶段练习]下列轨道表示式能表示基态硫原子最外层电子排布的是( )
A. B.
C. D.
4 [2025连云港赣榆期末]下列表示错误的是( )
A. Cu的简化电子排布式:[Ar]3d104s1
B. px轨道电子云轮廓图:
C. 核外电子按能量分为不同的能层:如1s、2s、2p、3d等
D. 氧的基态原子的轨道表示式:
5 [2024苏州昆山期中]下列关于基态Fe或Fe3+的说法错误的是( )
A. 基态Fe3+的单电子数目为5
B. 基态Fe有7种能量不同的电子
C. 基态Fe的价电子的原子轨道有6种伸展方向
D. 原子核外有26种不同运动状态的电子
6 下列各组指定的元素,不能形成AB2型化合物的是( )
A. [He]2s22p2和[He]2s22p4
B. [Ne]3s23p4和[He]2s22p4
C. [Ne]3s2和[He]2s22p5
D. [Ne]3s1和[Ne]3s23p4
7 “六六六”(如图所示)等有机氯杀虫剂揭开了人类施用有机合成农药的新篇章。其有较高的杀虫活性,对人体的急性毒性较低,还有容易生产、价格低廉等优点。下列说法正确的是( )
A. 原子半径:H>C>Cl
B. 气态氢化物的热稳定性:CH4>HCl
C. 氯原子的原子轨道能量高低:3px<3py
D. 基态氯原子中,未成对电子数与成对电子数之比为1∶16
8 [2024镇江句容期中]下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Cr的价电子排布图为
C. 基态Ni2+的电子排布式为[Ar]3d10
D. 基态Cu的价电子排布式为3d94s2
9 下列说法正确的是( )
A. 多电子原子不同能级能量高低:4s>3d>3p
B. 某元素基态原子的最外层电子数是次外层电子数的1.5倍,则该元素基态原子的核外电子排布式为1s22s22p1
C. 基态K原子的核外电子的空间运动状态共有19种
D. 根据洪特规则可知,1s22s22p2的价层电子的轨道表示式为
10 下列有关电子排布式或轨道表示式的结论错误的是( )
选项 电子排布式或轨道表示式 结论
A 1s22s22p2p 违背洪特规则
B 某激发态硼原子的轨道表示式
C O的轨道表示式: 违背泡利原理
D 1s22s22p63s23p63d54s1 书写正确
11 [2025无锡江阴月考]已知Mn的核电荷数为25,下列有关基态Mn的电子排布正确的是( )
A. 基态Mn的价电子排布图为
B. 基态Mn的电子在各轨道上排布时,先排满4s轨道,再排3d轨道
C. 基态Mn失去电子形成Mn2+时,应失去3d轨道上的电子
D. 基态Mn的2p和3p轨道的形状、能量均相同
12 CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在2060年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理CO2的手段,使CO2排放量减少甚至是回收利用,以此达到CO2“零排放”的目的。在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了CO2的转化过程如图所示。下列说法正确的是( )
CO2转化成甲醇的催化机理
A. 基态铜的电子排布:[Ar]3d94s2
B. 甲酸乙酯是该过程的催化剂
C. 步骤④中有化学键的断裂和形成
D. 反应过程中,催化剂参与反应,降低了反应的焓变
13 按要求填空。
(1) 根据构造原理写出下列基态原子或离子的核外电子排布式。
①A元素原子核外M层电子数是L层电子数的一半:______________。
②B元素原子的最外层电子数是次外层电子数的1.5倍:______________。
③基态Ni2+、Fe3+、S2-的电子排布式分别为__________________、__________________、__________________。
(2) 某元素的最外层电子排布式是4s24p5,则其元素符号为________。
(3) 基态Ti2+中,电子占据的最高的能层符号为________,该能层有____个能级。
(4) 写出基态砷原子的电子排布式:____________,砷位于元素周期中第______周期______族。
14 (1) 下列Li原子的电子排布图表示的状态中,能量最低和最高的分别为________、________(填字母)。
A.
B.
C.
D.
(2) 基态Fe原子价电子的电子排布图(或轨道表示式)为__________________
_______________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(3) 基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________。
(4) 基态Co原子核外电子排布式为______________。元素Mn与O中,基态原子核外未成对电子数较多的是________。
15 [2025南通阶段练习]现有部分元素的性质与原子(或分子)结构如下表:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下,单质为双原子分子,分子中含有3个共用电子对
Y M层比K层少1个电子
Z 第3周期元素的简单离子中半径最小
(1) 元素T在元素周期表中的位置是___________________。
(2) 元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填字母)。
a. Y单质的熔点比Z单质低
b. Y的化合价比Z低
c. Y单质与水反应比Z单质剧烈
d. Y最高价氧化物的水化物的碱性比Z强
(3) 元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时的密度与氧气相等(同温同压下),Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:______________________________。
16 原子序数依次增大的A、B、C、D、E、F、G七种元素。其中A的原子有5种不同运动状态的电子;B的基态原子有3个不同的能级,各能级中的电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;E为它所在周期中原子半径最大的主族元素;F和D位于同一主族,G的原子序数为29。
(1) 基态G原子的价电子排布式为________。
(2) 元素B、C的简单气态氢化物的沸点较高的是______(填化学式)。
(3) GD在加热条件下容易转化为G2D,从原子结构的角度解释原因:________
____________________________________________________________________________________________________________________________________________。
(4) G与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸盐,为将生成的两种气体(气体相对分子质量均小于50)完全转化为最高价含氧酸盐,消耗了1 mol O2 和1 L 2.2 mol/L NaOH溶液。则两种气体的分子式及物质的量分别为___________________,生成硫酸铜的物质的量为________。
课时2 原子核外电子的排布
1. D 水中倒影是光线反射的结果,与电子跃迁无关,故选D。
2. D 基态核外电子排布应该是1s22s22p63s23p2,A错误;基态核外电子排布应该是1s22s22p63s23p63d104s2,B错误;基态核外电子排布应该是1s22s22p63s23p63d14s2,C错误; 1s22s22p63s23p63d104s24p1符合原子核外电子排布规律,D正确。
3. C 基态硫原子最外层电子排布式为3s23p4,基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,其轨道表示式为。故选C。
4. C 能层可表示为K、L、M、N等,能级才用s、p、d等来表示,C错误。
5. C 基态Fe3+的电子排布式为[Ar]3d5,有5个单电子,A正确;处于不同能级上的电子的能量不同,基态Fe有1s、2s、2p、3s、3p、3d、4s 7个不同能级,故基态Fe有7种不同能量的电子,B正确;基态Fe的价电子排布为3d64s2,4s能级是球形,无伸展方向,3d能级有5个轨道,有5种伸展方向,C错误;铁有26个电子,原子核外有26种不同运动状态的电子,D正确。
6. D 核外电子排布式为[He]2s22p2的元素为C,核外电子排布式为[He]2s22p4的元素为O,二者可形成CO2,A不符合题意;核外电子排布式为[Ne]3s23p4的元素为S,核外电子排布式为[He]2s22p4的元素为O,二者可形成SO2,B不符合题意;核外电子排布式为[Ne]3s2的元素为Mg,核外电子排布式为[He]2s22p5 的元素为F,二者可形成MgF2,C不符合题意;核外电子排布式为[Ne]3s1的元素为Na,核外电子排布式为[Ne]3s23p4 的元素为S,二者可形成Na2S,不能形成AB2型化合物,D符合题意。
7. D 电子层数越多,原子半径越大,则原子半径Cl>C>H,A错误;非金属性Cl>C,非金属性越强,其气态氢化物的热稳定性越强,则热稳定性HCl>CH4,B错误;同一能级上简并轨道的能量相同,则氯原子的原子轨道能量3px=3py,C错误;基态Cl原子的核外电子排布式为1s22s22p63s23p5,未成对电子数为1,成对电子数为16,二者的个数之比为1∶16,D正确。
8. B 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量,如电子能量2p<3s,A错误;根据洪特规则,基态Cr原子的价电子排布图为,B正确;基态Ni2+的电子排布式为[Ar]3d8,C错误;根据洪特规则,基态Cu的价电子排布式为3d104s1,D错误。
9. B 根据构造原理可知,多电子原子不同能级能量高低3d>4s>3p,A错误;已知最外电子层上不超过8个电子,当某元素基态原子的最外层电子数是次外层电子数的1.5倍时,该元素基态原子的核外电子排布式为1s22s22p1,B正确;已知K是19号元素,基态K原子的核外电子排布式为1s22s22p63s23p64s1,共占据10个原子轨道,即其核外电子的空间运动状态共有10种,C错误;根据洪特规则可知,1s22s22p2的价层电子的轨道表示式为,D错误。
10. B 基态原子中,填入能量相同轨道的电子总是优先单独分占,且自旋平行,故2p能级上电子排布式违背了洪特规则,A正确;硼为5号元素,基态电子排布式为1s22s22p1,图示为基态硼原子的电子排布图,B错误;当电子排布在同一轨道时,每个轨道最多容纳2个电子,且自旋方向相反,该排布图违背了泡利原理,C正确;1s22s22p63s23p63d54s1的电子排布是半充满的,比较稳定,符合构造原理和洪特规则特例,书写正确,D正确。
11. B 基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,基态Mn的价电子排布图为,A错误;基态Mn失去电子形成Mn2+时,应失去4s轨道上的电子,C错误;基态Mn的2p和3p轨道的能量不同,2p轨道的能量低于3p,D错误。
12. C 电子排布为半充满时,原子的能量最低,较稳定,所以基态铜(Cu)的电子排布式为[Ar]3d104s1,A错误;甲酸乙酯先生成后消耗,是中间产物,不是催化剂,B错误;由图可知,步骤④中的C—O和H—O均发生了断裂,生成了金属羟基化合物(H—O—M)和甲酸乙酯,C正确;催化剂可以增大反应速率,降低反应的活化能,改变反应历程,但不改变反应的焓变,D错误。
13. (1) ①1s22s22p63s23p2 ②1s22s22p1 ③1s22s22p63s23p63d8或[Ar]3d8 1s22s22p63s23p63d5或[Ar]3d5 1s22s22p63s23p6或[Ne]3s23p6 (2) Br
(3) M 3 (4) [Ar]3d104s24p3 4 ⅤA
14. (1) D C
(2) 纺锤
(3) N 球形
(4) 1s22s22p63s23p63d74s2或[Ar]3d74s2 Mn
15. (1) 第2周期ⅥA族 (2) Na cd
(3) N2H4+2H2O2===N2↑+4H2O
16. (1) 3d104s1 (2) NH3
(3) Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,故Cu2O更稳定
(4) 0.9 mol NO、1.3 mol NO2 2 mol
解析:由题给信息推知,A、B、C、D、E、F、G依次为B、C、N、O、Na、S、Cu。(1) G为Cu,基态铜原子的核外电子排布式为[Ar]3d104s1,则价电子排布式为3d104s1。(2) 元素B、C分别为C元素和N元素,简单气态氢化物分别为CH4和NH3,由于NH3分子之间存在氢键,所以NH3的沸点较高。(3) Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,故Cu2O更稳定,CuO在加热条件下容易转化为Cu2O。(4) 同时产生两种气体,气体相对分子质量均小于50,则气体为NO、NO2,根据原子守恒可知,生成的n(NaNO3)=2.2 mol,则n(NO)+n(NO2)=2.2 mol,根据得失电子守恒可知3n(NO)+n(NO2)=4n(O2)=4 mol,联立解得n(NO)=0.9 mol,n(NO2)=1.3 mol,根据原子守恒及得失电子守恒可知,n(CuSO4)=n(Cu)=2n(O2)=2 mol。
