3.1 金属键 金属晶体 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 3.1 金属键 金属晶体 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 764.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 11:19:04 | ||
图片预览



文档简介
第一单元 金属键 金属晶体
1 下列有关金属元素特性的叙述正确的是( )
A. 金属元素的原子具有还原性,离子只具有氧化性
B. 金属元素在化合物中一般显正价
C. 金属元素在不同化合物中的化合价均不同
D. 金属元素的单质在常温下均为金属晶体
2 [2025连云港期末]2024年12月26日,我国第六代战机首飞成功。战机中常使用高强度、耐高温的钛合金材料,钛合金材料属于( )
A. 分子晶体 B. 离子晶体 C. 金属晶体 D. 共价晶体
3 下列有关金属键的叙述错误的是( )
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C. 金属键中的自由电子属于整块固态金属
D. 金属的部分性质与金属键有关
4 2022年12月2日,《科学》杂志发表了中国科学技术大学潘建伟、赵博团队的重大成果,他们在国际上首次制备了高相空间密度的钠钾超冷三原子分子系综。这是超冷分子研究的里程碑,为超冷化学和量子模拟等研究开辟了新方向。下列关于钠、钾的说法正确的是( )
A. 钙的熔、沸点低于钾
B. 金属钠中的金属键比金属钾弱
C. 钠钾合金的熔点比钠单质高
D. 金属镁的硬度大于金属钠
5 铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体在不同温度下转化的图示。
δ-Fe γ-Fe α-Fe
已知:δFeγFeαFe。下列有关说法正确的是( )
A. δ、γ、α三种晶体互为同分异构体
B. γ-Fe晶体为体心立方体紧密堆积
C. α-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
D. δ-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
6 下列有关金属晶体的说法错误的是( )
A. 金属晶体是一种“巨型分子”
B. “电子气”为所有原子所共有
C. 简单立方堆积的空间利用率最低
D. 体心立方堆积的空间利用率最高
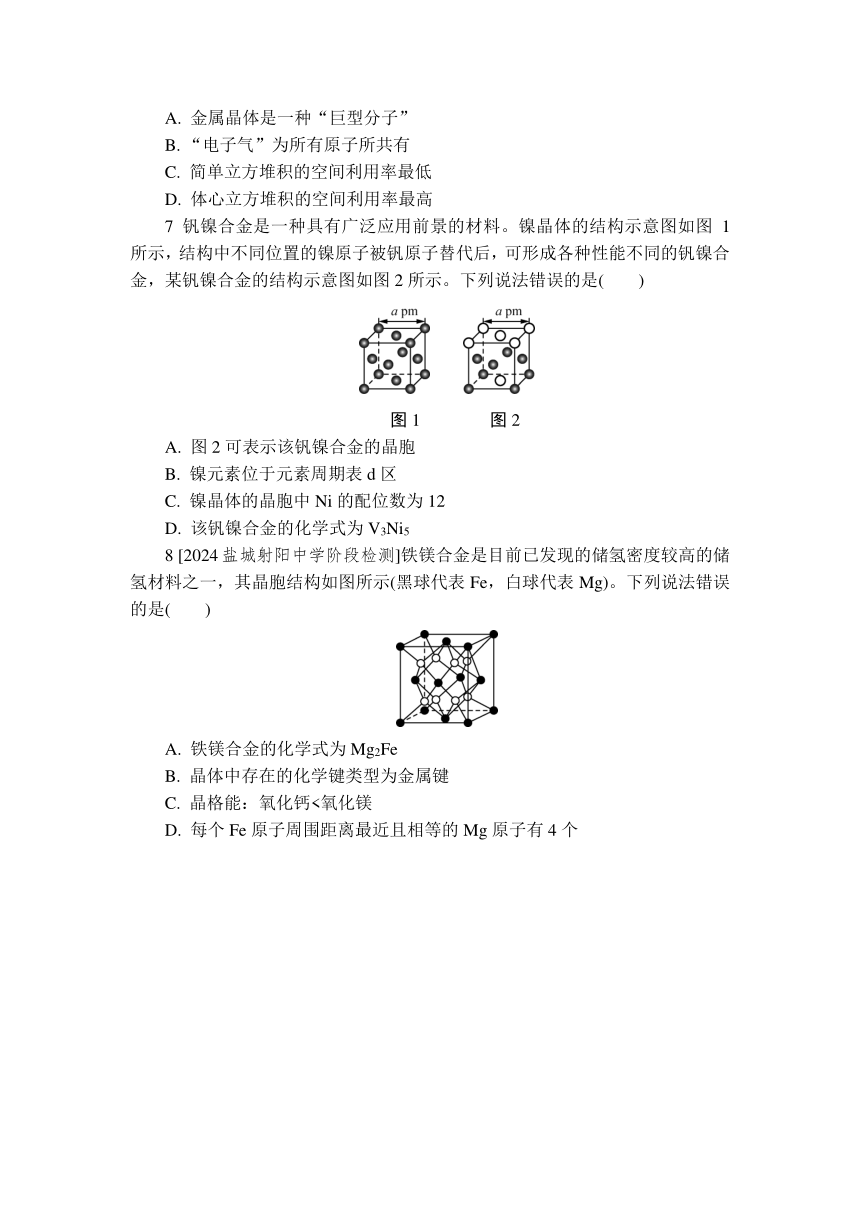
7 钒镍合金是一种具有广泛应用前景的材料。镍晶体的结构示意图如图1所示,结构中不同位置的镍原子被钒原子替代后,可形成各种性能不同的钒镍合金,某钒镍合金的结构示意图如图2所示。下列说法错误的是( )
图1 图2
A. 图2可表示该钒镍合金的晶胞
B. 镍元素位于元素周期表d区
C. 镍晶体的晶胞中Ni的配位数为12
D. 该钒镍合金的化学式为V3Ni5
8 [2024盐城射阳中学阶段检测]铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。下列说法错误的是( )
A. 铁镁合金的化学式为Mg2Fe
B. 晶体中存在的化学键类型为金属键
C. 晶格能:氧化钙<氧化镁
D. 每个Fe原子周围距离最近且相等的Mg原子有4个
9 某小组设计下列实验验证Ag+ 和Fe2+的反应为可逆反应。
实验1:将0.010 0 mol/L Ag2SO4溶液与0.040 0 mol/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验2:取实验1中沉淀,加入浓硝酸,灰黑色固体溶解,产生红棕色气体。
实验3:向少量Ag粉中加入0.010 0 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
下列说法正确的是( )
A. 实验1中发生反应的离子方程式为Ag2SO4+2Fe2+===2Fe3++2Ag↓+SO
B. 实验2可证明实验1中灰黑色沉淀为Ag,产生气体为NO
C. 实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替
D. 银的晶胞结构如图,Ag的配位数为8
10 下列有关Cu及其化合物的叙述正确的是( )
A. 如上图所示的Cu2O晶胞中,Cu原子的配位数为2
B. FeCl3溶液刻蚀Cu制印刷电路板,说明还原性:Cu>Fe
C. Cu是Ⅷ族元素
D. 除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥
11 铁与镁组成的储氢合金的立方晶胞结构如图所示。铁原子位于顶点和面心,镁原子位于将晶胞平分为8个立方单位的体心。下列说法正确的是( )
A. 距离Fe原子最近的Mg原子数为4
B. 晶体中存在金属阳离子,故该合金是离子晶体
C. Fe原子与Mg原子间最短距离为b nm
D. 晶体储氢时,H2在晶胞的体心和棱的中心位置,则储氢后化学式为FeMg2H2
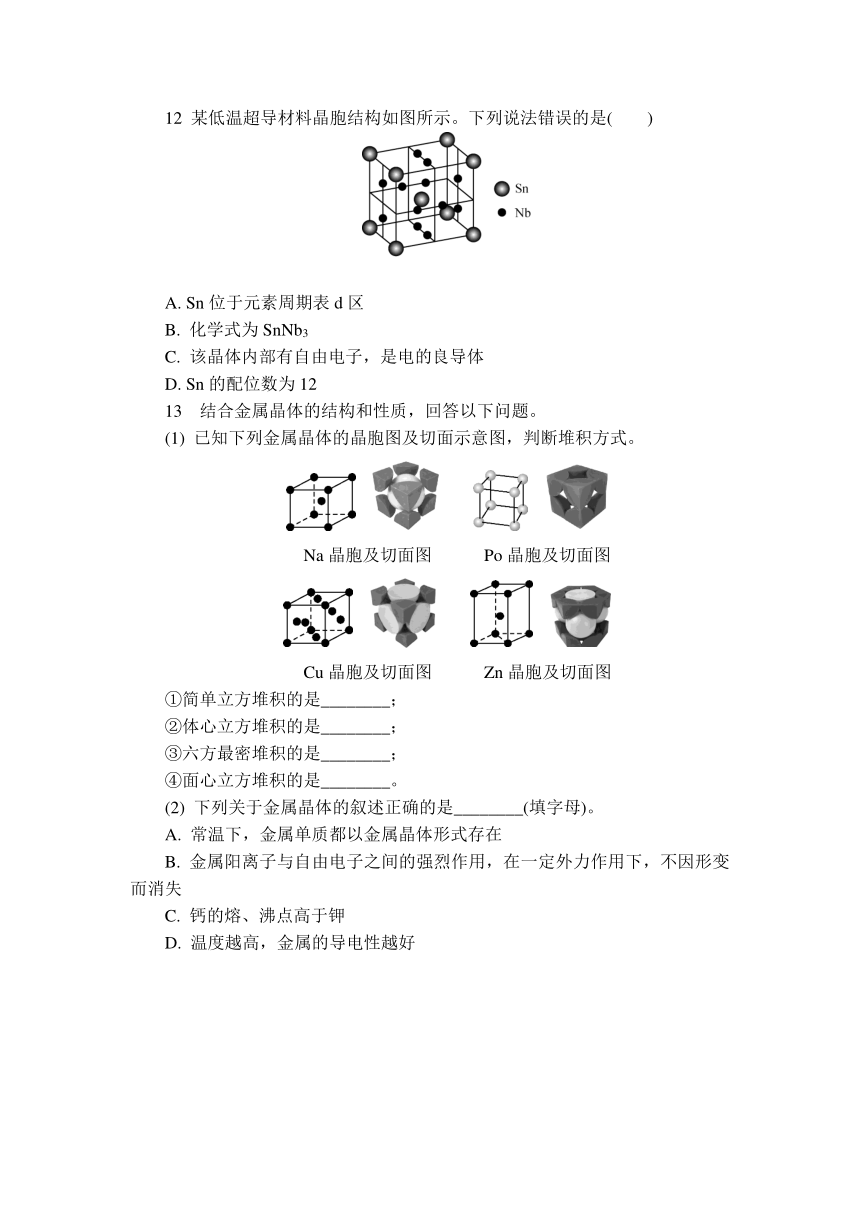
12 某低温超导材料晶胞结构如图所示。下列说法错误的是( )
A. Sn位于元素周期表d区
B. 化学式为SnNb3
C. 该晶体内部有自由电子,是电的良导体
D. Sn的配位数为12
13 结合金属晶体的结构和性质,回答以下问题。
(1) 已知下列金属晶体的晶胞图及切面示意图,判断堆积方式。
Na晶胞及切面图 Po晶胞及切面图
Cu晶胞及切面图 Zn晶胞及切面图
①简单立方堆积的是________;
②体心立方堆积的是________;
③六方最密堆积的是________;
④面心立方堆积的是________。
(2) 下列关于金属晶体的叙述正确的是________(填字母)。
A. 常温下,金属单质都以金属晶体形式存在
B. 金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C. 钙的熔、沸点高于钾
D. 温度越高,金属的导电性越好
14 金属晶体在生产、生活中有广泛应用。回答下列问题。
(1) 1 183 K以下纯铁晶体的基本结构单元如图1所示,1 183 K以上转变为图2所示的基本结构单元,在两种晶体中最邻近的铁原子间的距离相同。
图1 图2
①铁原子的简化电子排布式为_____________;铁晶体中铁原子以________键相互结合。
②在1 183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为________;在1 183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为________。
(2) 铜的晶胞示意图为图3,1个晶胞中所含的铜原子数为________。
图3
15 (1) [2024泰州中学月考]铁的晶体有多种结构,其中两种晶体的晶胞结构如图1中甲、乙所示,则甲、乙两种晶胞中铁原子的个数之比为________。
甲 乙
图1
(2) [2025南通海安中学月考]一种镍基合金储氢后的晶胞结构如图2所示。写出基态Ni核外电子排布式:___________________,该合金储氢后,H2与Ni的物质的量之比为________。
图2
16 (1) [2024南通期中]某种铁的合金晶胞结构如图1所示,则化学式为________。
图1
(2) [2024镇江丹阳开学考试]由Cr、Al元素所形成的某种合金的晶胞结构如图2所示。基态Cr的电子排布式为__________。该合金中Cr、Al原子个数比为________。
图2
(3) 某晶体的晶胞结构如图3所示。该晶体的化学式是______________,在晶体中,每个Ti原子、Co原子周围距离最近的O原子数目分别为________、________。
图3
(4) 有一种钛原子和碳原子构成的气态团簇分子如图4所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,其化学式为________(填字母,下同)。
A. Ti14C13
B. TiC
C. Ti14C4
D. Ti4C3 图4
(5) Fe的一种晶体结构如图5中的甲、乙(乙由八个甲堆积而成)所示,若按甲中虚线方向切乙,得到的切面图正确的是________。
甲 乙
图5
A. B. C. D.
第一单元 金属键 金属晶体
1. B 变价金属的中间价态离子既有还原性又有氧化性,A错误;金属元素在化合物中一般显正价,B正确;同种金属元素在不同化合物中的化合价可以相同,也可以不同,C错误;汞在常温下为液体,此时不属于晶体,D错误。
2. C 合金是金属材料,属于金属晶体,C正确。
3. B 金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此没有方向性和饱和性,A正确;金属键是存在于金属阳离子和“自由电子”之间的强烈的相互作用,这些“自由电子”为所有阳离子所共用,其本质是电性作用,包括静电吸引和静电排斥,B错误;由于在金属中电子是离域的,即不属于任何一个原子而属于金属整体,C正确;金属的性质与金属键的强弱有关,D正确。
4. D 钙离子的半径比钾离子小,且所带的电荷多,钙的金属键强于钾,故熔、沸点高于钾,A错误;钠离子的半径比钾离子小,故金属钠中的金属键比金属钾强,B错误;合金的熔点比各成分金属的低,故钠钾合金的熔点比钠单质或钾单质都低,C错误;镁离子的半径比钠离子小,且所带电荷多,故金属镁的金属键比金属钠强,金属镁的熔、沸点和硬度都比金属钠大,D正确。
5. C 同分异构体是分子式相同而结构不同的化合物的互称,铁的三种不同晶体均为单质,A错误;结合γ-Fe晶体的晶胞结构可知,其为面心立方紧密堆积,B错误;α-Fe晶体的堆积方式为简单立方堆积,与每个Fe原子距离相等且最近的Fe原子有6个,C正确;δ-Fe晶体中,以体心的Fe原子为例,位于顶点的8个Fe原子到体心的Fe原子的距离相等且最近,D错误。
6. D 金属晶体的堆积方式的空间利用率:简单立方为52%,体心立方为68%,面心立方为74%,因此简单立方的空间利用率最低,面心立方空间利用率最高,D错误。
7. A 晶体是由晶胞无隙并置形成的,图2结构不能进行无隙并置,故图2结构不是晶胞,A错误;镍元素为Ⅷ族元素,位于元素周期表d区,B正确;镍晶体的晶胞为面心立方结构,其配位数为12,C正确;依据图2的替换位置推出晶胞结构为,由均摊法可知,该晶胞中含有Ni个数=8×+4×=5,同理,V个数=8×+2×+1=3,故钒镍合金的化学式为V3Ni5,D正确。
8. D 由均摊法知,晶胞中,N(Mg)=8,N(Fe)=8×+6×=4,Fe、Mg原子个数之比为1∶2,故其化学式为Mg2Fe,A正确;铁镁合金中只含金属键,B正确;晶格能与离子半径成反比,与电荷数成正比,阴离子相同,半径Mg2+9. C 实验1中为0.010 0 mol/L Ag2SO4溶液与0.040 0 mol/L FeSO4溶液(pH=1)产生灰黑色沉淀,溶液呈黄色,则发生反应生成银单质和铁离子,离子方程式为Ag++Fe2+===Fe3++Ag↓,A错误;一氧化氮为无色气体,二氧化氮为红棕色气体,B错误;Fe(NO3)3溶液(pH=1)中的NO具有强氧化性,会干扰实验,故实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替,C正确; 由图可知,晶胞为面心立方堆积,Ag的配位数为12,D错误。
10. A 根据图示可知,白球数目=8×+1=2,黑球数目是4,结合Cu2O化学式可知,黑球表示Cu原子,白球表示O原子,则Cu2O晶胞中Cu原子的配位数为2,A正确;FeCl3刻蚀Cu制印刷电路板,发生反应2FeCl3+Cu===2FeCl2+CuCl2,说明微粒的还原性Cu>Fe2+,B错误;Cu是29号元素,在元素周期表中位于第4周期ⅠB族,C错误;稀硝酸与Cu、CuO都会反应生成可溶性Cu(NO3)2,不能达到除杂、净化的目的,应该使用稀盐酸或稀硫酸,D错误。
11. D 位于顶点的铁原子与位于体对角线上镁原子的距离最近,则铁原子的配位数为8,A错误;晶体中存在金属阳离子,没有阴离子,有自由电子,所以该合金是金属晶体,B错误;位于顶点的铁原子与镁原子间的最短距离为体对角线的,则铁原子与镁原子间最短距离为b nm,C错误;晶胞中位于顶点和面心的铁原子个数=8×+6×=4,位于体内的镁原子个数为8,位于体心和棱的中心位置的氢分子个数=12×+1=4,则储氢后化学式为FeMg2H2,D正确。
12. A Sn、C同主族,Sn的价电子排布式为5s25p2,位于元素周期表p区,A错误;晶胞中,N(Sn)=8×+1=2,N(Nb)=12×=6,则Sn、Nb的原子个数之比为1∶3,化学式为SnNb3,B正确;该晶体属于金属晶体,晶体内部有自由电子,可作为低温超导材料,是电的良导体,C正确;与顶点Sn距离最近且相等的Nb位于立方体的面心,则Sn的配位数为12,D正确。
13. (1) ①Po ②Na ③Zn ④Cu (2) BC
解析:(2) 常温下,Hg为液态,A错误;因为金属键无方向性,金属键在一定范围内不因形变而消失,B正确;钙的金属键强于钾,熔、沸点高于钾,C正确;温度升高,金属的导电性减弱,D错误。
14. (1) ①[Ar]3d64s2 金属 ②8 12 (2) 4
15. (1) 1∶2 (2) [Ar]3d84s2或1s22s22p63s23p63d84s2 3∶5
16. (1) FeNi2
(2) 1s22s22p63s23p63d54s1或[Ar]3d54s1 2∶1
(3) CoTiO3 6 12 (4) A (5) A
解析:(1) 由均摊法知,晶胞中,N(Fe)=8×+6×=4,N(Ni)=8,Fe、Ni原子个数之比为1∶2,故其化学式为FeNi2。(2) Cr为24号元素,半充满时最稳定,则其简化电子排布式为[Ar]3d54s1。晶胞中,N(Cr)=8×+2=4,N(Al)=8×+1=2,则该合金中Cr、Al原子个数比为2∶1。(3) 晶胞中含有的N(O)=6×=3,N(Co)=8×=1,N(Ti)=1,故其化学式为CoTiO3。Ti原子位于晶胞的体心,其周围距离最近的O原子位于6个面的中心,故Ti原子周围距离最近的O原子数目为6;Co原子位于晶胞的顶点,O原子位于晶胞的面心,故Co原子周围距离最近的O原子数目为12。(4) 由题意知,该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成,其化学式为Ti14C13,故选A。(5) 图甲中Fe位于顶点和体心,乙由8个甲组成,按虚线方向切乙形成的截面边长不等(边长和面对角线的长不相等),排除B、D;由于每个小立方体的体心均有1个铁原子,排除C。故选A。
1 下列有关金属元素特性的叙述正确的是( )
A. 金属元素的原子具有还原性,离子只具有氧化性
B. 金属元素在化合物中一般显正价
C. 金属元素在不同化合物中的化合价均不同
D. 金属元素的单质在常温下均为金属晶体
2 [2025连云港期末]2024年12月26日,我国第六代战机首飞成功。战机中常使用高强度、耐高温的钛合金材料,钛合金材料属于( )
A. 分子晶体 B. 离子晶体 C. 金属晶体 D. 共价晶体
3 下列有关金属键的叙述错误的是( )
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C. 金属键中的自由电子属于整块固态金属
D. 金属的部分性质与金属键有关
4 2022年12月2日,《科学》杂志发表了中国科学技术大学潘建伟、赵博团队的重大成果,他们在国际上首次制备了高相空间密度的钠钾超冷三原子分子系综。这是超冷分子研究的里程碑,为超冷化学和量子模拟等研究开辟了新方向。下列关于钠、钾的说法正确的是( )
A. 钙的熔、沸点低于钾
B. 金属钠中的金属键比金属钾弱
C. 钠钾合金的熔点比钠单质高
D. 金属镁的硬度大于金属钠
5 铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体在不同温度下转化的图示。
δ-Fe γ-Fe α-Fe
已知:δFeγFeαFe。下列有关说法正确的是( )
A. δ、γ、α三种晶体互为同分异构体
B. γ-Fe晶体为体心立方体紧密堆积
C. α-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
D. δ-Fe晶体中,与每个Fe原子距离相等且最近的Fe原子有6个
6 下列有关金属晶体的说法错误的是( )
A. 金属晶体是一种“巨型分子”
B. “电子气”为所有原子所共有
C. 简单立方堆积的空间利用率最低
D. 体心立方堆积的空间利用率最高
7 钒镍合金是一种具有广泛应用前景的材料。镍晶体的结构示意图如图1所示,结构中不同位置的镍原子被钒原子替代后,可形成各种性能不同的钒镍合金,某钒镍合金的结构示意图如图2所示。下列说法错误的是( )
图1 图2
A. 图2可表示该钒镍合金的晶胞
B. 镍元素位于元素周期表d区
C. 镍晶体的晶胞中Ni的配位数为12
D. 该钒镍合金的化学式为V3Ni5
8 [2024盐城射阳中学阶段检测]铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。下列说法错误的是( )
A. 铁镁合金的化学式为Mg2Fe
B. 晶体中存在的化学键类型为金属键
C. 晶格能:氧化钙<氧化镁
D. 每个Fe原子周围距离最近且相等的Mg原子有4个
9 某小组设计下列实验验证Ag+ 和Fe2+的反应为可逆反应。
实验1:将0.010 0 mol/L Ag2SO4溶液与0.040 0 mol/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验2:取实验1中沉淀,加入浓硝酸,灰黑色固体溶解,产生红棕色气体。
实验3:向少量Ag粉中加入0.010 0 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
下列说法正确的是( )
A. 实验1中发生反应的离子方程式为Ag2SO4+2Fe2+===2Fe3++2Ag↓+SO
B. 实验2可证明实验1中灰黑色沉淀为Ag,产生气体为NO
C. 实验3中Fe2(SO4)3溶液不可以用Fe(NO3)3溶液代替
D. 银的晶胞结构如图,Ag的配位数为8
10 下列有关Cu及其化合物的叙述正确的是( )
A. 如上图所示的Cu2O晶胞中,Cu原子的配位数为2
B. FeCl3溶液刻蚀Cu制印刷电路板,说明还原性:Cu>Fe
C. Cu是Ⅷ族元素
D. 除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥
11 铁与镁组成的储氢合金的立方晶胞结构如图所示。铁原子位于顶点和面心,镁原子位于将晶胞平分为8个立方单位的体心。下列说法正确的是( )
A. 距离Fe原子最近的Mg原子数为4
B. 晶体中存在金属阳离子,故该合金是离子晶体
C. Fe原子与Mg原子间最短距离为b nm
D. 晶体储氢时,H2在晶胞的体心和棱的中心位置,则储氢后化学式为FeMg2H2
12 某低温超导材料晶胞结构如图所示。下列说法错误的是( )
A. Sn位于元素周期表d区
B. 化学式为SnNb3
C. 该晶体内部有自由电子,是电的良导体
D. Sn的配位数为12
13 结合金属晶体的结构和性质,回答以下问题。
(1) 已知下列金属晶体的晶胞图及切面示意图,判断堆积方式。
Na晶胞及切面图 Po晶胞及切面图
Cu晶胞及切面图 Zn晶胞及切面图
①简单立方堆积的是________;
②体心立方堆积的是________;
③六方最密堆积的是________;
④面心立方堆积的是________。
(2) 下列关于金属晶体的叙述正确的是________(填字母)。
A. 常温下,金属单质都以金属晶体形式存在
B. 金属阳离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C. 钙的熔、沸点高于钾
D. 温度越高,金属的导电性越好
14 金属晶体在生产、生活中有广泛应用。回答下列问题。
(1) 1 183 K以下纯铁晶体的基本结构单元如图1所示,1 183 K以上转变为图2所示的基本结构单元,在两种晶体中最邻近的铁原子间的距离相同。
图1 图2
①铁原子的简化电子排布式为_____________;铁晶体中铁原子以________键相互结合。
②在1 183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为________;在1 183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为________。
(2) 铜的晶胞示意图为图3,1个晶胞中所含的铜原子数为________。
图3
15 (1) [2024泰州中学月考]铁的晶体有多种结构,其中两种晶体的晶胞结构如图1中甲、乙所示,则甲、乙两种晶胞中铁原子的个数之比为________。
甲 乙
图1
(2) [2025南通海安中学月考]一种镍基合金储氢后的晶胞结构如图2所示。写出基态Ni核外电子排布式:___________________,该合金储氢后,H2与Ni的物质的量之比为________。
图2
16 (1) [2024南通期中]某种铁的合金晶胞结构如图1所示,则化学式为________。
图1
(2) [2024镇江丹阳开学考试]由Cr、Al元素所形成的某种合金的晶胞结构如图2所示。基态Cr的电子排布式为__________。该合金中Cr、Al原子个数比为________。
图2
(3) 某晶体的晶胞结构如图3所示。该晶体的化学式是______________,在晶体中,每个Ti原子、Co原子周围距离最近的O原子数目分别为________、________。
图3
(4) 有一种钛原子和碳原子构成的气态团簇分子如图4所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,其化学式为________(填字母,下同)。
A. Ti14C13
B. TiC
C. Ti14C4
D. Ti4C3 图4
(5) Fe的一种晶体结构如图5中的甲、乙(乙由八个甲堆积而成)所示,若按甲中虚线方向切乙,得到的切面图正确的是________。
甲 乙
图5
A. B. C. D.
第一单元 金属键 金属晶体
1. B 变价金属的中间价态离子既有还原性又有氧化性,A错误;金属元素在化合物中一般显正价,B正确;同种金属元素在不同化合物中的化合价可以相同,也可以不同,C错误;汞在常温下为液体,此时不属于晶体,D错误。
2. C 合金是金属材料,属于金属晶体,C正确。
3. B 金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此没有方向性和饱和性,A正确;金属键是存在于金属阳离子和“自由电子”之间的强烈的相互作用,这些“自由电子”为所有阳离子所共用,其本质是电性作用,包括静电吸引和静电排斥,B错误;由于在金属中电子是离域的,即不属于任何一个原子而属于金属整体,C正确;金属的性质与金属键的强弱有关,D正确。
4. D 钙离子的半径比钾离子小,且所带的电荷多,钙的金属键强于钾,故熔、沸点高于钾,A错误;钠离子的半径比钾离子小,故金属钠中的金属键比金属钾强,B错误;合金的熔点比各成分金属的低,故钠钾合金的熔点比钠单质或钾单质都低,C错误;镁离子的半径比钠离子小,且所带电荷多,故金属镁的金属键比金属钠强,金属镁的熔、沸点和硬度都比金属钠大,D正确。
5. C 同分异构体是分子式相同而结构不同的化合物的互称,铁的三种不同晶体均为单质,A错误;结合γ-Fe晶体的晶胞结构可知,其为面心立方紧密堆积,B错误;α-Fe晶体的堆积方式为简单立方堆积,与每个Fe原子距离相等且最近的Fe原子有6个,C正确;δ-Fe晶体中,以体心的Fe原子为例,位于顶点的8个Fe原子到体心的Fe原子的距离相等且最近,D错误。
6. D 金属晶体的堆积方式的空间利用率:简单立方为52%,体心立方为68%,面心立方为74%,因此简单立方的空间利用率最低,面心立方空间利用率最高,D错误。
7. A 晶体是由晶胞无隙并置形成的,图2结构不能进行无隙并置,故图2结构不是晶胞,A错误;镍元素为Ⅷ族元素,位于元素周期表d区,B正确;镍晶体的晶胞为面心立方结构,其配位数为12,C正确;依据图2的替换位置推出晶胞结构为,由均摊法可知,该晶胞中含有Ni个数=8×+4×=5,同理,V个数=8×+2×+1=3,故钒镍合金的化学式为V3Ni5,D正确。
8. D 由均摊法知,晶胞中,N(Mg)=8,N(Fe)=8×+6×=4,Fe、Mg原子个数之比为1∶2,故其化学式为Mg2Fe,A正确;铁镁合金中只含金属键,B正确;晶格能与离子半径成反比,与电荷数成正比,阴离子相同,半径Mg2+
10. A 根据图示可知,白球数目=8×+1=2,黑球数目是4,结合Cu2O化学式可知,黑球表示Cu原子,白球表示O原子,则Cu2O晶胞中Cu原子的配位数为2,A正确;FeCl3刻蚀Cu制印刷电路板,发生反应2FeCl3+Cu===2FeCl2+CuCl2,说明微粒的还原性Cu>Fe2+,B错误;Cu是29号元素,在元素周期表中位于第4周期ⅠB族,C错误;稀硝酸与Cu、CuO都会反应生成可溶性Cu(NO3)2,不能达到除杂、净化的目的,应该使用稀盐酸或稀硫酸,D错误。
11. D 位于顶点的铁原子与位于体对角线上镁原子的距离最近,则铁原子的配位数为8,A错误;晶体中存在金属阳离子,没有阴离子,有自由电子,所以该合金是金属晶体,B错误;位于顶点的铁原子与镁原子间的最短距离为体对角线的,则铁原子与镁原子间最短距离为b nm,C错误;晶胞中位于顶点和面心的铁原子个数=8×+6×=4,位于体内的镁原子个数为8,位于体心和棱的中心位置的氢分子个数=12×+1=4,则储氢后化学式为FeMg2H2,D正确。
12. A Sn、C同主族,Sn的价电子排布式为5s25p2,位于元素周期表p区,A错误;晶胞中,N(Sn)=8×+1=2,N(Nb)=12×=6,则Sn、Nb的原子个数之比为1∶3,化学式为SnNb3,B正确;该晶体属于金属晶体,晶体内部有自由电子,可作为低温超导材料,是电的良导体,C正确;与顶点Sn距离最近且相等的Nb位于立方体的面心,则Sn的配位数为12,D正确。
13. (1) ①Po ②Na ③Zn ④Cu (2) BC
解析:(2) 常温下,Hg为液态,A错误;因为金属键无方向性,金属键在一定范围内不因形变而消失,B正确;钙的金属键强于钾,熔、沸点高于钾,C正确;温度升高,金属的导电性减弱,D错误。
14. (1) ①[Ar]3d64s2 金属 ②8 12 (2) 4
15. (1) 1∶2 (2) [Ar]3d84s2或1s22s22p63s23p63d84s2 3∶5
16. (1) FeNi2
(2) 1s22s22p63s23p63d54s1或[Ar]3d54s1 2∶1
(3) CoTiO3 6 12 (4) A (5) A
解析:(1) 由均摊法知,晶胞中,N(Fe)=8×+6×=4,N(Ni)=8,Fe、Ni原子个数之比为1∶2,故其化学式为FeNi2。(2) Cr为24号元素,半充满时最稳定,则其简化电子排布式为[Ar]3d54s1。晶胞中,N(Cr)=8×+2=4,N(Al)=8×+1=2,则该合金中Cr、Al原子个数比为2∶1。(3) 晶胞中含有的N(O)=6×=3,N(Co)=8×=1,N(Ti)=1,故其化学式为CoTiO3。Ti原子位于晶胞的体心,其周围距离最近的O原子位于6个面的中心,故Ti原子周围距离最近的O原子数目为6;Co原子位于晶胞的顶点,O原子位于晶胞的面心,故Co原子周围距离最近的O原子数目为12。(4) 由题意知,该物质是气态团簇分子,故题目中图示应是该物质的一个完整的分子,由14个Ti原子和13个C原子构成,其化学式为Ti14C13,故选A。(5) 图甲中Fe位于顶点和体心,乙由8个甲组成,按虚线方向切乙形成的截面边长不等(边长和面对角线的长不相等),排除B、D;由于每个小立方体的体心均有1个铁原子,排除C。故选A。
