3.2 离子键 离子晶体 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 3.2 离子键 离子晶体 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 448.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 11:16:58 | ||
图片预览

文档简介
第二单元 离子键 离子晶体
1 下列物质中,属于离子化合物的是( )
A. NaOH B. HCl
C. O2 D. NH3
2 下列物质只含有离子键的是( )
A. H2O B. MgCl2
C. SiO2 D. NH4Cl
3 下列说法正确的是( )
A. 固态时能导电的晶体一定是离子晶体
B. 熔融态能导电的晶体一定是离子晶体
C. 水溶液能导电的晶体一定是离子晶体
D. 固态不导电而熔融态导电的晶体一定是离子晶体
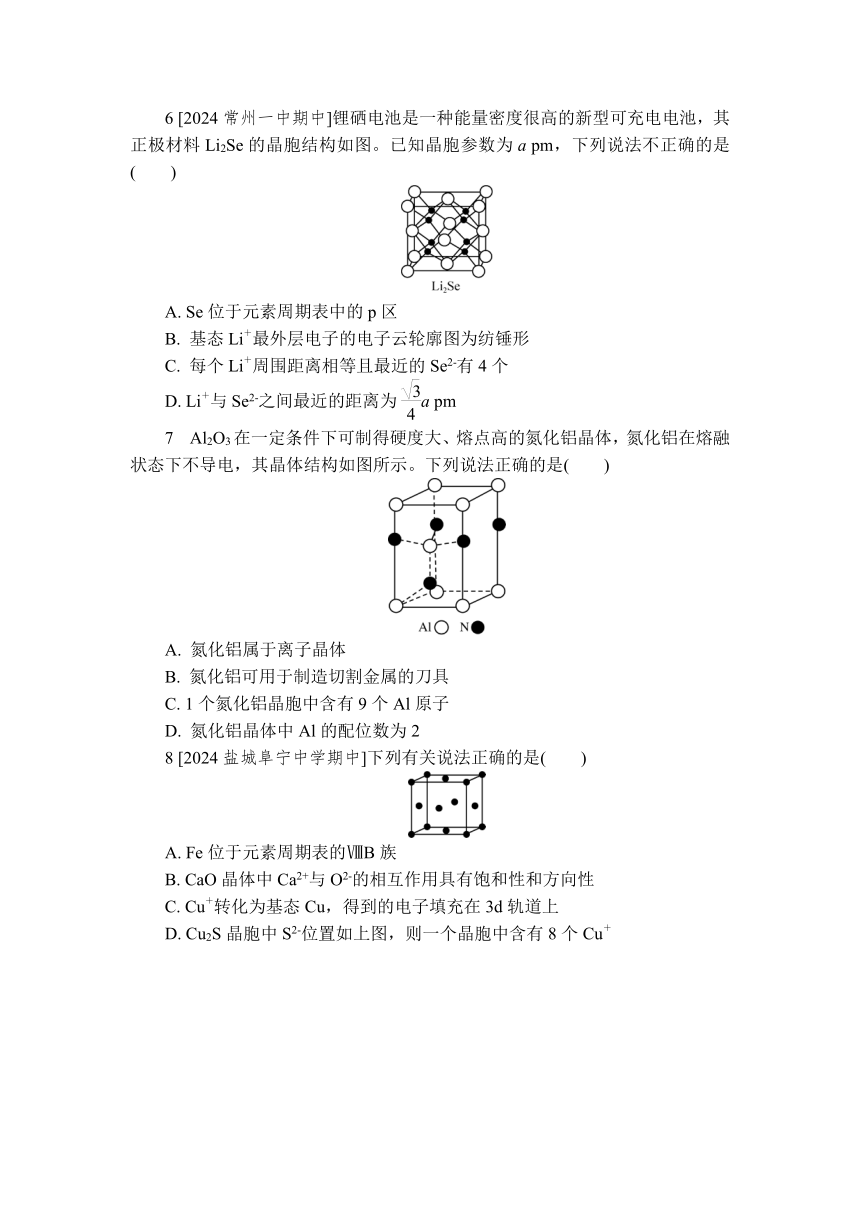
4 下列有关离子晶体的数据大小比较错误的是( )
CsCl晶胞 NaCl晶胞 CaF2晶胞
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
5 [2024无锡三中期中]认真分析NaCl和CsCl的晶体结构,判断下列说法错误的是( )
A. NaCl晶体中,Na+填充在Cl-构成的正八面体空隙中
B. CsCl晶体中,Cs+填充在Cl-构成的正四面体空隙中
C. NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8
D. NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子半径比(即几何因素)不同
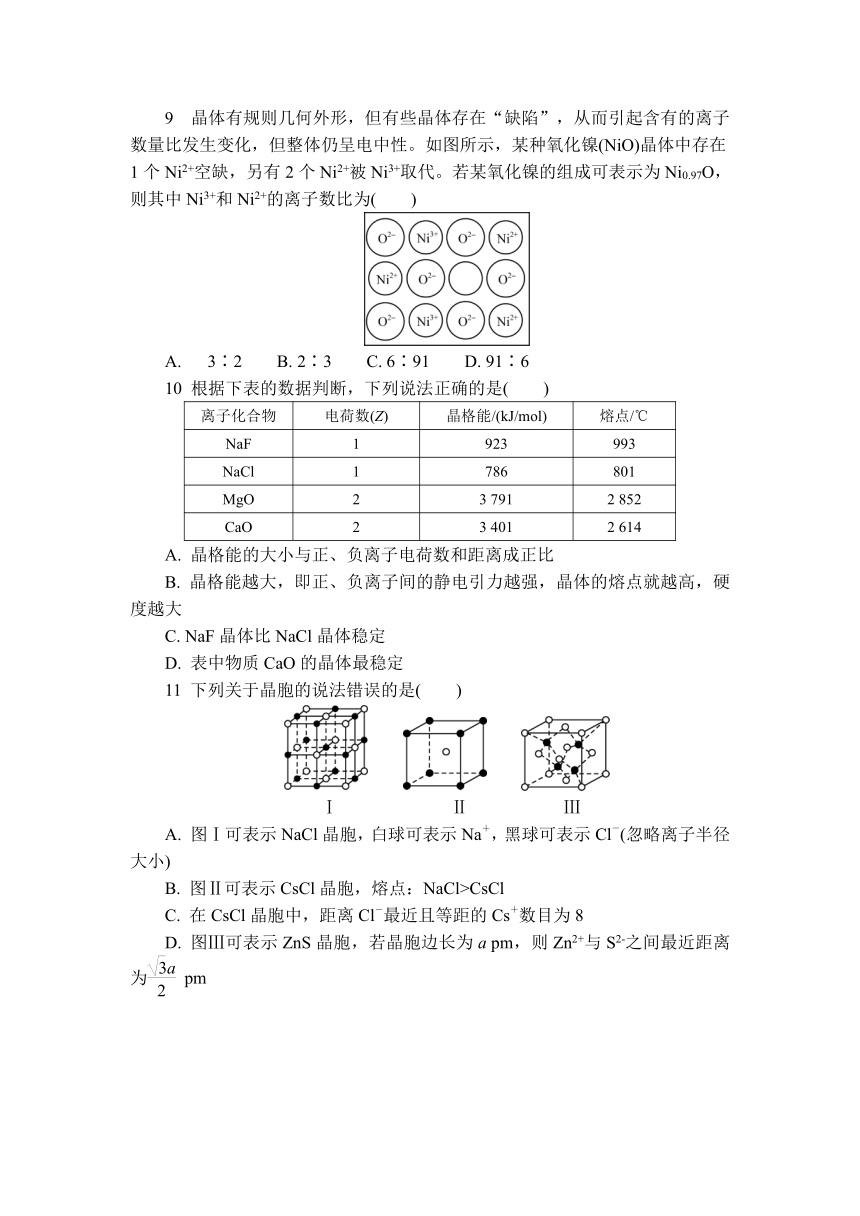
6 [2024常州一中期中]锂硒电池是一种能量密度很高的新型可充电电池,其正极材料Li2Se的晶胞结构如图。已知晶胞参数为a pm,下列说法不正确的是( )
A. Se位于元素周期表中的p区
B. 基态Li+最外层电子的电子云轮廓图为纺锤形
C. 每个Li+周围距离相等且最近的Se2-有4个
D. Li+与Se2-之间最近的距离为a pm
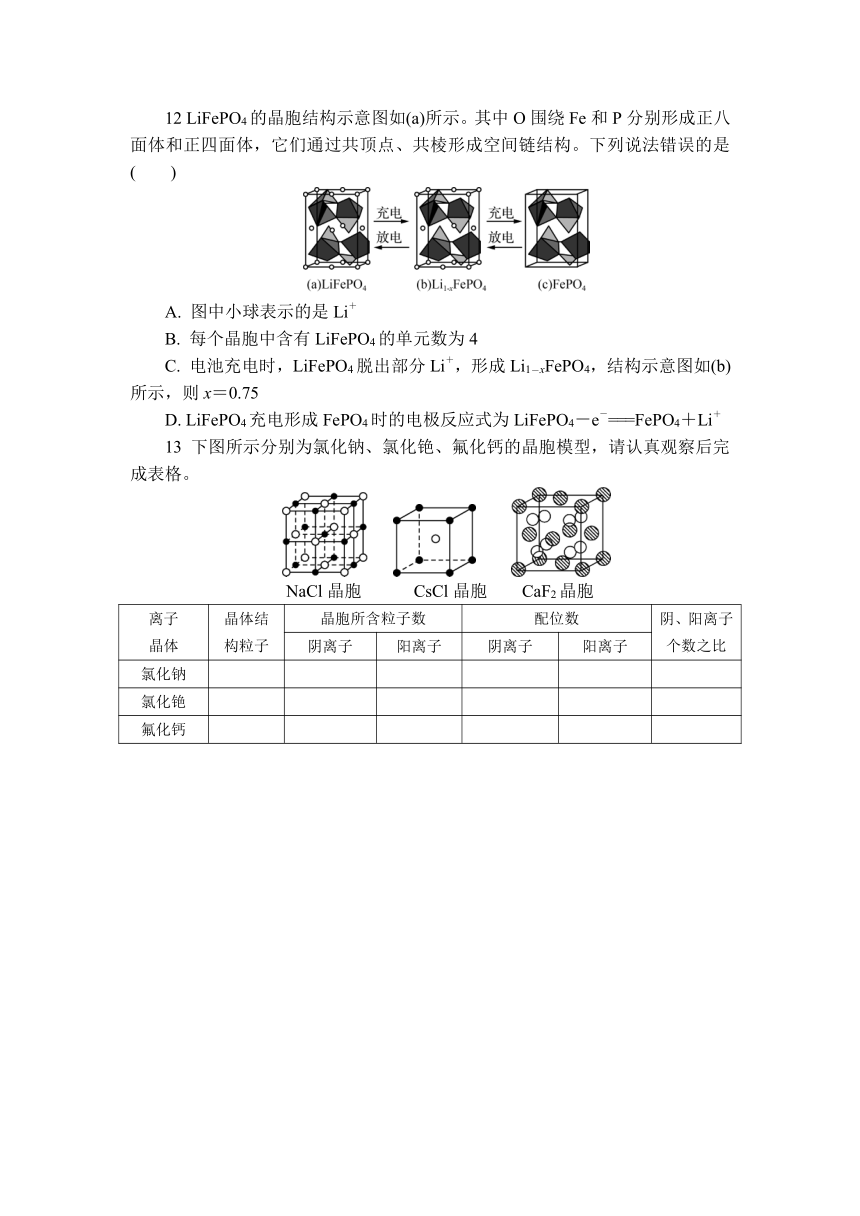
7 Al2O3在一定条件下可制得硬度大、熔点高的氮化铝晶体,氮化铝在熔融状态下不导电,其晶体结构如图所示。下列说法正确的是( )
A. 氮化铝属于离子晶体
B. 氮化铝可用于制造切割金属的刀具
C. 1个氮化铝晶胞中含有9个Al原子
D. 氮化铝晶体中Al的配位数为2
8 [2024盐城阜宁中学期中]下列有关说法正确的是( )
A. Fe位于元素周期表的ⅧB族
B. CaO晶体中Ca2+与O2-的相互作用具有饱和性和方向性
C. Cu+转化为基态Cu,得到的电子填充在3d轨道上
D. Cu2S晶胞中S2-位置如上图,则一个晶胞中含有8个Cu+
9 晶体有规则几何外形,但有些晶体存在“缺陷”,从而引起含有的离子数量比发生变化,但整体仍呈电中性。如图所示,某种氧化镍(NiO)晶体中存在1个Ni2+空缺,另有2个Ni2+被Ni3+取代。若某氧化镍的组成可表示为Ni0.97O,则其中Ni3+和Ni2+的离子数比为( )
A. 3∶2 B. 2∶3 C. 6∶91 D. 91∶6
10 根据下表的数据判断,下列说法正确的是( )
离子化合物 电荷数(Z) 晶格能/(kJ/mol) 熔点/℃
NaF 1 923 993
NaCl 1 786 801
MgO 2 3 791 2 852
CaO 2 3 401 2 614
A. 晶格能的大小与正、负离子电荷数和距离成正比
B. 晶格能越大,即正、负离子间的静电引力越强,晶体的熔点就越高,硬度越大
C. NaF晶体比NaCl晶体稳定
D. 表中物质CaO的晶体最稳定
11 下列关于晶胞的说法错误的是( )
Ⅰ Ⅱ Ⅲ
A. 图Ⅰ可表示NaCl晶胞,白球可表示Na+,黑球可表示Cl-(忽略离子半径大小)
B. 图Ⅱ可表示CsCl晶胞,熔点:NaCl>CsCl
C. 在CsCl晶胞中,距离Cl-最近且等距的Cs+数目为8
D. 图Ⅲ可表示ZnS晶胞,若晶胞边长为a pm,则Zn2+与S2-之间最近距离为 pm
12 LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。下列说法错误的是( )
A. 图中小球表示的是Li+
B. 每个晶胞中含有LiFePO4的单元数为4
C. 电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=0.75
D. LiFePO4充电形成FePO4时的电极反应式为LiFePO4-e-===FePO4+Li+
13 下图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。
NaCl晶胞 CsCl晶胞 CaF2晶胞
离子 晶体 晶体结 构粒子 晶胞所含粒子数 配位数 阴、阳离子 个数之比
阴离子 阳离子 阴离子 阳离子
氯化钠
氯化铯
氟化钙
14 (1) [2025连云港中学月考]氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,其晶胞结构如图,该晶胞中每个Cu+的配位数与含有的Cl-的个数之比为________;铜的第一电离能(I1)小于锌的第一电离能,其主要原因是_____________
____________________________________________________________________________________________________________________________________________。
(2) [2025无锡江阴月考]富集钴渣经进一步处理后可制得CoxTiOy,此时Co的价层电子排布为3d7,CoxTiOy晶胞结构如图所示。y=________,与Ti原子距离最近的Co原子有________个。
(3) [2025连云港期中]ZnO晶体有立方岩盐结构、立方闪锌矿结构等,晶胞如图所示,立方岩盐结构、立方闪锌矿结构晶胞中锌原子的配位数之比为________。
(4) [2024南通海安实验中学阶段考试]由CoCl2可制备AlxCoOy晶体,其立方晶胞如图,Al与O最小间距大于Co与O最小间距,x、y为整数,则Co在晶胞中的位置为________;晶体中一个Al周围与其距离最近的O的个数为________。
15 前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素的氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素原子内层均排满电子。
(1) 基态原子E的简化电子排布式为________,依据电子排布周期表划分为5个区,该元素位于周期表的________区。
(2) 元素A、B、D电负性由大到小的顺序为____________(用元素符号表示)。
(3) 单质C经常用于储氢,储氢后形成晶体结构如图所示。
该晶体中与C离子近邻的氢离子有________个,这些氢离子构成的空间结构为________;该晶体的化学式为________。
第二单元 离子键 离子晶体
1. A Na+和OH-之间存在离子键,是离子化合物,A符合题意;氢原子和氯原子之间只存在共价键,是共价化合物,B不符合题意;氧气是单质,不是离子化合物,C不符合题意;氮原子和氢原子之间只存在共价键,是共价化合物,D不符合题意。
2. B H2O是共价化合物,只存在共价键,不含离子键,A错误;MgCl2属于离子晶体,只含有离子键,B正确;SiO2是共价化合物,只存在共价键,不含离子键,C错误;NH4Cl中含离子键,在NH内存在N—H极性共价键,D错误。
3. D 离子晶体是由阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电,A错误;离子化合物在熔融状态时能电离,故能导电,但是金属晶体在熔融状态下也能导电,B错误;有些分子晶体的水溶液也能导电,C错误;离子晶体在固态时不导电而熔融态下能导电,D正确。
4. A 离子半径越小、所带电荷越多,离子晶体熔点越高,故熔点NaFNaCl>NaBr,B正确;由图知,阴离子的配位数(即阴离子周围距离最近且相等的其他原子总数)分别为8、6、4,故阴离子的配位数CsCl>NaCl>CaF2,C正确;离子半径Ba2+>Ca2+>Mg2+,故硬度MgO>CaO>BaO,D正确。
5. B CsCl晶体中,Cs+填充在Cl-构成的立方体空隙中,B错误;电子层数越多,离子半径越大,Na+半径小于Cs+,故NaCl和CsCl的阴、阳离子半径比(即几何因素)不同,D正确。
6. B Se位于第4周期ⅥA族,位于元素周期表的p区,A正确;基态Li+的电子排布式为1s2,最外层电子位于s轨道,电子云轮廓图为球形,B错误;由均摊法计算知,黑球为Li+,每个Li+周围距离相等且最近的Se2-有4个,C正确;Li+位于体对角线的处,与顶点处Se2-距离最近,二者距离为a pm,D正确。
7. B 氮化铝硬度大、熔点高,在熔融状态下不导电,则氮化铝不属于离子晶体,A错误;氮化铝硬度大、熔点高,可用于制造切割金属的刀具,B正确;根据均摊法知,氮化铝晶胞中,含有Al原子数=8×+1=2,C错误;根据晶胞结构图知,1个Al原子连接4个N原子,则氮化铝晶体中Al的配位数为4,D错误。
8. D Fe位于元素周期表的Ⅷ族,A错误;离子键没有饱和性和方向性,B错误;得到的电子填充在4s轨道上,C错误。
9. C 设1 mol Ni0.97O中的Ni3+为x mol,Ni2+为(0.97-x) mol,根据晶体仍呈电中性可知,3x+2×(0.97-x)=2×1,解得x=0.06 mol ,则Ni2+为0.91 mol,则N(Ni3+)∶N(Ni2+)=0.06∶0.91=6∶91,故选C。
10. C 根据表中的数据可知,NaF中离子所带电荷数为1,MgO中离子所带电荷数为2,晶格能的大小与正、负离子电荷数成正比,MgO、CaO中离子所带电荷数相同,但镁离子半径小于钙离子半径,键长MgO11. D 根据ZnS的晶胞结构可知,Zn2+与S2-之间最近距离为体对角线的,故Zn2+与S2-之间最近距离为 pm,D错误。
12. C O围绕Fe和P分别形成正八面体和正四面体,可知图中小球表示的是Li+,A正确;均摊法可知,晶胞中Li+数目为8×+4×+4× =4,故每个晶胞中含有LiFePO4的单元数为4,B正确;由图可知,(a)→(b)充电过程中,晶胞失去1个棱心、1个面心位置的Li+,(b)晶胞中Li+数目为8×+3×+3×= ,Fe原子数目不变,有4个,故(1-x)∶1= ∶4,解得x= ,C错误;LiFePO4充电形成FePO4,失去全部的Li+,LiFePO4失去电子被氧化生成FePO4,则电极反应式为LiFePO4-e-===FePO4+Li+,D正确。
13.
Na+、Cl- 4 4 6 6 1∶1
Cs+、Cl- 1 1 8 8 1∶1
Ca2+、F- 8 4 4 8 2∶1
14. (1) 1∶1 Cu失去1个电子时,核外电子排布从[Ar]3d104s1变为能量较低的稳定结构[Ar]3d10较容易;Zn失去1个电子时,核外电子排布从[Ar]3d104s2变为[Ar]3d104s1较难
(2) 3 8
(3) 3∶2
(4) 体心 12
15. (1) [Ar]3d104s1 ds (2) F>O>Cl
(3) 6 八面体 NaH
1 下列物质中,属于离子化合物的是( )
A. NaOH B. HCl
C. O2 D. NH3
2 下列物质只含有离子键的是( )
A. H2O B. MgCl2
C. SiO2 D. NH4Cl
3 下列说法正确的是( )
A. 固态时能导电的晶体一定是离子晶体
B. 熔融态能导电的晶体一定是离子晶体
C. 水溶液能导电的晶体一定是离子晶体
D. 固态不导电而熔融态导电的晶体一定是离子晶体
4 下列有关离子晶体的数据大小比较错误的是( )
CsCl晶胞 NaCl晶胞 CaF2晶胞
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
5 [2024无锡三中期中]认真分析NaCl和CsCl的晶体结构,判断下列说法错误的是( )
A. NaCl晶体中,Na+填充在Cl-构成的正八面体空隙中
B. CsCl晶体中,Cs+填充在Cl-构成的正四面体空隙中
C. NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8
D. NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子半径比(即几何因素)不同
6 [2024常州一中期中]锂硒电池是一种能量密度很高的新型可充电电池,其正极材料Li2Se的晶胞结构如图。已知晶胞参数为a pm,下列说法不正确的是( )
A. Se位于元素周期表中的p区
B. 基态Li+最外层电子的电子云轮廓图为纺锤形
C. 每个Li+周围距离相等且最近的Se2-有4个
D. Li+与Se2-之间最近的距离为a pm
7 Al2O3在一定条件下可制得硬度大、熔点高的氮化铝晶体,氮化铝在熔融状态下不导电,其晶体结构如图所示。下列说法正确的是( )
A. 氮化铝属于离子晶体
B. 氮化铝可用于制造切割金属的刀具
C. 1个氮化铝晶胞中含有9个Al原子
D. 氮化铝晶体中Al的配位数为2
8 [2024盐城阜宁中学期中]下列有关说法正确的是( )
A. Fe位于元素周期表的ⅧB族
B. CaO晶体中Ca2+与O2-的相互作用具有饱和性和方向性
C. Cu+转化为基态Cu,得到的电子填充在3d轨道上
D. Cu2S晶胞中S2-位置如上图,则一个晶胞中含有8个Cu+
9 晶体有规则几何外形,但有些晶体存在“缺陷”,从而引起含有的离子数量比发生变化,但整体仍呈电中性。如图所示,某种氧化镍(NiO)晶体中存在1个Ni2+空缺,另有2个Ni2+被Ni3+取代。若某氧化镍的组成可表示为Ni0.97O,则其中Ni3+和Ni2+的离子数比为( )
A. 3∶2 B. 2∶3 C. 6∶91 D. 91∶6
10 根据下表的数据判断,下列说法正确的是( )
离子化合物 电荷数(Z) 晶格能/(kJ/mol) 熔点/℃
NaF 1 923 993
NaCl 1 786 801
MgO 2 3 791 2 852
CaO 2 3 401 2 614
A. 晶格能的大小与正、负离子电荷数和距离成正比
B. 晶格能越大,即正、负离子间的静电引力越强,晶体的熔点就越高,硬度越大
C. NaF晶体比NaCl晶体稳定
D. 表中物质CaO的晶体最稳定
11 下列关于晶胞的说法错误的是( )
Ⅰ Ⅱ Ⅲ
A. 图Ⅰ可表示NaCl晶胞,白球可表示Na+,黑球可表示Cl-(忽略离子半径大小)
B. 图Ⅱ可表示CsCl晶胞,熔点:NaCl>CsCl
C. 在CsCl晶胞中,距离Cl-最近且等距的Cs+数目为8
D. 图Ⅲ可表示ZnS晶胞,若晶胞边长为a pm,则Zn2+与S2-之间最近距离为 pm
12 LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。下列说法错误的是( )
A. 图中小球表示的是Li+
B. 每个晶胞中含有LiFePO4的单元数为4
C. 电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=0.75
D. LiFePO4充电形成FePO4时的电极反应式为LiFePO4-e-===FePO4+Li+
13 下图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。
NaCl晶胞 CsCl晶胞 CaF2晶胞
离子 晶体 晶体结 构粒子 晶胞所含粒子数 配位数 阴、阳离子 个数之比
阴离子 阳离子 阴离子 阳离子
氯化钠
氯化铯
氟化钙
14 (1) [2025连云港中学月考]氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,其晶胞结构如图,该晶胞中每个Cu+的配位数与含有的Cl-的个数之比为________;铜的第一电离能(I1)小于锌的第一电离能,其主要原因是_____________
____________________________________________________________________________________________________________________________________________。
(2) [2025无锡江阴月考]富集钴渣经进一步处理后可制得CoxTiOy,此时Co的价层电子排布为3d7,CoxTiOy晶胞结构如图所示。y=________,与Ti原子距离最近的Co原子有________个。
(3) [2025连云港期中]ZnO晶体有立方岩盐结构、立方闪锌矿结构等,晶胞如图所示,立方岩盐结构、立方闪锌矿结构晶胞中锌原子的配位数之比为________。
(4) [2024南通海安实验中学阶段考试]由CoCl2可制备AlxCoOy晶体,其立方晶胞如图,Al与O最小间距大于Co与O最小间距,x、y为整数,则Co在晶胞中的位置为________;晶体中一个Al周围与其距离最近的O的个数为________。
15 前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素的氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素原子内层均排满电子。
(1) 基态原子E的简化电子排布式为________,依据电子排布周期表划分为5个区,该元素位于周期表的________区。
(2) 元素A、B、D电负性由大到小的顺序为____________(用元素符号表示)。
(3) 单质C经常用于储氢,储氢后形成晶体结构如图所示。
该晶体中与C离子近邻的氢离子有________个,这些氢离子构成的空间结构为________;该晶体的化学式为________。
第二单元 离子键 离子晶体
1. A Na+和OH-之间存在离子键,是离子化合物,A符合题意;氢原子和氯原子之间只存在共价键,是共价化合物,B不符合题意;氧气是单质,不是离子化合物,C不符合题意;氮原子和氢原子之间只存在共价键,是共价化合物,D不符合题意。
2. B H2O是共价化合物,只存在共价键,不含离子键,A错误;MgCl2属于离子晶体,只含有离子键,B正确;SiO2是共价化合物,只存在共价键,不含离子键,C错误;NH4Cl中含离子键,在NH内存在N—H极性共价键,D错误。
3. D 离子晶体是由阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电,A错误;离子化合物在熔融状态时能电离,故能导电,但是金属晶体在熔融状态下也能导电,B错误;有些分子晶体的水溶液也能导电,C错误;离子晶体在固态时不导电而熔融态下能导电,D正确。
4. A 离子半径越小、所带电荷越多,离子晶体熔点越高,故熔点NaF
5. B CsCl晶体中,Cs+填充在Cl-构成的立方体空隙中,B错误;电子层数越多,离子半径越大,Na+半径小于Cs+,故NaCl和CsCl的阴、阳离子半径比(即几何因素)不同,D正确。
6. B Se位于第4周期ⅥA族,位于元素周期表的p区,A正确;基态Li+的电子排布式为1s2,最外层电子位于s轨道,电子云轮廓图为球形,B错误;由均摊法计算知,黑球为Li+,每个Li+周围距离相等且最近的Se2-有4个,C正确;Li+位于体对角线的处,与顶点处Se2-距离最近,二者距离为a pm,D正确。
7. B 氮化铝硬度大、熔点高,在熔融状态下不导电,则氮化铝不属于离子晶体,A错误;氮化铝硬度大、熔点高,可用于制造切割金属的刀具,B正确;根据均摊法知,氮化铝晶胞中,含有Al原子数=8×+1=2,C错误;根据晶胞结构图知,1个Al原子连接4个N原子,则氮化铝晶体中Al的配位数为4,D错误。
8. D Fe位于元素周期表的Ⅷ族,A错误;离子键没有饱和性和方向性,B错误;得到的电子填充在4s轨道上,C错误。
9. C 设1 mol Ni0.97O中的Ni3+为x mol,Ni2+为(0.97-x) mol,根据晶体仍呈电中性可知,3x+2×(0.97-x)=2×1,解得x=0.06 mol ,则Ni2+为0.91 mol,则N(Ni3+)∶N(Ni2+)=0.06∶0.91=6∶91,故选C。
10. C 根据表中的数据可知,NaF中离子所带电荷数为1,MgO中离子所带电荷数为2,晶格能的大小与正、负离子电荷数成正比,MgO、CaO中离子所带电荷数相同,但镁离子半径小于钙离子半径,键长MgO
12. C O围绕Fe和P分别形成正八面体和正四面体,可知图中小球表示的是Li+,A正确;均摊法可知,晶胞中Li+数目为8×+4×+4× =4,故每个晶胞中含有LiFePO4的单元数为4,B正确;由图可知,(a)→(b)充电过程中,晶胞失去1个棱心、1个面心位置的Li+,(b)晶胞中Li+数目为8×+3×+3×= ,Fe原子数目不变,有4个,故(1-x)∶1= ∶4,解得x= ,C错误;LiFePO4充电形成FePO4,失去全部的Li+,LiFePO4失去电子被氧化生成FePO4,则电极反应式为LiFePO4-e-===FePO4+Li+,D正确。
13.
Na+、Cl- 4 4 6 6 1∶1
Cs+、Cl- 1 1 8 8 1∶1
Ca2+、F- 8 4 4 8 2∶1
14. (1) 1∶1 Cu失去1个电子时,核外电子排布从[Ar]3d104s1变为能量较低的稳定结构[Ar]3d10较容易;Zn失去1个电子时,核外电子排布从[Ar]3d104s2变为[Ar]3d104s1较难
(2) 3 8
(3) 3∶2
(4) 体心 12
15. (1) [Ar]3d104s1 ds (2) F>O>Cl
(3) 6 八面体 NaH
