3.4 课时1范德华力氢键 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2
文档属性
| 名称 | 3.4 课时1范德华力氢键 同步练 (含答案) 2024-2025学年高二化学苏教版(2020)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 150.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 11:21:37 | ||
图片预览



文档简介
课时1 范德华力 氢键
1 下列有关微粒间作用力的说法正确的是( )
A. 分子间作用力就是范德华力
B. HF的水溶液中有2种氢键
C. Na2SiO3中仅含离子键
D. 已知Si—C键能为a kJ/mol,理论上分解1 mol SiC形成气态原子需4a kJ能量
2 下列有关物质性质判断正确且可以用范德华力来解释的是( )
A. 沸点:HBr>HCl
B. 沸点:CH3CH2Br<C2H5OH
C. 热稳定性:HF>HCl
D. —OH上氢原子的活泼性:H—O—H>C2H5—O—H
3 下列说法错误的是( )
A. HCl、HBr、HI的熔、沸点依次升高
B. H3BO3晶体中存在的作用力只有共价键
C. H2S的沸点低于H2O
D. 胍()分子间能够形成氢键
4 下列说法正确的是( )
A. 氢键是一种较弱的化学键
B. NH3的热稳定性很强,是因为其分子间能形成氢键
C. 最外层能达到稳定结构的微粒只有稀有气体的原子
D. 常温常压下,Cl2、Br2、I2由气态、液态到固态变化的主要原因是范德华力在逐渐增大
5 下列叙述与范德华力无关的是( )
A. 干冰易升华
B. 通常状况下氯化氢为气体
C. 氟、氯、溴、碘单质的熔、沸点依次升高
D. 氟、氯、溴、碘的简单氢化物的热稳定性越来越弱
6 下列说法正确的是( )
A. BF3分子和PCl3分子中,每个原子的最外层都达到8电子稳定结构
B. CO2和SiO2均为共价化合物,其固体熔化时,均破坏了分子间作用力
C. NaHSO4固体溶于水时,既破坏了离子键也破坏了共价键
D. CaO2和CaCl2中含有的化学键类型完全相同
7 下列有关冰和干冰的叙述不正确的是( )
A. 干冰中只存在范德华力,不存在氢键
B. 干冰和冰的晶体类型不同
C. 干冰比冰的熔点低
D. 冰中存在氢键,每个水分子周围有4个紧邻的水分子
8 下列排序不正确的是( )
A. 晶体熔点:>
B. 硬度:金刚石>碳化硅>晶体硅
C. 熔点:K>Na>Li
D. 晶格能:NaF>NaCl>NaBr>NaI
9 [2025宿迁开学考试]尿素()是一种高效化肥,也是一种化工原料。反应:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(l)可用于尿素的制备。下列有关说法正确的是( )
A. CO2为共价晶体
B. NH3的沸点低于同族的PH3
C. NH3极易溶于水的主要原因是NH3与H2O分子之间存在氢键
D. 尿素分子中σ键和π键的数目之比为3∶1
10 如图所示为FeSO4·7H2O晶体的结构,设NA为阿伏加德罗常数的值。下列有关说法错误的是( )
A. Fe2+的d轨道参与了成键
B. 1 mol FeSO4·7H2O中含σ键的数目为24NA
C. H2O与SO、H2O与Fe2+之间的作用力类型不同
D. 该物质中存在的化学键类型有配位键、共价键、氢键和离子键
11 咔唑()是一种新型有机液体储氢材料,其沸点比()的高,其主要影响因素是( )
A. 分子量 B. 极性
C. 氢键 D. 键能
12 联氨(N2H4)为二元弱碱,在水中性质与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列说法正确的是( )
A. N2H4与水分子可形成氢键
B. Cu2+的价层电子排布式为3d10
C. 基态原子核外未成对电子数:ND. 电负性:N>O>H
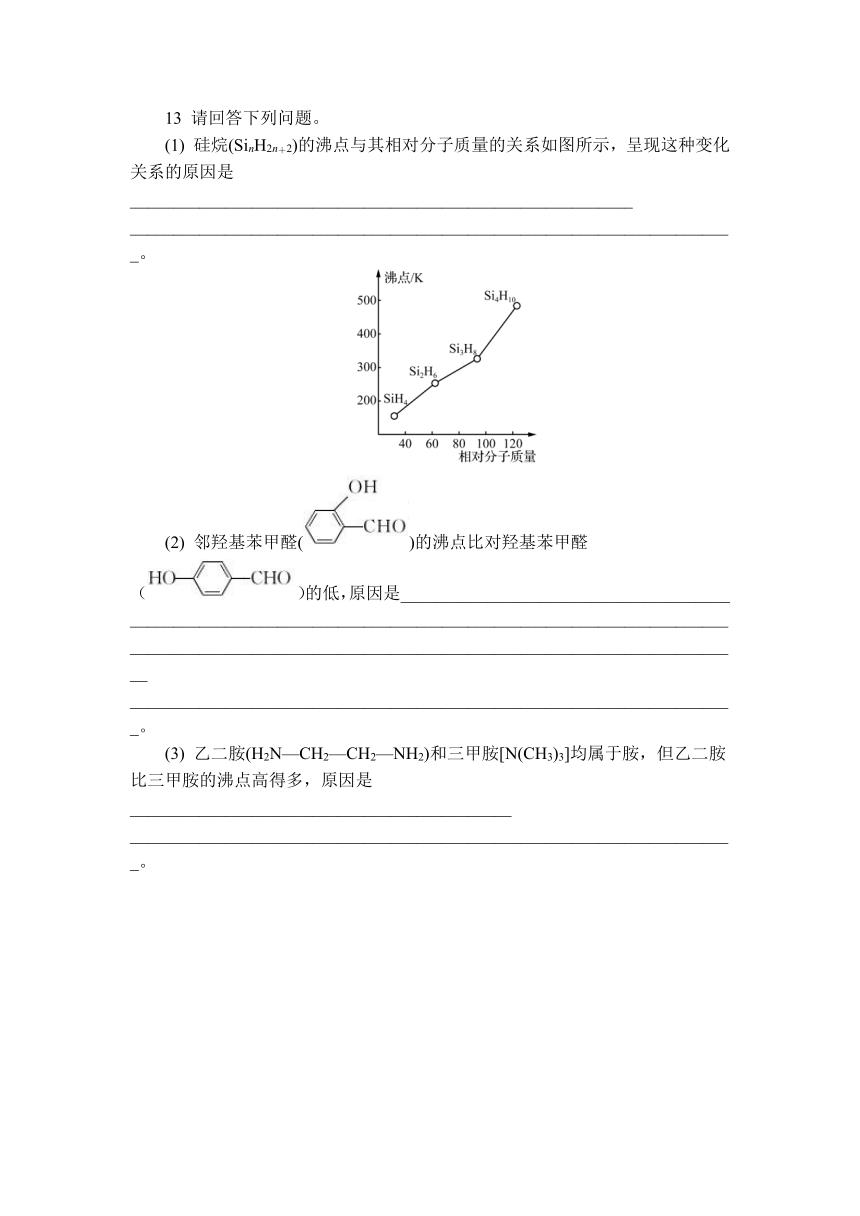
13 请回答下列问题。
(1) 硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化关系的原因是__________________________________________________________
______________________________________________________________________。
(2) 邻羟基苯甲醛()的沸点比对羟基苯甲醛()的低,原因是______________________________________
____________________________________________________________________________________________________________________________________________
______________________________________________________________________。
(3) 乙二胺(H2N—CH2—CH2—NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是____________________________________________
______________________________________________________________________。
14 水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体。
(1) 1 mol冰中有 mol “氢键”。
(2) 水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是 (填字母,下同)。
A. 把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B. 把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C. 该水蒸气冷凝后,测水的pH
D. 该水蒸气冷凝后,测氢氧原子个数比
(3) 水分子可电离生成两种含有相同电子数的粒子,其电离方程式为
。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是__________________________________________________________________
______________________________________________________________________。
(4) 在冰的结构中,每个水分子与相邻的 4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11 kJ/mol)。已知冰的升华热是51 kJ/mol,则冰晶体中每个氢键的能量是 kJ/mol。
(5) 氨气极易溶于水的原因之一也与氢键有关。则NH3溶于水后,形成的NH3·H2O的合理结构是 。
15 现有几组物质的熔点数据。
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
据此回答下列问题。
(1) A组属于 晶体。
(2) B组晶体共同的物理性质是 (填序号,下同)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3) C组中HF熔点反常是由于________________________________________
______________________________________________________________________。
(4) D组晶体可能具有的性质是 。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5) D组晶体的熔点为NaCl>KCl>RbCl>CsCl,其原因为___________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________。
16 现有五种短周期非金属元素A、B、C、D、E,其中A、B、C的价电子排布式可分别表示为asa、bsbbpb、csccp2c,D与B同主族,E位于C的下一周期,且是同周期元素中电负性最大的元素。试回答下列问题。
(1) 由A、B、C、E四种元素中的两种元素可形成多种分子。下列分子:①BC2、②BA4、③A2C2、④BE4中,属于极性分子的是 (填序号)。
(2) C的氢化物比下一周期同族元素的氢化物沸点还要高,其原因是________
______________________________________________________________________。
(3) B、C两种元素都能和A元素形成两种常见的溶剂,其分子式分别为 、 。DE4在前者中的溶解度 (填“大于”或“小于”)在后者中的溶解度。
(4) BA4、BE4和DE4的沸点从高到低的顺序为___________________________
______________(用化学式表示)。
课时1 范德华力 氢键
1. D 分子间作用力包括范德华力和氢键,A错误;HF分子之间能形成氢键,水分子之间能形成氢键,HF分子和水分子之间也能形成氢键,故HF的水溶液中不止有2种氢键,B错误;SiO中含有共价键,C错误;1 mol SiC中含有4 mol Si—C,故理论上分解1 mol SiC形成气态原子需4a kJ能量,D正确。
2. A HBr与HCl结构相似,HBr的相对分子质量比HCl的大,HBr分子间的范德华力比HCl的强,所以其沸点比HCl的高,A符合题意;C2H5Br的沸点比C2H5OH的低,是由于C2H5OH分子间形成氢键,从而增大了分子间作用力,B不符合题意;HF比HCl稳定,是由于H—F键能比H—Cl键能大,C不符合题意;H2O分子中的—OH氢原子比C2H5OH中的—OH氢原子更活泼,是由于—C2H5的影响使O—H极性减弱,D不符合题意。
3. B HCl、HBr、HI均由分子构成,相对分子质量越大,范德华力越大,熔、沸点越高,故HCl、HBr、HI的熔、沸点依次升高,A正确;H3BO3由分子构成,晶体中存在的作用力除了共价键外,还存在分子间作用力,B错误;H2O能形成分子间氢键,H2S不能形成分子间氢键,故H2O的沸点高于H2S,C正确;由胍结构简式可知,胍分子中含有氨基和亚氨基,可以形成分子间氢键,D正确。
4. D 氢键是一种分子间作用力,而不是化学键,A错误;H—N的键能较大,故NH3的热稳定性很强,与氢键无关,B错误;最外层达稳定结构的微粒不一定是稀有气体的原子,也可能是处于稳定结构的阴离子或阳离子,C错误;一般来说,结构相似的分子,相对分子质量越大,范德华力越大,则常温常压下,卤素单质从F2到I2由气态、液态到固态变化的原因是范德华力逐渐增大,D正确。
5. D 分子间作用力主要影响构成分子的物质的熔、沸点等物理性质。干冰易升华与范德华力有关,A不符合题意;HCl分子之间的作用力是很弱的范德华力,因此通常状况下氯化氢为气体,B不符合题意;一般来说,组成和结构相似的物质,随着相对分子质量的增加,范德华力逐渐增大,物质的熔、沸点逐渐升高,C不符合题意;简单氢化物的热稳定性与分子中化学键强弱有关,与范德华力无关,D符合题意。
6. C B原子最外层含有3个电子,则BF3中B的最外层电子数为6,B原子最外层未达到8电子稳定结构,A错误;SiO2是共价晶体,熔化时需克服微粒间的作用力是共价键,B错误;CaO2中Ca2+和O之间为离子键,O中O—O为共价键,而CaCl2中只含离子键,D错误。
7. B 干冰是固态的CO2,干冰中不存在氢键,A正确;干冰和冰均由分子构成,所属的晶体类型相同,B错误;冰中存在分子间氢键,熔点高于干冰,C正确;冰中存在氢键,每个水分子周围有4个紧邻的水分子形成四面体结构,中间有空隙,D正确。
8. C 对羟基苯甲酸能形成分子间氢键,邻羟基苯甲酸能形成分子内氢键,则前者的沸点高于后者,A正确;金刚石、碳化硅和硅均是共价晶体,其硬度与原子半径有关系,形成共价键的原子半径越小,硬度越大,则硬度:金刚石>碳化硅>晶体硅,B正确;钾、钠、锂形成的晶体均是金属晶体,其熔点与金属阳离子的半径以及所带电荷数有关系,离子半径越小,电荷数越多,熔点越高,则熔点K<Na<Li,C错误;形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,晶格能越大,则晶格能NaF>NaCl>NaBr>NaI,D正确。
9. C 共价晶体由原子构成,CO2晶体由分子构成,故CO2晶体不属于共价晶体,A错误;NH3分子间存在氢键,沸点高于同族的PH3,B错误;尿素分子的结构简式是,σ键和π键的数目之比为7∶1,D错误。
10. D 配位时Fe2+的3d轨道上的6个电子分别成对,空出2个3d轨道参与成键,Fe2+的d轨道参与了成键,A正确;由图示信息可知,1 mol FeSO4·7H2O中含6 mol Fe—O σ键、14 mol H—O σ键和4 mol S—O σ键,一共含σ键的数目为24NA,B正确;H2O与SO之间形成的是氢键,H2O与Fe2+之间形成的是配位键,作用力类型不同,C正确;氢键不是化学键,D错误。
11. C 咔唑分子中含有亚氨基,能形成分子间氢键,后者不能形成分子间氢键,故前者沸点高于后者。故选C。
12. A N2H4中含有—NH2,与水分子可形成氢键,A正确;Cu2+的价层电子排布式为3d9,B错误;基态O有2个未成对电子,基态N有3个未成对电子,基态原子核外未成对电子数N>O,C错误;电负性O>N>H,D错误。
13. (1) 硅烷的结构和组成相似,相对分子质量越大,分子间作用力越大,沸点越高
(2) 邻羟基苯甲醛形成的是分子内氢键,而对羟基苯甲醛可形成分子间氢键,分子间氢键使分子间的作用力增大,沸点升高
(3) 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
14. (1) 2 (2) AB
(3) 2H2O H3O++OH- H2O2分子间的氢键数目比H2O多
(4) 20 (5) b
15. (1) 共价 (2) ①②③④
(3) HF分子间能形成氢键,其熔化时需要消耗的能量更多 (4) ②④
(5) D组晶体都为离子晶体,r(Na+)16. (1) ③ (2) H2O分子间形成氢键
(3) C6H6 H2O 大于
(4) SiCl4>CCl4>CH4
解析:由A、B、C、D、E为短周期的非金属元素及s轨道最多可容纳2个电子可得a=1,b=c=2。即A为H,B为C(碳),C为O;由D与B同主族,且为非金属元素知,D为Si;由E位于C的下一周期且为同周期中电负性最大的元素知,E为Cl。
1 下列有关微粒间作用力的说法正确的是( )
A. 分子间作用力就是范德华力
B. HF的水溶液中有2种氢键
C. Na2SiO3中仅含离子键
D. 已知Si—C键能为a kJ/mol,理论上分解1 mol SiC形成气态原子需4a kJ能量
2 下列有关物质性质判断正确且可以用范德华力来解释的是( )
A. 沸点:HBr>HCl
B. 沸点:CH3CH2Br<C2H5OH
C. 热稳定性:HF>HCl
D. —OH上氢原子的活泼性:H—O—H>C2H5—O—H
3 下列说法错误的是( )
A. HCl、HBr、HI的熔、沸点依次升高
B. H3BO3晶体中存在的作用力只有共价键
C. H2S的沸点低于H2O
D. 胍()分子间能够形成氢键
4 下列说法正确的是( )
A. 氢键是一种较弱的化学键
B. NH3的热稳定性很强,是因为其分子间能形成氢键
C. 最外层能达到稳定结构的微粒只有稀有气体的原子
D. 常温常压下,Cl2、Br2、I2由气态、液态到固态变化的主要原因是范德华力在逐渐增大
5 下列叙述与范德华力无关的是( )
A. 干冰易升华
B. 通常状况下氯化氢为气体
C. 氟、氯、溴、碘单质的熔、沸点依次升高
D. 氟、氯、溴、碘的简单氢化物的热稳定性越来越弱
6 下列说法正确的是( )
A. BF3分子和PCl3分子中,每个原子的最外层都达到8电子稳定结构
B. CO2和SiO2均为共价化合物,其固体熔化时,均破坏了分子间作用力
C. NaHSO4固体溶于水时,既破坏了离子键也破坏了共价键
D. CaO2和CaCl2中含有的化学键类型完全相同
7 下列有关冰和干冰的叙述不正确的是( )
A. 干冰中只存在范德华力,不存在氢键
B. 干冰和冰的晶体类型不同
C. 干冰比冰的熔点低
D. 冰中存在氢键,每个水分子周围有4个紧邻的水分子
8 下列排序不正确的是( )
A. 晶体熔点:>
B. 硬度:金刚石>碳化硅>晶体硅
C. 熔点:K>Na>Li
D. 晶格能:NaF>NaCl>NaBr>NaI
9 [2025宿迁开学考试]尿素()是一种高效化肥,也是一种化工原料。反应:CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(l)可用于尿素的制备。下列有关说法正确的是( )
A. CO2为共价晶体
B. NH3的沸点低于同族的PH3
C. NH3极易溶于水的主要原因是NH3与H2O分子之间存在氢键
D. 尿素分子中σ键和π键的数目之比为3∶1
10 如图所示为FeSO4·7H2O晶体的结构,设NA为阿伏加德罗常数的值。下列有关说法错误的是( )
A. Fe2+的d轨道参与了成键
B. 1 mol FeSO4·7H2O中含σ键的数目为24NA
C. H2O与SO、H2O与Fe2+之间的作用力类型不同
D. 该物质中存在的化学键类型有配位键、共价键、氢键和离子键
11 咔唑()是一种新型有机液体储氢材料,其沸点比()的高,其主要影响因素是( )
A. 分子量 B. 极性
C. 氢键 D. 键能
12 联氨(N2H4)为二元弱碱,在水中性质与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列说法正确的是( )
A. N2H4与水分子可形成氢键
B. Cu2+的价层电子排布式为3d10
C. 基态原子核外未成对电子数:N
13 请回答下列问题。
(1) 硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化关系的原因是__________________________________________________________
______________________________________________________________________。
(2) 邻羟基苯甲醛()的沸点比对羟基苯甲醛()的低,原因是______________________________________
____________________________________________________________________________________________________________________________________________
______________________________________________________________________。
(3) 乙二胺(H2N—CH2—CH2—NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是____________________________________________
______________________________________________________________________。
14 水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体。
(1) 1 mol冰中有 mol “氢键”。
(2) 水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是 (填字母,下同)。
A. 把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B. 把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C. 该水蒸气冷凝后,测水的pH
D. 该水蒸气冷凝后,测氢氧原子个数比
(3) 水分子可电离生成两种含有相同电子数的粒子,其电离方程式为
。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是__________________________________________________________________
______________________________________________________________________。
(4) 在冰的结构中,每个水分子与相邻的 4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11 kJ/mol)。已知冰的升华热是51 kJ/mol,则冰晶体中每个氢键的能量是 kJ/mol。
(5) 氨气极易溶于水的原因之一也与氢键有关。则NH3溶于水后,形成的NH3·H2O的合理结构是 。
15 现有几组物质的熔点数据。
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
据此回答下列问题。
(1) A组属于 晶体。
(2) B组晶体共同的物理性质是 (填序号,下同)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3) C组中HF熔点反常是由于________________________________________
______________________________________________________________________。
(4) D组晶体可能具有的性质是 。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5) D组晶体的熔点为NaCl>KCl>RbCl>CsCl,其原因为___________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________。
16 现有五种短周期非金属元素A、B、C、D、E,其中A、B、C的价电子排布式可分别表示为asa、bsbbpb、csccp2c,D与B同主族,E位于C的下一周期,且是同周期元素中电负性最大的元素。试回答下列问题。
(1) 由A、B、C、E四种元素中的两种元素可形成多种分子。下列分子:①BC2、②BA4、③A2C2、④BE4中,属于极性分子的是 (填序号)。
(2) C的氢化物比下一周期同族元素的氢化物沸点还要高,其原因是________
______________________________________________________________________。
(3) B、C两种元素都能和A元素形成两种常见的溶剂,其分子式分别为 、 。DE4在前者中的溶解度 (填“大于”或“小于”)在后者中的溶解度。
(4) BA4、BE4和DE4的沸点从高到低的顺序为___________________________
______________(用化学式表示)。
课时1 范德华力 氢键
1. D 分子间作用力包括范德华力和氢键,A错误;HF分子之间能形成氢键,水分子之间能形成氢键,HF分子和水分子之间也能形成氢键,故HF的水溶液中不止有2种氢键,B错误;SiO中含有共价键,C错误;1 mol SiC中含有4 mol Si—C,故理论上分解1 mol SiC形成气态原子需4a kJ能量,D正确。
2. A HBr与HCl结构相似,HBr的相对分子质量比HCl的大,HBr分子间的范德华力比HCl的强,所以其沸点比HCl的高,A符合题意;C2H5Br的沸点比C2H5OH的低,是由于C2H5OH分子间形成氢键,从而增大了分子间作用力,B不符合题意;HF比HCl稳定,是由于H—F键能比H—Cl键能大,C不符合题意;H2O分子中的—OH氢原子比C2H5OH中的—OH氢原子更活泼,是由于—C2H5的影响使O—H极性减弱,D不符合题意。
3. B HCl、HBr、HI均由分子构成,相对分子质量越大,范德华力越大,熔、沸点越高,故HCl、HBr、HI的熔、沸点依次升高,A正确;H3BO3由分子构成,晶体中存在的作用力除了共价键外,还存在分子间作用力,B错误;H2O能形成分子间氢键,H2S不能形成分子间氢键,故H2O的沸点高于H2S,C正确;由胍结构简式可知,胍分子中含有氨基和亚氨基,可以形成分子间氢键,D正确。
4. D 氢键是一种分子间作用力,而不是化学键,A错误;H—N的键能较大,故NH3的热稳定性很强,与氢键无关,B错误;最外层达稳定结构的微粒不一定是稀有气体的原子,也可能是处于稳定结构的阴离子或阳离子,C错误;一般来说,结构相似的分子,相对分子质量越大,范德华力越大,则常温常压下,卤素单质从F2到I2由气态、液态到固态变化的原因是范德华力逐渐增大,D正确。
5. D 分子间作用力主要影响构成分子的物质的熔、沸点等物理性质。干冰易升华与范德华力有关,A不符合题意;HCl分子之间的作用力是很弱的范德华力,因此通常状况下氯化氢为气体,B不符合题意;一般来说,组成和结构相似的物质,随着相对分子质量的增加,范德华力逐渐增大,物质的熔、沸点逐渐升高,C不符合题意;简单氢化物的热稳定性与分子中化学键强弱有关,与范德华力无关,D符合题意。
6. C B原子最外层含有3个电子,则BF3中B的最外层电子数为6,B原子最外层未达到8电子稳定结构,A错误;SiO2是共价晶体,熔化时需克服微粒间的作用力是共价键,B错误;CaO2中Ca2+和O之间为离子键,O中O—O为共价键,而CaCl2中只含离子键,D错误。
7. B 干冰是固态的CO2,干冰中不存在氢键,A正确;干冰和冰均由分子构成,所属的晶体类型相同,B错误;冰中存在分子间氢键,熔点高于干冰,C正确;冰中存在氢键,每个水分子周围有4个紧邻的水分子形成四面体结构,中间有空隙,D正确。
8. C 对羟基苯甲酸能形成分子间氢键,邻羟基苯甲酸能形成分子内氢键,则前者的沸点高于后者,A正确;金刚石、碳化硅和硅均是共价晶体,其硬度与原子半径有关系,形成共价键的原子半径越小,硬度越大,则硬度:金刚石>碳化硅>晶体硅,B正确;钾、钠、锂形成的晶体均是金属晶体,其熔点与金属阳离子的半径以及所带电荷数有关系,离子半径越小,电荷数越多,熔点越高,则熔点K<Na<Li,C错误;形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,晶格能越大,则晶格能NaF>NaCl>NaBr>NaI,D正确。
9. C 共价晶体由原子构成,CO2晶体由分子构成,故CO2晶体不属于共价晶体,A错误;NH3分子间存在氢键,沸点高于同族的PH3,B错误;尿素分子的结构简式是,σ键和π键的数目之比为7∶1,D错误。
10. D 配位时Fe2+的3d轨道上的6个电子分别成对,空出2个3d轨道参与成键,Fe2+的d轨道参与了成键,A正确;由图示信息可知,1 mol FeSO4·7H2O中含6 mol Fe—O σ键、14 mol H—O σ键和4 mol S—O σ键,一共含σ键的数目为24NA,B正确;H2O与SO之间形成的是氢键,H2O与Fe2+之间形成的是配位键,作用力类型不同,C正确;氢键不是化学键,D错误。
11. C 咔唑分子中含有亚氨基,能形成分子间氢键,后者不能形成分子间氢键,故前者沸点高于后者。故选C。
12. A N2H4中含有—NH2,与水分子可形成氢键,A正确;Cu2+的价层电子排布式为3d9,B错误;基态O有2个未成对电子,基态N有3个未成对电子,基态原子核外未成对电子数N>O,C错误;电负性O>N>H,D错误。
13. (1) 硅烷的结构和组成相似,相对分子质量越大,分子间作用力越大,沸点越高
(2) 邻羟基苯甲醛形成的是分子内氢键,而对羟基苯甲醛可形成分子间氢键,分子间氢键使分子间的作用力增大,沸点升高
(3) 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
14. (1) 2 (2) AB
(3) 2H2O H3O++OH- H2O2分子间的氢键数目比H2O多
(4) 20 (5) b
15. (1) 共价 (2) ①②③④
(3) HF分子间能形成氢键,其熔化时需要消耗的能量更多 (4) ②④
(5) D组晶体都为离子晶体,r(Na+)
(3) C6H6 H2O 大于
(4) SiCl4>CCl4>CH4
解析:由A、B、C、D、E为短周期的非金属元素及s轨道最多可容纳2个电子可得a=1,b=c=2。即A为H,B为C(碳),C为O;由D与B同主族,且为非金属元素知,D为Si;由E位于C的下一周期且为同周期中电负性最大的元素知,E为Cl。
