7.2 课题1氨气 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 7.2 课题1氨气 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2 |
|
|
| 格式 | docx | ||
| 文件大小 | 299.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 16:36:57 | ||
图片预览

文档简介
课题1 氨气
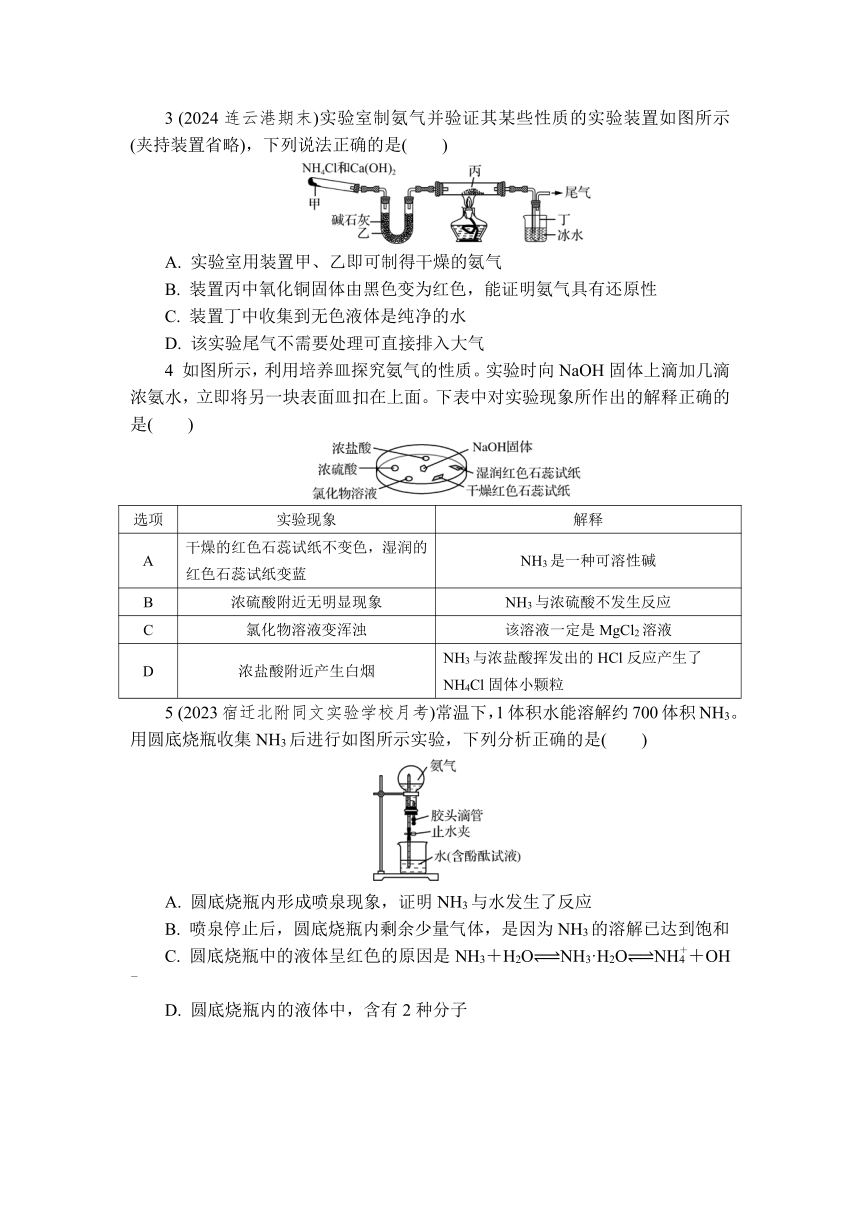
阅读下列材料,回答1~3题。
大气中有少量的N2通过氮的固定进入土壤和海洋,植物从土壤中吸收含氮化合物制造蛋白质,动物则食用植物获取蛋白质。动植物的腐败物在土壤中被细菌分解,变为含氮化合物,部分被植物吸收;土壤中的硝酸盐也会被细菌分解而转化为N2返回大气中。部分氮元素在自然界中的循环如图所示。
20世纪初实验室首次利用氮气和氢气人工合成了氨:N2(g)+3H2(g)2NH3(g),实现了工业固氮;NH3与灼热的氧化铜反应生成N2和Cu。
1 (2024连云港期末)下列说法正确的是( )
A. “雷电作用”中,N2与O2在放电条件下直接生成NO2
B. “工业固氮”合成氨中N2发生氧化反应
C. “生物固氮”过程中氮元素从游离态转变为化合态
D. 亚硝酸盐转化为硝酸盐一定需要O2参加
2 (2024连云港期末)H2与N2在催化剂表面生成NH3,反应历程及能量变化示意如图。下列说法正确的是( )
A. 该反应为吸热反应
B. ①→②:断开H—H和N≡N时需要放出能量
C. 选择不同的催化剂不会改变此反应ΔH的数值
D. 反应达到平衡状态时,反应停止
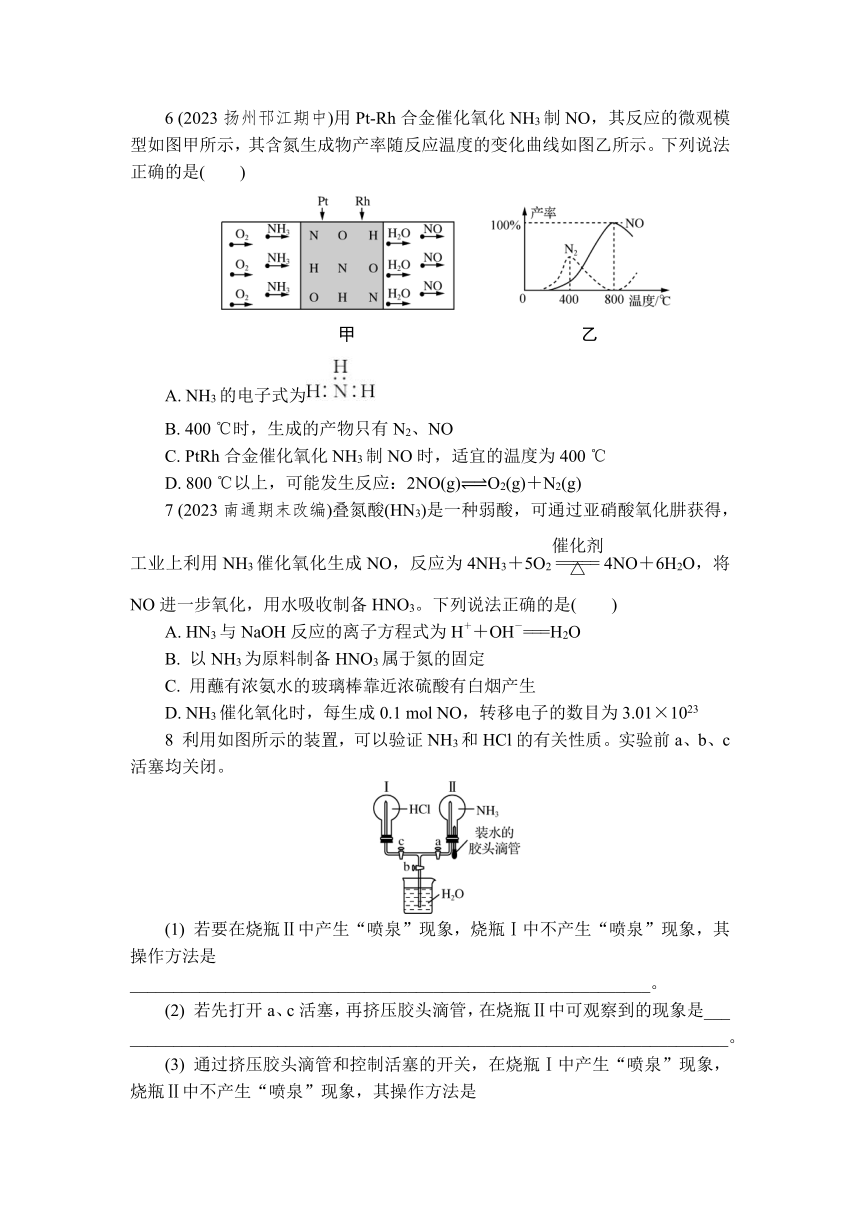
3 (2024连云港期末)实验室制氨气并验证其某些性质的实验装置如图所示(夹持装置省略),下列说法正确的是( )
A. 实验室用装置甲、乙即可制得干燥的氨气
B. 装置丙中氧化铜固体由黑色变为红色,能证明氨气具有还原性
C. 装置丁中收集到无色液体是纯净的水
D. 该实验尾气不需要处理可直接排入大气
4 如图所示,利用培养皿探究氨气的性质。实验时向NaOH固体上滴加几滴浓氨水,立即将另一块表面皿扣在上面。下表中对实验现象所作出的解释正确的是( )
选项 实验现象 解释
A 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 NH3是一种可溶性碱
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是MgCl2溶液
D 浓盐酸附近产生白烟 NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体小颗粒
5 (2023宿迁北附同文实验学校月考)常温下,1体积水能溶解约700体积NH3。用圆底烧瓶收集NH3后进行如图所示实验,下列分析正确的是( )
A. 圆底烧瓶内形成喷泉现象,证明NH3与水发生了反应
B. 喷泉停止后,圆底烧瓶内剩余少量气体,是因为NH3的溶解已达到饱和
C. 圆底烧瓶中的液体呈红色的原因是NH3+H2O NH3·H2O NH+OH-
D. 圆底烧瓶内的液体中,含有2种分子
6 (2023扬州邗江期中)用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图甲所示,其含氮生成物产率随反应温度的变化曲线如图乙所示。下列说法正确的是( )
甲 乙
A. NH3的电子式为
B. 400 ℃时,生成的产物只有N2、NO
C. PtRh合金催化氧化NH3制NO时,适宜的温度为400 ℃
D. 800 ℃以上,可能发生反应:2NO(g) O2(g)+N2(g)
7 (2023南通期末改编)叠氮酸(HN3)是一种弱酸,可通过亚硝酸氧化肼获得,工业上利用NH3催化氧化生成NO,反应为4NH3+5O24NO+6H2O,将NO进一步氧化,用水吸收制备HNO3。下列说法正确的是( )
A. HN3与NaOH反应的离子方程式为H++OH-===H2O
B. 以NH3为原料制备HNO3属于氮的固定
C. 用蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生
D. NH3催化氧化时,每生成0.1 mol NO,转移电子的数目为3.01×1023
8 利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1) 若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是____________________________________________________________。
(2) 若先打开a、c活塞,再挤压胶头滴管,在烧瓶Ⅱ中可观察到的现象是___
_____________________________________________________________________。
(3) 通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是_______________________________
______________________________________________________________________。
9 (2023苏州期末)合成氨工业对人类社会的发展具有里程碑式意义。
(1) 工业常用CH4与H2O高温下制合成氨的原料气H2,1 mol CH4完全转化为CO2时,理论能制得H2的物质的量为________。
(2) 等离子体合成氨使用H2O代替H2作为氢源,模拟制备原理如图所示,在高压电场作用下,N2与H2O以一定流速通过反应器,主要得到NH3与HNO2(弱酸),气体流出反应器后,经过一定长度的导管进入成分分析装置。
①等离子体合成氨反应的化学方程式为________________________________。
②成分分析表明,连接反应器与成分分析装置的导管的长度d越长,测得气体中NH3与HNO2的含量越低,其原因可能是_______________________________。
③若将原料气中N2替换为空气,反应器流出气体中NH3及NOx浓度随原料气相对湿度(水蒸气含量)的变化如图所示,流出气体中NH3的浓度几乎为0的原因可能是______________________________________________________________
______________________________________________________________________。
(3) 用如图装置(注:CCl4不与NH3反应,也不能溶解NH3)吸收一段时间氨后,再通入空气,同时将红热的铂丝插入锥形瓶内,能使铂丝保持红热的原因是____________________________,锥形瓶内还可观察到的现象是_______________
____________________________________________________。
课题1 氨气
1. C “雷电作用”中,N2和O2反应生成NO,A错误;由转化关系,工业固氮将N2转化为氨或铵盐,氮元素化合价降低,发生还原反应,B错误;固氮指N2转化为化合态氮,C正确;亚硝酸盐可能被其他氧化剂氧化为硝酸盐,D错误。
2. C 由图可知,生成物总能量小于反应物总能量,为放热反应,A错误;断键需要吸收能量,B错误;催化剂可改变反应历程,但不影响焓变,C正确;化学平衡状态是动态平衡,反应没有停止,D错误。
3. B 实验室用NH4Cl和Ca(OH)2的固体混合物制备NH3时,需要加热,A错误;CuO―→Cu,发生还原反应,说明NH3具有还原性,B正确;装置丁中的无色液体为氨水,C错误;尾气中可能含有氨气,排入大气之前需要进行尾气处理,D错误。
4. D 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝,是因为NH3与H2O发生反应生成了NH3·H2O,其溶液呈碱性,NH3不是碱,A错误;浓硫酸与NH3可发生反应,其化学方程式为2NH3+H2SO4===(NH4)2SO4,但无明显现象,B错误;该溶液可能为MgCl2溶液、AlCl3溶液等,C错误;浓盐酸易挥发,挥发出的HCl气体遇NH3会反应生成白烟,该烟是NH4Cl固体小颗粒,D正确。
5. C 试管内液面上升,不能证明NH3与H2O发生了反应,也可能是因为NH3极易溶于水,A错误;用排空气法收集的气体不一定纯净,NH3极易溶于水,1∶1溶解时远没有达到饱和状态,则试管中剩余少量气体,不是因为NH3在水中的溶解达到了饱和,而是因为收集的NH3中含有少量的空气杂质,B错误;圆底烧瓶中的液体呈红色,说明液体呈碱性,原因是NH3+H2O NH3·H2O NH+OH-,C正确;圆底烧瓶内的液体中含有H2O、NH3·H2O和NH3,共3种分子,D错误。
6. D NH3的电子式中,N原子应满足8电子结构,A错误;反应物NH3中含有H元素,故400 ℃时,不止生成N2、NO,还有H2O生成,B错误;由图可知,Pt-Rh合金催化氧化NH3制NO,适宜温度为800 ℃,C错误;800 ℃以上,NO产率降低,N2产率上升,故可能发生反应:2NO(g) O2(g)+N2(g),D正确。
7. D HN3是一种弱酸,故HN3与NaOH反应的离子方程式为HN3+OH-===H2O+N,A错误;氮的固定为将游离态的氮转化为含氮的化合物,以NH3为原料制备HNO3不属于氮的固定,B错误;用蘸有浓氨水的玻璃棒靠近浓硫酸,浓硫酸没有挥发性,故无白烟产生,C错误;NH3催化氧化时,每生成0.1 mol NO,转移电子的数目为3.01×1023,D正确。
8. (1) 先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞)
(2) 导管口处产生白烟
(3) 先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,关闭a活塞,然后打开b活塞
9. (1) 4 mol
(2) ①N2+2H2ONH3+HNO2
②NH3与HNO2反应生成了NH4NO2
③高压电作用下,N2和空气中的O2反应生成NO,几乎不与水反应生成NH3
(3) 反应放热 有红棕色气体生成
阅读下列材料,回答1~3题。
大气中有少量的N2通过氮的固定进入土壤和海洋,植物从土壤中吸收含氮化合物制造蛋白质,动物则食用植物获取蛋白质。动植物的腐败物在土壤中被细菌分解,变为含氮化合物,部分被植物吸收;土壤中的硝酸盐也会被细菌分解而转化为N2返回大气中。部分氮元素在自然界中的循环如图所示。
20世纪初实验室首次利用氮气和氢气人工合成了氨:N2(g)+3H2(g)2NH3(g),实现了工业固氮;NH3与灼热的氧化铜反应生成N2和Cu。
1 (2024连云港期末)下列说法正确的是( )
A. “雷电作用”中,N2与O2在放电条件下直接生成NO2
B. “工业固氮”合成氨中N2发生氧化反应
C. “生物固氮”过程中氮元素从游离态转变为化合态
D. 亚硝酸盐转化为硝酸盐一定需要O2参加
2 (2024连云港期末)H2与N2在催化剂表面生成NH3,反应历程及能量变化示意如图。下列说法正确的是( )
A. 该反应为吸热反应
B. ①→②:断开H—H和N≡N时需要放出能量
C. 选择不同的催化剂不会改变此反应ΔH的数值
D. 反应达到平衡状态时,反应停止
3 (2024连云港期末)实验室制氨气并验证其某些性质的实验装置如图所示(夹持装置省略),下列说法正确的是( )
A. 实验室用装置甲、乙即可制得干燥的氨气
B. 装置丙中氧化铜固体由黑色变为红色,能证明氨气具有还原性
C. 装置丁中收集到无色液体是纯净的水
D. 该实验尾气不需要处理可直接排入大气
4 如图所示,利用培养皿探究氨气的性质。实验时向NaOH固体上滴加几滴浓氨水,立即将另一块表面皿扣在上面。下表中对实验现象所作出的解释正确的是( )
选项 实验现象 解释
A 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 NH3是一种可溶性碱
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是MgCl2溶液
D 浓盐酸附近产生白烟 NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体小颗粒
5 (2023宿迁北附同文实验学校月考)常温下,1体积水能溶解约700体积NH3。用圆底烧瓶收集NH3后进行如图所示实验,下列分析正确的是( )
A. 圆底烧瓶内形成喷泉现象,证明NH3与水发生了反应
B. 喷泉停止后,圆底烧瓶内剩余少量气体,是因为NH3的溶解已达到饱和
C. 圆底烧瓶中的液体呈红色的原因是NH3+H2O NH3·H2O NH+OH-
D. 圆底烧瓶内的液体中,含有2种分子
6 (2023扬州邗江期中)用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图甲所示,其含氮生成物产率随反应温度的变化曲线如图乙所示。下列说法正确的是( )
甲 乙
A. NH3的电子式为
B. 400 ℃时,生成的产物只有N2、NO
C. PtRh合金催化氧化NH3制NO时,适宜的温度为400 ℃
D. 800 ℃以上,可能发生反应:2NO(g) O2(g)+N2(g)
7 (2023南通期末改编)叠氮酸(HN3)是一种弱酸,可通过亚硝酸氧化肼获得,工业上利用NH3催化氧化生成NO,反应为4NH3+5O24NO+6H2O,将NO进一步氧化,用水吸收制备HNO3。下列说法正确的是( )
A. HN3与NaOH反应的离子方程式为H++OH-===H2O
B. 以NH3为原料制备HNO3属于氮的固定
C. 用蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生
D. NH3催化氧化时,每生成0.1 mol NO,转移电子的数目为3.01×1023
8 利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1) 若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是____________________________________________________________。
(2) 若先打开a、c活塞,再挤压胶头滴管,在烧瓶Ⅱ中可观察到的现象是___
_____________________________________________________________________。
(3) 通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是_______________________________
______________________________________________________________________。
9 (2023苏州期末)合成氨工业对人类社会的发展具有里程碑式意义。
(1) 工业常用CH4与H2O高温下制合成氨的原料气H2,1 mol CH4完全转化为CO2时,理论能制得H2的物质的量为________。
(2) 等离子体合成氨使用H2O代替H2作为氢源,模拟制备原理如图所示,在高压电场作用下,N2与H2O以一定流速通过反应器,主要得到NH3与HNO2(弱酸),气体流出反应器后,经过一定长度的导管进入成分分析装置。
①等离子体合成氨反应的化学方程式为________________________________。
②成分分析表明,连接反应器与成分分析装置的导管的长度d越长,测得气体中NH3与HNO2的含量越低,其原因可能是_______________________________。
③若将原料气中N2替换为空气,反应器流出气体中NH3及NOx浓度随原料气相对湿度(水蒸气含量)的变化如图所示,流出气体中NH3的浓度几乎为0的原因可能是______________________________________________________________
______________________________________________________________________。
(3) 用如图装置(注:CCl4不与NH3反应,也不能溶解NH3)吸收一段时间氨后,再通入空气,同时将红热的铂丝插入锥形瓶内,能使铂丝保持红热的原因是____________________________,锥形瓶内还可观察到的现象是_______________
____________________________________________________。
课题1 氨气
1. C “雷电作用”中,N2和O2反应生成NO,A错误;由转化关系,工业固氮将N2转化为氨或铵盐,氮元素化合价降低,发生还原反应,B错误;固氮指N2转化为化合态氮,C正确;亚硝酸盐可能被其他氧化剂氧化为硝酸盐,D错误。
2. C 由图可知,生成物总能量小于反应物总能量,为放热反应,A错误;断键需要吸收能量,B错误;催化剂可改变反应历程,但不影响焓变,C正确;化学平衡状态是动态平衡,反应没有停止,D错误。
3. B 实验室用NH4Cl和Ca(OH)2的固体混合物制备NH3时,需要加热,A错误;CuO―→Cu,发生还原反应,说明NH3具有还原性,B正确;装置丁中的无色液体为氨水,C错误;尾气中可能含有氨气,排入大气之前需要进行尾气处理,D错误。
4. D 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝,是因为NH3与H2O发生反应生成了NH3·H2O,其溶液呈碱性,NH3不是碱,A错误;浓硫酸与NH3可发生反应,其化学方程式为2NH3+H2SO4===(NH4)2SO4,但无明显现象,B错误;该溶液可能为MgCl2溶液、AlCl3溶液等,C错误;浓盐酸易挥发,挥发出的HCl气体遇NH3会反应生成白烟,该烟是NH4Cl固体小颗粒,D正确。
5. C 试管内液面上升,不能证明NH3与H2O发生了反应,也可能是因为NH3极易溶于水,A错误;用排空气法收集的气体不一定纯净,NH3极易溶于水,1∶1溶解时远没有达到饱和状态,则试管中剩余少量气体,不是因为NH3在水中的溶解达到了饱和,而是因为收集的NH3中含有少量的空气杂质,B错误;圆底烧瓶中的液体呈红色,说明液体呈碱性,原因是NH3+H2O NH3·H2O NH+OH-,C正确;圆底烧瓶内的液体中含有H2O、NH3·H2O和NH3,共3种分子,D错误。
6. D NH3的电子式中,N原子应满足8电子结构,A错误;反应物NH3中含有H元素,故400 ℃时,不止生成N2、NO,还有H2O生成,B错误;由图可知,Pt-Rh合金催化氧化NH3制NO,适宜温度为800 ℃,C错误;800 ℃以上,NO产率降低,N2产率上升,故可能发生反应:2NO(g) O2(g)+N2(g),D正确。
7. D HN3是一种弱酸,故HN3与NaOH反应的离子方程式为HN3+OH-===H2O+N,A错误;氮的固定为将游离态的氮转化为含氮的化合物,以NH3为原料制备HNO3不属于氮的固定,B错误;用蘸有浓氨水的玻璃棒靠近浓硫酸,浓硫酸没有挥发性,故无白烟产生,C错误;NH3催化氧化时,每生成0.1 mol NO,转移电子的数目为3.01×1023,D正确。
8. (1) 先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞)
(2) 导管口处产生白烟
(3) 先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,关闭a活塞,然后打开b活塞
9. (1) 4 mol
(2) ①N2+2H2ONH3+HNO2
②NH3与HNO2反应生成了NH4NO2
③高压电作用下,N2和空气中的O2反应生成NO,几乎不与水反应生成NH3
(3) 反应放热 有红棕色气体生成
