7.3 含氮化合物的合理使用 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 7.3 含氮化合物的合理使用 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 276.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 17:00:27 | ||
图片预览


文档简介
第三单元 含氮化合物的合理使用
1 (2024镇江期末)下列物质结构与性质或性质与用途具有对应关系的是( )
A. 黑磷具有类似石墨片层结构,可用于导电
B. NH3极易溶于水,液氨可用作制冷剂
C. NH4Cl受热易分解,可用作氮肥
D. 稀硝酸具有强氧化性,可用铁罐车运输
2 (2024徐州期末)下列关于含氮化合物的制备、性质等实验原理及装置、现象正确的是( )
甲 乙 丙 丁
A. 装置甲可用于制备并干燥NH3
B. 装置乙用于制备NO2气体
C. 装置丙仅起到安全瓶作用
D. 反应一段时间后,装置丁中溶液变为蓝色
3 (2024连云港东海期中)氮及其化合物的转化具有重要应用。下列说法正确的是( )
A. 实验室探究浓硝酸与铜反应的气态产物:HNO3(浓)NO
NO2
B. 工业制硝酸过程中的物质转化:N2NOHNO3
C. NO2溶于水发生反应的离子方程式:3NO2+H2O===2H++2NO+NO
D. 汽车尾气催化转化器中发生的主要反应:NO+COC+NO2
4 (2023徐州铜山期中)施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A. 氮肥溶于水,其中的氮元素均以铵根离子形式存在
B. CO(NH2)2是一种有机氮肥
C. 储存碳酸氢铵时,应密封并置于阴凉通风处
D. 铵态氮肥不能与碱性物质(如草木灰等)混合施用
5 一定温度下,有关物质的转化如图所示,下列说法不正确的是( )
A. MgO可循环使用
B. 反应①实现了氮的固定
C. 高温下,反应②的化学方程式为2MgCl2+O22MgO+2Cl2
D. 图示转化可实现用NH4Cl获得NH3和Cl2
6 (2023宿迁泗阳实验高级中学月考)工业上常采用生物硝化法将NH转化为NO来处理氨氮废水,工艺流程如图所示。下列说法错误的是( )
A. 生物硝化法处理废水,会导致水体酸性增强:NH+2O2===NO+2H++H2O
B. 长期使用过量NH4Cl等铵态氮肥,会使水体富营养化
C. 检验NH所需的试剂是NaOH浓溶液、湿润的蓝色石蕊试纸
D. 可以加入石灰石来调节水体的酸碱性
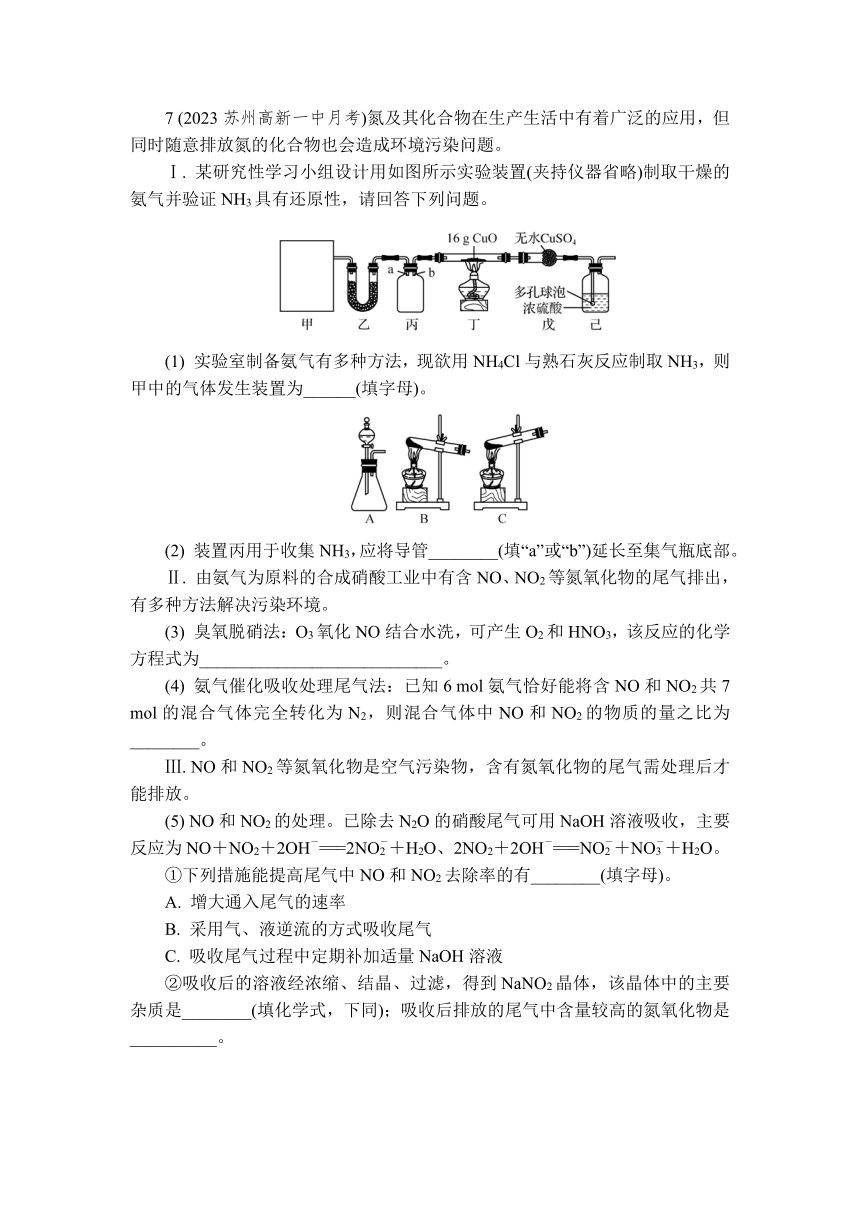
7 (2023苏州高新一中月考)氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
Ⅰ. 某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题。
(1) 实验室制备氨气有多种方法,现欲用NH4Cl与熟石灰反应制取NH3,则甲中的气体发生装置为______(填字母)。
(2) 装置丙用于收集NH3,应将导管________(填“a”或“b”)延长至集气瓶底部。
Ⅱ. 由氨气为原料的合成硝酸工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决污染环境。
(3) 臭氧脱硝法:O3氧化NO结合水洗,可产生O2和HNO3,该反应的化学方程式为____________________________。
(4) 氨气催化吸收处理尾气法:已知6 mol氨气恰好能将含NO和NO2共7 mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为________。
Ⅲ. NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(5) NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-===2NO+H2O、2NO2+2OH-===NO+NO+H2O。
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A. 增大通入尾气的速率
B. 采用气、液逆流的方式吸收尾气
C. 吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式,下同);吸收后排放的尾气中含量较高的氮氧化物是__________。
8 (2024镇江期末)氨氮(NH)与硝氮(NO)是含氮废水中常见的氮元素存在形态。
(一) 除氨氮(NH)
(1) 沉淀法
Mg2+、PO、氨氮生成MgNH4PO4·6H2O沉淀可达到去除氨氮的目的。已知:ⅰ. P元素在pH=8~10时主要存在形式为HPO;ⅱ. Mg3(PO4)2为沉淀。
①请写出pH=8时沉淀法去除NH的离子方程式:______________________
______________________________________________。
②氨氮去除率与含磷微粒浓度随pH变化如图所示,解释pH>10时氨氮去除率随pH变化的原因:____________________________________________________
____________________________________________________________________________________________________________________________________________。
(2) 氧化法
废水中加入适量的NaClO溶液,控制pH在6~7,可将氨氮转化为无毒物质,该过程发生了3个反应:
ⅰ. ClO-+H+===HClO
ⅱ. NH+HClO===NH2Cl+H++H2O(非氧化还原反应)
ⅲ. 2NH2Cl+HClO===N2+3H++3Cl-+H2O
①为了完全从废水中去除氨氮,加入的NaClO与水体中NH物质的量之比最小是________。
②已知:水体中以+1价形式存在的氯元素有杀菌消毒的作用,被称为“余氯”,该水体中的“余氯”除ClO-外,还有________________(填化学式)。
③为研究空气对NaClO氧化氨氮的影响,其他条件不变,增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是________(填字母)。
a. O2的氧化性比NaClO弱
b. 空气中的N2进入溶液中
c. O2在溶液中溶解度比较小
(二) 除硝氮(NO)
(3) 催化还原法
在WCu/Al2O3的催化下,使用H2作还原剂,可将水中的NO转化为N2。机理分为三步,如图所示:
第一步:NO在表面被还原为NO,Cu被氧化为CuO;
第二步:NO从Cu表面迁移至W的表面;
①第三步:_________________________________________________________
______________________________________________________________________。
(请描述虚框内的2个反应机理)
②若改用Pd-Cu/Al2O3作为还原硝酸盐过程的催化剂,其催化机理与W-Cu/Al2O3相似。但还原过程中检测到三种含氮微粒,其浓度变化如图所示,在1.5~2.5 h过程中,NO部分转化为NH的可能原因是_______________________
______________________________________________________________________。
第三单元 含氮化合物的合理使用
1. A 液氨汽化时从环境吸热,可用作制冷剂,与其易溶于水无关,B错误;NH4Cl中含有氮元素,可用作氮肥,与其受热易分解无关,C错误;不能用铁罐车运输稀硝酸,D错误。
2. D 固体加热,试管口应略向下倾斜,A错误;在铂催化剂和加热条件下,NH3与O2反应生成NO,B错误;装置丙不仅可以作为安全瓶防止倒吸,还可以使NO和O2反应,C错误;装置丁中有HNO3生成,HNO3与铜反应,含Cu2+的溶液呈蓝色,D正确。
3. C 浓硝酸与铜反应直接生成NO2,A错误;NO不和水反应,B错误;NO2和水反应生成HNO3和NO,C正确;NO和CO在催化剂作用下反应生成N2和CO2,D错误。
4. A 酰胺态氮肥(如尿素)溶于水后,氮元素以分子形式存在,A错误;CO2和NH3在一定条件下反应生成酰胺态氮肥CO(NH2)2和水,CO(NH2)2属于有机物,B正确;碳酸氢铵受热易分解,储存碳酸氢铵时,应密封并置于阴凉通风处,C正确;铵盐与碱反应放出氨气,铵态氮肥不能与碱性物质(如草木灰等)混合施用,D正确。
5. B 氮的固定指N2为反应物,转化为化合态的氮,B错误。
6. C 根据流程图可知,发生的反应为NH+2O2===NO+2H++H2O,氢离子浓度增大,所以会导致水体酸性增强,A正确;长期使用过量NH4Cl等铵态氮肥,水体中N元素含量升高,使水体富营养化,B正确;氨气能使湿润的红色石蕊试纸变蓝,检验NH所需的试剂是NaOH浓溶液、湿润的红色石蕊试纸,C错误;石灰石能消耗水体中的氢离子,可以加入石灰石来调节水体的酸碱性,D正确。
7. (1) B (2) b
(3) 3O3+2NO+H2O===2HNO3+3O2
(4) 5∶2 (5) ①BC ②NaNO3 NO
8. (1) ①Mg2++HPO+NH+5H2O+OH-===MgNH4PO4·6H2O↓
②pH>10时,Mg2+与PO反应生成Mg3(PO4)2沉淀,Mg2+与OH-反应生成Mg(OH)2沉淀,使氨氮去除率降低
(2) ①3∶2 ②NH2Cl、HClO ③ac
(3) ①H2在W表面吸附并解离为活性氢原子(W…H),活性氢原子将NO还原为N2,CuO还原为Cu
②在Pd催化作用下NO与氢原子反应转化为NH
1 (2024镇江期末)下列物质结构与性质或性质与用途具有对应关系的是( )
A. 黑磷具有类似石墨片层结构,可用于导电
B. NH3极易溶于水,液氨可用作制冷剂
C. NH4Cl受热易分解,可用作氮肥
D. 稀硝酸具有强氧化性,可用铁罐车运输
2 (2024徐州期末)下列关于含氮化合物的制备、性质等实验原理及装置、现象正确的是( )
甲 乙 丙 丁
A. 装置甲可用于制备并干燥NH3
B. 装置乙用于制备NO2气体
C. 装置丙仅起到安全瓶作用
D. 反应一段时间后,装置丁中溶液变为蓝色
3 (2024连云港东海期中)氮及其化合物的转化具有重要应用。下列说法正确的是( )
A. 实验室探究浓硝酸与铜反应的气态产物:HNO3(浓)NO
NO2
B. 工业制硝酸过程中的物质转化:N2NOHNO3
C. NO2溶于水发生反应的离子方程式:3NO2+H2O===2H++2NO+NO
D. 汽车尾气催化转化器中发生的主要反应:NO+COC+NO2
4 (2023徐州铜山期中)施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A. 氮肥溶于水,其中的氮元素均以铵根离子形式存在
B. CO(NH2)2是一种有机氮肥
C. 储存碳酸氢铵时,应密封并置于阴凉通风处
D. 铵态氮肥不能与碱性物质(如草木灰等)混合施用
5 一定温度下,有关物质的转化如图所示,下列说法不正确的是( )
A. MgO可循环使用
B. 反应①实现了氮的固定
C. 高温下,反应②的化学方程式为2MgCl2+O22MgO+2Cl2
D. 图示转化可实现用NH4Cl获得NH3和Cl2
6 (2023宿迁泗阳实验高级中学月考)工业上常采用生物硝化法将NH转化为NO来处理氨氮废水,工艺流程如图所示。下列说法错误的是( )
A. 生物硝化法处理废水,会导致水体酸性增强:NH+2O2===NO+2H++H2O
B. 长期使用过量NH4Cl等铵态氮肥,会使水体富营养化
C. 检验NH所需的试剂是NaOH浓溶液、湿润的蓝色石蕊试纸
D. 可以加入石灰石来调节水体的酸碱性
7 (2023苏州高新一中月考)氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
Ⅰ. 某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题。
(1) 实验室制备氨气有多种方法,现欲用NH4Cl与熟石灰反应制取NH3,则甲中的气体发生装置为______(填字母)。
(2) 装置丙用于收集NH3,应将导管________(填“a”或“b”)延长至集气瓶底部。
Ⅱ. 由氨气为原料的合成硝酸工业中有含NO、NO2等氮氧化物的尾气排出,有多种方法解决污染环境。
(3) 臭氧脱硝法:O3氧化NO结合水洗,可产生O2和HNO3,该反应的化学方程式为____________________________。
(4) 氨气催化吸收处理尾气法:已知6 mol氨气恰好能将含NO和NO2共7 mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为________。
Ⅲ. NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(5) NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-===2NO+H2O、2NO2+2OH-===NO+NO+H2O。
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A. 增大通入尾气的速率
B. 采用气、液逆流的方式吸收尾气
C. 吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式,下同);吸收后排放的尾气中含量较高的氮氧化物是__________。
8 (2024镇江期末)氨氮(NH)与硝氮(NO)是含氮废水中常见的氮元素存在形态。
(一) 除氨氮(NH)
(1) 沉淀法
Mg2+、PO、氨氮生成MgNH4PO4·6H2O沉淀可达到去除氨氮的目的。已知:ⅰ. P元素在pH=8~10时主要存在形式为HPO;ⅱ. Mg3(PO4)2为沉淀。
①请写出pH=8时沉淀法去除NH的离子方程式:______________________
______________________________________________。
②氨氮去除率与含磷微粒浓度随pH变化如图所示,解释pH>10时氨氮去除率随pH变化的原因:____________________________________________________
____________________________________________________________________________________________________________________________________________。
(2) 氧化法
废水中加入适量的NaClO溶液,控制pH在6~7,可将氨氮转化为无毒物质,该过程发生了3个反应:
ⅰ. ClO-+H+===HClO
ⅱ. NH+HClO===NH2Cl+H++H2O(非氧化还原反应)
ⅲ. 2NH2Cl+HClO===N2+3H++3Cl-+H2O
①为了完全从废水中去除氨氮,加入的NaClO与水体中NH物质的量之比最小是________。
②已知:水体中以+1价形式存在的氯元素有杀菌消毒的作用,被称为“余氯”,该水体中的“余氯”除ClO-外,还有________________(填化学式)。
③为研究空气对NaClO氧化氨氮的影响,其他条件不变,增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是________(填字母)。
a. O2的氧化性比NaClO弱
b. 空气中的N2进入溶液中
c. O2在溶液中溶解度比较小
(二) 除硝氮(NO)
(3) 催化还原法
在WCu/Al2O3的催化下,使用H2作还原剂,可将水中的NO转化为N2。机理分为三步,如图所示:
第一步:NO在表面被还原为NO,Cu被氧化为CuO;
第二步:NO从Cu表面迁移至W的表面;
①第三步:_________________________________________________________
______________________________________________________________________。
(请描述虚框内的2个反应机理)
②若改用Pd-Cu/Al2O3作为还原硝酸盐过程的催化剂,其催化机理与W-Cu/Al2O3相似。但还原过程中检测到三种含氮微粒,其浓度变化如图所示,在1.5~2.5 h过程中,NO部分转化为NH的可能原因是_______________________
______________________________________________________________________。
第三单元 含氮化合物的合理使用
1. A 液氨汽化时从环境吸热,可用作制冷剂,与其易溶于水无关,B错误;NH4Cl中含有氮元素,可用作氮肥,与其受热易分解无关,C错误;不能用铁罐车运输稀硝酸,D错误。
2. D 固体加热,试管口应略向下倾斜,A错误;在铂催化剂和加热条件下,NH3与O2反应生成NO,B错误;装置丙不仅可以作为安全瓶防止倒吸,还可以使NO和O2反应,C错误;装置丁中有HNO3生成,HNO3与铜反应,含Cu2+的溶液呈蓝色,D正确。
3. C 浓硝酸与铜反应直接生成NO2,A错误;NO不和水反应,B错误;NO2和水反应生成HNO3和NO,C正确;NO和CO在催化剂作用下反应生成N2和CO2,D错误。
4. A 酰胺态氮肥(如尿素)溶于水后,氮元素以分子形式存在,A错误;CO2和NH3在一定条件下反应生成酰胺态氮肥CO(NH2)2和水,CO(NH2)2属于有机物,B正确;碳酸氢铵受热易分解,储存碳酸氢铵时,应密封并置于阴凉通风处,C正确;铵盐与碱反应放出氨气,铵态氮肥不能与碱性物质(如草木灰等)混合施用,D正确。
5. B 氮的固定指N2为反应物,转化为化合态的氮,B错误。
6. C 根据流程图可知,发生的反应为NH+2O2===NO+2H++H2O,氢离子浓度增大,所以会导致水体酸性增强,A正确;长期使用过量NH4Cl等铵态氮肥,水体中N元素含量升高,使水体富营养化,B正确;氨气能使湿润的红色石蕊试纸变蓝,检验NH所需的试剂是NaOH浓溶液、湿润的红色石蕊试纸,C错误;石灰石能消耗水体中的氢离子,可以加入石灰石来调节水体的酸碱性,D正确。
7. (1) B (2) b
(3) 3O3+2NO+H2O===2HNO3+3O2
(4) 5∶2 (5) ①BC ②NaNO3 NO
8. (1) ①Mg2++HPO+NH+5H2O+OH-===MgNH4PO4·6H2O↓
②pH>10时,Mg2+与PO反应生成Mg3(PO4)2沉淀,Mg2+与OH-反应生成Mg(OH)2沉淀,使氨氮去除率降低
(2) ①3∶2 ②NH2Cl、HClO ③ac
(3) ①H2在W表面吸附并解离为活性氢原子(W…H),活性氢原子将NO还原为N2,CuO还原为Cu
②在Pd催化作用下NO与氢原子反应转化为NH
