9.1 金属的冶炼方法 练习 (含答案) 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 9.1 金属的冶炼方法 练习 (含答案) 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 221.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 17:19:39 | ||
图片预览


文档简介
第一单元 金属的冶炼方法
1 (2023淮安、宿迁七校联考)下列变化过程不属于金属冶炼的是( )
A. 电解熔融氯化钠
B. 铁在氧气中燃烧
C. 铁矿石与焦炭在高温下反应
D. 铝粉与二氧化锰在高温下反应
2 (2023宿迁北附同文实验学校月考)铝粉与氧化铁在高温条件下的反应可用来焊接钢轨。下列说法不正确的是( )
A. 该反应放出大量的热,生成的铁呈熔融态
B. 该反应的化学方程式2Al+Fe2O3Al2O3+2Fe
C. 被氧化的物质与被还原的物质的物质的量之比为1∶2
D. 实验室引发该反应通常在铝热剂表面加氯酸钾,插上镁带并点燃
3 我国古代“药金”的冶炼方法:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800 ℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
4 (2023淮安盱眙中学阶段测试)类比推理是学习化学的重要思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
选项 陈述Ⅰ 类比推理陈述Ⅱ
A 冶炼铁通常用热还原法 冶炼铜也可用热还原法
B 工业上用电解Al2O3的方法得到铝单质 工业上用电解MgO的方法得到镁单质
C Fe能把CuSO4溶液中的铜置换出来 Na也能把CuSO4溶液中的铜置换出来
D 可用铝热法制备金属铬 可用铝热法制备金属镁
5 (2024苏州期中)下列有关金属冶炼的方法不正确的是( )
A. 制镁:将海水富集得到的MgCl2溶液电解得到Mg和Cl2
B. 制铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁的氧化物
C. 制汞:加热氧化汞得到汞,同时生成O2
D. 制锰:将铝粉与难熔的MnO2以一定比例混合后,高温冶炼得到Mn
6 (2023辽宁重点高中期末联考)铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是Al2O3)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝,主要的工艺流程如图所示。
下列说法正确的是( )
A. 碱溶①后,溶液中主要含有的阳离子为Na+和Al3+
B. 步骤②通入足量的CO2发生反应的离子方程式为2[Al(OH)4]-+CO2===2Al(OH)3↓+CO+H2O
C. Al(OH)3受热分解,生成高熔点物质和水,该高熔点物质常用作高温耐火材料
D. 灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6)的目的是增强导电性
7 (2023南京江宁期末)某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备MgO的流程图。下列说法错误的是( )
A. 步骤(Ⅰ)和步骤(Ⅱ)中一定要用到的玻璃仪器是漏斗、玻璃棒
B. 步骤(Ⅰ)获得的滤液X中含有的阳离子主要有Mg2+、Al3+、H+
C. 步骤(Ⅱ)中获得Mg(OH)2沉淀,说明Al3+不与NaOH溶液反应
D. 步骤(Ⅲ)发生反应的化学方程式为Mg(OH)2MgO+H2O
8 (2023无锡期末)CuSO4是一种重要的化工原料,制备途径如图所示。下列说法正确的是( )
A. 将途径①反应所得气体循环利用体现了绿色化学思想
B. 途径②制备0.1 mol CuSO4,被还原的硫酸的物质的量为0.1 mol
C. 途径③制备CuSO4,当Cu过量时,H2SO4能完全反应
D. 生成等量的CuSO4,三种途径中参加反应的H2SO4的物质的量:①=②=③
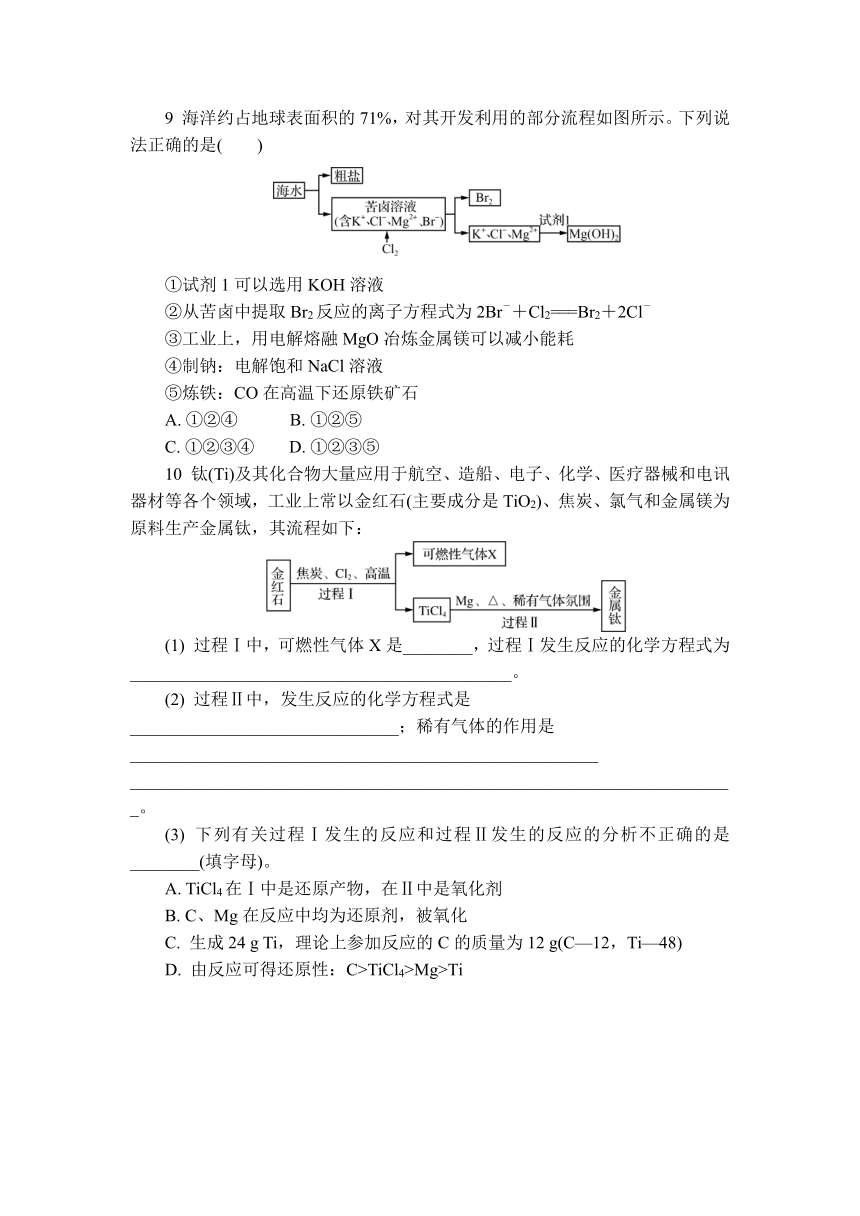
9 海洋约占地球表面积的71%,对其开发利用的部分流程如图所示。下列说法正确的是( )
①试剂1可以选用KOH溶液
②从苦卤中提取Br2反应的离子方程式为2Br-+Cl2===Br2+2Cl-
③工业上,用电解熔融MgO冶炼金属镁可以减小能耗
④制钠:电解饱和NaCl溶液
⑤炼铁:CO在高温下还原铁矿石
A. ①②④ B. ①②⑤
C. ①②③④ D. ①②③⑤
10 钛(Ti)及其化合物大量应用于航空、造船、电子、化学、医疗器械和电讯器材等各个领域,工业上常以金红石(主要成分是TiO2)、焦炭、氯气和金属镁为原料生产金属钛,其流程如下:
(1) 过程Ⅰ中,可燃性气体X是________,过程Ⅰ发生反应的化学方程式为____________________________________________。
(2) 过程Ⅱ中,发生反应的化学方程式是_______________________________;稀有气体的作用是______________________________________________________
______________________________________________________________________。
(3) 下列有关过程Ⅰ发生的反应和过程Ⅱ发生的反应的分析不正确的是________(填字母)。
A. TiCl4在Ⅰ中是还原产物,在Ⅱ中是氧化剂
B. C、Mg在反应中均为还原剂,被氧化
C. 生成24 g Ti,理论上参加反应的C的质量为12 g(C—12,Ti—48)
D. 由反应可得还原性:C>TiCl4>Mg>Ti
11 (2023徐州期中)某兴趣小组利用废旧电池的铜帽(铜、锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
(1) “滤液”中主要含有的阳离子是________。
(2) “溶解Ⅱ”过程中,发生反应的离子方程式为________________________
______________________________________________________________________。
(3) “溶解Ⅱ”过程中应控制反应温度不能过高的原因是_________________
___________________________________________________。
(4) 操作Ⅰ的具体操作是____________________________________________
______________________________________________________________________。
(5) 为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.570 g样品,配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.040 00 mol/L Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-===2CuI↓+I2;2S2O+I2===S4O+2I-。M(CuSO4·5H2O)=250 g/mol。
①配制250 mL溶液所需的玻璃仪器除烧杯、玻璃棒外,还有_______________。
②计算出样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留三位有效数字)。
第一单元 金属的冶炼方法
1. B 铁在氧气中燃烧生成四氧化三铁,不属于金属的冶炼,B符合题意。
2. C 该反应放出大量的热,温度较高,可以使铁融化,A正确;该反应为置换反应,铝置换出氧化铁中的铁,化学方程式为2Al+Fe2O3Al2O3+2Fe,B正确;该反应中,2 mol 铝被氧化,同时1 mol三氧化二铁被还原,物质的量之比为2∶1,C错误;该反应需要高温引发,在铝热剂表面加氯酸钾可以提供氧气,帮助镁条燃烧,D正确。
3. A 冶炼“药金”相关反应的化学方程式为ZnCO3ZnO+CO2↑,2ZnO+C2Zn+CO2↑,2Cu2O+C4Cu+CO2↑,A正确,B错误;王水可以溶解黄金和“药金”,C错误;用火焰灼烧可以区别黄金和“药金”,因为高温下黄金与空气不反应,而“药金”可与空气反应而变色,D错误。
4. A 冶炼铁通常用热还原法,冶炼铜也可用热还原法,A正确;MgO的熔点很高,工业上常用电解熔融MgCl2法制取镁单质,B错误;Na与CuSO4溶液反应生成Cu(OH)2沉淀和H2,C错误;镁的金属活动性强于铝,不能利用铝热反应制备金属镁,D错误。
5. A 制镁的方法是电解熔融的MgCl2,若电解MgCl2溶液,则会生成Mg(OH)2、Cl2和H2,A错误。
6. C 碱溶①后,溶液中主要含有的阳离子为Na+,Al3+与OH-不能大量共存,A错误;酸化②通入足量的CO2,应生成HCO,B错误;电解④添加冰晶石(Na3AlF6)的目的是降低Al2O3的熔融温度,D错误。
7. C 步骤(Ⅱ)中获得Mg(OH)2沉淀,未获得Al(OH)3沉淀,是因为Al(OH)3沉淀可溶于NaOH溶液,C错误。
8. A 途径①反应中会产生有害气体NO,NO循环使用,体现了绿色化学思想,A正确;途径②中反应为2Cu+O22CuO、CuO+H2SO4===CuSO4+H2O,硫酸未参与氧化还原反应,B错误;Cu与稀硫酸不反应,Cu过量时,H2SO4不能完全反应,C错误;根据化学方程式知,生成等量的CuSO4,三种途径中参加反应的H2SO4的物质的量:①=②<③,D错误。
9. B 工业上,用电解熔融MgCl2冶炼金属Mg可以减小能耗,③错误;应电解熔融NaCl制钠,④错误。故选B。
10. (1) CO TiO2+2Cl2+2CTiCl4+2CO
(2) TiCl4+2Mg2MgCl2+Ti 防止高温下Mg、Ti与空气中的O2、N2或CO2反应(或防止金属Mg、Ti被氧化)
(3) D
11. (1) Zn2+、H+
(2) 3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(3) 防止硝酸挥发及分解
(4) 蒸发浓缩、冷却结晶、过滤
(5) ①250 mL容量瓶、胶头滴管
②n(S2O)=0.040 00 mol/L×25.00×10-3L=1×10-3 mol
由题给信息可得关系式:
CuSO4·5H2O~Cu2+~I2~S2O
1 1
n(CuSO4·5H2O) 1×10-3mol×
解得n(CuSO4·5H2O)=1×10-2 mol,
m(CuSO4·5H2O)=1×10-2 mol×250 g/mol=2.5 g,
w(CuSO4·5H2O)=×100%≈97.3%。
1 (2023淮安、宿迁七校联考)下列变化过程不属于金属冶炼的是( )
A. 电解熔融氯化钠
B. 铁在氧气中燃烧
C. 铁矿石与焦炭在高温下反应
D. 铝粉与二氧化锰在高温下反应
2 (2023宿迁北附同文实验学校月考)铝粉与氧化铁在高温条件下的反应可用来焊接钢轨。下列说法不正确的是( )
A. 该反应放出大量的热,生成的铁呈熔融态
B. 该反应的化学方程式2Al+Fe2O3Al2O3+2Fe
C. 被氧化的物质与被还原的物质的物质的量之比为1∶2
D. 实验室引发该反应通常在铝热剂表面加氯酸钾,插上镁带并点燃
3 我国古代“药金”的冶炼方法:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800 ℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
4 (2023淮安盱眙中学阶段测试)类比推理是学习化学的重要思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
选项 陈述Ⅰ 类比推理陈述Ⅱ
A 冶炼铁通常用热还原法 冶炼铜也可用热还原法
B 工业上用电解Al2O3的方法得到铝单质 工业上用电解MgO的方法得到镁单质
C Fe能把CuSO4溶液中的铜置换出来 Na也能把CuSO4溶液中的铜置换出来
D 可用铝热法制备金属铬 可用铝热法制备金属镁
5 (2024苏州期中)下列有关金属冶炼的方法不正确的是( )
A. 制镁:将海水富集得到的MgCl2溶液电解得到Mg和Cl2
B. 制铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁的氧化物
C. 制汞:加热氧化汞得到汞,同时生成O2
D. 制锰:将铝粉与难熔的MnO2以一定比例混合后,高温冶炼得到Mn
6 (2023辽宁重点高中期末联考)铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是Al2O3)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝,主要的工艺流程如图所示。
下列说法正确的是( )
A. 碱溶①后,溶液中主要含有的阳离子为Na+和Al3+
B. 步骤②通入足量的CO2发生反应的离子方程式为2[Al(OH)4]-+CO2===2Al(OH)3↓+CO+H2O
C. Al(OH)3受热分解,生成高熔点物质和水,该高熔点物质常用作高温耐火材料
D. 灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6)的目的是增强导电性
7 (2023南京江宁期末)某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备MgO的流程图。下列说法错误的是( )
A. 步骤(Ⅰ)和步骤(Ⅱ)中一定要用到的玻璃仪器是漏斗、玻璃棒
B. 步骤(Ⅰ)获得的滤液X中含有的阳离子主要有Mg2+、Al3+、H+
C. 步骤(Ⅱ)中获得Mg(OH)2沉淀,说明Al3+不与NaOH溶液反应
D. 步骤(Ⅲ)发生反应的化学方程式为Mg(OH)2MgO+H2O
8 (2023无锡期末)CuSO4是一种重要的化工原料,制备途径如图所示。下列说法正确的是( )
A. 将途径①反应所得气体循环利用体现了绿色化学思想
B. 途径②制备0.1 mol CuSO4,被还原的硫酸的物质的量为0.1 mol
C. 途径③制备CuSO4,当Cu过量时,H2SO4能完全反应
D. 生成等量的CuSO4,三种途径中参加反应的H2SO4的物质的量:①=②=③
9 海洋约占地球表面积的71%,对其开发利用的部分流程如图所示。下列说法正确的是( )
①试剂1可以选用KOH溶液
②从苦卤中提取Br2反应的离子方程式为2Br-+Cl2===Br2+2Cl-
③工业上,用电解熔融MgO冶炼金属镁可以减小能耗
④制钠:电解饱和NaCl溶液
⑤炼铁:CO在高温下还原铁矿石
A. ①②④ B. ①②⑤
C. ①②③④ D. ①②③⑤
10 钛(Ti)及其化合物大量应用于航空、造船、电子、化学、医疗器械和电讯器材等各个领域,工业上常以金红石(主要成分是TiO2)、焦炭、氯气和金属镁为原料生产金属钛,其流程如下:
(1) 过程Ⅰ中,可燃性气体X是________,过程Ⅰ发生反应的化学方程式为____________________________________________。
(2) 过程Ⅱ中,发生反应的化学方程式是_______________________________;稀有气体的作用是______________________________________________________
______________________________________________________________________。
(3) 下列有关过程Ⅰ发生的反应和过程Ⅱ发生的反应的分析不正确的是________(填字母)。
A. TiCl4在Ⅰ中是还原产物,在Ⅱ中是氧化剂
B. C、Mg在反应中均为还原剂,被氧化
C. 生成24 g Ti,理论上参加反应的C的质量为12 g(C—12,Ti—48)
D. 由反应可得还原性:C>TiCl4>Mg>Ti
11 (2023徐州期中)某兴趣小组利用废旧电池的铜帽(铜、锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
(1) “滤液”中主要含有的阳离子是________。
(2) “溶解Ⅱ”过程中,发生反应的离子方程式为________________________
______________________________________________________________________。
(3) “溶解Ⅱ”过程中应控制反应温度不能过高的原因是_________________
___________________________________________________。
(4) 操作Ⅰ的具体操作是____________________________________________
______________________________________________________________________。
(5) 为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.570 g样品,配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.040 00 mol/L Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-===2CuI↓+I2;2S2O+I2===S4O+2I-。M(CuSO4·5H2O)=250 g/mol。
①配制250 mL溶液所需的玻璃仪器除烧杯、玻璃棒外,还有_______________。
②计算出样品中CuSO4·5H2O的质量分数(写出计算过程,结果保留三位有效数字)。
第一单元 金属的冶炼方法
1. B 铁在氧气中燃烧生成四氧化三铁,不属于金属的冶炼,B符合题意。
2. C 该反应放出大量的热,温度较高,可以使铁融化,A正确;该反应为置换反应,铝置换出氧化铁中的铁,化学方程式为2Al+Fe2O3Al2O3+2Fe,B正确;该反应中,2 mol 铝被氧化,同时1 mol三氧化二铁被还原,物质的量之比为2∶1,C错误;该反应需要高温引发,在铝热剂表面加氯酸钾可以提供氧气,帮助镁条燃烧,D正确。
3. A 冶炼“药金”相关反应的化学方程式为ZnCO3ZnO+CO2↑,2ZnO+C2Zn+CO2↑,2Cu2O+C4Cu+CO2↑,A正确,B错误;王水可以溶解黄金和“药金”,C错误;用火焰灼烧可以区别黄金和“药金”,因为高温下黄金与空气不反应,而“药金”可与空气反应而变色,D错误。
4. A 冶炼铁通常用热还原法,冶炼铜也可用热还原法,A正确;MgO的熔点很高,工业上常用电解熔融MgCl2法制取镁单质,B错误;Na与CuSO4溶液反应生成Cu(OH)2沉淀和H2,C错误;镁的金属活动性强于铝,不能利用铝热反应制备金属镁,D错误。
5. A 制镁的方法是电解熔融的MgCl2,若电解MgCl2溶液,则会生成Mg(OH)2、Cl2和H2,A错误。
6. C 碱溶①后,溶液中主要含有的阳离子为Na+,Al3+与OH-不能大量共存,A错误;酸化②通入足量的CO2,应生成HCO,B错误;电解④添加冰晶石(Na3AlF6)的目的是降低Al2O3的熔融温度,D错误。
7. C 步骤(Ⅱ)中获得Mg(OH)2沉淀,未获得Al(OH)3沉淀,是因为Al(OH)3沉淀可溶于NaOH溶液,C错误。
8. A 途径①反应中会产生有害气体NO,NO循环使用,体现了绿色化学思想,A正确;途径②中反应为2Cu+O22CuO、CuO+H2SO4===CuSO4+H2O,硫酸未参与氧化还原反应,B错误;Cu与稀硫酸不反应,Cu过量时,H2SO4不能完全反应,C错误;根据化学方程式知,生成等量的CuSO4,三种途径中参加反应的H2SO4的物质的量:①=②<③,D错误。
9. B 工业上,用电解熔融MgCl2冶炼金属Mg可以减小能耗,③错误;应电解熔融NaCl制钠,④错误。故选B。
10. (1) CO TiO2+2Cl2+2CTiCl4+2CO
(2) TiCl4+2Mg2MgCl2+Ti 防止高温下Mg、Ti与空气中的O2、N2或CO2反应(或防止金属Mg、Ti被氧化)
(3) D
11. (1) Zn2+、H+
(2) 3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(3) 防止硝酸挥发及分解
(4) 蒸发浓缩、冷却结晶、过滤
(5) ①250 mL容量瓶、胶头滴管
②n(S2O)=0.040 00 mol/L×25.00×10-3L=1×10-3 mol
由题给信息可得关系式:
CuSO4·5H2O~Cu2+~I2~S2O
1 1
n(CuSO4·5H2O) 1×10-3mol×
解得n(CuSO4·5H2O)=1×10-2 mol,
m(CuSO4·5H2O)=1×10-2 mol×250 g/mol=2.5 g,
w(CuSO4·5H2O)=×100%≈97.3%。
