9.3 金属材料的性能及应用 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 9.3 金属材料的性能及应用 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 353.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 00:00:00 | ||
图片预览


文档简介
第三单元 金属材料的性能及应用
1 (2023无锡锡山高级中学期中)《流浪地球2》向观众展示了太空电梯、行星发动机、超级计算机550 W等超前的科技幻想,探讨了数字生命、人工智能等科技伦理问题。它们与化学有着密切联系,下列说法不正确的是( )
A. 我国“硅石墨烯锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
B. 我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是SiO2
C. 新型陶瓷碳化硅(SiC)可作耐高温结构材料
D. 富勒烯、石墨烯都是含碳化合物
2 (2023镇江期末)下列成果研究的物质属于无机非金属材料的是( )
A. 聚乳酸塑料 B. 钛合金
C. 纳米酶 D. 高温结构陶瓷
3 (2023连云港新海高中、徐州一中学情调研)下列说法不正确的是( )
A. 晶体硅可用作航天器的太阳能电池板
B. 武德合金的熔点低,可用作电器的保险丝
C. 制造5G芯片的氮化铝属于无机非金属材料
D. “超轻海绵”使用的石墨烯是有机高分子材料
4 下列有关物质的性质与用途具有对应关系的是( )
A. Al2O3能与碱反应,可用于电解冶炼铝
B. NH3易溶于水,可用作制冷剂
C. FeCl3溶液呈酸性,可用于刻蚀铜质电路板
D. 浓硫酸具有吸水性,可用于干燥Cl2
5 下列表述正确的是( )
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
②我国用二氧化氯取代氯气对饮用水进行消毒,是因为二氧化氯杀菌、消毒能力强,持效长
③氧化镁可用来制造耐火砖和坩埚等
④明矾能使水中的悬浮物凝聚,可作净水剂
⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料
A. ①④⑤ B. ①②⑤
C. ②③④ D. ①②③④⑤
6 (2024扬州高邮月考)工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如图(注:SiO2碱溶时转变为铝硅酸钠沉淀)。下列叙述错误的是( )
A. 操作Ⅰ适当增大NaOH溶液浓度,可提高Al2O3的浸取速率
B. 通入过量CO2的离子方程式为[Al(OH)4]-+CO2===Al(OH)3↓+HCO
C. 实验室进行操作Ⅳ的仪器有蒸发皿、酒精灯、铁架台等
D. 加入冰晶石的目的是降低Al2O3的熔融温度
7 (2024宿迁期末)一种利用废铜渣(主要成分CuO,及少量Fe2O3、SiO2杂质)制备超细铜粉流程如图。下列说法正确的是( )
A. “酸浸”所得滤渣的主要成分为H2SiO3
B. “沉铁”发生反应的离子方程式为Fe3++3OH-===Fe(OH)3↓
C. “沉铜”发生的反应中,氧化剂与还原剂的物质的量之比为2∶3
D. “转化”后所得滤液中含有的主要阳离子:NH、H+、Cu2+
8 钛和钛的合金大量用于航空工业。工业上以金红石(主要成分TiO2)为原料生产钛锭的流程如图。下列说法不正确的是( )
A. 将金红石粉碎可加快反应速率
B. 步骤①中生成的可燃性气体是CO
C. 步骤②可以在Ar或N2气流中加热
D. 该流程中可以循环利用的物质有Mg和Cl2
9 部分被氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如图处理。下列说法正确的是( )
①滤液A中的阳离子为Fe2+、Fe3+、H+ ②样品中氧原子的物质的量为0.02 mol ③溶解样品的过程中消耗H2SO4的总物质的量为0.04 mol ④V=224 ⑤V=448
A.①③④ B.②③④ C.②③⑤ D.①②⑤
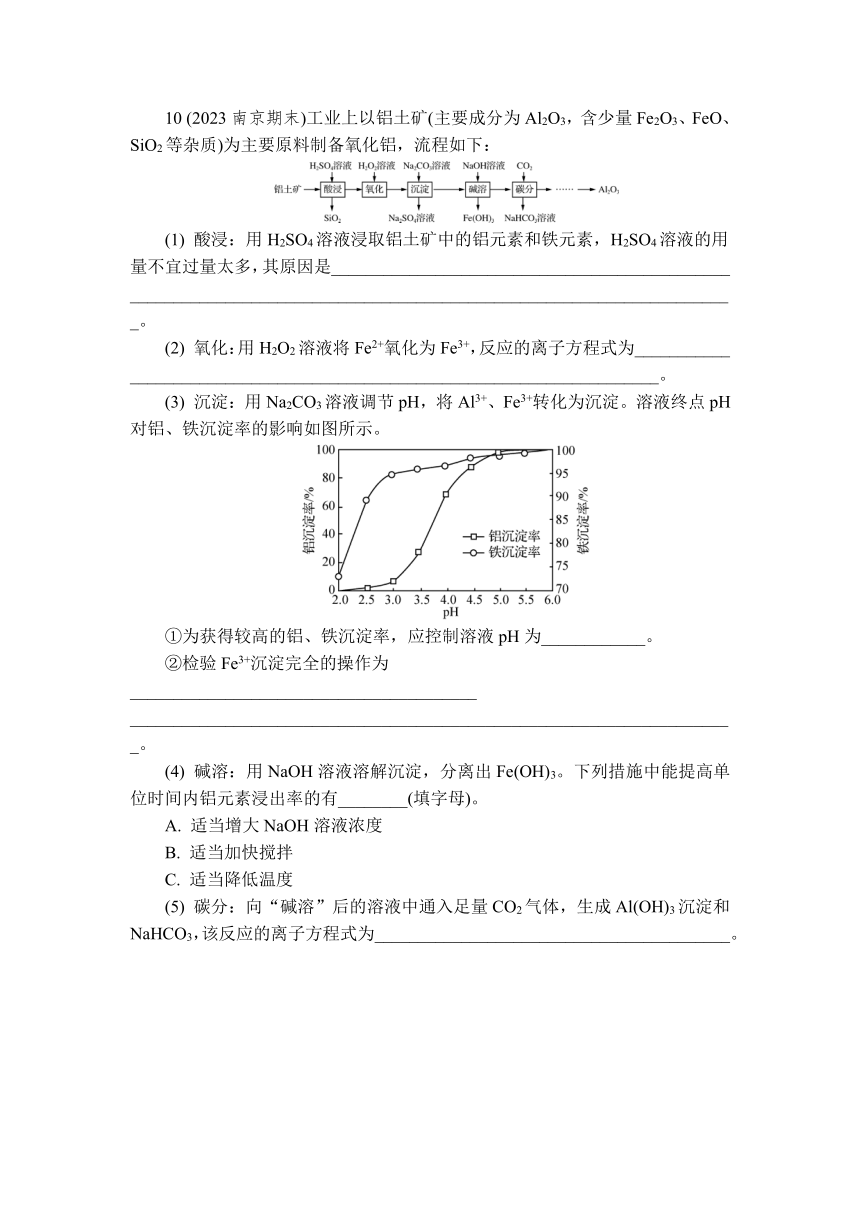
10 (2023南京期末)工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下:
(1) 酸浸:用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是______________________________________________
______________________________________________________________________。
(2) 氧化:用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为___________
_____________________________________________________________。
(3) 沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
①为获得较高的铝、铁沉淀率,应控制溶液pH为____________。
②检验Fe3+沉淀完全的操作为________________________________________
______________________________________________________________________。
(4) 碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3。下列措施中能提高单位时间内铝元素浸出率的有________(填字母)。
A. 适当增大NaOH溶液浓度
B. 适当加快搅拌
C. 适当降低温度
(5) 碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为_________________________________________。
11 (2024徐州期末)BeO广泛应用于原子能、航天等领域,是重要的战略物资。利用绿柱石(主要化学成分为BeO、Al2O3、SiO2及一定量的FeO、Fe2O3)生产BeO的一种工艺流程如图。
已知:①Be(OH)2性质与Al(OH)3相似,[Be(OH)4]2-的性质与[Al(OH)4]-相似。②几种金属离子的氢氧化物沉淀时pH如表所示。
离子 Be2+ Al3+ Fe3+ Fe2+
开始沉淀时的pH 5.2 3.3 1.5 6.5
沉淀完全时的pH 8.8 5.0 3.7 9.7
(1) 增大绿柱石浸取率的方法有____________________________________(任写两条)。
(2) 写出步骤Ⅰ中发生反应的离子方程式:_____________________________。
(3) 步骤Ⅱ中调节pH的范围为__________;步骤Ⅲ中滤液的成分为__________(填化学式)。
(4) 步骤Ⅲ当pH>8.8时,Be(OH)2的质量随溶液pH变化如图所示,原因是__________________________________________________________________________________________________________________(用离子方程式表示)。
(5) 步骤Ⅲ中沉淀Be(OH)2的方法分为直接沉淀法和沸腾沉淀法。沉淀方法对沉淀质量的影响如图所示,分别对获得Be(OH)2进行分析,沉淀形态及纯度的影响如表。使用直接沉淀法沉淀质量较大,但Be(OH)2 的纯度较低的原因是_____
______________________________________________________________________。
沉淀方法 沉淀形态 Be(OH)2的纯度/%
直接沉淀法 胶状无定型 45.77
沸腾沉淀法 大颗粒晶体 60.20
第三单元 金属材料的性能及应用
1. D C、Si、Ge都是主族元素,A正确;光纤的主要成分是SiO2,B正确;新型陶瓷碳化硅(SiC)可作耐高温结构材料,C正确;富勒烯和石墨烯都是碳元素的单质,D错误。
2. D 聚乳酸塑料属于有机高分子材料,A错误;钛合金属于金属材料,B错误;纳米酶是一类既有纳米材料的独特性能,又有催化功能的模拟酶,C错误;高温结构陶瓷属于无机非金属材料,D正确。
3. D 晶体硅可用作航天器的太阳能电池板,A正确;武德合金的熔点低,可用作电器的保险丝,B正确;制造5G芯片的氮化铝属于新型无机非金属材料,C正确; “超轻海绵”使用的石墨烯属于无机物,不属于有机高分子材料,D错误。
4. D Al2O3是离子化合物,熔融状态下能导电,可用于电解冶炼铝,A错误;NH3易液化,液氨汽化时吸收大量的热,能使环境温度降低,工业上常作制冷剂,与NH3易溶于水无关,B错误;FeCl3可用于刻蚀铜质电路板,体现其氧化性,与FeCl3溶液呈酸性无关,C错误;浓硫酸具有吸水性,并且不与氯气反应,可用来干燥氯气,D正确。
5. D 开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生,①正确;二氧化氯杀菌、消毒能力强,持效长,因此二氧化氯常用于自来水的杀菌、消毒,②正确;氧化镁的熔点高,是很好的耐火材料,③正确;明矾溶于水后,电离出的铝离子水解生成氢氧化铝胶体,具有吸附作用,可作净水剂,④正确;玻璃、陶瓷和水泥是三大硅酸盐材料,⑤正确。故选D。
6. C 操作Ⅳ为灼烧,需要用到坩埚、铁架台、泥三角等,用不到蒸发皿,C错误。
7. D SiO2不溶于硫酸,滤渣的主要成分为SiO2,A错误;NH3·H2O是弱碱,在离子方程式中不能拆,B错误;CuNH4SO3中Cu显+1价,“沉铜”时,Cu2+是氧化剂,化合价降1,SO2是还原剂,化合价升2,则氧化剂与还原剂的物质的量之比为2∶1,C错误;“转化”时,CuNH4SO3中Cu+发生歧化反应得到Cu2+和Cu,故“转化”后所得滤液中含有的主要阳离子:NH、H+、Cu2+,D正确。
8. C 加热条件下,Mg与N2反应生成Mg3N2,会引入杂质,故步骤②不可以在N2气流中加热,C错误。
9. C 滤液A中不含Cu2+,说明Cu元素以Cu单质的形式存在于滤渣中,由于Fe3+与Cu不能大量共存,故滤液A中不可能含有Fe3+,①错误;稀硫酸是足量的,故3.2 g滤渣全部是金属Cu,则n(Cu)==0.05 mol,在空气中灼烧得到的3.2 g固体为Fe2O3,n(Fe2O3)==0.02 mol,5.76 g部分被氧化的FeCu合金样品中的n(O)==0.02 mol,②正确;溶解样品的过程中消耗H2SO4用于生成FeSO4,滤液A中含有0.04 mol FeSO4,则溶解样品的过程中消耗H2SO4的总物质的量为0.04 mol,③正确;参与反应的0.04 mol H2SO4中的H+用于生成H2O和H2,样品中氧原子的物质的量为0.02 mol,则可生成0.02 mol H2O和0.02 mol H2,标准状况下,H2的体积为448 mL,④错误,⑤正确。故选C。
10. (1) 防止增大后续步骤中Na2CO3和NaOH溶液的消耗,造成浪费
(2) 2Fe2++H2O2+2H+===2Fe3++2H2O
(3) ①5.0左右 ②静置,取上层清液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,则说明Fe3+沉淀完全
(4) AB
(5) [Al(OH)4]-+CO2===Al(OH)3↓+HCO
11. (1) 适当升高温度、“酸浸”前将绿柱石进行粉碎、适当增大硫酸的浓度等(任写两条)
(2) 2Fe2++2H++H2O2===2Fe3++2H2O
(3) 5.0≤pH<5.2 Na2SO4
(4) Be(OH)2+2OH-===[Be(OH)4]2-
(5) 直接沉淀法生成的Be(OH)2是胶状无定型,具有吸附性,易吸附大量杂质
1 (2023无锡锡山高级中学期中)《流浪地球2》向观众展示了太空电梯、行星发动机、超级计算机550 W等超前的科技幻想,探讨了数字生命、人工智能等科技伦理问题。它们与化学有着密切联系,下列说法不正确的是( )
A. 我国“硅石墨烯锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
B. 我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是SiO2
C. 新型陶瓷碳化硅(SiC)可作耐高温结构材料
D. 富勒烯、石墨烯都是含碳化合物
2 (2023镇江期末)下列成果研究的物质属于无机非金属材料的是( )
A. 聚乳酸塑料 B. 钛合金
C. 纳米酶 D. 高温结构陶瓷
3 (2023连云港新海高中、徐州一中学情调研)下列说法不正确的是( )
A. 晶体硅可用作航天器的太阳能电池板
B. 武德合金的熔点低,可用作电器的保险丝
C. 制造5G芯片的氮化铝属于无机非金属材料
D. “超轻海绵”使用的石墨烯是有机高分子材料
4 下列有关物质的性质与用途具有对应关系的是( )
A. Al2O3能与碱反应,可用于电解冶炼铝
B. NH3易溶于水,可用作制冷剂
C. FeCl3溶液呈酸性,可用于刻蚀铜质电路板
D. 浓硫酸具有吸水性,可用于干燥Cl2
5 下列表述正确的是( )
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
②我国用二氧化氯取代氯气对饮用水进行消毒,是因为二氧化氯杀菌、消毒能力强,持效长
③氧化镁可用来制造耐火砖和坩埚等
④明矾能使水中的悬浮物凝聚,可作净水剂
⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料
A. ①④⑤ B. ①②⑤
C. ②③④ D. ①②③④⑤
6 (2024扬州高邮月考)工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如图(注:SiO2碱溶时转变为铝硅酸钠沉淀)。下列叙述错误的是( )
A. 操作Ⅰ适当增大NaOH溶液浓度,可提高Al2O3的浸取速率
B. 通入过量CO2的离子方程式为[Al(OH)4]-+CO2===Al(OH)3↓+HCO
C. 实验室进行操作Ⅳ的仪器有蒸发皿、酒精灯、铁架台等
D. 加入冰晶石的目的是降低Al2O3的熔融温度
7 (2024宿迁期末)一种利用废铜渣(主要成分CuO,及少量Fe2O3、SiO2杂质)制备超细铜粉流程如图。下列说法正确的是( )
A. “酸浸”所得滤渣的主要成分为H2SiO3
B. “沉铁”发生反应的离子方程式为Fe3++3OH-===Fe(OH)3↓
C. “沉铜”发生的反应中,氧化剂与还原剂的物质的量之比为2∶3
D. “转化”后所得滤液中含有的主要阳离子:NH、H+、Cu2+
8 钛和钛的合金大量用于航空工业。工业上以金红石(主要成分TiO2)为原料生产钛锭的流程如图。下列说法不正确的是( )
A. 将金红石粉碎可加快反应速率
B. 步骤①中生成的可燃性气体是CO
C. 步骤②可以在Ar或N2气流中加热
D. 该流程中可以循环利用的物质有Mg和Cl2
9 部分被氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如图处理。下列说法正确的是( )
①滤液A中的阳离子为Fe2+、Fe3+、H+ ②样品中氧原子的物质的量为0.02 mol ③溶解样品的过程中消耗H2SO4的总物质的量为0.04 mol ④V=224 ⑤V=448
A.①③④ B.②③④ C.②③⑤ D.①②⑤
10 (2023南京期末)工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下:
(1) 酸浸:用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是______________________________________________
______________________________________________________________________。
(2) 氧化:用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为___________
_____________________________________________________________。
(3) 沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
①为获得较高的铝、铁沉淀率,应控制溶液pH为____________。
②检验Fe3+沉淀完全的操作为________________________________________
______________________________________________________________________。
(4) 碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3。下列措施中能提高单位时间内铝元素浸出率的有________(填字母)。
A. 适当增大NaOH溶液浓度
B. 适当加快搅拌
C. 适当降低温度
(5) 碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为_________________________________________。
11 (2024徐州期末)BeO广泛应用于原子能、航天等领域,是重要的战略物资。利用绿柱石(主要化学成分为BeO、Al2O3、SiO2及一定量的FeO、Fe2O3)生产BeO的一种工艺流程如图。
已知:①Be(OH)2性质与Al(OH)3相似,[Be(OH)4]2-的性质与[Al(OH)4]-相似。②几种金属离子的氢氧化物沉淀时pH如表所示。
离子 Be2+ Al3+ Fe3+ Fe2+
开始沉淀时的pH 5.2 3.3 1.5 6.5
沉淀完全时的pH 8.8 5.0 3.7 9.7
(1) 增大绿柱石浸取率的方法有____________________________________(任写两条)。
(2) 写出步骤Ⅰ中发生反应的离子方程式:_____________________________。
(3) 步骤Ⅱ中调节pH的范围为__________;步骤Ⅲ中滤液的成分为__________(填化学式)。
(4) 步骤Ⅲ当pH>8.8时,Be(OH)2的质量随溶液pH变化如图所示,原因是__________________________________________________________________________________________________________________(用离子方程式表示)。
(5) 步骤Ⅲ中沉淀Be(OH)2的方法分为直接沉淀法和沸腾沉淀法。沉淀方法对沉淀质量的影响如图所示,分别对获得Be(OH)2进行分析,沉淀形态及纯度的影响如表。使用直接沉淀法沉淀质量较大,但Be(OH)2 的纯度较低的原因是_____
______________________________________________________________________。
沉淀方法 沉淀形态 Be(OH)2的纯度/%
直接沉淀法 胶状无定型 45.77
沸腾沉淀法 大颗粒晶体 60.20
第三单元 金属材料的性能及应用
1. D C、Si、Ge都是主族元素,A正确;光纤的主要成分是SiO2,B正确;新型陶瓷碳化硅(SiC)可作耐高温结构材料,C正确;富勒烯和石墨烯都是碳元素的单质,D错误。
2. D 聚乳酸塑料属于有机高分子材料,A错误;钛合金属于金属材料,B错误;纳米酶是一类既有纳米材料的独特性能,又有催化功能的模拟酶,C错误;高温结构陶瓷属于无机非金属材料,D正确。
3. D 晶体硅可用作航天器的太阳能电池板,A正确;武德合金的熔点低,可用作电器的保险丝,B正确;制造5G芯片的氮化铝属于新型无机非金属材料,C正确; “超轻海绵”使用的石墨烯属于无机物,不属于有机高分子材料,D错误。
4. D Al2O3是离子化合物,熔融状态下能导电,可用于电解冶炼铝,A错误;NH3易液化,液氨汽化时吸收大量的热,能使环境温度降低,工业上常作制冷剂,与NH3易溶于水无关,B错误;FeCl3可用于刻蚀铜质电路板,体现其氧化性,与FeCl3溶液呈酸性无关,C错误;浓硫酸具有吸水性,并且不与氯气反应,可用来干燥氯气,D正确。
5. D 开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生,①正确;二氧化氯杀菌、消毒能力强,持效长,因此二氧化氯常用于自来水的杀菌、消毒,②正确;氧化镁的熔点高,是很好的耐火材料,③正确;明矾溶于水后,电离出的铝离子水解生成氢氧化铝胶体,具有吸附作用,可作净水剂,④正确;玻璃、陶瓷和水泥是三大硅酸盐材料,⑤正确。故选D。
6. C 操作Ⅳ为灼烧,需要用到坩埚、铁架台、泥三角等,用不到蒸发皿,C错误。
7. D SiO2不溶于硫酸,滤渣的主要成分为SiO2,A错误;NH3·H2O是弱碱,在离子方程式中不能拆,B错误;CuNH4SO3中Cu显+1价,“沉铜”时,Cu2+是氧化剂,化合价降1,SO2是还原剂,化合价升2,则氧化剂与还原剂的物质的量之比为2∶1,C错误;“转化”时,CuNH4SO3中Cu+发生歧化反应得到Cu2+和Cu,故“转化”后所得滤液中含有的主要阳离子:NH、H+、Cu2+,D正确。
8. C 加热条件下,Mg与N2反应生成Mg3N2,会引入杂质,故步骤②不可以在N2气流中加热,C错误。
9. C 滤液A中不含Cu2+,说明Cu元素以Cu单质的形式存在于滤渣中,由于Fe3+与Cu不能大量共存,故滤液A中不可能含有Fe3+,①错误;稀硫酸是足量的,故3.2 g滤渣全部是金属Cu,则n(Cu)==0.05 mol,在空气中灼烧得到的3.2 g固体为Fe2O3,n(Fe2O3)==0.02 mol,5.76 g部分被氧化的FeCu合金样品中的n(O)==0.02 mol,②正确;溶解样品的过程中消耗H2SO4用于生成FeSO4,滤液A中含有0.04 mol FeSO4,则溶解样品的过程中消耗H2SO4的总物质的量为0.04 mol,③正确;参与反应的0.04 mol H2SO4中的H+用于生成H2O和H2,样品中氧原子的物质的量为0.02 mol,则可生成0.02 mol H2O和0.02 mol H2,标准状况下,H2的体积为448 mL,④错误,⑤正确。故选C。
10. (1) 防止增大后续步骤中Na2CO3和NaOH溶液的消耗,造成浪费
(2) 2Fe2++H2O2+2H+===2Fe3++2H2O
(3) ①5.0左右 ②静置,取上层清液于试管中,向其中滴加几滴KSCN溶液,若溶液不变红,则说明Fe3+沉淀完全
(4) AB
(5) [Al(OH)4]-+CO2===Al(OH)3↓+HCO
11. (1) 适当升高温度、“酸浸”前将绿柱石进行粉碎、适当增大硫酸的浓度等(任写两条)
(2) 2Fe2++2H++H2O2===2Fe3++2H2O
(3) 5.0≤pH<5.2 Na2SO4
(4) Be(OH)2+2OH-===[Be(OH)4]2-
(5) 直接沉淀法生成的Be(OH)2是胶状无定型,具有吸附性,易吸附大量杂质
