专题7氮与社会可持续发展 综合评价 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 专题7氮与社会可持续发展 综合评价 练习(含答案) 2024-2025学年高一化学苏教版(2019)必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 543.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 17:25:01 | ||
图片预览



文档简介
专题7 氮与社会可持续发展 综合评价
姓名________ 学号________
单项选择题(本题包括13小题,每题3分,共计39分)
阅读下列材料,回答1~3题。
含氮化合物应用广泛。肼(H2N—NH2)又称联氨,是一种可燃性液体,可用作火箭燃料。叠氮酸(HN3)是一种弱酸,可通过亚硝酸氧化肼获得。硝酸是一种易挥发的液体,硝酸和纤维素可发生酯化反应制备硝酸纤维。工业上利用NH3催化氧化生成NO,反应为4NH3+5O24NO+6H2O,将NO进一步氧化,用水吸收制备HNO3。
1 (2024宿迁期末)下列有关含氮微粒的说法正确的是( )
A. N2H4中只含极性共价键
B. N2结构式为N≡N
C. HN3属于离子化合物
D. NH3易液化,是因为NH3与H2O之间能形成氢键
2 (2024宿迁期末)下列说法正确的是( )
A. N2与O2形成的NO属于酸性氧化物
B. HN3与NaOH反应的离子方程式为H++OH-===H2O
C. 用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生
D. NH3催化氧化时,每生成0.1 mol NO,转移电子的数目为6.02×1023
3 (2024宿迁期末)下列有关物质的性质与用途具有对应关系的是( )
A. N2性质稳定,可用作食品保护气
B. NH3极易溶于水,常用作制冷剂
C. NH4HCO3受热易分解,可用作氮肥
D. 浓硝酸有强氧化性,可用于制备NH4NO3
4 (2024常州联盟月考)用氨水检验Cl2管道泄漏的原理为8NH3+3Cl2===6NH4Cl+N2。下列说法不正确的是( )
A. N元素位于元素周期表中第2周期ⅤA族
B. NH3的结构式为
C. NH4Cl为离子化合物
D. N2的电子式为
5 (2023连云港期中)用NaOH溶液吸收处理氮氧化物,主要反应为NO+NO2+2OH-===2NO+H2O、2NO2+2OH-===NO+NO+H2O,在指定条件下,下列微粒间的转化能够实现的是( )
A. NH3N2 B. NO2NO
C. HNO3NO D. SO2SO
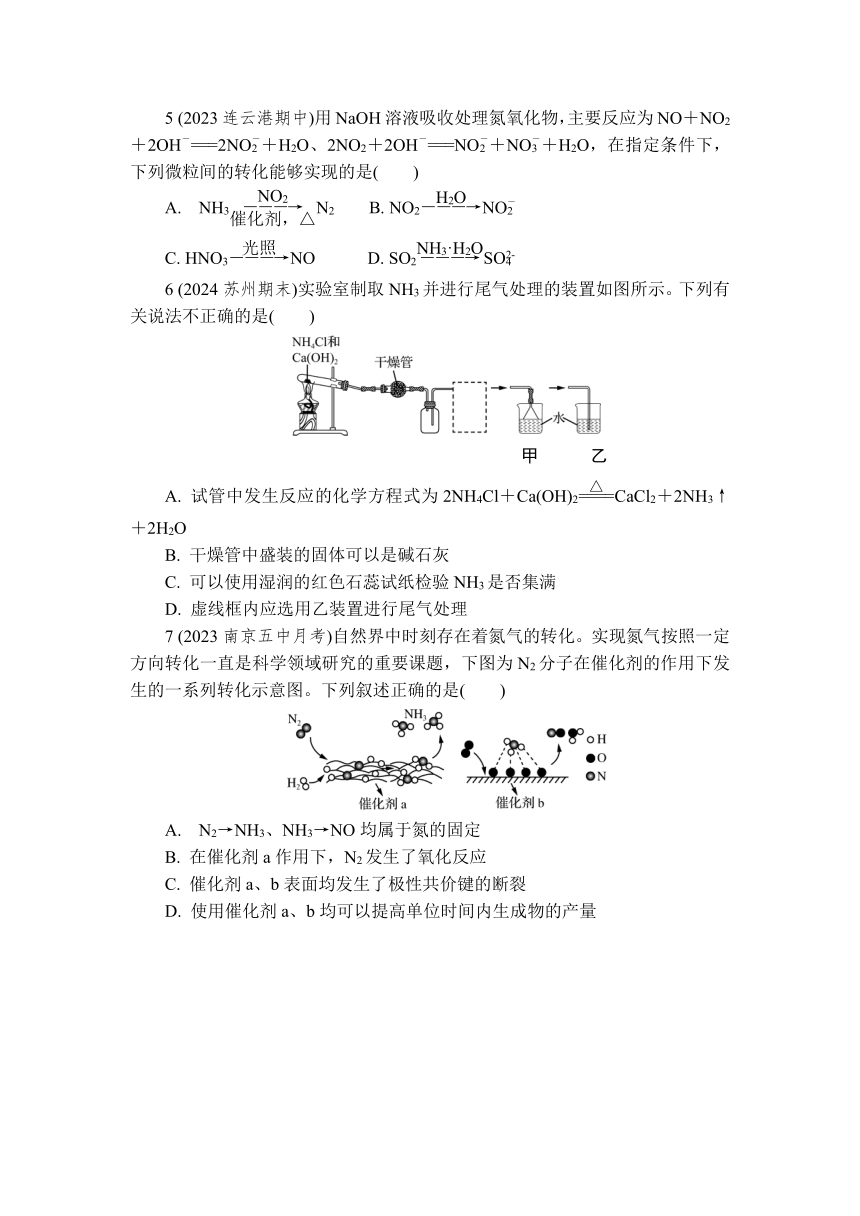
6 (2024苏州期末)实验室制取NH3并进行尾气处理的装置如图所示。下列有关说法不正确的是( )
甲 乙
A. 试管中发生反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
B. 干燥管中盛装的固体可以是碱石灰
C. 可以使用湿润的红色石蕊试纸检验NH3是否集满
D. 虚线框内应选用乙装置进行尾气处理
7 (2023南京五中月考)自然界中时刻存在着氮气的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,下图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是( )
A. N2→NH3、NH3→NO均属于氮的固定
B. 在催化剂a作用下,N2发生了氧化反应
C. 催化剂a、b表面均发生了极性共价键的断裂
D. 使用催化剂a、b均可以提高单位时间内生成物的产量
8 (2024徐州期末)下列有关半导体光催化电解还原N2制备NH3的说法错误的是( )
A. 该过程属于氮的固定过程
B. 该反应可说明氧化性:N2>O2
C. 生成0.1 mol NH3时转移0.3 mol电子
D. 水分子一侧发生的电极反应为2H2O-4e-===O2↑+4H+
9 (2023徐州期中)图中的每一方格中表示有关的一种反应物或生成物,其中A、C、D、E为无色气体,F为红棕色气体。下列说法不正确的是( )
A. F与水的反应中,氧化剂与还原剂的物质的量之比为2∶1
B. 用蘸有浓盐酸的玻璃棒靠近瓶口可以检验C气体是否收集满
C. M可能是纯净物或混合物
D. D在一定条件下可与C发生置换反应
10 (2024无锡江阴期末)叠氮化钠(NaN3)不溶于乙醚,易溶于水,常用于汽车安全防护袋的气源。尿素法制备水合肼(N2H4·H2O,强还原性)并利用其进一步反应制取NaN3的流程如图。下列说法不正确的是( )
A. NaN3中存在离子键和共价键
B. 吸收塔中发生反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O
C. 反应器1中加料方式为向含NaClO的吸收液中加入MnSO4并缓慢加入尿素
D. 反应器2中加入无水乙醚的作用是降低NaN3的溶解度,有利于NaN3晶体析出
11(2023盐城射阳中学月考)用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2,部分工艺流程如图。下列说法不正确的是( )
A. 采用气液逆流接触有利于尾气中NO、NO2的充分吸收
B. 加快通入尾气速率可提高NO、NO2的去除率
C. 吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O
D. 若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高
12 (2024南通期末)氮肥厂高浓度氨氮(NH和NH3·H2O)废水可通过下列步骤实现回收、处理。
步骤Ⅰ:向废水中加入石灰乳,调节pH至9,升温至30 ℃,通入空气。
步骤Ⅱ:微生物在弱碱性、有氧条件下,实现硝化过程:NH→NO→NO。
步骤Ⅲ:向硝化后的废水中加入CH3OH,实现反硝化过程:NO→NO→N2。
下列说法正确的是( )
A. 步骤Ⅰ中,加入石灰乳后NH浓度增大
B. 步骤Ⅰ中,“升温至30 ℃,通入空气”可降低氨氮浓度
C. 步骤Ⅱ中,发生反应:NH+3O22NO+4H++2H2O
D. 步骤Ⅲ中,利用了CH3OH的氧化性
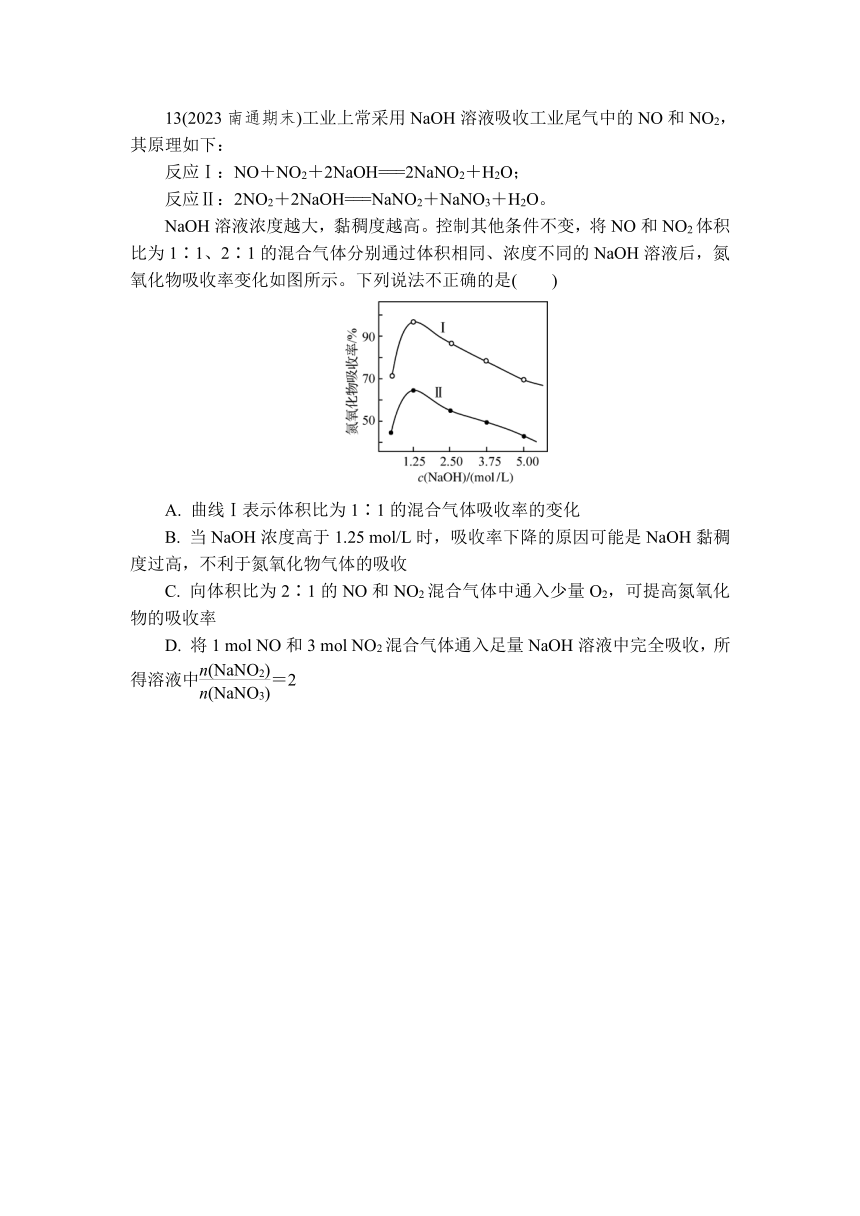
13(2023南通期末)工业上常采用NaOH溶液吸收工业尾气中的NO和NO2,其原理如下:
反应Ⅰ:NO+NO2+2NaOH===2NaNO2+H2O;
反应Ⅱ:2NO2+2NaOH===NaNO2+NaNO3+H2O。
NaOH溶液浓度越大,黏稠度越高。控制其他条件不变,将NO和NO2体积比为1∶1、2∶1的混合气体分别通过体积相同、浓度不同的NaOH溶液后,氮氧化物吸收率变化如图所示。下列说法不正确的是( )
A. 曲线Ⅰ表示体积比为1∶1的混合气体吸收率的变化
B. 当NaOH浓度高于1.25 mol/L时,吸收率下降的原因可能是NaOH黏稠度过高,不利于氮氧化物气体的吸收
C. 向体积比为2∶1的NO和NO2混合气体中通入少量O2,可提高氮氧化物的吸收率
D. 将1 mol NO和3 mol NO2混合气体通入足量NaOH溶液中完全吸收,所得溶液中=2
非选择题(本题包括4小题,共计61分)
14 (15分)某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知:NO+NO2+2NaOH===2NaNO2+H2O)。
(1) 设计装置A的目的是____________________________________________
______________________________________________________________________,
为达此目的应进行的操作是________________________________________;装置A中发生反应的化学方程式是____________________________________。
(2) 在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热,观察到装置B中的现象是____________________________________;装置B中反应的离子方程式是________________________________________。
(3) 装置E、F的作用是__________________________________________,为达到此目的,操作方法是________________________________________。
(4) 装置D的作用是________________________________________________。
15 (14分)(2024连云港期末)水合肼(N2H4·H2O)是重要的化工原料。水合肼的沸点约为118 ℃,与氨水(NH3·H2O)相似,其水溶液显弱碱性,具有强还原性,易被氧化生成N2。某探究小组利用尿素与NaClO反应制取水合肼的原理为CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl。实验装置如图所示。
(1) ①水合肼溶液呈碱性的原因:__________________________________(用化学用语表示)。
②反应过程中需控制温度,同时将a中溶液缓慢滴入三颈烧瓶,仪器a中盛装的溶液是________(填字母)。
A. NaOH和NaClO溶液
B. CO(NH2)2溶液
若滴速过快则会导致产品产率降低,其可能原因是______________________。
(2) 工业上还可以用NH3和NaClO溶液反应制取水合肼,写出该反应的化学方程式:_______________________________________________________________
______________________________________________________________________。
(3) 实验室用如图装置制取氨气,固体b可以选用多种物质,最佳选项为________(填字母)。
A. 熟石灰
B. MnO2
C. NaOH
D. NH4Cl
(4) 测定样品中水合肼含量:称取样品10.00 g,加入适量NaHCO3固体,加水配成500 mL溶液,取25.00 mL该溶液置于锥形瓶中,用0.100 0 mol/L I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。已知:N2H4·H2O+4NaHCO3+2I2===N2↑+4CO2↑+4NaI+5H2O。实验测得消耗I2溶液的平均值为20.00 mL。计算样品中水合肼N2H4·H2O的质量分数。(写出计算过程)
16 (17分)(2024泰州期末)工厂烟气(主要污染物NO)直接排放会造成空气污染,需处理后才能排放。“纳米零价铁 H2O2”体系可将烟气中难溶的NO氧化为可溶的NO。
(1) NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①X催化H2O2分解产生HO·,HO·将NO氧化为NO的机理如图所示,则Y为________,纳米零价铁的作用是_______________________________________。
②写出酸性条件下,NO与HO·反应的离子方程式:_______________________
________________________________________。
③H2O2与Y反应可实现X再生,同时产生HO2·,写出HO2·的电子式:________________,此时H2O2作________剂。
④NO脱除率随温度的变化如图所示。温度高于120 ℃时,NO脱除率随温度升高呈现下降趋势的主要原因是__________________________________________
______________________________________________________________________。
(2) 纳米铁粉也可用于去除废水中的硝态氮(以NO表示),可大致分为2个过程,反应原理如图所示。研究发现,在纳米铁粉总量一定时,水中的溶解氧过少或过多均不利于硝态氮的去除。解释水中溶解氧过多,硝态氮去除率下降的原因:___________________________________________________________________
______________________________________________________________________。
17 (15分)(2024无锡江阴期末)烟气中的主要含氮污染物有NO2、NO,烟气脱硝是指去除氮氧化物的过程,从而大大减少对环境的污染。
(1) 碱液吸收脱硝法
用NaOH溶液吸收烟气,主要反应如下:NO+NO2+2OH-===2NO+H2O;2NO2+2OH-===NO+NO+H2O。
①下列措施一定能提高NaOH溶液吸收烟气中NO和NO2效率的有________(填字母)。
A. 降低通入烟气的速率 B. 气、液逆流吸收烟气 C. 水浴加热NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式,下同);吸收后排放的尾气中含量较高的氮氧化物是____
________________________________________________________________。
(2) 络合脱硝法
六氨合钴溶液中的[Co(NH3)6]2+能络合烟气中的NO和O2,形成的两种络合物在溶液中极易发生反应,实现NO的脱除。在吸收液中加入活性炭可有效催化[Co(NH3)6]2+的再生,维持溶液脱除NO的能力,原理如图所示。写出上述络合脱硝法总反应的离子方程式:_______________________________________________。
(3) 氧化脱硝法
利用ClO2氧化脱硝过程发生的反应如下:5NO+2ClO2+H2O===5NO2+2HCl、2NO2+H2O===HNO2+HNO3。随着ClO2溶液初始浓度的增加,脱硝时从溶液中逸出的NO2却随之增加。研究表明,溶液中的ClO2不能吸收NO2,且在一定程度上阻碍水对NO2的吸收。
①设计实验验证ClO2对水吸收NO2有抑制作用:分别取等体积的蒸馏水和一定浓度ClO2溶液,____________________________________________________
__________________________________________________________________________________________________________________(NO2的浓度由仪器直接测定)。
②其他条件相同,当NO烟气中含有SO2时,用ClO2溶液处理烟气的实验结果如图所示。脱硝处理含SO2的NO烟气时逸出的NO2明显减少,其原因是____________________________________________________________________________________________________________________________________________。
专题7 氮与社会可持续发展 综合评价
1. B N2H4中有N—H极性共价键和N—N非极性共价键,A错误;N2共用三对电子,结构式为N≡N,B正确;叠氮酸(HN3)是一种弱酸,为共价化合物,C错误;NH3易液化,是因为NH3与NH3之间能形成氢键,D错误。
2. C NO属于不成盐氧化物,A错误;HN3是一种弱酸,故与NaOH反应的离子方程式为HN3+OH-===H2O+N,B错误;浓氨水和浓硝酸都有挥发性,用蘸有浓氨水的玻璃棒靠近浓硝酸时,有白烟产生,C正确;NH3催化氧化转化为NO,1 mol NH3转移5 mol电子,每生成0.1 mol NO,转移电子的数目为3.01×1023,D错误。
3. A N2可用作食品保护气,因为其性质稳定,A正确;液氨汽化吸收大量的热,可用作制冷剂,B错误;NH4HCO3中含有植物所需的N元素,可用作氮肥,C错误;浓硝酸与氨气反应制备NH4NO3,利用了HNO3的酸性,D错误。
4. D N2的电子式为N N,D错误。
5. A NH3中N元素化合价为-3,NO2中N元素化合价为+4,NH3、NO2发生归中反应生成N2和H2O,A正确;NO2和H2O反应生成HNO3和NO,B错误;浓硝酸在光照条件下生成NO2、O2、H2O,C错误;二氧化硫和过量氨水反应生成亚硫酸铵,D错误。
6. D NH3易溶于水,要有防倒吸措施,虚线框内应选用甲装置进行尾气处理,D错误。
7. D 氮的固定是指氮由游离态转变为化合态,N2→NH3的反应为氮的固定,但NH3→NO的反应没有氮气参与,不属于氮的固定,A错误;在催化剂a作用下,氮元素化合价降低被还原,氮气发生还原反应,B错误;催化剂a的表面发生了非极性共价键的断裂,没有发生极性共价键的断裂,C错误;使用催化剂a、b可增大反应速率,能提高单位时间内生成物的产量,D正确。
8. B 游离态氮转化为化合态氮,属于氮的固定,A正确;该反应是在特定条件下发生的氧化还原反应,不是自发进行的氧化还原反应,不能说明氧化性N2>O2,B错误;由得失电子守恒可知,生成0.1 mol NH3时转移0.3 mol电子,C正确;H2O―→O2,电极上发生失电子的反应,电极反应式为2H2O-4e-===O2↑+4H+,D正确。
9. A 依据题给信息推出,A为CO2,B为H2O,C为NH3,D为O2,E为NO,F为NO2,G为HNO3,M为(NH4)2CO3或NH4HCO3或二者的混合物,C正确;NO2与水的反应为3NO2+H2O===2HNO3+NO,氧化剂与还原剂的物质的量之比为1∶2,A错误;可用蘸有浓盐酸的玻璃棒靠近瓶口检验NH3是否收集满,B正确;一定条件下,O2可与NH3发生置换反应生成N2和H2O,D正确。
10. C 水合肼是在反应器1中生成的,已知水合肼有强还原性,可被NaClO氧化,故反应生成的水合肼不能置于NaClO氛围中,反应器1加入的NaClO的量不能过多,应该向尿素中加入MnSO4并缓慢加入含NaClO的吸收液,C错误。
11. B 采用气液逆流接触可以使气体与石灰乳充分接触,有利于尾气中NO、NO2的充分吸收,A正确;加快通入尾气速率,尾气与石灰乳接触时间短,不利于提高NO、NO2的去除率,B错误;石灰乳吸收硝酸工业的尾气中的NO、NO2生成Ca(NO2)2,根据得失电子守恒,吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,C正确;NO与Ca(OH)2不反应,若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高,D正确。
12. B 步骤Ⅰ中,加入石灰乳,NH与OH-反应生成NH3·H2O,NH浓度减小,A错误;升温至30 ℃,通入空气,有利于NH3逸出,可降低氨氮浓度,B正确;在弱碱性环境中不能生成H+,C错误;步骤Ⅲ中,NO→NO→N2,N元素被还原,利用了CH3OH的还原性,D错误。
13. D 根据反应Ⅰ和反应Ⅱ可知,体积比为1∶1时吸收率远大于2∶1时,故曲线Ⅰ表示体积比为1∶1的混合气体吸收率的变化,A正确;当NaOH浓度高于1.25 mol/L时,吸收率下降的原因可能是NaOH黏稠度过高,不利于氮氧化物气体的吸收,B正确;向体积比为2∶1的NO和NO2混合气体中通入少量O2,O2可以将NO氧化为NO2,可提高氮氧化物的吸收率,C正确;将1 mol NO和3 mol NO2混合气体通入足量NaOH溶液中完全吸收,所得溶液中=3,D错误。
14. (1) 利用生成的CO2将整套装置内的空气赶尽,以排除对气体产物观察的干扰 打开K,当装置C中澄清石灰水变浑浊时,关闭K CaCO3+2HNO3===Ca(NO3)2+CO2↑+H2O (2) 产生无色气泡,溶液变为蓝色 3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(3) 验证无色气体为NO 将装置F中的空气推入装置E中
(4) 吸收尾气,防止污染空气
15. (1) ①N2H4·H2O N2H+OH-
②A 水合肼具有强还原性,易被氧化生成N2
(2) 2NH3+NaClO===N2H4·H2O+NaCl (3) C
(4) 解:n(I2)=0.100 0 mol/L×20×10-3 L=2×10-3 mol,
N2H4·H2O ~ 2I2
1 2
n(N2H4·H2O) 2×10-3 mol
则25.00 mL溶液中,n(N2H4·H2O)=1×10-3 mol,500 mL溶液中含2×10-2 mol N2H4·H2O,m(N2H4·H2O)=2×10-2 mol×50 g/mol=1.00 g,10.00 g 样品中w(N2H4·H2O)=×100%=10%
16. (1) ①FeCl3或Fe3+
纳米零价铁与HCl溶液反应产生FeCl2
②NO+3HO·===NO+H2O+H+
③ 还原
④H2O2的分解速率随温度的升高而加快,H2O2的浓度减小,NO脱除率降低
(2) 水中溶解氧过多,会将Fe2+氧化成Fe3+,导致Fe2+浓度降低,不利于硝态氮去除
17. (1) ①B ②NaNO3 NO
(2) 2NO+O2+2OH-===NO+NO+H2O
(3) ①在相同时间内以相同的流速向两份溶液中通入NO2,比较逸出NO2的浓度,若通过蒸馏水逸出的NO2浓度较小,则说明ClO2对NO2的吸收有抑制作用
②ClO2溶液中的部分ClO2与SO2发生反应,溶液中剩余的ClO2浓度减小,减弱了ClO2对水吸收NO2的阻碍作用,逸出的NO2明显减少
姓名________ 学号________
单项选择题(本题包括13小题,每题3分,共计39分)
阅读下列材料,回答1~3题。
含氮化合物应用广泛。肼(H2N—NH2)又称联氨,是一种可燃性液体,可用作火箭燃料。叠氮酸(HN3)是一种弱酸,可通过亚硝酸氧化肼获得。硝酸是一种易挥发的液体,硝酸和纤维素可发生酯化反应制备硝酸纤维。工业上利用NH3催化氧化生成NO,反应为4NH3+5O24NO+6H2O,将NO进一步氧化,用水吸收制备HNO3。
1 (2024宿迁期末)下列有关含氮微粒的说法正确的是( )
A. N2H4中只含极性共价键
B. N2结构式为N≡N
C. HN3属于离子化合物
D. NH3易液化,是因为NH3与H2O之间能形成氢键
2 (2024宿迁期末)下列说法正确的是( )
A. N2与O2形成的NO属于酸性氧化物
B. HN3与NaOH反应的离子方程式为H++OH-===H2O
C. 用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生
D. NH3催化氧化时,每生成0.1 mol NO,转移电子的数目为6.02×1023
3 (2024宿迁期末)下列有关物质的性质与用途具有对应关系的是( )
A. N2性质稳定,可用作食品保护气
B. NH3极易溶于水,常用作制冷剂
C. NH4HCO3受热易分解,可用作氮肥
D. 浓硝酸有强氧化性,可用于制备NH4NO3
4 (2024常州联盟月考)用氨水检验Cl2管道泄漏的原理为8NH3+3Cl2===6NH4Cl+N2。下列说法不正确的是( )
A. N元素位于元素周期表中第2周期ⅤA族
B. NH3的结构式为
C. NH4Cl为离子化合物
D. N2的电子式为
5 (2023连云港期中)用NaOH溶液吸收处理氮氧化物,主要反应为NO+NO2+2OH-===2NO+H2O、2NO2+2OH-===NO+NO+H2O,在指定条件下,下列微粒间的转化能够实现的是( )
A. NH3N2 B. NO2NO
C. HNO3NO D. SO2SO
6 (2024苏州期末)实验室制取NH3并进行尾气处理的装置如图所示。下列有关说法不正确的是( )
甲 乙
A. 试管中发生反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
B. 干燥管中盛装的固体可以是碱石灰
C. 可以使用湿润的红色石蕊试纸检验NH3是否集满
D. 虚线框内应选用乙装置进行尾气处理
7 (2023南京五中月考)自然界中时刻存在着氮气的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,下图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是( )
A. N2→NH3、NH3→NO均属于氮的固定
B. 在催化剂a作用下,N2发生了氧化反应
C. 催化剂a、b表面均发生了极性共价键的断裂
D. 使用催化剂a、b均可以提高单位时间内生成物的产量
8 (2024徐州期末)下列有关半导体光催化电解还原N2制备NH3的说法错误的是( )
A. 该过程属于氮的固定过程
B. 该反应可说明氧化性:N2>O2
C. 生成0.1 mol NH3时转移0.3 mol电子
D. 水分子一侧发生的电极反应为2H2O-4e-===O2↑+4H+
9 (2023徐州期中)图中的每一方格中表示有关的一种反应物或生成物,其中A、C、D、E为无色气体,F为红棕色气体。下列说法不正确的是( )
A. F与水的反应中,氧化剂与还原剂的物质的量之比为2∶1
B. 用蘸有浓盐酸的玻璃棒靠近瓶口可以检验C气体是否收集满
C. M可能是纯净物或混合物
D. D在一定条件下可与C发生置换反应
10 (2024无锡江阴期末)叠氮化钠(NaN3)不溶于乙醚,易溶于水,常用于汽车安全防护袋的气源。尿素法制备水合肼(N2H4·H2O,强还原性)并利用其进一步反应制取NaN3的流程如图。下列说法不正确的是( )
A. NaN3中存在离子键和共价键
B. 吸收塔中发生反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O
C. 反应器1中加料方式为向含NaClO的吸收液中加入MnSO4并缓慢加入尿素
D. 反应器2中加入无水乙醚的作用是降低NaN3的溶解度,有利于NaN3晶体析出
11(2023盐城射阳中学月考)用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2,部分工艺流程如图。下列说法不正确的是( )
A. 采用气液逆流接触有利于尾气中NO、NO2的充分吸收
B. 加快通入尾气速率可提高NO、NO2的去除率
C. 吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O
D. 若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高
12 (2024南通期末)氮肥厂高浓度氨氮(NH和NH3·H2O)废水可通过下列步骤实现回收、处理。
步骤Ⅰ:向废水中加入石灰乳,调节pH至9,升温至30 ℃,通入空气。
步骤Ⅱ:微生物在弱碱性、有氧条件下,实现硝化过程:NH→NO→NO。
步骤Ⅲ:向硝化后的废水中加入CH3OH,实现反硝化过程:NO→NO→N2。
下列说法正确的是( )
A. 步骤Ⅰ中,加入石灰乳后NH浓度增大
B. 步骤Ⅰ中,“升温至30 ℃,通入空气”可降低氨氮浓度
C. 步骤Ⅱ中,发生反应:NH+3O22NO+4H++2H2O
D. 步骤Ⅲ中,利用了CH3OH的氧化性
13(2023南通期末)工业上常采用NaOH溶液吸收工业尾气中的NO和NO2,其原理如下:
反应Ⅰ:NO+NO2+2NaOH===2NaNO2+H2O;
反应Ⅱ:2NO2+2NaOH===NaNO2+NaNO3+H2O。
NaOH溶液浓度越大,黏稠度越高。控制其他条件不变,将NO和NO2体积比为1∶1、2∶1的混合气体分别通过体积相同、浓度不同的NaOH溶液后,氮氧化物吸收率变化如图所示。下列说法不正确的是( )
A. 曲线Ⅰ表示体积比为1∶1的混合气体吸收率的变化
B. 当NaOH浓度高于1.25 mol/L时,吸收率下降的原因可能是NaOH黏稠度过高,不利于氮氧化物气体的吸收
C. 向体积比为2∶1的NO和NO2混合气体中通入少量O2,可提高氮氧化物的吸收率
D. 将1 mol NO和3 mol NO2混合气体通入足量NaOH溶液中完全吸收,所得溶液中=2
非选择题(本题包括4小题,共计61分)
14 (15分)某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知:NO+NO2+2NaOH===2NaNO2+H2O)。
(1) 设计装置A的目的是____________________________________________
______________________________________________________________________,
为达此目的应进行的操作是________________________________________;装置A中发生反应的化学方程式是____________________________________。
(2) 在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热,观察到装置B中的现象是____________________________________;装置B中反应的离子方程式是________________________________________。
(3) 装置E、F的作用是__________________________________________,为达到此目的,操作方法是________________________________________。
(4) 装置D的作用是________________________________________________。
15 (14分)(2024连云港期末)水合肼(N2H4·H2O)是重要的化工原料。水合肼的沸点约为118 ℃,与氨水(NH3·H2O)相似,其水溶液显弱碱性,具有强还原性,易被氧化生成N2。某探究小组利用尿素与NaClO反应制取水合肼的原理为CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl。实验装置如图所示。
(1) ①水合肼溶液呈碱性的原因:__________________________________(用化学用语表示)。
②反应过程中需控制温度,同时将a中溶液缓慢滴入三颈烧瓶,仪器a中盛装的溶液是________(填字母)。
A. NaOH和NaClO溶液
B. CO(NH2)2溶液
若滴速过快则会导致产品产率降低,其可能原因是______________________。
(2) 工业上还可以用NH3和NaClO溶液反应制取水合肼,写出该反应的化学方程式:_______________________________________________________________
______________________________________________________________________。
(3) 实验室用如图装置制取氨气,固体b可以选用多种物质,最佳选项为________(填字母)。
A. 熟石灰
B. MnO2
C. NaOH
D. NH4Cl
(4) 测定样品中水合肼含量:称取样品10.00 g,加入适量NaHCO3固体,加水配成500 mL溶液,取25.00 mL该溶液置于锥形瓶中,用0.100 0 mol/L I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。已知:N2H4·H2O+4NaHCO3+2I2===N2↑+4CO2↑+4NaI+5H2O。实验测得消耗I2溶液的平均值为20.00 mL。计算样品中水合肼N2H4·H2O的质量分数。(写出计算过程)
16 (17分)(2024泰州期末)工厂烟气(主要污染物NO)直接排放会造成空气污染,需处理后才能排放。“纳米零价铁 H2O2”体系可将烟气中难溶的NO氧化为可溶的NO。
(1) NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①X催化H2O2分解产生HO·,HO·将NO氧化为NO的机理如图所示,则Y为________,纳米零价铁的作用是_______________________________________。
②写出酸性条件下,NO与HO·反应的离子方程式:_______________________
________________________________________。
③H2O2与Y反应可实现X再生,同时产生HO2·,写出HO2·的电子式:________________,此时H2O2作________剂。
④NO脱除率随温度的变化如图所示。温度高于120 ℃时,NO脱除率随温度升高呈现下降趋势的主要原因是__________________________________________
______________________________________________________________________。
(2) 纳米铁粉也可用于去除废水中的硝态氮(以NO表示),可大致分为2个过程,反应原理如图所示。研究发现,在纳米铁粉总量一定时,水中的溶解氧过少或过多均不利于硝态氮的去除。解释水中溶解氧过多,硝态氮去除率下降的原因:___________________________________________________________________
______________________________________________________________________。
17 (15分)(2024无锡江阴期末)烟气中的主要含氮污染物有NO2、NO,烟气脱硝是指去除氮氧化物的过程,从而大大减少对环境的污染。
(1) 碱液吸收脱硝法
用NaOH溶液吸收烟气,主要反应如下:NO+NO2+2OH-===2NO+H2O;2NO2+2OH-===NO+NO+H2O。
①下列措施一定能提高NaOH溶液吸收烟气中NO和NO2效率的有________(填字母)。
A. 降低通入烟气的速率 B. 气、液逆流吸收烟气 C. 水浴加热NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式,下同);吸收后排放的尾气中含量较高的氮氧化物是____
________________________________________________________________。
(2) 络合脱硝法
六氨合钴溶液中的[Co(NH3)6]2+能络合烟气中的NO和O2,形成的两种络合物在溶液中极易发生反应,实现NO的脱除。在吸收液中加入活性炭可有效催化[Co(NH3)6]2+的再生,维持溶液脱除NO的能力,原理如图所示。写出上述络合脱硝法总反应的离子方程式:_______________________________________________。
(3) 氧化脱硝法
利用ClO2氧化脱硝过程发生的反应如下:5NO+2ClO2+H2O===5NO2+2HCl、2NO2+H2O===HNO2+HNO3。随着ClO2溶液初始浓度的增加,脱硝时从溶液中逸出的NO2却随之增加。研究表明,溶液中的ClO2不能吸收NO2,且在一定程度上阻碍水对NO2的吸收。
①设计实验验证ClO2对水吸收NO2有抑制作用:分别取等体积的蒸馏水和一定浓度ClO2溶液,____________________________________________________
__________________________________________________________________________________________________________________(NO2的浓度由仪器直接测定)。
②其他条件相同,当NO烟气中含有SO2时,用ClO2溶液处理烟气的实验结果如图所示。脱硝处理含SO2的NO烟气时逸出的NO2明显减少,其原因是____________________________________________________________________________________________________________________________________________。
专题7 氮与社会可持续发展 综合评价
1. B N2H4中有N—H极性共价键和N—N非极性共价键,A错误;N2共用三对电子,结构式为N≡N,B正确;叠氮酸(HN3)是一种弱酸,为共价化合物,C错误;NH3易液化,是因为NH3与NH3之间能形成氢键,D错误。
2. C NO属于不成盐氧化物,A错误;HN3是一种弱酸,故与NaOH反应的离子方程式为HN3+OH-===H2O+N,B错误;浓氨水和浓硝酸都有挥发性,用蘸有浓氨水的玻璃棒靠近浓硝酸时,有白烟产生,C正确;NH3催化氧化转化为NO,1 mol NH3转移5 mol电子,每生成0.1 mol NO,转移电子的数目为3.01×1023,D错误。
3. A N2可用作食品保护气,因为其性质稳定,A正确;液氨汽化吸收大量的热,可用作制冷剂,B错误;NH4HCO3中含有植物所需的N元素,可用作氮肥,C错误;浓硝酸与氨气反应制备NH4NO3,利用了HNO3的酸性,D错误。
4. D N2的电子式为N N,D错误。
5. A NH3中N元素化合价为-3,NO2中N元素化合价为+4,NH3、NO2发生归中反应生成N2和H2O,A正确;NO2和H2O反应生成HNO3和NO,B错误;浓硝酸在光照条件下生成NO2、O2、H2O,C错误;二氧化硫和过量氨水反应生成亚硫酸铵,D错误。
6. D NH3易溶于水,要有防倒吸措施,虚线框内应选用甲装置进行尾气处理,D错误。
7. D 氮的固定是指氮由游离态转变为化合态,N2→NH3的反应为氮的固定,但NH3→NO的反应没有氮气参与,不属于氮的固定,A错误;在催化剂a作用下,氮元素化合价降低被还原,氮气发生还原反应,B错误;催化剂a的表面发生了非极性共价键的断裂,没有发生极性共价键的断裂,C错误;使用催化剂a、b可增大反应速率,能提高单位时间内生成物的产量,D正确。
8. B 游离态氮转化为化合态氮,属于氮的固定,A正确;该反应是在特定条件下发生的氧化还原反应,不是自发进行的氧化还原反应,不能说明氧化性N2>O2,B错误;由得失电子守恒可知,生成0.1 mol NH3时转移0.3 mol电子,C正确;H2O―→O2,电极上发生失电子的反应,电极反应式为2H2O-4e-===O2↑+4H+,D正确。
9. A 依据题给信息推出,A为CO2,B为H2O,C为NH3,D为O2,E为NO,F为NO2,G为HNO3,M为(NH4)2CO3或NH4HCO3或二者的混合物,C正确;NO2与水的反应为3NO2+H2O===2HNO3+NO,氧化剂与还原剂的物质的量之比为1∶2,A错误;可用蘸有浓盐酸的玻璃棒靠近瓶口检验NH3是否收集满,B正确;一定条件下,O2可与NH3发生置换反应生成N2和H2O,D正确。
10. C 水合肼是在反应器1中生成的,已知水合肼有强还原性,可被NaClO氧化,故反应生成的水合肼不能置于NaClO氛围中,反应器1加入的NaClO的量不能过多,应该向尿素中加入MnSO4并缓慢加入含NaClO的吸收液,C错误。
11. B 采用气液逆流接触可以使气体与石灰乳充分接触,有利于尾气中NO、NO2的充分吸收,A正确;加快通入尾气速率,尾气与石灰乳接触时间短,不利于提高NO、NO2的去除率,B错误;石灰乳吸收硝酸工业的尾气中的NO、NO2生成Ca(NO2)2,根据得失电子守恒,吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O,C正确;NO与Ca(OH)2不反应,若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高,D正确。
12. B 步骤Ⅰ中,加入石灰乳,NH与OH-反应生成NH3·H2O,NH浓度减小,A错误;升温至30 ℃,通入空气,有利于NH3逸出,可降低氨氮浓度,B正确;在弱碱性环境中不能生成H+,C错误;步骤Ⅲ中,NO→NO→N2,N元素被还原,利用了CH3OH的还原性,D错误。
13. D 根据反应Ⅰ和反应Ⅱ可知,体积比为1∶1时吸收率远大于2∶1时,故曲线Ⅰ表示体积比为1∶1的混合气体吸收率的变化,A正确;当NaOH浓度高于1.25 mol/L时,吸收率下降的原因可能是NaOH黏稠度过高,不利于氮氧化物气体的吸收,B正确;向体积比为2∶1的NO和NO2混合气体中通入少量O2,O2可以将NO氧化为NO2,可提高氮氧化物的吸收率,C正确;将1 mol NO和3 mol NO2混合气体通入足量NaOH溶液中完全吸收,所得溶液中=3,D错误。
14. (1) 利用生成的CO2将整套装置内的空气赶尽,以排除对气体产物观察的干扰 打开K,当装置C中澄清石灰水变浑浊时,关闭K CaCO3+2HNO3===Ca(NO3)2+CO2↑+H2O (2) 产生无色气泡,溶液变为蓝色 3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(3) 验证无色气体为NO 将装置F中的空气推入装置E中
(4) 吸收尾气,防止污染空气
15. (1) ①N2H4·H2O N2H+OH-
②A 水合肼具有强还原性,易被氧化生成N2
(2) 2NH3+NaClO===N2H4·H2O+NaCl (3) C
(4) 解:n(I2)=0.100 0 mol/L×20×10-3 L=2×10-3 mol,
N2H4·H2O ~ 2I2
1 2
n(N2H4·H2O) 2×10-3 mol
则25.00 mL溶液中,n(N2H4·H2O)=1×10-3 mol,500 mL溶液中含2×10-2 mol N2H4·H2O,m(N2H4·H2O)=2×10-2 mol×50 g/mol=1.00 g,10.00 g 样品中w(N2H4·H2O)=×100%=10%
16. (1) ①FeCl3或Fe3+
纳米零价铁与HCl溶液反应产生FeCl2
②NO+3HO·===NO+H2O+H+
③ 还原
④H2O2的分解速率随温度的升高而加快,H2O2的浓度减小,NO脱除率降低
(2) 水中溶解氧过多,会将Fe2+氧化成Fe3+,导致Fe2+浓度降低,不利于硝态氮去除
17. (1) ①B ②NaNO3 NO
(2) 2NO+O2+2OH-===NO+NO+H2O
(3) ①在相同时间内以相同的流速向两份溶液中通入NO2,比较逸出NO2的浓度,若通过蒸馏水逸出的NO2浓度较小,则说明ClO2对NO2的吸收有抑制作用
②ClO2溶液中的部分ClO2与SO2发生反应,溶液中剩余的ClO2浓度减小,减弱了ClO2对水吸收NO2的阻碍作用,逸出的NO2明显减少
