第54练 化学平衡与图像分析 课时作业(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第54练 化学平衡与图像分析 课时作业(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 437.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 16:39:21 | ||
图片预览




文档简介
第54练 化学平衡与图像分析
1. 在催化剂作用下,以C2H6、CO2为原料合成C2H4,其主要反应有:
反应1:C2H6(g)+CO2(g)===C2H4(g)+H2O(g)+CO(g) ΔH=+177 kJ·mol-1
反应2:C2H6(g)===CH4(g)+H2(g)+C(s) ΔH=+9 kJ·mol-1
将体积比为1∶1的C2H6、CO2混合气体按一定流速通过催化反应管,测得C2H6、CO2的转化率随温度变化的关系如图所示。
已知C2H4的选择性=×100%
下列说法正确的是( )
A. 图中曲线①表示CO2转化率随温度的变化
B. 720~800 ℃范围内,随温度的升高,出口处C2H4及CH4的量均增大
C. 720~800 ℃范围内,随温度的升高,C2H4的选择性不断增大
D. 其他条件不变,加入CaO(s)或选用高效催化剂,均能提高平衡时C2H4产率
(第1题图)
(第2题图)
2. 在体积均为1.0 L的甲、乙两恒容密闭容器中加入足量相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,发生反应CO2(g)+C(s)2CO(g)达到平衡。CO2的平衡转化率随温度的变化如图所示。下列说法正确的是( )
A. 反应CO2(g)+C(s)===2CO(g)的ΔH<0
B. 曲线Ⅱ表示容器甲中CO2的平衡转化率
C. 达平衡后,两容器中c(CO):c(CO)Q>c(CO)R
D. 其他条件不变时,在曲线Ⅰ对应容器中加入合适的催化剂,可使CO2的平衡转化率由P点达到S点I
3. (2024·南通一模)CO2—CH4催化重整可获得合成气(CO、H2)。重整过程中主要反应的热化学方程式为
反应①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247 kJ·mol-1
反应②CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1
反应③CH4(g)===C(s)+2H2(g) ΔH=+75 kJ·mol-1
反应④2CO(g)===CO2(g)+C(s) ΔH=-172 kJ·mol-1
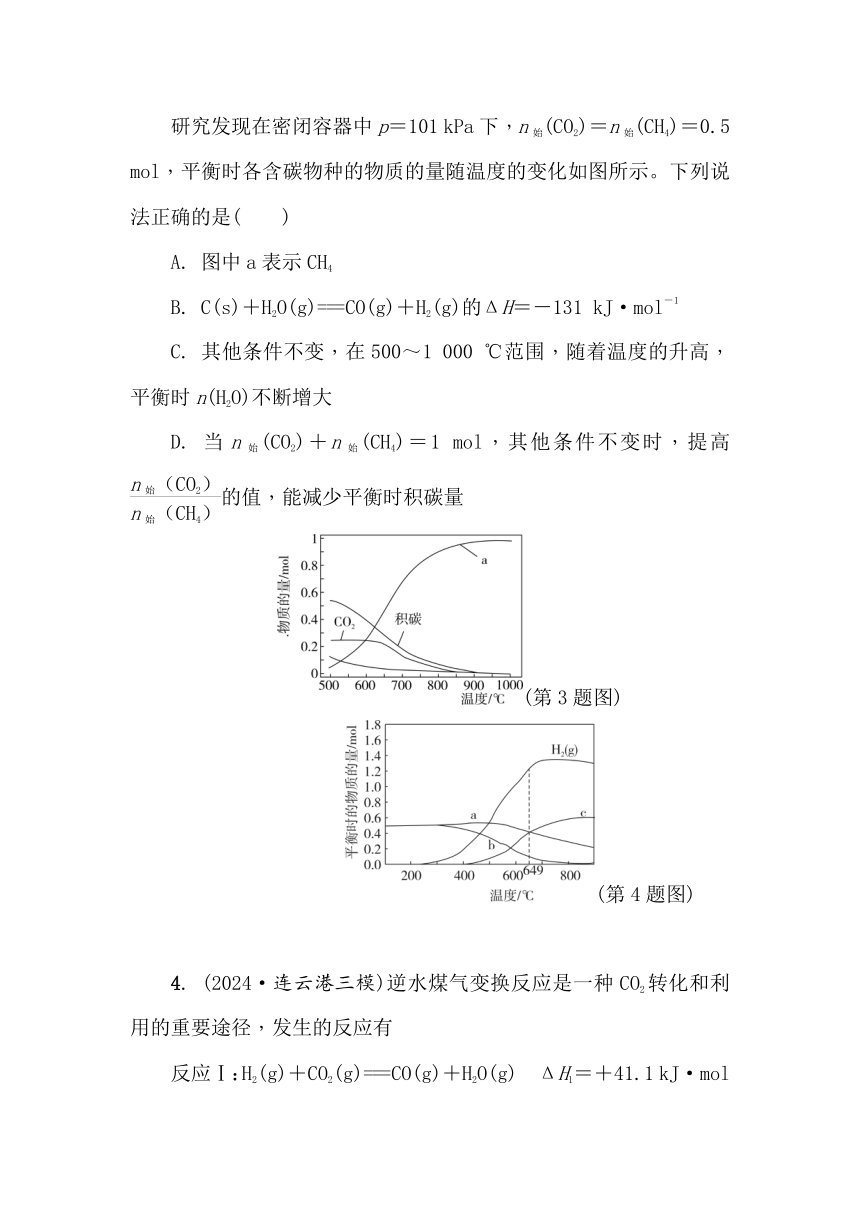
研究发现在密闭容器中p=101 kPa下,n始(CO2)=n始(CH4)=0.5 mol,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 图中a表示CH4
B. C(s)+H2O(g)===CO(g)+H2(g)的ΔH=-131 kJ·mol-1
C. 其他条件不变,在500~1 000 ℃范围,随着温度的升高,平衡时n(H2O)不断增大
D. 当n始(CO2)+n始(CH4)=1 mol,其他条件不变时,提高的值,能减少平衡时积碳量
(第3题图)
(第4题图)
4. (2024·连云港三模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ:H2(g)+CO2(g)===CO(g)+H2O(g) ΔH1=+41.1 kJ·mol-1
反应Ⅱ:4H2(g)+CO2(g)===CH4(g)+2H2O(g) ΔH2=-165.0 kJ·mol-1
反应Ⅲ:3H2(g)+CO(g)===CH4(g)+H2O(g) ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达平衡时H2和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是( )
A. ΔH3=+206.1 kJ·mol-1
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250 ℃~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
5. 在CO2与反应制甲醇的反应体系中,主要反应的热化学方程式为
反应Ⅰ:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)===CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+H2(g)===CO(g)+H2O(g)ΔH3=40.9 kJ·mol-1
向恒压密闭容器中通入1 mol CO2和3 mol H2,CO2的平衡转化率、CH3OH的平衡产率随温度的变化如图所示。下列说法正确的是( )
A. 反应Ⅰ的平衡常数K=
B. ΔH2=+90.4 kJ·mol-1
C. 曲线a代表的是CO2的平衡转化率
D. 其他条件相同时,改变用量可使CO2的平衡转化率与CH3OH的平衡产率相等
6. (2025·靖江高三上期末)恒压条件下,密闭容器中将CO2、H2按照体积之比为1∶3合成CH3OH,其中涉及的主要反应如下:
Ⅰ. CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1=-49 kJ·mol-1
Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
在不同催化剂作用下发生反应Ⅰ、Ⅱ,在相同的时间段内CH3OH选择性和产率随温度的变化如图。
已知:CH3OH的选择性=×100%。下列说法正确的是( )
A. 反应CO(g)+2H2(g)CH3OH(g) ΔH=+90 kJ·mol-1
B. 合成甲醇的适宜工业条件是290 ℃,催化剂选择CZ(Zr 1)T
C. 230 ℃以上,升高温度CO2转化率增大,但甲醇的产率降低,原因是230 ℃以上,升温对反应Ⅱ的影响更大
D. 恒压恒温下充入氦气,不影响CO2转化率
7. (2024·南航附中高三上期中)一种捕获并利用CO2的方法是将CO2催化加氢合成CH3OCH3,其过程中主要发生如下反应:
Ⅰ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH1=+41.2 kJ·mol-1 K1;
Ⅱ. 2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH2=-122.5 kJ·mol-1 K2。
向恒压密闭容器中充入1 mol CO2和3 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性[CH3OCH3的选择性=×100%]随温度的变化如图所示。下列说法正确的是( )
A. 由图可知,300 ℃时,K1B. 为提高CH3OCH3产率,可采用降低温度和增大体系压强的方法
C. 反应状态达A点时,容器中n(CH3OCH3)为 mol
D. 2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g) ΔH=-81.3 kJ·mol-1
第54练 化学平衡与图像分析
1. B 解析:将体积比为1∶1的C2H6、CO2混合气体按一定流速通过催化反应管,其主要反应有:C2H6(g)+CO2(g)===C2H4(g)+H2O(g)+CO(g)、C2H6(g)===CH4(g)+H2(g)+C(s),则C2H6的转化率应该大于CO2的转化率,图中曲线①表示C2H6转化率随温度的变化,曲线②表示CO2的转化率,以此解答。由分析可知,图中曲线①表示C2H6转化率随温度的变化,故A错误;720~800 ℃范围内,随温度的升高,C2H6、CO2的转化率都增大,则生成C2H6、CO2的物质的量增大,出口处C2H4及CH4的量均增大,故B正确;720~800 ℃范围内,随温度的升高,C2H6、CO2的转化率都增大,但C2H6的转化率程度大于CO2,说明反应2正向进行的程度增大大于反应1,C2H4的选择性不断减小,故C错误;催化剂虽然不能改变平衡转化率,但是催化剂有选择性,可以提升目标产物的产率;CaO会吸收水和二氧化碳,但是无法判断平衡如何移动,因此不能判断平衡时C2H4的产率如何变化,故D错误。故选B。
2. C 解析:由图可知,升高温度二氧化碳的平衡转化率升高,平衡正向移动,正反应为吸热反应,焓变大于零,A错误;反应为气体分子数增加的反应,相同温度下,增加二氧化碳的量,会导致二氧化碳的转化率降低,故曲线Ⅱ表示容器乙中CO2的平衡转化率,B错误;R相当于2份Q达平衡后,然后合并到1个容器中,压强增加平衡逆向移动,导致一氧化碳的浓度小于2倍的Q中一氧化碳浓度,故两容器中c(CO):c(CO)Q>c(CO)R,C正确;催化剂改变反应速率,不改变物质的平衡转化率,D错误。故选C。
3. D 解析:根据图可知,温度升高,a的物质的量增大,根据反应①和③可知,温度升高,平衡正向移动,CH4减小,所以a一定不是CH4,A错误;通过反应②+④得到CO(g)+H2(g)===C(s)+H2O(g),所以C(s)+H2O(g)===CO(g)+H2(g)的ΔH=+131 kJ·mol-1,B错误;根据C(s)+H2O(g)===CO(g)+H2(g)反应为吸热反应,其他条件不变,在500~1 000 ℃范围,随着温度的升高,平衡正向移动,n(H2O)不断减小,C错误;当n始(CO2)+n始(CH4)=1 mol,其他条件不变时,提高的值,二氧化碳物质的量增大,甲烷物质的量减小,平衡③④逆向移动,消耗C,能减少平衡时积碳量,D正确。故选D。
4. D 解析:根据盖斯定律,反应Ⅲ=反应Ⅱ-反应Ⅰ,则ΔH3=ΔH2-ΔH1=-206.1 kJ·mol-1,A错误;温度升高,反应Ⅰ正向移动,反应Ⅱ和Ⅲ逆向移动,可知c线为CO,a为CO2,b为CH4,649 ℃时,反应平衡时n(H2)=1.2 mol,转换为氢气为0.8 mol,生成的H2O小于0.8 mol,n(CO)=n(CO2),平衡常数:K<=<1,B错误;由图像可知,250 ℃~649 ℃范围内,随着温度的升高,平衡时n(H2)增大,平衡逆向移动,则平衡时n(H2O)不断减小;649 ℃~900 ℃范围内,随着温度的升高,平衡时n(H2)减小,平衡正向移动,则平衡时n(H2O)不断增大,C错误;高温时反应Ⅰ进行程度很大,反应Ⅱ、Ⅲ程度很小,CH4含量很少,平衡不受压强影响,适当增大体系压强,n(CO)保持不变,D正确。故选D。
5. C 解析:由反应方程式可知,反应Ⅰ的平衡常数K=,故A错误;根据盖斯定律可知,反应Ⅰ-反应Ⅲ可得反应Ⅱ,则ΔH2=ΔH1-ΔH3=-49.5 kJ·mol-1-40.9kJ·mol-1=-90.4 kJ·mol-1,故B错误;反应Ⅰ为放热反应,温度升高平衡逆向移动,CO2的平衡转化率减小,反应Ⅲ为吸热反应,温度升高平衡正向移动,CO2的平衡转化率增大,所以升高温度CO2的平衡转化率先减小后增大,即曲线a代表的是CO2的平衡转化率,故C正确;CO2的平衡转化率=×100%,CH3OH的平衡产率=×100%,由反应式可知,起始时含碳组分为CO2,平衡时含碳组分为CH3OH、CO和CO2,根据碳元素守恒,n(CO2)起始-n(CO2)平衡≠n(CH3OH)平衡,所以在其他条件相同时,改变用量不可能使CO2的平衡转化率与CH3OH的平衡产率相等,故D错误。故选C。
6. C 解析:由盖斯定律知,Ⅰ-Ⅱ得CO(g)+2H2(g)??CH3OH(g) ΔH=ΔH1-ΔH2=(-49 kJ·mol-1)-41 kJ·mol-1=-90 kJ·mol-1,A错误;相同条件下,使用催化剂CZ(Zr 1)T时,CH3OH选择性更高,此催化剂在230 ℃时,CH3OH选择性最高且CH3OH产率较高,故合成甲醇的最适宜条件为约230 ℃、催化剂选择CZ(Zr 1)T,B错误;230 ℃以上,升高温度,反应Ⅰ为放热反应,平衡逆向移动,甲醇的产率降低,反应Ⅱ为吸热反应,平衡正向移动,CO2转化率增大,升温对反应Ⅱ的影响更大,C正确;恒压恒温下,充入氦气,相当于减压,平衡逆向移动,CO2转化率减小,D错误。
7. B 解析:由图可知,300 ℃时,CH3OCH3的选择性接近20%,则有接近40%的二氧化碳发生反应Ⅱ,则反应Ⅰ程度较大,即K1>K2,A错误;由题干方程式可知,反应Ⅱ正反应是一个气体体积减小的放热反应方向,而反应Ⅰ是一个气体体积不变的吸热反应方向,降低温度能使反应Ⅱ正向移动,而反应Ⅱ的平衡逆向移动,增大体系压强能使反应Ⅱ正向移动,而反应Ⅱ的平衡不移动,故均能提高CH3OCH3产率,B正确;由图可知,CO2的平衡转化率和平衡时CH3OCH3的选择性均为25%,反应消耗二氧化碳的物质的量为1 mol×25%=0.25 mol,容器中CH3OCH3的物质的量:= mol,C错误;根据盖斯定律,Ⅱ-Ⅰ×2得:4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g) ΔH=-204.9 kJ·mol-1,D错误。故选B。
1. 在催化剂作用下,以C2H6、CO2为原料合成C2H4,其主要反应有:
反应1:C2H6(g)+CO2(g)===C2H4(g)+H2O(g)+CO(g) ΔH=+177 kJ·mol-1
反应2:C2H6(g)===CH4(g)+H2(g)+C(s) ΔH=+9 kJ·mol-1
将体积比为1∶1的C2H6、CO2混合气体按一定流速通过催化反应管,测得C2H6、CO2的转化率随温度变化的关系如图所示。
已知C2H4的选择性=×100%
下列说法正确的是( )
A. 图中曲线①表示CO2转化率随温度的变化
B. 720~800 ℃范围内,随温度的升高,出口处C2H4及CH4的量均增大
C. 720~800 ℃范围内,随温度的升高,C2H4的选择性不断增大
D. 其他条件不变,加入CaO(s)或选用高效催化剂,均能提高平衡时C2H4产率
(第1题图)
(第2题图)
2. 在体积均为1.0 L的甲、乙两恒容密闭容器中加入足量相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,发生反应CO2(g)+C(s)2CO(g)达到平衡。CO2的平衡转化率随温度的变化如图所示。下列说法正确的是( )
A. 反应CO2(g)+C(s)===2CO(g)的ΔH<0
B. 曲线Ⅱ表示容器甲中CO2的平衡转化率
C. 达平衡后,两容器中c(CO):c(CO)Q>c(CO)R
D. 其他条件不变时,在曲线Ⅰ对应容器中加入合适的催化剂,可使CO2的平衡转化率由P点达到S点I
3. (2024·南通一模)CO2—CH4催化重整可获得合成气(CO、H2)。重整过程中主要反应的热化学方程式为
反应①CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247 kJ·mol-1
反应②CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1
反应③CH4(g)===C(s)+2H2(g) ΔH=+75 kJ·mol-1
反应④2CO(g)===CO2(g)+C(s) ΔH=-172 kJ·mol-1
研究发现在密闭容器中p=101 kPa下,n始(CO2)=n始(CH4)=0.5 mol,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 图中a表示CH4
B. C(s)+H2O(g)===CO(g)+H2(g)的ΔH=-131 kJ·mol-1
C. 其他条件不变,在500~1 000 ℃范围,随着温度的升高,平衡时n(H2O)不断增大
D. 当n始(CO2)+n始(CH4)=1 mol,其他条件不变时,提高的值,能减少平衡时积碳量
(第3题图)
(第4题图)
4. (2024·连云港三模)逆水煤气变换反应是一种CO2转化和利用的重要途径,发生的反应有
反应Ⅰ:H2(g)+CO2(g)===CO(g)+H2O(g) ΔH1=+41.1 kJ·mol-1
反应Ⅱ:4H2(g)+CO2(g)===CH4(g)+2H2O(g) ΔH2=-165.0 kJ·mol-1
反应Ⅲ:3H2(g)+CO(g)===CH4(g)+H2O(g) ΔH3
常压下,向密闭容器中投入1 mol CO2和2 mol H2,达平衡时H2和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是( )
A. ΔH3=+206.1 kJ·mol-1
B. 649 ℃时,反应Ⅰ的平衡常数K>1
C. 其他条件不变,在250 ℃~900 ℃范围内,随着温度的升高,平衡时n(H2O)不断增大
D. 800 ℃时,适当增大体系压强,n(CO)保持不变
5. 在CO2与反应制甲醇的反应体系中,主要反应的热化学方程式为
反应Ⅰ:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)===CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+H2(g)===CO(g)+H2O(g)ΔH3=40.9 kJ·mol-1
向恒压密闭容器中通入1 mol CO2和3 mol H2,CO2的平衡转化率、CH3OH的平衡产率随温度的变化如图所示。下列说法正确的是( )
A. 反应Ⅰ的平衡常数K=
B. ΔH2=+90.4 kJ·mol-1
C. 曲线a代表的是CO2的平衡转化率
D. 其他条件相同时,改变用量可使CO2的平衡转化率与CH3OH的平衡产率相等
6. (2025·靖江高三上期末)恒压条件下,密闭容器中将CO2、H2按照体积之比为1∶3合成CH3OH,其中涉及的主要反应如下:
Ⅰ. CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1=-49 kJ·mol-1
Ⅱ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
在不同催化剂作用下发生反应Ⅰ、Ⅱ,在相同的时间段内CH3OH选择性和产率随温度的变化如图。
已知:CH3OH的选择性=×100%。下列说法正确的是( )
A. 反应CO(g)+2H2(g)CH3OH(g) ΔH=+90 kJ·mol-1
B. 合成甲醇的适宜工业条件是290 ℃,催化剂选择CZ(Zr 1)T
C. 230 ℃以上,升高温度CO2转化率增大,但甲醇的产率降低,原因是230 ℃以上,升温对反应Ⅱ的影响更大
D. 恒压恒温下充入氦气,不影响CO2转化率
7. (2024·南航附中高三上期中)一种捕获并利用CO2的方法是将CO2催化加氢合成CH3OCH3,其过程中主要发生如下反应:
Ⅰ. CO2(g)+H2(g)===CO(g)+H2O(g) ΔH1=+41.2 kJ·mol-1 K1;
Ⅱ. 2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH2=-122.5 kJ·mol-1 K2。
向恒压密闭容器中充入1 mol CO2和3 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性[CH3OCH3的选择性=×100%]随温度的变化如图所示。下列说法正确的是( )
A. 由图可知,300 ℃时,K1
C. 反应状态达A点时,容器中n(CH3OCH3)为 mol
D. 2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g) ΔH=-81.3 kJ·mol-1
第54练 化学平衡与图像分析
1. B 解析:将体积比为1∶1的C2H6、CO2混合气体按一定流速通过催化反应管,其主要反应有:C2H6(g)+CO2(g)===C2H4(g)+H2O(g)+CO(g)、C2H6(g)===CH4(g)+H2(g)+C(s),则C2H6的转化率应该大于CO2的转化率,图中曲线①表示C2H6转化率随温度的变化,曲线②表示CO2的转化率,以此解答。由分析可知,图中曲线①表示C2H6转化率随温度的变化,故A错误;720~800 ℃范围内,随温度的升高,C2H6、CO2的转化率都增大,则生成C2H6、CO2的物质的量增大,出口处C2H4及CH4的量均增大,故B正确;720~800 ℃范围内,随温度的升高,C2H6、CO2的转化率都增大,但C2H6的转化率程度大于CO2,说明反应2正向进行的程度增大大于反应1,C2H4的选择性不断减小,故C错误;催化剂虽然不能改变平衡转化率,但是催化剂有选择性,可以提升目标产物的产率;CaO会吸收水和二氧化碳,但是无法判断平衡如何移动,因此不能判断平衡时C2H4的产率如何变化,故D错误。故选B。
2. C 解析:由图可知,升高温度二氧化碳的平衡转化率升高,平衡正向移动,正反应为吸热反应,焓变大于零,A错误;反应为气体分子数增加的反应,相同温度下,增加二氧化碳的量,会导致二氧化碳的转化率降低,故曲线Ⅱ表示容器乙中CO2的平衡转化率,B错误;R相当于2份Q达平衡后,然后合并到1个容器中,压强增加平衡逆向移动,导致一氧化碳的浓度小于2倍的Q中一氧化碳浓度,故两容器中c(CO):c(CO)Q>c(CO)R,C正确;催化剂改变反应速率,不改变物质的平衡转化率,D错误。故选C。
3. D 解析:根据图可知,温度升高,a的物质的量增大,根据反应①和③可知,温度升高,平衡正向移动,CH4减小,所以a一定不是CH4,A错误;通过反应②+④得到CO(g)+H2(g)===C(s)+H2O(g),所以C(s)+H2O(g)===CO(g)+H2(g)的ΔH=+131 kJ·mol-1,B错误;根据C(s)+H2O(g)===CO(g)+H2(g)反应为吸热反应,其他条件不变,在500~1 000 ℃范围,随着温度的升高,平衡正向移动,n(H2O)不断减小,C错误;当n始(CO2)+n始(CH4)=1 mol,其他条件不变时,提高的值,二氧化碳物质的量增大,甲烷物质的量减小,平衡③④逆向移动,消耗C,能减少平衡时积碳量,D正确。故选D。
4. D 解析:根据盖斯定律,反应Ⅲ=反应Ⅱ-反应Ⅰ,则ΔH3=ΔH2-ΔH1=-206.1 kJ·mol-1,A错误;温度升高,反应Ⅰ正向移动,反应Ⅱ和Ⅲ逆向移动,可知c线为CO,a为CO2,b为CH4,649 ℃时,反应平衡时n(H2)=1.2 mol,转换为氢气为0.8 mol,生成的H2O小于0.8 mol,n(CO)=n(CO2),平衡常数:K<=<1,B错误;由图像可知,250 ℃~649 ℃范围内,随着温度的升高,平衡时n(H2)增大,平衡逆向移动,则平衡时n(H2O)不断减小;649 ℃~900 ℃范围内,随着温度的升高,平衡时n(H2)减小,平衡正向移动,则平衡时n(H2O)不断增大,C错误;高温时反应Ⅰ进行程度很大,反应Ⅱ、Ⅲ程度很小,CH4含量很少,平衡不受压强影响,适当增大体系压强,n(CO)保持不变,D正确。故选D。
5. C 解析:由反应方程式可知,反应Ⅰ的平衡常数K=,故A错误;根据盖斯定律可知,反应Ⅰ-反应Ⅲ可得反应Ⅱ,则ΔH2=ΔH1-ΔH3=-49.5 kJ·mol-1-40.9kJ·mol-1=-90.4 kJ·mol-1,故B错误;反应Ⅰ为放热反应,温度升高平衡逆向移动,CO2的平衡转化率减小,反应Ⅲ为吸热反应,温度升高平衡正向移动,CO2的平衡转化率增大,所以升高温度CO2的平衡转化率先减小后增大,即曲线a代表的是CO2的平衡转化率,故C正确;CO2的平衡转化率=×100%,CH3OH的平衡产率=×100%,由反应式可知,起始时含碳组分为CO2,平衡时含碳组分为CH3OH、CO和CO2,根据碳元素守恒,n(CO2)起始-n(CO2)平衡≠n(CH3OH)平衡,所以在其他条件相同时,改变用量不可能使CO2的平衡转化率与CH3OH的平衡产率相等,故D错误。故选C。
6. C 解析:由盖斯定律知,Ⅰ-Ⅱ得CO(g)+2H2(g)??CH3OH(g) ΔH=ΔH1-ΔH2=(-49 kJ·mol-1)-41 kJ·mol-1=-90 kJ·mol-1,A错误;相同条件下,使用催化剂CZ(Zr 1)T时,CH3OH选择性更高,此催化剂在230 ℃时,CH3OH选择性最高且CH3OH产率较高,故合成甲醇的最适宜条件为约230 ℃、催化剂选择CZ(Zr 1)T,B错误;230 ℃以上,升高温度,反应Ⅰ为放热反应,平衡逆向移动,甲醇的产率降低,反应Ⅱ为吸热反应,平衡正向移动,CO2转化率增大,升温对反应Ⅱ的影响更大,C正确;恒压恒温下,充入氦气,相当于减压,平衡逆向移动,CO2转化率减小,D错误。
7. B 解析:由图可知,300 ℃时,CH3OCH3的选择性接近20%,则有接近40%的二氧化碳发生反应Ⅱ,则反应Ⅰ程度较大,即K1>K2,A错误;由题干方程式可知,反应Ⅱ正反应是一个气体体积减小的放热反应方向,而反应Ⅰ是一个气体体积不变的吸热反应方向,降低温度能使反应Ⅱ正向移动,而反应Ⅱ的平衡逆向移动,增大体系压强能使反应Ⅱ正向移动,而反应Ⅱ的平衡不移动,故均能提高CH3OCH3产率,B正确;由图可知,CO2的平衡转化率和平衡时CH3OCH3的选择性均为25%,反应消耗二氧化碳的物质的量为1 mol×25%=0.25 mol,容器中CH3OCH3的物质的量:= mol,C错误;根据盖斯定律,Ⅱ-Ⅰ×2得:4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g) ΔH=-204.9 kJ·mol-1,D错误。故选B。
同课章节目录
