第56练 电离平衡 电离平衡常数及电离度 课时作业(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第56练 电离平衡 电离平衡常数及电离度 课时作业(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 502.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 16:42:38 | ||
图片预览




文档简介
第56练 电离平衡 电离平衡常数及电离度
一、 单项选择题
1. 下列说法正确的是( )
A. 易溶于水的电解质一定是强电解质,难溶于水的电解质一定是弱电解质
B. 强电解质溶液的导电能力一定比弱电解质溶液强
C. Na2O溶液在电流的作用下电离成Na+和O2-
D. NaCl晶体不导电是由于NaCl晶体中不存在自由移动的离子
2. 下列物质在水中电离方程式正确的是( )
A. NaHSO4===Na++H++SO
B. NH3·H2O===NH+OH-
C. Ca(NO3)2===Ca2++2NO
D. H2CO3===2H++CO
3. 改变下列条件,能使CH3COOH溶液的电离平衡向右移动,且c(H+)增大的是( )
A. 加入CH3COONa固体
B. 加入蒸馏水
C. 通入HCl气体
D. 升高温度
4. (2024·宁海中学高三上期初)关于0.1 mol·L-1氨水,下列说法正确的是( )
A. 加水稀释,氨水中所有的离子浓度都减小
B. 加水稀释,氨水的电离平衡正向移动,减小
C. 加入浓氨水,氨水的电离平衡正向移动,NH3·H2O的电离度增大
D. 加入浓氨水,水的电离平衡逆向移动,c(H+)·c(OH-)不变
5. 常温下0.1 mol·L-1氨水pH为11,则下列说法中不正确的是( )
A. 此溶液中NH3·H2O在常温下的电离度约为1%
B. 若向此溶液中通入少量氨气,NH3·H2O电离平衡正向移动,水的电离平衡逆向移动
C. 若向其中加入pH为11的NaOH溶液,NH3·H2O电离平衡不移动,但n(NH)减小
D. 若向其中加入少量水,溶液中n(H+)增大
6.
硼酸(H3BO3)在水溶液中存在电离平衡:H3BO3+H2O[B(OH)4]-+H+ K=10-9.34。用0.01 mol·L-1 NaOH溶液分别滴定体积均为20 mL的0.01 mol·L-1硼酸溶液、0.01 mol·L-1硼酸和甘露醇混合溶液,滴定过程中硼酸溶液pH,混合溶液的随加入的NaOH溶液体积的变化如图。
已知:
下列说法错误的是( )
A. 加入甘露醇有利于硼酸的准确滴定
B. 从V1 mL滴定到V2 mL,混合溶液的ΔpH比硼酸溶液的ΔpH大
C. P点:c(Na+)>c(H3BO3)=c{[B(OH)4]-}
D. W点:c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.01 mol·L-1
7. 已知:室温时,0.1 mol·L-1某一元弱酸HA在水中有0.1%发生电离。下列叙述错误的是( )
A. 该溶液中c(H+)=10-4 mol·L-1
B. 升高温度,溶液的酸性减弱
C. 该一元酸的电离平衡常数约为1×10-7
D. 向一元酸HA的溶液中,通入HCl气体,HA的电离平衡逆向移动,但c(H+)增大
8. 0.01 mol·L-1某一元弱酸HA溶液中的c(H+)=10-4 mol·L-1,则其电离度为( )
A. 1% B. 2% C. 5% D. 10%
9. 常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A. 溶液Ⅰ中c(H+)=c(OH-)+c(A-)
B. 溶液Ⅱ中的HA的电离度[]为
C. 溶液Ⅰ和Ⅱ中的c(HA)不相等
D. 溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
10. (2024·苏州高三下三模)常温常压下,H2S气体在水中的饱和浓度约为0.10 mol·L-1,已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13;Ksp(FeS)=6.3×10-18。下列说法不正确的是( )
A. 饱和H2S溶液中存在c(H+)>c(HS-)>c(S2-)>c(OH-)
B. 向10 mL 0.010 mol·L-1 H2S溶液中加几滴浓盐酸,使其浓度达到0.010 mol·L-1,此时溶液中c(S2-)约为1.4×10-18 mol·L-1
C. 向0.010 mol·L-1 FeCl2溶液中通入H2S气体直至饱和,溶液中有FeS沉淀生成
D. FeS(s)+2H+(aq)Fe2+(aq)+H2S(aq)的平衡常数为4.4×102
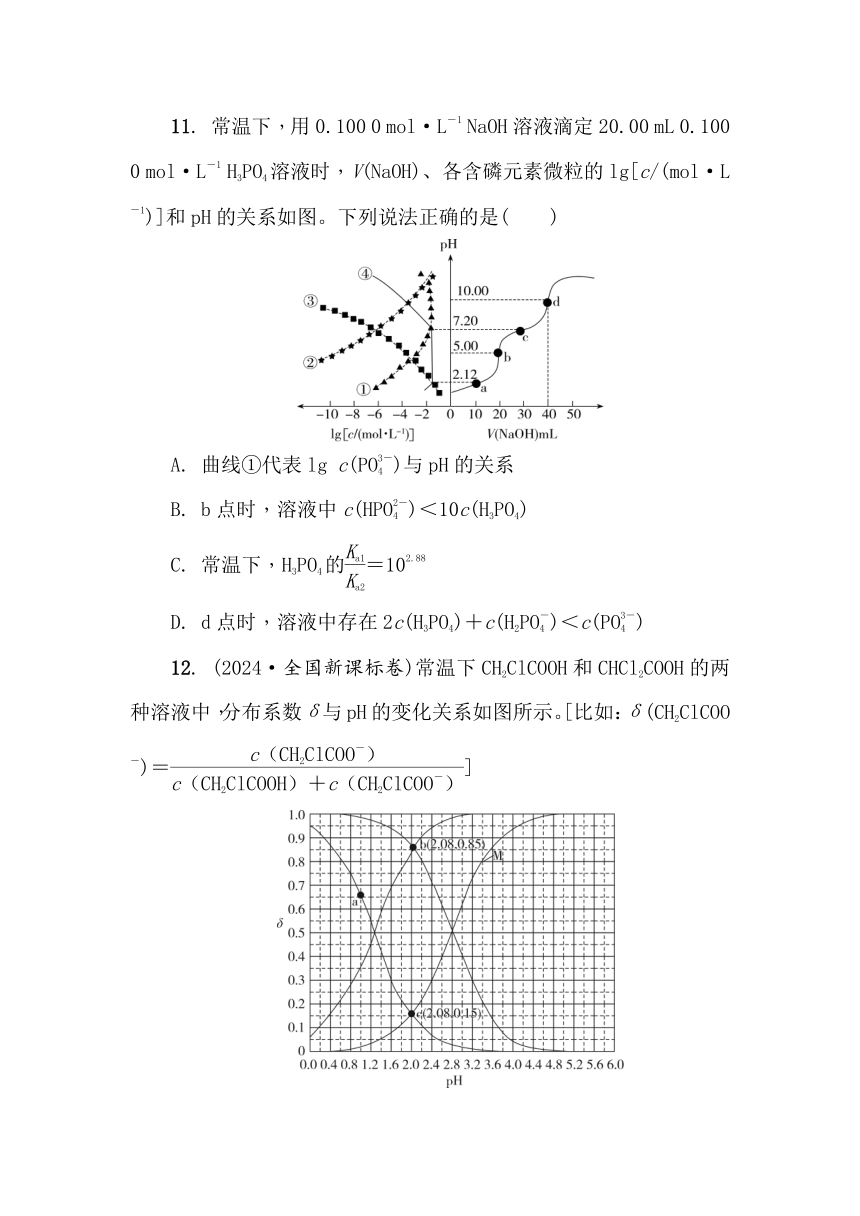
11. 常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H3PO4溶液时,V(NaOH)、各含磷元素微粒的lg[c/(mol·L-1)]和pH的关系如图。下列说法正确的是( )
A. 曲线①代表lg c(PO)与pH的关系
B. b点时,溶液中c(HPO)<10c(H3PO4)
C. 常温下,H3PO4的=102.88
D. d点时,溶液中存在2c(H3PO4)+c(H2PO)<c(PO)
12. (2024·全国新课标卷)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是( )
A. 曲线M表示δ(CHCl2COO-)~pH的变化关系
B. 若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C. CH2ClCOOH的电离常数Ka=10-1.3
D. pH=2.08时,=
二、 非选择题
13. (2024·泰州中学高三上月考)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时,HAc的Ka=1.75×10-5=10-4.76。
某小组研究25 ℃下HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序号 V(HAc)/mL V(NaAc)/mL V(H2O)/mL n(NaAc)∶n(HAc) pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3∶4 4.53
Ⅷ 4.00 4.00 32.00 1∶1 4.65
(1)根据表中信息,数据:a=__________,b=__________。
(2)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡正向移动;结合表中数据,给出判断理由:____________________________________________________________________________。
(3)由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡__________(填“正”或“逆”)向移动。实验结论:假设成立。
第56练 电离平衡 电离平衡常数及电离度
1. D 解析:易溶于水的电解质不一定是强电解质,如醋酸是弱电解质,难溶于水的电解质不一定是弱电解质,如氯化银、硫酸钡都是强电解质,故A错误;电解质溶液导电能力与离子浓度成正比,与电解质强弱无关,故B错误;Na2O和水反应生成氢氧化钠,氢氧化钠溶液中电离出钠离子和氢氧根离子,不需要通电,故C错误;含有自由移动离子或电子的物质能导电,氯化钠晶体不导电是由于氯化钠晶体中不存在自由移动的离子,故D正确。故选D。
2. A 解析:NH3·H2O是弱电解质,电离方程式应该用可逆符号,B错误;NO带一个单位的负电荷,C错误;H2CO3是二元弱酸,分步电离,电离方程式为H2CO3H++HCO,D错误。
3. D 解析:加入CH3COONa固体,c(CH3COO-)增大,电离平衡CH3COOHCH3COO-+H+逆向移动,c(H+)减小,A不选;加入蒸馏水,电离平衡:CH3COOHCH3COO-+H+向右移动,但溶液酸性减弱,c(H+)减小,B不选;通入HCl气体,溶液中c(H+)增大,电离平衡CH3COOHCH3COO-+H+逆向移动,C不选;CH3COOH的电离平衡吸热,升高温度CH3COOHCH3COO-+H+向右移动,c(H+)增大,D选。故选D。
4. D 解析:加水稀释,氨水中氢氧根离子浓度减小,则氢离子浓度增大,故A错误;加水稀释,氨水的电离平衡正向移动,氢氧根物质的量增大,氨水物质的量减小,则增大,两种粒子体积相等,则增大,故B错误;加入浓氨水,氨水的电离平衡正向移动,氨水浓度增大,则NH3·H2O的电离度减小,故C错误;加入浓氨水,溶液中氢氧根的浓度增大,水的电离平衡逆向移动,c(H+)·c(OH-)=Kw,温度不变,Kw不变,故D正确。故选D。
5. C 解析:常温下0.1 mol·L-1氨水pH为11,即c(H+)=10-11 mol·L-1,则c(OH-)==10-3 mol·L-1,据此解答。根据电离方程式建立三段式:
则此溶液中NH3·H2O在常温下的电离度约为:×100%=1%,A正确;若向此溶液中通入少量氨气,即NH3·H2O的浓度增大,NH3·H2O电离平衡正向移动,溶液碱性增强,对水的电离的抑制程度增大,则水的电离平衡逆向移动,B正确;向其中加入pH为11的NaOH溶液,溶液体积增大,c(NH)减小,NH3·H2O电离平衡正向移动,n(NH)增大,C错误;若向氨水中加入少量水,将促进NH3·H2O电离,但NH3·H2O电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,温度不变,离子积常数不变,则溶液中c(H+)增大,溶液体积也增大,所以溶液中n(H+)增大,D正确。故选C。
6. D 解析:随着NaOH溶液的加入,溶液的碱性逐渐增强,溶液pH逐渐增大,因此P、W两点所在曲线为溶液pH与V(NaOH)变化曲线,而M、N两点所在曲线是与V(NaOH)的变化曲线。根据已知条件可知:加入甘露醇后,能够与弱酸H3BO3电离产生的酸根阴离子[B(OH)4]-结合形成甘露醇 硼酸配离子,使[B(OH)4]-浓度减小,硼酸的电离平衡正向移动,促进硼酸电离平衡正向移动,有利于硼酸的准确滴定,A正确;加入甘露醇后,能够与弱酸H3BO3电离产生的酸根阴离子[B(OH)4]-结合形成甘露醇 硼酸配离子,使[B(OH)4]-浓度减小,硼酸的电离平衡正向移动,促进硼酸电离平衡正向移动,利于与NaOH溶液的反应,所以混合溶液的ΔpH比硼酸溶液的ΔpH大,B正确;P点的pH=9.34,c(H+)=10-9.34 mol·L-1,H3BO3的电离平衡常数K==10-9.34,此时碱性溶液中NaOH过量,即P点:c(Na+)>c(H3BO3)=c{[B(OH)4]-},C正确;W点对应的V(NaOH)的最大,是pH的转折点,则该点时V(NaOH)=V(H3BO3)=20 mL,溶液中存在电荷守恒:c(Na+)+c(H+)===c{[B(OH)4]-}+c(OH-),根据物料守恒可知c(H3BO3)+c{[B(OH)4]-}=0.005 mol·L-1,整理可得c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.005 mol·L-1<0.01 mol·L-1,D错误。故选D。
7. B 解析:室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则c(H+)=0.1 mol·L-1×0.1%=10-4 mol·L-1,A正确;升高温度,HA的电离平衡正向移动,c(H+)增大,溶液的酸性增强,B错误;该一元酸的电离平衡常数K=≈=1×10-7,C正确;通入HCl气体,c(H+)增大,HA的电离平衡逆向移动,D正确。
8. A 解析:电离度==×100%=1%。故选A。
9. B 解析:常温下溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 mol·L-1,c(H+)<c(OH-)+c(A-),A错误;常温下溶液Ⅱ的pH=1.0,溶液中c(H+)=0.1 mol·L-1,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),则=1.0×10-3,解得=,B正确;根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;常温下溶液Ⅰ的pH=7.0,溶液Ⅰ中c(H+)=1×10-7 mol·L-1,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),=1.0×10-3,溶液Ⅰ中c总(HA)=(104+1)·c(HA),溶液Ⅱ的pH=1.0,溶液Ⅱ中c(H+)=0.1 mol·L-1,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),=1.0×10-3,溶液Ⅱ中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,溶液Ⅰ和Ⅱ中c总(HA)之比为[(104+1)·c(HA)]∶[1.01c(HA)]=(104+1)∶1.01≈104,D错误。故选B。
10. A 解析:氢硫酸是二元弱酸,在溶液中分步电离,以一级电离为主,且一级电离抑制二级电离,则饱和氢硫酸溶液中氢离子浓度略大于氢硫酸根离子,由一级电离常数可知,溶液中的氢离子浓度约为=×10-4 mol·L-1≈1.05×10-4 mol·L-1,由二级电离常数Ka2(H2S)=可知,溶液中硫离子浓度约为1.3×10-13 mol·L-1,由水的离子积常数可知,溶液中氢氧根离子浓度约为≈9.5×10-11 mol·L-1,则溶液中离子浓度的大小顺序为c(H+)>c(HS-)>c(OH-)>c(S2-),故A错误;由电离常数可得:Ka1(H2S)Ka2(H2S)=,由题意可知,溶液中氢离子浓度和氢硫酸浓度都约为0.01 mol·L-1,则溶液中硫离子浓度约为≈1.4×10-18 mol·L-1,故B正确;氢硫酸饱和溶液中氢离子浓度约等于硫氢根氢离子浓度,由电离常数Ka2(H2S)=可知,溶液中硫离子浓度约为1.3×10-13 mol·L-1,则溶液中浓度熵Qc=c(Fe2+)·c(S2-)=0.01×1.3×10-13=1.3×10-15>Ksp(FeS)=6.3×10-18,所以溶液中有氯化亚铁生成,故C正确;由方程式可知,反应的平衡常数K====≈4.4×102 mol·L-1,故D正确。故选A。
11. B 解析:根据图中a点,V(NaOH)=10 mL时,溶液中溶质为n(H3PO4)∶n(NaH2PO4)=1∶1,故③④为磷酸和磷酸二氢钠的曲线,又因为随着pH变大,H3PO4浓度变小,故③为lg c(H3PO4)与pH的关系曲线,④为lg c(H2PO)与pH的关系曲线;又因为pH=2.12时,c(PO)最小,故曲线②为lg c(PO)与pH的关系曲线。①为lg c(HPO)与pH的关系曲线,据此分析回答。根据上述分析可知,曲线①代表lg c(HPO)与pH的关系,A错误;根据图中a点c(H3PO4)=c(H2PO),Ka1=eq \f(c(H+)·c(H2PO),c(H3PO4))=c(H+)=10-2.12;根据图中c点c(H2PO)=c(HPO),Ka2=eq \f(c(H+)·c(HPO),c(H2PO))=c(H+)=10-7.20,则b点时,V(NaOH)=20 mL,溶质为NaH2PO4,此时溶液pH=5,c(H+)=10-5 mol·L-1,Ka1·Ka2=eq \f(c(H+)·c(H2PO),c(H3PO4))×eq \f(c(H+)·c(HPO),c(H2PO)),eq \f(c(HPO),c(H3PO4))===100.68<10,故b点时溶液中c(HPO)<10c(H3PO4),B正确;a点,V(NaOH)=10 mL,溶液中溶质为c(H3PO4)∶c(NaH2PO4)=1∶1,即c(H3PO4)=c(H2PO),Ka1=eq \f(c(H+)·c(H2PO),c(H3PO4))=c(H+)=10-2.12;c点时,V(NaOH)=30 mL,c(H2PO)∶c(HPO)=1∶1,即c(H2PO)=c(HPO),Ka2=eq \f(c(H+)·c(HPO),c(H2PO))=c(H+)=10-7.20,则==105.08,C错误;d点时,V(NaOH)=40 mL,n(NaOH)=2n(H3PO4),溶液中溶质为Na2HPO4,溶液中存在质子守恒c(H+)+2c(H3PO4)+c(H2PO)=c(PO)+c(OH-),此时溶液pH为10.00,溶液显碱性,则c(OH-)>c(H+),则2c(H3PO4)+c(H2PO)>c(PO),D错误。故选B。
12. D 解析:随着pH的增大,CH2ClCOOH、CHCl2COOH浓度减小,CH2ClCOO-、CHCl2COO-浓度增大,—Cl为吸电子基团,CHCl2COOH的酸性强于CH2ClCOOH,即Ka(CHCl2COOH)>Ka(CH2ClCOOH)),δ(酸分子)=δ(酸根离子)=0.5时的pH分别约为1.3、2.8,则两种酸的电离常数分别为Ka(CHCl2COOH)≈10-1.3,Ka(CH2ClCOOH)≈10-2.8,由此分析解题。根据分析,曲线M表示δ(CH2ClCOO-)~pH的变化关系,A错误;根据Ka(CHCl2COOH)=,初始c0(CHCl2COOH)=0.1 mol·L-1,若溶液中溶质只有CHCl2COOH,则c(CHCl2COO-)=c(H+)≈=10-1.15 mol·L-1,但a点对应的c(H+)=0.1 mol·L-1,说明此时溶液中加入了酸性更强的酸,根据电荷守恒,c(H+)>c(CHCl2COO-)+c(OH-),B错误;根据分析,CH2ClCOOH的电离常数Ka=10-2.8,C错误;电离度α=,n始=n电离+n未电离,则α(CH2ClCOOH)=δ(CH2ClCOO-),α(CHCl2COOH)=δ(CHCl2COO-),pH=2.08时,δ(CH2ClCOO-)=0.15,δ(CHCl2COO-)=0.85,D正确。故选D。
13. (1)3.00 33.00 (2)实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1 (3)逆
解析:(1)NaAc溶液和HAc溶液的浓度相同,实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc溶液)=4.00 mL,因此V(NaAc溶液)=3.00 mL;由实验Ⅰ可知,溶液最终的体积为40.00 mL,则V(H2O)=33.00 mL;
(2)实验Ⅰ所得溶液的pH=2.86,实验Ⅱ的溶液中c(HAc)为实验Ⅰ的,稀释过程中,若电离平衡不移动,则实验Ⅱ所得溶液的pH=2.86+1=3.86,但实际溶液的pH=3.36<3.86,说明稀释过程中,溶液中n(H+)增大,即电离平衡正向移动;判断理由:实实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1;
(3)在醋酸的电离平衡中增大产物的浓度,平衡逆向移动。
一、 单项选择题
1. 下列说法正确的是( )
A. 易溶于水的电解质一定是强电解质,难溶于水的电解质一定是弱电解质
B. 强电解质溶液的导电能力一定比弱电解质溶液强
C. Na2O溶液在电流的作用下电离成Na+和O2-
D. NaCl晶体不导电是由于NaCl晶体中不存在自由移动的离子
2. 下列物质在水中电离方程式正确的是( )
A. NaHSO4===Na++H++SO
B. NH3·H2O===NH+OH-
C. Ca(NO3)2===Ca2++2NO
D. H2CO3===2H++CO
3. 改变下列条件,能使CH3COOH溶液的电离平衡向右移动,且c(H+)增大的是( )
A. 加入CH3COONa固体
B. 加入蒸馏水
C. 通入HCl气体
D. 升高温度
4. (2024·宁海中学高三上期初)关于0.1 mol·L-1氨水,下列说法正确的是( )
A. 加水稀释,氨水中所有的离子浓度都减小
B. 加水稀释,氨水的电离平衡正向移动,减小
C. 加入浓氨水,氨水的电离平衡正向移动,NH3·H2O的电离度增大
D. 加入浓氨水,水的电离平衡逆向移动,c(H+)·c(OH-)不变
5. 常温下0.1 mol·L-1氨水pH为11,则下列说法中不正确的是( )
A. 此溶液中NH3·H2O在常温下的电离度约为1%
B. 若向此溶液中通入少量氨气,NH3·H2O电离平衡正向移动,水的电离平衡逆向移动
C. 若向其中加入pH为11的NaOH溶液,NH3·H2O电离平衡不移动,但n(NH)减小
D. 若向其中加入少量水,溶液中n(H+)增大
6.
硼酸(H3BO3)在水溶液中存在电离平衡:H3BO3+H2O[B(OH)4]-+H+ K=10-9.34。用0.01 mol·L-1 NaOH溶液分别滴定体积均为20 mL的0.01 mol·L-1硼酸溶液、0.01 mol·L-1硼酸和甘露醇混合溶液,滴定过程中硼酸溶液pH,混合溶液的随加入的NaOH溶液体积的变化如图。
已知:
下列说法错误的是( )
A. 加入甘露醇有利于硼酸的准确滴定
B. 从V1 mL滴定到V2 mL,混合溶液的ΔpH比硼酸溶液的ΔpH大
C. P点:c(Na+)>c(H3BO3)=c{[B(OH)4]-}
D. W点:c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.01 mol·L-1
7. 已知:室温时,0.1 mol·L-1某一元弱酸HA在水中有0.1%发生电离。下列叙述错误的是( )
A. 该溶液中c(H+)=10-4 mol·L-1
B. 升高温度,溶液的酸性减弱
C. 该一元酸的电离平衡常数约为1×10-7
D. 向一元酸HA的溶液中,通入HCl气体,HA的电离平衡逆向移动,但c(H+)增大
8. 0.01 mol·L-1某一元弱酸HA溶液中的c(H+)=10-4 mol·L-1,则其电离度为( )
A. 1% B. 2% C. 5% D. 10%
9. 常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A. 溶液Ⅰ中c(H+)=c(OH-)+c(A-)
B. 溶液Ⅱ中的HA的电离度[]为
C. 溶液Ⅰ和Ⅱ中的c(HA)不相等
D. 溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
10. (2024·苏州高三下三模)常温常压下,H2S气体在水中的饱和浓度约为0.10 mol·L-1,已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13;Ksp(FeS)=6.3×10-18。下列说法不正确的是( )
A. 饱和H2S溶液中存在c(H+)>c(HS-)>c(S2-)>c(OH-)
B. 向10 mL 0.010 mol·L-1 H2S溶液中加几滴浓盐酸,使其浓度达到0.010 mol·L-1,此时溶液中c(S2-)约为1.4×10-18 mol·L-1
C. 向0.010 mol·L-1 FeCl2溶液中通入H2S气体直至饱和,溶液中有FeS沉淀生成
D. FeS(s)+2H+(aq)Fe2+(aq)+H2S(aq)的平衡常数为4.4×102
11. 常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H3PO4溶液时,V(NaOH)、各含磷元素微粒的lg[c/(mol·L-1)]和pH的关系如图。下列说法正确的是( )
A. 曲线①代表lg c(PO)与pH的关系
B. b点时,溶液中c(HPO)<10c(H3PO4)
C. 常温下,H3PO4的=102.88
D. d点时,溶液中存在2c(H3PO4)+c(H2PO)<c(PO)
12. (2024·全国新课标卷)常温下CH2ClCOOH和CHCl2COOH的两种溶液中,分布系数δ与pH的变化关系如图所示。[比如:δ(CH2ClCOO-)=]
下列叙述正确的是( )
A. 曲线M表示δ(CHCl2COO-)~pH的变化关系
B. 若酸的初始浓度为0.10 mol·L-1,则a点对应的溶液中有c(H+)=c(CHCl2COO-)+c(OH-)
C. CH2ClCOOH的电离常数Ka=10-1.3
D. pH=2.08时,=
二、 非选择题
13. (2024·泰州中学高三上月考)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时,HAc的Ka=1.75×10-5=10-4.76。
某小组研究25 ℃下HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序号 V(HAc)/mL V(NaAc)/mL V(H2O)/mL n(NaAc)∶n(HAc) pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3∶4 4.53
Ⅷ 4.00 4.00 32.00 1∶1 4.65
(1)根据表中信息,数据:a=__________,b=__________。
(2)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡正向移动;结合表中数据,给出判断理由:____________________________________________________________________________。
(3)由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡__________(填“正”或“逆”)向移动。实验结论:假设成立。
第56练 电离平衡 电离平衡常数及电离度
1. D 解析:易溶于水的电解质不一定是强电解质,如醋酸是弱电解质,难溶于水的电解质不一定是弱电解质,如氯化银、硫酸钡都是强电解质,故A错误;电解质溶液导电能力与离子浓度成正比,与电解质强弱无关,故B错误;Na2O和水反应生成氢氧化钠,氢氧化钠溶液中电离出钠离子和氢氧根离子,不需要通电,故C错误;含有自由移动离子或电子的物质能导电,氯化钠晶体不导电是由于氯化钠晶体中不存在自由移动的离子,故D正确。故选D。
2. A 解析:NH3·H2O是弱电解质,电离方程式应该用可逆符号,B错误;NO带一个单位的负电荷,C错误;H2CO3是二元弱酸,分步电离,电离方程式为H2CO3H++HCO,D错误。
3. D 解析:加入CH3COONa固体,c(CH3COO-)增大,电离平衡CH3COOHCH3COO-+H+逆向移动,c(H+)减小,A不选;加入蒸馏水,电离平衡:CH3COOHCH3COO-+H+向右移动,但溶液酸性减弱,c(H+)减小,B不选;通入HCl气体,溶液中c(H+)增大,电离平衡CH3COOHCH3COO-+H+逆向移动,C不选;CH3COOH的电离平衡吸热,升高温度CH3COOHCH3COO-+H+向右移动,c(H+)增大,D选。故选D。
4. D 解析:加水稀释,氨水中氢氧根离子浓度减小,则氢离子浓度增大,故A错误;加水稀释,氨水的电离平衡正向移动,氢氧根物质的量增大,氨水物质的量减小,则增大,两种粒子体积相等,则增大,故B错误;加入浓氨水,氨水的电离平衡正向移动,氨水浓度增大,则NH3·H2O的电离度减小,故C错误;加入浓氨水,溶液中氢氧根的浓度增大,水的电离平衡逆向移动,c(H+)·c(OH-)=Kw,温度不变,Kw不变,故D正确。故选D。
5. C 解析:常温下0.1 mol·L-1氨水pH为11,即c(H+)=10-11 mol·L-1,则c(OH-)==10-3 mol·L-1,据此解答。根据电离方程式建立三段式:
则此溶液中NH3·H2O在常温下的电离度约为:×100%=1%,A正确;若向此溶液中通入少量氨气,即NH3·H2O的浓度增大,NH3·H2O电离平衡正向移动,溶液碱性增强,对水的电离的抑制程度增大,则水的电离平衡逆向移动,B正确;向其中加入pH为11的NaOH溶液,溶液体积增大,c(NH)减小,NH3·H2O电离平衡正向移动,n(NH)增大,C错误;若向氨水中加入少量水,将促进NH3·H2O电离,但NH3·H2O电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,温度不变,离子积常数不变,则溶液中c(H+)增大,溶液体积也增大,所以溶液中n(H+)增大,D正确。故选C。
6. D 解析:随着NaOH溶液的加入,溶液的碱性逐渐增强,溶液pH逐渐增大,因此P、W两点所在曲线为溶液pH与V(NaOH)变化曲线,而M、N两点所在曲线是与V(NaOH)的变化曲线。根据已知条件可知:加入甘露醇后,能够与弱酸H3BO3电离产生的酸根阴离子[B(OH)4]-结合形成甘露醇 硼酸配离子,使[B(OH)4]-浓度减小,硼酸的电离平衡正向移动,促进硼酸电离平衡正向移动,有利于硼酸的准确滴定,A正确;加入甘露醇后,能够与弱酸H3BO3电离产生的酸根阴离子[B(OH)4]-结合形成甘露醇 硼酸配离子,使[B(OH)4]-浓度减小,硼酸的电离平衡正向移动,促进硼酸电离平衡正向移动,利于与NaOH溶液的反应,所以混合溶液的ΔpH比硼酸溶液的ΔpH大,B正确;P点的pH=9.34,c(H+)=10-9.34 mol·L-1,H3BO3的电离平衡常数K==10-9.34,此时碱性溶液中NaOH过量,即P点:c(Na+)>c(H3BO3)=c{[B(OH)4]-},C正确;W点对应的V(NaOH)的最大,是pH的转折点,则该点时V(NaOH)=V(H3BO3)=20 mL,溶液中存在电荷守恒:c(Na+)+c(H+)===c{[B(OH)4]-}+c(OH-),根据物料守恒可知c(H3BO3)+c{[B(OH)4]-}=0.005 mol·L-1,整理可得c(Na+)+c(H+)+c(H3BO3)-c(OH-)=0.005 mol·L-1<0.01 mol·L-1,D错误。故选D。
7. B 解析:室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则c(H+)=0.1 mol·L-1×0.1%=10-4 mol·L-1,A正确;升高温度,HA的电离平衡正向移动,c(H+)增大,溶液的酸性增强,B错误;该一元酸的电离平衡常数K=≈=1×10-7,C正确;通入HCl气体,c(H+)增大,HA的电离平衡逆向移动,D正确。
8. A 解析:电离度==×100%=1%。故选A。
9. B 解析:常温下溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 mol·L-1,c(H+)<c(OH-)+c(A-),A错误;常温下溶液Ⅱ的pH=1.0,溶液中c(H+)=0.1 mol·L-1,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),则=1.0×10-3,解得=,B正确;根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;常温下溶液Ⅰ的pH=7.0,溶液Ⅰ中c(H+)=1×10-7 mol·L-1,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),=1.0×10-3,溶液Ⅰ中c总(HA)=(104+1)·c(HA),溶液Ⅱ的pH=1.0,溶液Ⅱ中c(H+)=0.1 mol·L-1,Ka==1.0×10-3,c总(HA)=c(HA)+c(A-),=1.0×10-3,溶液Ⅱ中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,溶液Ⅰ和Ⅱ中c总(HA)之比为[(104+1)·c(HA)]∶[1.01c(HA)]=(104+1)∶1.01≈104,D错误。故选B。
10. A 解析:氢硫酸是二元弱酸,在溶液中分步电离,以一级电离为主,且一级电离抑制二级电离,则饱和氢硫酸溶液中氢离子浓度略大于氢硫酸根离子,由一级电离常数可知,溶液中的氢离子浓度约为=×10-4 mol·L-1≈1.05×10-4 mol·L-1,由二级电离常数Ka2(H2S)=可知,溶液中硫离子浓度约为1.3×10-13 mol·L-1,由水的离子积常数可知,溶液中氢氧根离子浓度约为≈9.5×10-11 mol·L-1,则溶液中离子浓度的大小顺序为c(H+)>c(HS-)>c(OH-)>c(S2-),故A错误;由电离常数可得:Ka1(H2S)Ka2(H2S)=,由题意可知,溶液中氢离子浓度和氢硫酸浓度都约为0.01 mol·L-1,则溶液中硫离子浓度约为≈1.4×10-18 mol·L-1,故B正确;氢硫酸饱和溶液中氢离子浓度约等于硫氢根氢离子浓度,由电离常数Ka2(H2S)=可知,溶液中硫离子浓度约为1.3×10-13 mol·L-1,则溶液中浓度熵Qc=c(Fe2+)·c(S2-)=0.01×1.3×10-13=1.3×10-15>Ksp(FeS)=6.3×10-18,所以溶液中有氯化亚铁生成,故C正确;由方程式可知,反应的平衡常数K====≈4.4×102 mol·L-1,故D正确。故选A。
11. B 解析:根据图中a点,V(NaOH)=10 mL时,溶液中溶质为n(H3PO4)∶n(NaH2PO4)=1∶1,故③④为磷酸和磷酸二氢钠的曲线,又因为随着pH变大,H3PO4浓度变小,故③为lg c(H3PO4)与pH的关系曲线,④为lg c(H2PO)与pH的关系曲线;又因为pH=2.12时,c(PO)最小,故曲线②为lg c(PO)与pH的关系曲线。①为lg c(HPO)与pH的关系曲线,据此分析回答。根据上述分析可知,曲线①代表lg c(HPO)与pH的关系,A错误;根据图中a点c(H3PO4)=c(H2PO),Ka1=eq \f(c(H+)·c(H2PO),c(H3PO4))=c(H+)=10-2.12;根据图中c点c(H2PO)=c(HPO),Ka2=eq \f(c(H+)·c(HPO),c(H2PO))=c(H+)=10-7.20,则b点时,V(NaOH)=20 mL,溶质为NaH2PO4,此时溶液pH=5,c(H+)=10-5 mol·L-1,Ka1·Ka2=eq \f(c(H+)·c(H2PO),c(H3PO4))×eq \f(c(H+)·c(HPO),c(H2PO)),eq \f(c(HPO),c(H3PO4))===100.68<10,故b点时溶液中c(HPO)<10c(H3PO4),B正确;a点,V(NaOH)=10 mL,溶液中溶质为c(H3PO4)∶c(NaH2PO4)=1∶1,即c(H3PO4)=c(H2PO),Ka1=eq \f(c(H+)·c(H2PO),c(H3PO4))=c(H+)=10-2.12;c点时,V(NaOH)=30 mL,c(H2PO)∶c(HPO)=1∶1,即c(H2PO)=c(HPO),Ka2=eq \f(c(H+)·c(HPO),c(H2PO))=c(H+)=10-7.20,则==105.08,C错误;d点时,V(NaOH)=40 mL,n(NaOH)=2n(H3PO4),溶液中溶质为Na2HPO4,溶液中存在质子守恒c(H+)+2c(H3PO4)+c(H2PO)=c(PO)+c(OH-),此时溶液pH为10.00,溶液显碱性,则c(OH-)>c(H+),则2c(H3PO4)+c(H2PO)>c(PO),D错误。故选B。
12. D 解析:随着pH的增大,CH2ClCOOH、CHCl2COOH浓度减小,CH2ClCOO-、CHCl2COO-浓度增大,—Cl为吸电子基团,CHCl2COOH的酸性强于CH2ClCOOH,即Ka(CHCl2COOH)>Ka(CH2ClCOOH)),δ(酸分子)=δ(酸根离子)=0.5时的pH分别约为1.3、2.8,则两种酸的电离常数分别为Ka(CHCl2COOH)≈10-1.3,Ka(CH2ClCOOH)≈10-2.8,由此分析解题。根据分析,曲线M表示δ(CH2ClCOO-)~pH的变化关系,A错误;根据Ka(CHCl2COOH)=,初始c0(CHCl2COOH)=0.1 mol·L-1,若溶液中溶质只有CHCl2COOH,则c(CHCl2COO-)=c(H+)≈=10-1.15 mol·L-1,但a点对应的c(H+)=0.1 mol·L-1,说明此时溶液中加入了酸性更强的酸,根据电荷守恒,c(H+)>c(CHCl2COO-)+c(OH-),B错误;根据分析,CH2ClCOOH的电离常数Ka=10-2.8,C错误;电离度α=,n始=n电离+n未电离,则α(CH2ClCOOH)=δ(CH2ClCOO-),α(CHCl2COOH)=δ(CHCl2COO-),pH=2.08时,δ(CH2ClCOO-)=0.15,δ(CHCl2COO-)=0.85,D正确。故选D。
13. (1)3.00 33.00 (2)实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1 (3)逆
解析:(1)NaAc溶液和HAc溶液的浓度相同,实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc溶液)=4.00 mL,因此V(NaAc溶液)=3.00 mL;由实验Ⅰ可知,溶液最终的体积为40.00 mL,则V(H2O)=33.00 mL;
(2)实验Ⅰ所得溶液的pH=2.86,实验Ⅱ的溶液中c(HAc)为实验Ⅰ的,稀释过程中,若电离平衡不移动,则实验Ⅱ所得溶液的pH=2.86+1=3.86,但实际溶液的pH=3.36<3.86,说明稀释过程中,溶液中n(H+)增大,即电离平衡正向移动;判断理由:实实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1;
(3)在醋酸的电离平衡中增大产物的浓度,平衡逆向移动。
同课章节目录
