第59练 单一电解质溶液中粒子浓度比较 课时作业(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第59练 单一电解质溶液中粒子浓度比较 课时作业(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 303.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 16:54:25 | ||
图片预览




文档简介
第59练 单一电解质溶液中粒子浓度比较
一、 单项选择题
1. 常温下,浓度均为 0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
A. 氨水中:c(NH)=c(OH-)=0.1 mol·L-1
B. NH4Cl溶液中:c(NH)>c(Cl-)
C. Na2SO4溶液中:c(Na+)>c(SO)>c(OH-)=c(H+)
D. Na2CO3溶液中:c(Na+)=2c(CO)+c(HCO)+c(H2CO3)
2. 25 ℃下,下列关于0.1 mol·L-1 Na2S溶液的说法正确的是( )
A. 升高温度,溶液的pH降低
B. 加入NaOH固体,溶液中的c(Na+)、c(S2-)均增大
C. c(Na+)>c(S2-)>c(H+)>c(OH-)
D. 2c(Na+)=c(S2-)+c(HS-)+c(H2S)
3. 已知Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11(25 ℃)。对于NH4HCO3溶液下列说法错误的是( )
A. 溶液呈酸性
B. 溶液中水的电离程度比纯水大
C. c(NH)>c(HCO)>c(H2CO3)>c(NH3·H2O)
D. 与同浓度氨水相比,NH4HCO3溶液中c(NH)更大
4. 下列溶液中的粒子浓度关系正确的是( )
A. 0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
B. 1 L 0.1 mol·L-1 Na2S溶液中:c(OH-)-c(H+)=c(HS-)+c(H2S)
C. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
D. 室温下,pH=3.5的柑橘汁中c(H+)是pH=6.5的牛奶中c(H+)的1 000倍
5.
(2025·东山中学高三月考)一种利用K2CO3捕集水煤气中CO2的工艺如图所示。[该温度下Ka1(H2CO3)=4.6×10-7,Ka2(H2CO3)=5.0×10-11]。下列说法正确的是( )
A. K2CO3溶液中:2c(K+)=c(CO)+c(HCO)+c(H2CO3)
B. 吸收塔中c(CO)∶c(HCO)=1∶2时,溶液pH=10
C. 再生塔所得到的溶液中可能存在:c(H2CO3)>c(HCO)
D. 再生塔中发生反应的化学方程式:KHCO3+KOH===K2CO3+H2O+CO2↑
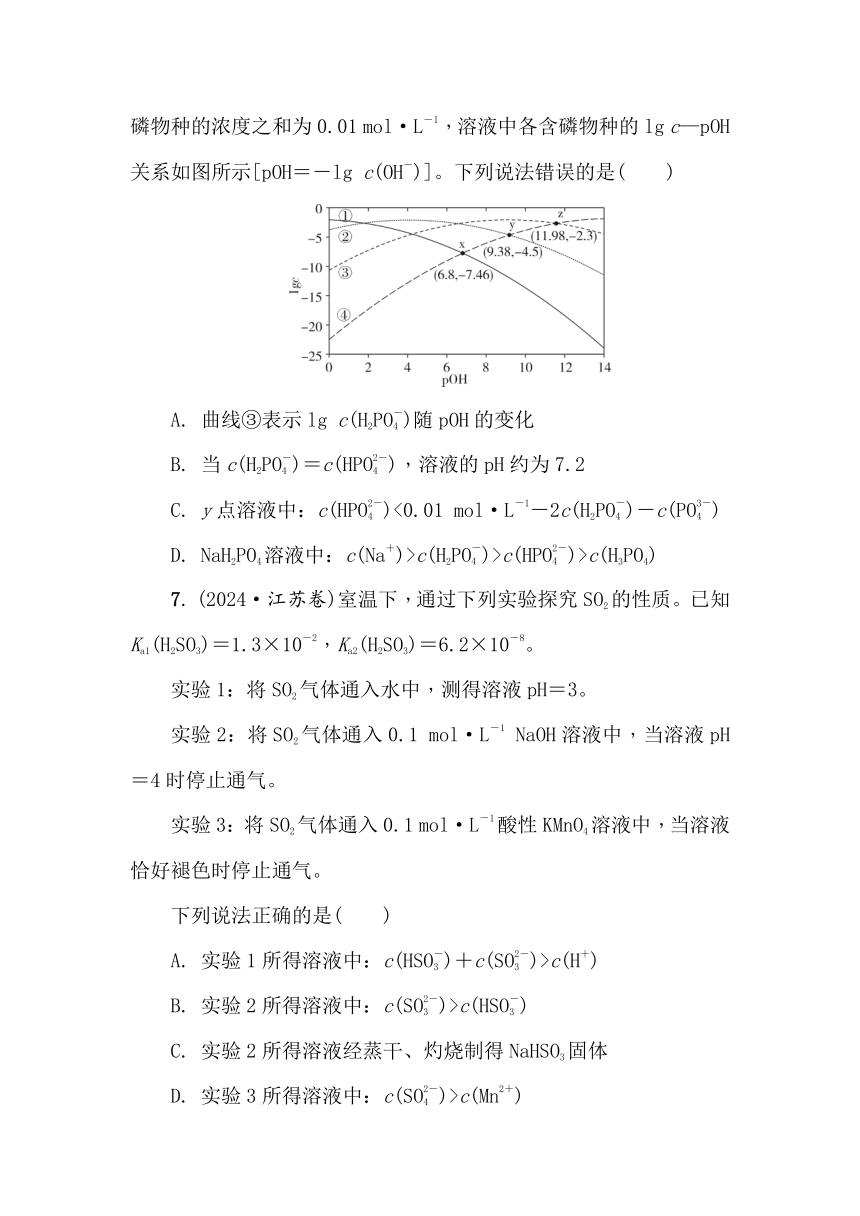
6. (2025·南京十三中高三下月考)常温下,已知H3PO4溶液中含磷物种的浓度之和为0.01 mol·L-1,溶液中各含磷物种的lg c—pOH关系如图所示[pOH=-lg c(OH-)]。下列说法错误的是( )
A. 曲线③表示lg c(H2PO)随pOH的变化
B. 当c(H2PO)=c(HPO),溶液的pH约为7.2
C. y点溶液中:c(HPO)<0.01 mol·L-1-2c(H2PO)-c(PO)
D. NaH2PO4溶液中:c(Na+)>c(H2PO)>c(HPO)>c(H3PO4)
7. (2024·江苏卷)室温下,通过下列实验探究SO2的性质。已知Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8。
实验1:将SO2气体通入水中,测得溶液pH=3。
实验2:将SO2气体通入0.1 mol·L-1 NaOH溶液中,当溶液pH=4时停止通气。
实验3:将SO2气体通入0.1 mol·L-1酸性KMnO4溶液中,当溶液恰好褪色时停止通气。
下列说法正确的是( )
A. 实验1所得溶液中:c(HSO)+c(SO)>c(H+)
B. 实验2所得溶液中:c(SO)>c(HSO)
C. 实验2所得溶液经蒸干、灼烧制得NaHSO3固体
D. 实验3所得溶液中:c(SO)>c(Mn2+)
8. 氨法烟气脱硫可制备硫酸羟胺[(NH3OH)2SO4],同时得到副产品硫酸铵。其过程如下:
“脱硫”过程中控制pH在5.0~5.5,得到NH4HSO3溶液。已知25 ℃时,Kb(NH3·H2O)=1.8×10-5,Ka1(H2SO3)=1.5×10-2,Ka2(H2SO3)=1.0×10-7。下列说法正确的是( )
A. “脱硫”过程中温度越高,“脱硫”速率越快
B. NH4HSO3溶液中:c(HSO)>c(NH)>c(SO)
C. NH4HSO3溶液中:c(NH3·H2O)+c(HSO)+c(OH-)>c(H2SO3)+c(H+)
D. “制备”过程的离子方程式:NO+HSO+SO2+OH-+H2O===NH3OH++2SO
二、 非选择题
9. 回答下列问题。
有同学认为,NaHCO3溶液中HCO水解程度大于其电离程度,因此溶液中c(OH-)>c(CO),某课题组先利用pH数字传感器对不同浓度的NaHCO3溶液进行pH测定,结果如下表。[已知:Ka2(H2CO3)=4.7×10-11]
NaHCO3溶液的浓度/(mol·L-1) 0.1 10-2 10-3 10-4
pH(25 ℃) 8.30 8.29 7.84 7.65
(1)关于上述不同浓度的NaHCO3溶液,下列说法正确的是__________。
A. 加入3滴甲基橙,溶液均呈黄色
B. 溶液中始终存在c(HCO)>c(CO)>c(OH-)>c(H+)
C. 溶液中存在c(H3O+)+c(H2CO3)=c(OH-)+c(CO)
D. 溶液中存在c(Na+)=c(H2CO3)+c(HCO)+2c(CO)
(2)25 ℃时,0.1 mol·L-1的NaHCO3溶液中c(CO)=______________ mol·L-1。
第59练 单一电解质溶液中粒子浓度比较
1. C 解析:氨水显碱性,根据电荷守恒知,c(NH)+c(H+)=c(OH-),c(OH-)>c(NH),A错误;NH4Cl溶液显酸性,根据电荷守恒知,c(NH)+c(H+)=c(OH-)+c(Cl-),由c(OH-)<c(H+),得c(NH)<c(Cl-),B错误;c(Na+)=2c(SO),该溶液为中性,故c(OH-)=c(H+),水的电离是微弱的,C正确;根据元素质量守恒知,c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3),D错误。
2. B 解析:水解过程吸热,升高温度,S2-水解程度增大,碱性增强,pH增大,A错误;Na2S水解,使溶液显碱性,加入NaOH固体,电离出Na+和OH-,OH-抑制了S2-的水解,溶液中c(Na+)、c(S2-)均增大,B正确;Na2S水解使溶液显碱性,c(OH-)>c(H+),根据水解过程微弱规律可知,Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(H+),C错误;Na2S水解显碱性,根据元素质量守恒可知,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],D错误。
3. A 解析:氨水的电离平衡常数大于碳酸的电离平衡常数,则铵根离子的水解小于碳酸氢根离子的水解程度,碳酸氢根水解显碱性,故溶液应为碱性,A错误;NH4HCO3为可水解的盐,盐类水解促进水的电离,故溶液中水的电离程度比纯水大,B正确;铵根离子的水解小于碳酸氢根离子的水解程度,所以溶液中c(NH)>c(HCO),且水解生成的一水合氨浓度小于水解生成的碳酸浓度,所以c(NH)>c(HCO)>c(H2CO3)>c(NH3·H2O),C正确;氨水的电离平衡常数为:Kb(NH3·H2O)=1.8×10-5,电离程度较小氨水中主要以一水合氨形式存在,铵根离子水解平衡常数为:Kh==4. D 解析:NaHCO3溶液中碳酸氢根离子水解程度大于电离程度,溶液显碱性,则NaHCO3溶液中存在c(Na+)>c(HCO)>c(H2CO3)>c(CO),故A错误;任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒得①c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),根据电荷守恒得②c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),将①代入②得:c(HS-)+2c(H2S)=c(OH-)-c(H+),故B错误;等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中,无法判断电离程度和水解程度,不能判断溶液的酸碱性,即无法比较c(OH-)和c(H+)的大小,溶液中必满足电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-)和物料守恒2c(Na+)=c(X-)+c(HX),故C错误;pH=3.5的柑橘汁中c(H+)=10-3.5,pH=6.5的牛奶中c(H+)=10-6.5,所以pH=3.5的柑橘汁中c(H+)是pH=6.5的牛奶中c(H+)的1 000倍,故D正确。故选D。
5. B 解析:K2CO3溶液中,依据物料守恒:c(K+)=2c(CO)+2c(HCO)+2c(H2CO3),A不正确;吸收塔中,Ka2=eq \f(c(H+)·c(CO),c(HCO))=5.0×10-11,c(CO)∶c(HCO)=1∶2时,c(H+)=5.0×10-11×2=1×10-10 mol·L-1,溶液pH=10,B正确;进入再生塔的KHCO3溶液呈碱性,c(H+)<1.0×10-7,Ka1=eq \f(c(H+)·c(HCO),c(H2CO3))=4.6×10-7,则eq \f(c(HCO),c(H2CO3))=>=4.6,则所得到的溶液中可能存在:c(H2CO3)<c(HCO),C不正确;再生塔中发生反应的化学方程式:2KHCO3K2CO3+H2O+CO2↑,D不正确。故选B。
6. C 解析:H3PO4溶液中含P微粒有H3PO4、H2PO、HPO、PO。由图示可知,随着pOH减小,溶液碱性增强,H3PO4浓度减小,H2PO、HPO浓度先增加后减小,PO浓度逐渐增大,故曲线①表示pc(PO)随pOH的变化,曲线②表示pc(HPO)随pOH的变化,曲线③表示pc(H2PO)随pOH的变化,曲线④表示pc(H3PO4),并可写出H3PO4平衡常数的表达式Ka1=eq \f(c(H2PO)·c(H+),c(H3PO4)),Ka2=eq \f(c(HPO)·c(H+),c(H2PO)),Ka3=eq \f(c(PO)·c(H+),c(HPO))。曲线③表示pc(H2PO)随pOH的变化,故A正确;图中z(11.98,-2.3),此时pc(H2PO)=pc(H3PO4),当pOH=11.98时,即c(H+)=10-2.02时,c(H2PO)=c(H3PO4),则Ka1=eq \f(c(H2PO)·c(H+),c(H3PO4))=c(H+)=10-2.02;根据图中y(9.38,-4.5)知当pOH=9.38时,pc(HPO)=pc(H3PO4),即当c(H+)=10-4.62时,c(HPO)=c(H3PO4),则Ka1·Ka2=eq \f(c(H2PO)·c(H+),c(H3PO4))·eq \f(c(HPO)·c(H+),c(H2PO))=c2(H+)=(10-4.62)2=10-9.24,Ka2=eq \f(c(HPO)·c(H+),c(H2PO))===10-7.22≈10-7.2,当c(H2PO)=c(HPO)时Ka2=c(H+)≈10-7.2,溶液的pH约为7.2,故B正确;y点溶液中c(H2PO)>c(H3PO4),根据P原子守恒可知c(HPO)+c(H3PO4)+c(H2PO)+c(PO)=0.01 mol·L-1,c(HPO)+2c(H2PO)+c(PO)>0.01 mol·L-1,c(HPO)>0.01 mol·L-1-2c(H2PO)-c(PO),故C错误;NaH2PO4溶液中Kh(H2PO)===10-11.98,Ka2≈10-7.2,Kh(H2PO)c(H3PO4),故溶液中c(Na+)>c(H2PO)>c(HPO)>c(H3PO4),故D正确。故选C。
7. D 解析:实验1得到H2SO3溶液,实验2溶液的pH为4,实验2为NaHSO3溶液,实验3中SO2和酸性KMnO4溶液反应的离子方程式为:5SO2+2MnO+2H2O===5SO+2Mn2++4H+。实验1得到H2SO3溶液,其电荷守恒关系式为:c(HSO)+2c(SO)+c(OH-)=c(H+),则c(HSO)+c(SO)c(Mn2+),D正确。故选D。
8. C 解析:由电离常数可知,亚硫酸氢根离子在溶液中的水解常数Kh==<Ka2(H2SO3)=1.0×10-7,则亚硫酸氢铵溶液中亚硫酸氢根离子在溶液中的电离程度大于水解程度;同理可知,铵根离子在溶液中的水解常数Kh==<Ka2(H2SO3)=1.0×10-7,说明亚硫酸氢根离子在溶液中的电离抑制铵根离子的水解,则溶液中离子浓度大小顺序为c(NH)>c(HSO)>c(SO);由图可知,脱硫过程发生的反应为一水合氨与烟气中的二氧化硫反应生成亚硫酸氢铵和可以排放的烟气;制备过程发生的反应为亚硫酸氢铵溶液与亚硝酸铵和二氧化硫反应生成硫酸羟胺和硫酸。温度越高,气体的溶解度越小,则“脱硫”过程中温度越高,二氧化硫的溶解度越小,“脱硫”速率越慢,故A错误;由分析可知,亚硫酸氢铵溶液中离子浓度大小顺序为c(NH)>c(HSO)>c(SO),故B错误;由分析可知,亚硫酸氢铵溶液中亚硫酸氢根离子浓度大于硫酸根离子浓度,溶液中存在质子守恒关系c(NH3·H2O)+c(SO)+c(OH-)=c(H2SO3)+c(H+),则溶液中c(NH3·H2O)+c(HSO)+c(OH-)>c(NH3·H2O)+c(SO)+c(OH-)=c(H2SO3)+c(H+),故C正确;由分析可知,制备过程发生的反应为亚硫酸氢铵溶液与亚硝酸铵和二氧化硫反应生成硫酸羟胺和硫酸,反应的离子方程式为NO+HSO+SO2+2H2O===NH3OH++2SO+H+,故D错误。故选C。
9. (1)AC
(2)9.4×10-4
解析:(1)pH>4.4时,甲基橙为黄色,故加入甲基橙溶液后,溶液均呈黄色,A正确;由于水会电离出OH-,故浓度为c(OH-)>c(CO),B错误;由质子守恒可得c(H+)+c(H2CO3)=c(CO)+c(OH-),C正确;由物料守恒可得:c(Na+)=c(H2CO3)+c(HCO)+c(CO),D错误;故答案为AC;
(2)Ka2=eq \f(c(H+)·c(CO),c(HCO)),0.1 mol·L-1的NaHCO3溶液中,pH=8.3,则c(H+)=10-8.3 mol·L-1,c(HCO)约为0.1 mol·L-1,代入Ka2表达式可得Ka2=eq \f(c(H+)·c(CO),c(HCO))=eq \f(10-8.3×c(CO),0.1)=4.7×10-11,得c(CO)=9.4×10-4 mol·L-1。
一、 单项选择题
1. 常温下,浓度均为 0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
A. 氨水中:c(NH)=c(OH-)=0.1 mol·L-1
B. NH4Cl溶液中:c(NH)>c(Cl-)
C. Na2SO4溶液中:c(Na+)>c(SO)>c(OH-)=c(H+)
D. Na2CO3溶液中:c(Na+)=2c(CO)+c(HCO)+c(H2CO3)
2. 25 ℃下,下列关于0.1 mol·L-1 Na2S溶液的说法正确的是( )
A. 升高温度,溶液的pH降低
B. 加入NaOH固体,溶液中的c(Na+)、c(S2-)均增大
C. c(Na+)>c(S2-)>c(H+)>c(OH-)
D. 2c(Na+)=c(S2-)+c(HS-)+c(H2S)
3. 已知Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11(25 ℃)。对于NH4HCO3溶液下列说法错误的是( )
A. 溶液呈酸性
B. 溶液中水的电离程度比纯水大
C. c(NH)>c(HCO)>c(H2CO3)>c(NH3·H2O)
D. 与同浓度氨水相比,NH4HCO3溶液中c(NH)更大
4. 下列溶液中的粒子浓度关系正确的是( )
A. 0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
B. 1 L 0.1 mol·L-1 Na2S溶液中:c(OH-)-c(H+)=c(HS-)+c(H2S)
C. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
D. 室温下,pH=3.5的柑橘汁中c(H+)是pH=6.5的牛奶中c(H+)的1 000倍
5.
(2025·东山中学高三月考)一种利用K2CO3捕集水煤气中CO2的工艺如图所示。[该温度下Ka1(H2CO3)=4.6×10-7,Ka2(H2CO3)=5.0×10-11]。下列说法正确的是( )
A. K2CO3溶液中:2c(K+)=c(CO)+c(HCO)+c(H2CO3)
B. 吸收塔中c(CO)∶c(HCO)=1∶2时,溶液pH=10
C. 再生塔所得到的溶液中可能存在:c(H2CO3)>c(HCO)
D. 再生塔中发生反应的化学方程式:KHCO3+KOH===K2CO3+H2O+CO2↑
6. (2025·南京十三中高三下月考)常温下,已知H3PO4溶液中含磷物种的浓度之和为0.01 mol·L-1,溶液中各含磷物种的lg c—pOH关系如图所示[pOH=-lg c(OH-)]。下列说法错误的是( )
A. 曲线③表示lg c(H2PO)随pOH的变化
B. 当c(H2PO)=c(HPO),溶液的pH约为7.2
C. y点溶液中:c(HPO)<0.01 mol·L-1-2c(H2PO)-c(PO)
D. NaH2PO4溶液中:c(Na+)>c(H2PO)>c(HPO)>c(H3PO4)
7. (2024·江苏卷)室温下,通过下列实验探究SO2的性质。已知Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8。
实验1:将SO2气体通入水中,测得溶液pH=3。
实验2:将SO2气体通入0.1 mol·L-1 NaOH溶液中,当溶液pH=4时停止通气。
实验3:将SO2气体通入0.1 mol·L-1酸性KMnO4溶液中,当溶液恰好褪色时停止通气。
下列说法正确的是( )
A. 实验1所得溶液中:c(HSO)+c(SO)>c(H+)
B. 实验2所得溶液中:c(SO)>c(HSO)
C. 实验2所得溶液经蒸干、灼烧制得NaHSO3固体
D. 实验3所得溶液中:c(SO)>c(Mn2+)
8. 氨法烟气脱硫可制备硫酸羟胺[(NH3OH)2SO4],同时得到副产品硫酸铵。其过程如下:
“脱硫”过程中控制pH在5.0~5.5,得到NH4HSO3溶液。已知25 ℃时,Kb(NH3·H2O)=1.8×10-5,Ka1(H2SO3)=1.5×10-2,Ka2(H2SO3)=1.0×10-7。下列说法正确的是( )
A. “脱硫”过程中温度越高,“脱硫”速率越快
B. NH4HSO3溶液中:c(HSO)>c(NH)>c(SO)
C. NH4HSO3溶液中:c(NH3·H2O)+c(HSO)+c(OH-)>c(H2SO3)+c(H+)
D. “制备”过程的离子方程式:NO+HSO+SO2+OH-+H2O===NH3OH++2SO
二、 非选择题
9. 回答下列问题。
有同学认为,NaHCO3溶液中HCO水解程度大于其电离程度,因此溶液中c(OH-)>c(CO),某课题组先利用pH数字传感器对不同浓度的NaHCO3溶液进行pH测定,结果如下表。[已知:Ka2(H2CO3)=4.7×10-11]
NaHCO3溶液的浓度/(mol·L-1) 0.1 10-2 10-3 10-4
pH(25 ℃) 8.30 8.29 7.84 7.65
(1)关于上述不同浓度的NaHCO3溶液,下列说法正确的是__________。
A. 加入3滴甲基橙,溶液均呈黄色
B. 溶液中始终存在c(HCO)>c(CO)>c(OH-)>c(H+)
C. 溶液中存在c(H3O+)+c(H2CO3)=c(OH-)+c(CO)
D. 溶液中存在c(Na+)=c(H2CO3)+c(HCO)+2c(CO)
(2)25 ℃时,0.1 mol·L-1的NaHCO3溶液中c(CO)=______________ mol·L-1。
第59练 单一电解质溶液中粒子浓度比较
1. C 解析:氨水显碱性,根据电荷守恒知,c(NH)+c(H+)=c(OH-),c(OH-)>c(NH),A错误;NH4Cl溶液显酸性,根据电荷守恒知,c(NH)+c(H+)=c(OH-)+c(Cl-),由c(OH-)<c(H+),得c(NH)<c(Cl-),B错误;c(Na+)=2c(SO),该溶液为中性,故c(OH-)=c(H+),水的电离是微弱的,C正确;根据元素质量守恒知,c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3),D错误。
2. B 解析:水解过程吸热,升高温度,S2-水解程度增大,碱性增强,pH增大,A错误;Na2S水解,使溶液显碱性,加入NaOH固体,电离出Na+和OH-,OH-抑制了S2-的水解,溶液中c(Na+)、c(S2-)均增大,B正确;Na2S水解使溶液显碱性,c(OH-)>c(H+),根据水解过程微弱规律可知,Na2S溶液中:c(Na+)>c(S2-)>c(OH-)>c(H+),C错误;Na2S水解显碱性,根据元素质量守恒可知,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],D错误。
3. A 解析:氨水的电离平衡常数大于碳酸的电离平衡常数,则铵根离子的水解小于碳酸氢根离子的水解程度,碳酸氢根水解显碱性,故溶液应为碱性,A错误;NH4HCO3为可水解的盐,盐类水解促进水的电离,故溶液中水的电离程度比纯水大,B正确;铵根离子的水解小于碳酸氢根离子的水解程度,所以溶液中c(NH)>c(HCO),且水解生成的一水合氨浓度小于水解生成的碳酸浓度,所以c(NH)>c(HCO)>c(H2CO3)>c(NH3·H2O),C正确;氨水的电离平衡常数为:Kb(NH3·H2O)=1.8×10-5,电离程度较小氨水中主要以一水合氨形式存在,铵根离子水解平衡常数为:Kh==
5. B 解析:K2CO3溶液中,依据物料守恒:c(K+)=2c(CO)+2c(HCO)+2c(H2CO3),A不正确;吸收塔中,Ka2=eq \f(c(H+)·c(CO),c(HCO))=5.0×10-11,c(CO)∶c(HCO)=1∶2时,c(H+)=5.0×10-11×2=1×10-10 mol·L-1,溶液pH=10,B正确;进入再生塔的KHCO3溶液呈碱性,c(H+)<1.0×10-7,Ka1=eq \f(c(H+)·c(HCO),c(H2CO3))=4.6×10-7,则eq \f(c(HCO),c(H2CO3))=>=4.6,则所得到的溶液中可能存在:c(H2CO3)<c(HCO),C不正确;再生塔中发生反应的化学方程式:2KHCO3K2CO3+H2O+CO2↑,D不正确。故选B。
6. C 解析:H3PO4溶液中含P微粒有H3PO4、H2PO、HPO、PO。由图示可知,随着pOH减小,溶液碱性增强,H3PO4浓度减小,H2PO、HPO浓度先增加后减小,PO浓度逐渐增大,故曲线①表示pc(PO)随pOH的变化,曲线②表示pc(HPO)随pOH的变化,曲线③表示pc(H2PO)随pOH的变化,曲线④表示pc(H3PO4),并可写出H3PO4平衡常数的表达式Ka1=eq \f(c(H2PO)·c(H+),c(H3PO4)),Ka2=eq \f(c(HPO)·c(H+),c(H2PO)),Ka3=eq \f(c(PO)·c(H+),c(HPO))。曲线③表示pc(H2PO)随pOH的变化,故A正确;图中z(11.98,-2.3),此时pc(H2PO)=pc(H3PO4),当pOH=11.98时,即c(H+)=10-2.02时,c(H2PO)=c(H3PO4),则Ka1=eq \f(c(H2PO)·c(H+),c(H3PO4))=c(H+)=10-2.02;根据图中y(9.38,-4.5)知当pOH=9.38时,pc(HPO)=pc(H3PO4),即当c(H+)=10-4.62时,c(HPO)=c(H3PO4),则Ka1·Ka2=eq \f(c(H2PO)·c(H+),c(H3PO4))·eq \f(c(HPO)·c(H+),c(H2PO))=c2(H+)=(10-4.62)2=10-9.24,Ka2=eq \f(c(HPO)·c(H+),c(H2PO))===10-7.22≈10-7.2,当c(H2PO)=c(HPO)时Ka2=c(H+)≈10-7.2,溶液的pH约为7.2,故B正确;y点溶液中c(H2PO)>c(H3PO4),根据P原子守恒可知c(HPO)+c(H3PO4)+c(H2PO)+c(PO)=0.01 mol·L-1,c(HPO)+2c(H2PO)+c(PO)>0.01 mol·L-1,c(HPO)>0.01 mol·L-1-2c(H2PO)-c(PO),故C错误;NaH2PO4溶液中Kh(H2PO)===10-11.98,Ka2≈10-7.2,Kh(H2PO)
7. D 解析:实验1得到H2SO3溶液,实验2溶液的pH为4,实验2为NaHSO3溶液,实验3中SO2和酸性KMnO4溶液反应的离子方程式为:5SO2+2MnO+2H2O===5SO+2Mn2++4H+。实验1得到H2SO3溶液,其电荷守恒关系式为:c(HSO)+2c(SO)+c(OH-)=c(H+),则c(HSO)+c(SO)
8. C 解析:由电离常数可知,亚硫酸氢根离子在溶液中的水解常数Kh==<Ka2(H2SO3)=1.0×10-7,则亚硫酸氢铵溶液中亚硫酸氢根离子在溶液中的电离程度大于水解程度;同理可知,铵根离子在溶液中的水解常数Kh==<Ka2(H2SO3)=1.0×10-7,说明亚硫酸氢根离子在溶液中的电离抑制铵根离子的水解,则溶液中离子浓度大小顺序为c(NH)>c(HSO)>c(SO);由图可知,脱硫过程发生的反应为一水合氨与烟气中的二氧化硫反应生成亚硫酸氢铵和可以排放的烟气;制备过程发生的反应为亚硫酸氢铵溶液与亚硝酸铵和二氧化硫反应生成硫酸羟胺和硫酸。温度越高,气体的溶解度越小,则“脱硫”过程中温度越高,二氧化硫的溶解度越小,“脱硫”速率越慢,故A错误;由分析可知,亚硫酸氢铵溶液中离子浓度大小顺序为c(NH)>c(HSO)>c(SO),故B错误;由分析可知,亚硫酸氢铵溶液中亚硫酸氢根离子浓度大于硫酸根离子浓度,溶液中存在质子守恒关系c(NH3·H2O)+c(SO)+c(OH-)=c(H2SO3)+c(H+),则溶液中c(NH3·H2O)+c(HSO)+c(OH-)>c(NH3·H2O)+c(SO)+c(OH-)=c(H2SO3)+c(H+),故C正确;由分析可知,制备过程发生的反应为亚硫酸氢铵溶液与亚硝酸铵和二氧化硫反应生成硫酸羟胺和硫酸,反应的离子方程式为NO+HSO+SO2+2H2O===NH3OH++2SO+H+,故D错误。故选C。
9. (1)AC
(2)9.4×10-4
解析:(1)pH>4.4时,甲基橙为黄色,故加入甲基橙溶液后,溶液均呈黄色,A正确;由于水会电离出OH-,故浓度为c(OH-)>c(CO),B错误;由质子守恒可得c(H+)+c(H2CO3)=c(CO)+c(OH-),C正确;由物料守恒可得:c(Na+)=c(H2CO3)+c(HCO)+c(CO),D错误;故答案为AC;
(2)Ka2=eq \f(c(H+)·c(CO),c(HCO)),0.1 mol·L-1的NaHCO3溶液中,pH=8.3,则c(H+)=10-8.3 mol·L-1,c(HCO)约为0.1 mol·L-1,代入Ka2表达式可得Ka2=eq \f(c(H+)·c(CO),c(HCO))=eq \f(10-8.3×c(CO),0.1)=4.7×10-11,得c(CO)=9.4×10-4 mol·L-1。
同课章节目录
