有关质量守恒定律的计算高频考点 归纳练 2025年中考化学三轮复习备考
文档属性
| 名称 | 有关质量守恒定律的计算高频考点 归纳练 2025年中考化学三轮复习备考 |  | |
| 格式 | docx | ||
| 文件大小 | 504.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 18:03:30 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
有关质量守恒定律的计算高频考点 归纳练
2025年中考化学三轮复习备考
1.化学小组的同学为测定实验室里一瓶过氧化氢溶液中溶质的质量分数,进行了相关实验,反应的化学方程式为,测得的实验数据记录如表所示。
反应前物质的质量/g 充分反应后固液剩余物总质量/g
过氧化氢溶液 二氧化锰质量
34.0 2.0 35.2
请计算:
(1)生成氧气质量为 g。
(2)此过氧化氢溶液的溶质质量分数(写出计算过程)。
2.鸡蛋壳的主要成分是碳酸钙。兴趣小组同学用它来测定某瓶标签破损的稀盐酸中溶质的质量分数。称取6.0g干燥的鸡蛋壳(杂质不参加反应)于烧杯中,再将60g样品稀盐酸分3次加入,充分反应后得到实验数据如下:
第一次 第二次 第三次
稀盐酸的质量/g 20 20 20
剩余固体的质量/g 3.0 0.6 0.6
请计算:
(1)6.0g鸡蛋壳中碳酸钙的质量为 g。
(2)该稀盐酸中溶质的质量分数是多少?
3.实验室有一瓶标签破损的过氧化氢溶液,小刚为测定该过氧化氢溶液的溶质质量分数,将68g该过氧化氢溶液和2g硫酸铜(催化剂)放入烧杯中,测定不同时间内烧杯及烧杯内物质的总质量,记录数据如下表:
时间/min 0 T1 T2 T3 T4
烧杯及烧杯内物质的总质量/g 102.0 101.3 100.8 100.4 100.4
(1)T3时烧杯溶液中的溶质为 (填化学式)。
(2)该过氧化氢溶液的溶质质量分数 。(要求有必要的化学方程式和计算步骤)
4.某公司生产的新型融雪剂,其成分是无水和少量的,为测定的含量,同学称取该样品,加水充分溶解得到溶液,然后取一定质量分数的溶液分五次加入,充分振荡,实验数据见表。请根据表格数据和图像信息完成下列问题:
实验编号 1 2 3 4 5
加入溶液的质量/g 20 20 20 25 25
生成沉淀的质量/g 2.5 5.0 7.5 10 X
(1)X= ,a= 。
(2)A点所示溶液的溶质为 (填化学式)。
(3)样品中的质量分数(写出计算过程,计算结果精确至0.1%)。
5.古人早就掌握了炼铜的工艺,他们将孔雀石【主要成分是Cu2(OH)2CO3】和木炭一起加热得到红色的铜。兴趣小组为测定某孔雀石中Cu2(OH)2CO3的质量分数,进行下图所示实验,实验中反应的化学方程式为,假设杂质都不与稀硫酸发生反应。
(1)生成气体的质量为 g。
(2)求该孔雀石中Cu2(OH)2CO3的质量分数(写出计算过程)。
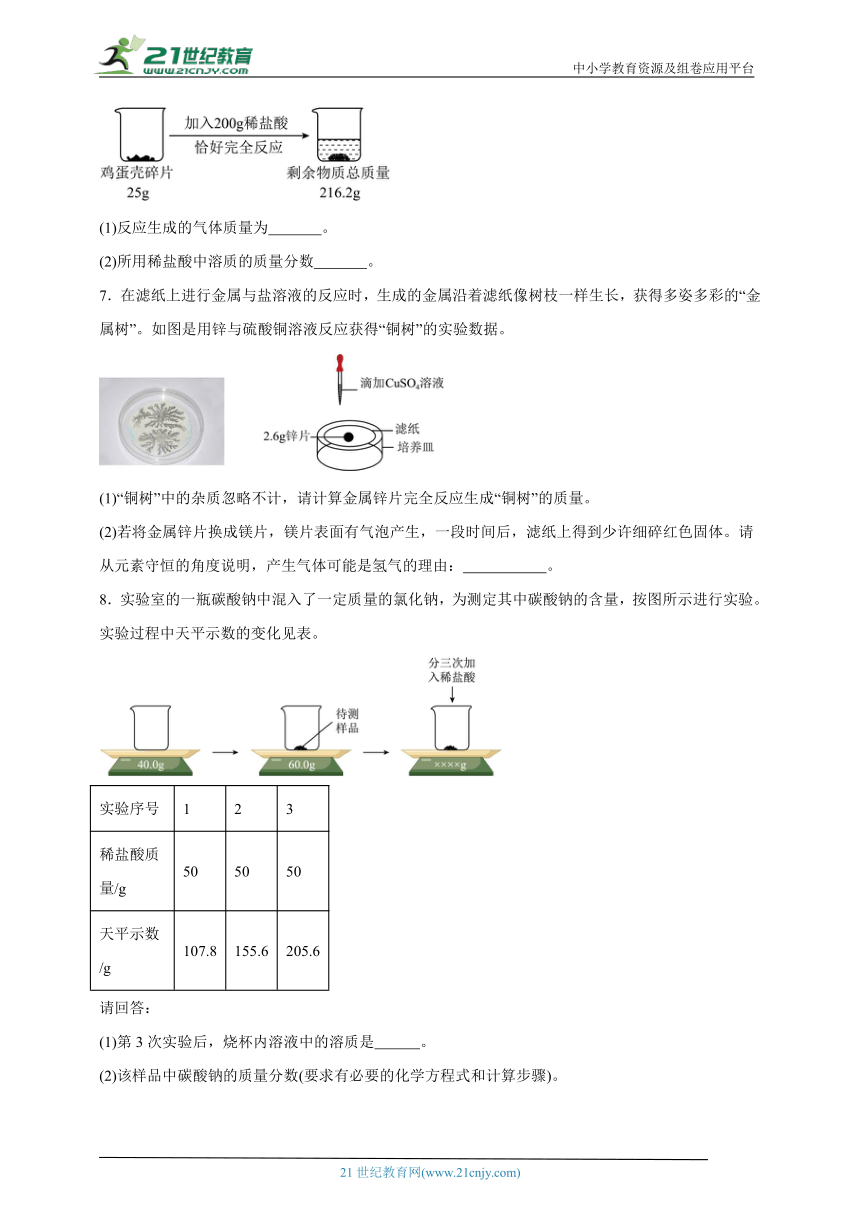
6.化学实验室开放日活动中,同学们欲利用鸡蛋壳中的碳酸钙测定稀盐酸中溶质的质量分数,按照下图操作进行实验(鸡蛋壳中的杂质不溶于水也不与稀盐酸反应)。分析并计算:
(1)反应生成的气体质量为 。
(2)所用稀盐酸中溶质的质量分数 。
7.在滤纸上进行金属与盐溶液的反应时,生成的金属沿着滤纸像树枝一样生长,获得多姿多彩的“金属树”。如图是用锌与硫酸铜溶液反应获得“铜树”的实验数据。
(1)“铜树”中的杂质忽略不计,请计算金属锌片完全反应生成“铜树”的质量。
(2)若将金属锌片换成镁片,镁片表面有气泡产生,一段时间后,滤纸上得到少许细碎红色固体。请从元素守恒的角度说明,产生气体可能是氢气的理由: 。
8.实验室的一瓶碳酸钠中混入了一定质量的氯化钠,为测定其中碳酸钠的含量,按图所示进行实验。实验过程中天平示数的变化见表。
实验序号 1 2 3
稀盐酸质量/g 50 50 50
天平示数/g 107.8 155.6 205.6
请回答:
(1)第3次实验后,烧杯内溶液中的溶质是 。
(2)该样品中碳酸钠的质量分数(要求有必要的化学方程式和计算步骤)。
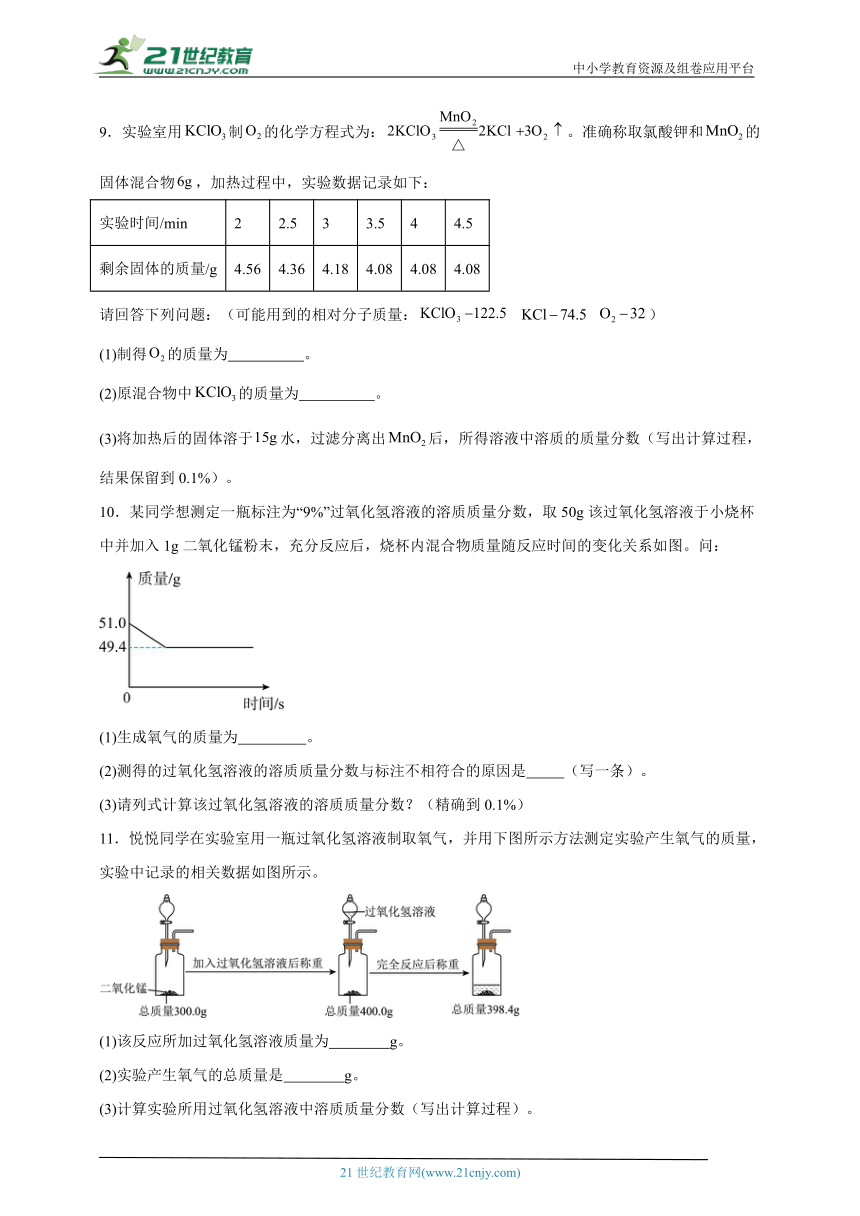
9.实验室用制的化学方程式为:。准确称取氯酸钾和的固体混合物,加热过程中,实验数据记录如下:
实验时间/min 2 2.5 3 3.5 4 4.5
剩余固体的质量/g 4.56 4.36 4.18 4.08 4.08 4.08
请回答下列问题:(可能用到的相对分子质量: )
(1)制得的质量为 。
(2)原混合物中的质量为 。
(3)将加热后的固体溶于水,过滤分离出后,所得溶液中溶质的质量分数(写出计算过程,结果保留到0.1%)。
10.某同学想测定一瓶标注为“9%”过氧化氢溶液的溶质质量分数,取50g该过氧化氢溶液于小烧杯中并加入1g二氧化锰粉末,充分反应后,烧杯内混合物质量随反应时间的变化关系如图。问:
(1)生成氧气的质量为 。
(2)测得的过氧化氢溶液的溶质质量分数与标注不相符合的原因是 (写一条)。
(3)请列式计算该过氧化氢溶液的溶质质量分数?(精确到0.1%)
11.悦悦同学在实验室用一瓶过氧化氢溶液制取氧气,并用下图所示方法测定实验产生氧气的质量,实验中记录的相关数据如图所示。
(1)该反应所加过氧化氢溶液质量为 g。
(2)实验产生氧气的总质量是 g。
(3)计算实验所用过氧化氢溶液中溶质质量分数(写出计算过程)。
12.鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的质量分数,该小组同学进行如下实验,将鸡蛋壳洗净、捣碎后准确称量12.5g,全部投入足量稀盐酸中,电子秤的示数变化情况如图:
(说明:忽略二氧化碳溶于水对实验结果的影响;假设其它物质不溶于水,也不与稀盐酸反应)
(1)捣碎鸡蛋壳的目的是增大反应物的 。
(2)蛋壳中的碳酸钙与盐酸反应生成二氧化碳的质量是 g.
(3)计算蛋壳中碳酸钙的质量分数。
参考答案
1.(1)0.8
(2)解:设过氧化氢溶液中溶质的质量为x。
解得:x=1.7g
则此过氧化氢溶液的溶质质量分数为
答:此过氧化氢溶液的溶质质量分数为5%。
(1)根据质量守恒定律,反应生成氧气的质量为,故填:0.8;
(2)详见答案。
2.(1)5.4
(2)解:第一次加入20g稀盐酸,稀盐酸恰好与6g-3g=3g碳酸钙完全反应;
设20g稀盐酸中溶质HCl的质量为x,
x=2.19g
该稀盐酸中溶质的质量分数是
答:该盐酸中HCl质量分数约为10.95%。
(1)鸡蛋壳主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,杂质不参与反应,最终剩余固体的质量0.6g即为6.0g鸡蛋壳中杂质的质量,则6.0g鸡蛋壳中碳酸钙的质量为6g-0.6g=5.4g;
(2)见答案。
3.(1)CuSO4
(2)根据质量守恒定律, 化学反应前后物质的总质量不变,则生成氧气的质量为:102.0g-100.4g=1.6g
解:设该过氧化氢溶液的溶质质量分数为x
x=5%
答:该过氧化氢溶液的溶质质量分数为5%
(1)过氧化氢在硫酸铜的催化下分解生成水和氧气,在该反应中,硫酸铜是催化剂,化学反应前后催化剂的质量和化学性质不变,由表可知,T3时和T4时,烧杯及烧杯内物质的总质量相等,说明T3时,过氧化氢已经完全反应,则此时溶液中的溶质是硫酸铜,化学式为:CuSO4;
(2)见答案。
4.(1) 10 120
(2)NaCl、Na2CO3
(3)解:设12g样品中氯化钙的质量为x。
x=11.1g
则样品中的质量分数为
答:样品中氯化钙的质量分数为92.5%。
(1)由表中的数据对比可知,前3次每加入20g碳酸钠溶液,生成沉淀质量2.5g,第4次加入25g碳酸钠,生成沉淀10g-7.5g=2.5g,说明第4次碳酸钠过量,且第4次参加反应的碳酸钠溶液的质量为20g,此时氯化钙已经完全反应,故生成的沉淀质量最多10g,即X=10;
分析图像可知,a点之前和之后溶液质量增加的幅度不一样,则a点表示氯化钙反应完全,根据质量守恒定律,恰好完全反应时所得溶液质量为50g+20g×4-10g=120g,即a=120;
(2)碳酸钠和氯化钙生成碳酸钙沉淀和氯化钠,A点在a点之后,此时碳酸钠溶液过量,对应溶液的溶质为碳酸钠和氯化钠,化学式分别是NaCl、Na2CO3;
(3)见答案。
5.(1)4.4
(2)解:设25g孔雀石样品中Cu2(OH)2CO3的质量为x。
x=22.2g
该孔雀石中Cu2(OH)2CO3的质量分数为:
答:该孔雀石中Cu2(OH)2CO3的质量分数为88.8%。
(1)由反应的化学方程式可知,反应中生成二氧化碳,二氧化碳逸出。根据质量守恒定律,反应中生成的二氧化碳质量为:25g+200g-220.6g=4.4g。
(2)根据反应生成的二氧化碳质量计算出孔雀石样品中Cu2(OH)2CO3的质量,然后计算出该孔雀石中Cu2(OH)2CO3的质量分数。详见答案。
6.(1)8.8g
(2)解:设参加反应的盐酸溶质质量为x
所用稀盐酸中溶质的质量分数为:
答:所用稀盐酸中溶质的质量分数为7.3%。
(1)根据质量守恒定律,反应生成的气体质量为:25g+200g-216.2g=8.8g;
(2)见答案。
7.(1)设生成“铜树”的质量为x,则
解得x=2.56g
答:生成“铜树”的质量为2.56g。
(2)镁和硫酸铜溶液反应,硫酸铜溶液中含有氢元素,根据质量守恒定律可知,化学反应前后元素的种类不变,所以产生的气体可能是氢气
(1)见答案。
(2)镁和硫酸铜溶液反应,硫酸铜溶液中含有氢元素,根据质量守恒定律可知,化学反应前后元素的种类不变,所以产生的气体可能是氢气。
8.(1)NaCl、HCl
(2)解:根据质量守恒定律,生成二氧化碳的质量为60g+50g×3-205.6g=4.4g;
设样品中碳酸钠的质量为x。
解得:x=10.6g
该样品中碳酸钠的质量分数为,
答:该样品中碳酸钠的质量分数为53%。
(1)碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,根据数据可知,第1次加入50g稀盐酸,生成气体的质量为:60g+50g-107.8g=2.2g;
第2次加入50g稀盐酸,生成气体的质量为:107.8g+50g-155.6g=2.2g;
第3次加入50g稀盐酸,155.6g+50g=205.6g,稀盐酸溶液的质量增大,说明第3次加入50g稀盐酸,没有生成气体,即碳酸钠已经反应完全,且稀盐酸过量,因此第3次实验后,烧杯内溶液中的溶质是氯化钠和氯化氢,化学式为:NaCl、HCl;
(2)见答案。
9.(1)1.92g
(2)4.9g
(3)解:设反应生成的KCl质量为y
y=2.98g
答:所得溶液中溶质的质量分数为16.6%。
(1)氯酸钾在二氧化锰催化作用、加热条件下分解生成氯化钾、氧气,化学方程式为。根据质量守恒定律,反应前后物质的总质量不变。反应前固体混合物质量为6g,根据表格信息可知反应后剩余固体质量为4.08g,所以制得氧气的质量为。
(2)设原混合物中的质量为x
x=4.9g
(3)根据氧气的质量计算,见答案。
10.(1)1.6g
(2)过氧化氢易分解生成水和氧气
(3)解:设该过氧化氢溶液的溶质质量分数为x
x=6.8%
答:该过氧化氢溶液的溶质质量分数为6.8%
(1)根据质量守恒定律,化学反应前后物质的总质量不变,则生成氧气的质量为:51.0g-49.4g=1.6g;
(2)测得的过氧化氢溶液的溶质质量分数与标注不相符合的原因是:过氧化氢易分解生成水和氧气;
(3)见答案。
11.(1)100.0
(2)1.6
(3)设:实验所用过氧化氢溶液中溶质质量分数x。
x=3.4%
答:实验所用过氧化氢溶液中溶质质量分数为3.4%。
(1)由图可知,加入过氧化氢溶液前的总质量为300.0g,反应前过氧化氢溶液和锥形瓶的总质量为400.0g,所以该反应所加过氧化氢溶液质量为400.0g 300.0g=100g;
(2)根据质量守恒定律,反应前后物质的总质量不变。反应前过氧化氢溶液和锥形瓶总质量为400.0g,反应后剩余物质和锥形瓶总质量为398.4g,所以实验产生氧气的总质量为400.0g 398.4g=1.6g;
(3)见答案。
12.(1)接触面积
(2)4.4
(3)设12.5g蛋壳中碳酸钙的质量为x,则
解得x=10g
则蛋壳中碳酸钙的质量分数为
答:蛋壳中碳酸钙的质量分数为80%。
(1)捣碎鸡蛋壳,能增大反应物的接触面积,从而反应更充分。
(2)根据反应前后物质的总质量不变,则生成二氧化碳的质量为160g+12.5g-168.1g=4.4g。
(3)见答案。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
有关质量守恒定律的计算高频考点 归纳练
2025年中考化学三轮复习备考
1.化学小组的同学为测定实验室里一瓶过氧化氢溶液中溶质的质量分数,进行了相关实验,反应的化学方程式为,测得的实验数据记录如表所示。
反应前物质的质量/g 充分反应后固液剩余物总质量/g
过氧化氢溶液 二氧化锰质量
34.0 2.0 35.2
请计算:
(1)生成氧气质量为 g。
(2)此过氧化氢溶液的溶质质量分数(写出计算过程)。
2.鸡蛋壳的主要成分是碳酸钙。兴趣小组同学用它来测定某瓶标签破损的稀盐酸中溶质的质量分数。称取6.0g干燥的鸡蛋壳(杂质不参加反应)于烧杯中,再将60g样品稀盐酸分3次加入,充分反应后得到实验数据如下:
第一次 第二次 第三次
稀盐酸的质量/g 20 20 20
剩余固体的质量/g 3.0 0.6 0.6
请计算:
(1)6.0g鸡蛋壳中碳酸钙的质量为 g。
(2)该稀盐酸中溶质的质量分数是多少?
3.实验室有一瓶标签破损的过氧化氢溶液,小刚为测定该过氧化氢溶液的溶质质量分数,将68g该过氧化氢溶液和2g硫酸铜(催化剂)放入烧杯中,测定不同时间内烧杯及烧杯内物质的总质量,记录数据如下表:
时间/min 0 T1 T2 T3 T4
烧杯及烧杯内物质的总质量/g 102.0 101.3 100.8 100.4 100.4
(1)T3时烧杯溶液中的溶质为 (填化学式)。
(2)该过氧化氢溶液的溶质质量分数 。(要求有必要的化学方程式和计算步骤)
4.某公司生产的新型融雪剂,其成分是无水和少量的,为测定的含量,同学称取该样品,加水充分溶解得到溶液,然后取一定质量分数的溶液分五次加入,充分振荡,实验数据见表。请根据表格数据和图像信息完成下列问题:
实验编号 1 2 3 4 5
加入溶液的质量/g 20 20 20 25 25
生成沉淀的质量/g 2.5 5.0 7.5 10 X
(1)X= ,a= 。
(2)A点所示溶液的溶质为 (填化学式)。
(3)样品中的质量分数(写出计算过程,计算结果精确至0.1%)。
5.古人早就掌握了炼铜的工艺,他们将孔雀石【主要成分是Cu2(OH)2CO3】和木炭一起加热得到红色的铜。兴趣小组为测定某孔雀石中Cu2(OH)2CO3的质量分数,进行下图所示实验,实验中反应的化学方程式为,假设杂质都不与稀硫酸发生反应。
(1)生成气体的质量为 g。
(2)求该孔雀石中Cu2(OH)2CO3的质量分数(写出计算过程)。
6.化学实验室开放日活动中,同学们欲利用鸡蛋壳中的碳酸钙测定稀盐酸中溶质的质量分数,按照下图操作进行实验(鸡蛋壳中的杂质不溶于水也不与稀盐酸反应)。分析并计算:
(1)反应生成的气体质量为 。
(2)所用稀盐酸中溶质的质量分数 。
7.在滤纸上进行金属与盐溶液的反应时,生成的金属沿着滤纸像树枝一样生长,获得多姿多彩的“金属树”。如图是用锌与硫酸铜溶液反应获得“铜树”的实验数据。
(1)“铜树”中的杂质忽略不计,请计算金属锌片完全反应生成“铜树”的质量。
(2)若将金属锌片换成镁片,镁片表面有气泡产生,一段时间后,滤纸上得到少许细碎红色固体。请从元素守恒的角度说明,产生气体可能是氢气的理由: 。
8.实验室的一瓶碳酸钠中混入了一定质量的氯化钠,为测定其中碳酸钠的含量,按图所示进行实验。实验过程中天平示数的变化见表。
实验序号 1 2 3
稀盐酸质量/g 50 50 50
天平示数/g 107.8 155.6 205.6
请回答:
(1)第3次实验后,烧杯内溶液中的溶质是 。
(2)该样品中碳酸钠的质量分数(要求有必要的化学方程式和计算步骤)。
9.实验室用制的化学方程式为:。准确称取氯酸钾和的固体混合物,加热过程中,实验数据记录如下:
实验时间/min 2 2.5 3 3.5 4 4.5
剩余固体的质量/g 4.56 4.36 4.18 4.08 4.08 4.08
请回答下列问题:(可能用到的相对分子质量: )
(1)制得的质量为 。
(2)原混合物中的质量为 。
(3)将加热后的固体溶于水,过滤分离出后,所得溶液中溶质的质量分数(写出计算过程,结果保留到0.1%)。
10.某同学想测定一瓶标注为“9%”过氧化氢溶液的溶质质量分数,取50g该过氧化氢溶液于小烧杯中并加入1g二氧化锰粉末,充分反应后,烧杯内混合物质量随反应时间的变化关系如图。问:
(1)生成氧气的质量为 。
(2)测得的过氧化氢溶液的溶质质量分数与标注不相符合的原因是 (写一条)。
(3)请列式计算该过氧化氢溶液的溶质质量分数?(精确到0.1%)
11.悦悦同学在实验室用一瓶过氧化氢溶液制取氧气,并用下图所示方法测定实验产生氧气的质量,实验中记录的相关数据如图所示。
(1)该反应所加过氧化氢溶液质量为 g。
(2)实验产生氧气的总质量是 g。
(3)计算实验所用过氧化氢溶液中溶质质量分数(写出计算过程)。
12.鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的质量分数,该小组同学进行如下实验,将鸡蛋壳洗净、捣碎后准确称量12.5g,全部投入足量稀盐酸中,电子秤的示数变化情况如图:
(说明:忽略二氧化碳溶于水对实验结果的影响;假设其它物质不溶于水,也不与稀盐酸反应)
(1)捣碎鸡蛋壳的目的是增大反应物的 。
(2)蛋壳中的碳酸钙与盐酸反应生成二氧化碳的质量是 g.
(3)计算蛋壳中碳酸钙的质量分数。
参考答案
1.(1)0.8
(2)解:设过氧化氢溶液中溶质的质量为x。
解得:x=1.7g
则此过氧化氢溶液的溶质质量分数为
答:此过氧化氢溶液的溶质质量分数为5%。
(1)根据质量守恒定律,反应生成氧气的质量为,故填:0.8;
(2)详见答案。
2.(1)5.4
(2)解:第一次加入20g稀盐酸,稀盐酸恰好与6g-3g=3g碳酸钙完全反应;
设20g稀盐酸中溶质HCl的质量为x,
x=2.19g
该稀盐酸中溶质的质量分数是
答:该盐酸中HCl质量分数约为10.95%。
(1)鸡蛋壳主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,杂质不参与反应,最终剩余固体的质量0.6g即为6.0g鸡蛋壳中杂质的质量,则6.0g鸡蛋壳中碳酸钙的质量为6g-0.6g=5.4g;
(2)见答案。
3.(1)CuSO4
(2)根据质量守恒定律, 化学反应前后物质的总质量不变,则生成氧气的质量为:102.0g-100.4g=1.6g
解:设该过氧化氢溶液的溶质质量分数为x
x=5%
答:该过氧化氢溶液的溶质质量分数为5%
(1)过氧化氢在硫酸铜的催化下分解生成水和氧气,在该反应中,硫酸铜是催化剂,化学反应前后催化剂的质量和化学性质不变,由表可知,T3时和T4时,烧杯及烧杯内物质的总质量相等,说明T3时,过氧化氢已经完全反应,则此时溶液中的溶质是硫酸铜,化学式为:CuSO4;
(2)见答案。
4.(1) 10 120
(2)NaCl、Na2CO3
(3)解:设12g样品中氯化钙的质量为x。
x=11.1g
则样品中的质量分数为
答:样品中氯化钙的质量分数为92.5%。
(1)由表中的数据对比可知,前3次每加入20g碳酸钠溶液,生成沉淀质量2.5g,第4次加入25g碳酸钠,生成沉淀10g-7.5g=2.5g,说明第4次碳酸钠过量,且第4次参加反应的碳酸钠溶液的质量为20g,此时氯化钙已经完全反应,故生成的沉淀质量最多10g,即X=10;
分析图像可知,a点之前和之后溶液质量增加的幅度不一样,则a点表示氯化钙反应完全,根据质量守恒定律,恰好完全反应时所得溶液质量为50g+20g×4-10g=120g,即a=120;
(2)碳酸钠和氯化钙生成碳酸钙沉淀和氯化钠,A点在a点之后,此时碳酸钠溶液过量,对应溶液的溶质为碳酸钠和氯化钠,化学式分别是NaCl、Na2CO3;
(3)见答案。
5.(1)4.4
(2)解:设25g孔雀石样品中Cu2(OH)2CO3的质量为x。
x=22.2g
该孔雀石中Cu2(OH)2CO3的质量分数为:
答:该孔雀石中Cu2(OH)2CO3的质量分数为88.8%。
(1)由反应的化学方程式可知,反应中生成二氧化碳,二氧化碳逸出。根据质量守恒定律,反应中生成的二氧化碳质量为:25g+200g-220.6g=4.4g。
(2)根据反应生成的二氧化碳质量计算出孔雀石样品中Cu2(OH)2CO3的质量,然后计算出该孔雀石中Cu2(OH)2CO3的质量分数。详见答案。
6.(1)8.8g
(2)解:设参加反应的盐酸溶质质量为x
所用稀盐酸中溶质的质量分数为:
答:所用稀盐酸中溶质的质量分数为7.3%。
(1)根据质量守恒定律,反应生成的气体质量为:25g+200g-216.2g=8.8g;
(2)见答案。
7.(1)设生成“铜树”的质量为x,则
解得x=2.56g
答:生成“铜树”的质量为2.56g。
(2)镁和硫酸铜溶液反应,硫酸铜溶液中含有氢元素,根据质量守恒定律可知,化学反应前后元素的种类不变,所以产生的气体可能是氢气
(1)见答案。
(2)镁和硫酸铜溶液反应,硫酸铜溶液中含有氢元素,根据质量守恒定律可知,化学反应前后元素的种类不变,所以产生的气体可能是氢气。
8.(1)NaCl、HCl
(2)解:根据质量守恒定律,生成二氧化碳的质量为60g+50g×3-205.6g=4.4g;
设样品中碳酸钠的质量为x。
解得:x=10.6g
该样品中碳酸钠的质量分数为,
答:该样品中碳酸钠的质量分数为53%。
(1)碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,根据数据可知,第1次加入50g稀盐酸,生成气体的质量为:60g+50g-107.8g=2.2g;
第2次加入50g稀盐酸,生成气体的质量为:107.8g+50g-155.6g=2.2g;
第3次加入50g稀盐酸,155.6g+50g=205.6g,稀盐酸溶液的质量增大,说明第3次加入50g稀盐酸,没有生成气体,即碳酸钠已经反应完全,且稀盐酸过量,因此第3次实验后,烧杯内溶液中的溶质是氯化钠和氯化氢,化学式为:NaCl、HCl;
(2)见答案。
9.(1)1.92g
(2)4.9g
(3)解:设反应生成的KCl质量为y
y=2.98g
答:所得溶液中溶质的质量分数为16.6%。
(1)氯酸钾在二氧化锰催化作用、加热条件下分解生成氯化钾、氧气,化学方程式为。根据质量守恒定律,反应前后物质的总质量不变。反应前固体混合物质量为6g,根据表格信息可知反应后剩余固体质量为4.08g,所以制得氧气的质量为。
(2)设原混合物中的质量为x
x=4.9g
(3)根据氧气的质量计算,见答案。
10.(1)1.6g
(2)过氧化氢易分解生成水和氧气
(3)解:设该过氧化氢溶液的溶质质量分数为x
x=6.8%
答:该过氧化氢溶液的溶质质量分数为6.8%
(1)根据质量守恒定律,化学反应前后物质的总质量不变,则生成氧气的质量为:51.0g-49.4g=1.6g;
(2)测得的过氧化氢溶液的溶质质量分数与标注不相符合的原因是:过氧化氢易分解生成水和氧气;
(3)见答案。
11.(1)100.0
(2)1.6
(3)设:实验所用过氧化氢溶液中溶质质量分数x。
x=3.4%
答:实验所用过氧化氢溶液中溶质质量分数为3.4%。
(1)由图可知,加入过氧化氢溶液前的总质量为300.0g,反应前过氧化氢溶液和锥形瓶的总质量为400.0g,所以该反应所加过氧化氢溶液质量为400.0g 300.0g=100g;
(2)根据质量守恒定律,反应前后物质的总质量不变。反应前过氧化氢溶液和锥形瓶总质量为400.0g,反应后剩余物质和锥形瓶总质量为398.4g,所以实验产生氧气的总质量为400.0g 398.4g=1.6g;
(3)见答案。
12.(1)接触面积
(2)4.4
(3)设12.5g蛋壳中碳酸钙的质量为x,则
解得x=10g
则蛋壳中碳酸钙的质量分数为
答:蛋壳中碳酸钙的质量分数为80%。
(1)捣碎鸡蛋壳,能增大反应物的接触面积,从而反应更充分。
(2)根据反应前后物质的总质量不变,则生成二氧化碳的质量为160g+12.5g-168.1g=4.4g。
(3)见答案。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
