福建卷__2025届高考化学考前冲刺卷(含解析)
文档属性
| 名称 | 福建卷__2025届高考化学考前冲刺卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 21:58:45 | ||
图片预览




文档简介
2025届高考化学考前冲刺卷
化学(福建专版) 分值:100分 时间:75分钟
可能用到的相对原子质量:H—1、C—12、O—16、V—51、Cr—52
一、选择题:本题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“天眸芯”、“梦想”号等彰显了我国科技发展的巨大成就。下列说法错误的是( )
A.首款基于原语的类脑互补视觉芯片“天眸芯”:用来制芯片的单质Si属于共价晶体
B.首艘大洋钻探船“梦想”号正式入列:勘探的天然气水合物中构成水分子笼的水分子之间以氢键连接
C.为无液氦极低温制冷提供新方案:氦原子稳定的原因是最外层电子完全填满,结构稳定
D.拟建立的太空发电站实验性平台“太原一号”卫星:其光伏发电系统可将化学能转化为电能
2.化合物C可由化合物A和B发生如下反应生成。下列说法错误的是( )
A.化合物A和C可由红外光谱进行鉴别
B.化合物C分子中所有碳原子可能在同一平面内
C.化合物B存在对映异构体
D.化合物C既能与盐酸反应,又能与氢氧化钠溶液反应
3.某离子液体的结构如图所示,其阴离子能与纤维素中的羟基形成氢键,对纤维素有很好的溶解性。W、X、Y、Z、Q是原子序数依次增大的短周期主族元素,其中Y是组成有机物的基本骨架元素。下列说法正确的是( )
A.第一电离能:Y>Z
B.阴离子中X不满足8电子稳定结构
C.氢化物的沸点:Z>Y
D.WQ属于酸,但能与某些酸性氧化物反应
4.金,银,铜是电脑,手机等电子线路中不可或缺的材料。从废旧电子材料中回收Au等可实现贵金属资源的再利用。如图是从废旧CPU中回收的一种工艺流程。已知:王水与Au的反应为。下列说法错误的是( )
A.在实验室中,步骤①应在通风橱中进行
B.步骤②用浓HCl和也可使Au溶解
C.配离子在溶液中能完全电离出
D.为实现步骤③中的转化,可尝试加入
5.可与等形成配离子使溶液显不同的颜色。如:为浅紫色,为红色,为无色。某同学按如下步骤进行实验并观察到的现象如下:
已知与在溶液中存在以下平衡,。
下列说法错误的是( )
A.和中共价键数目之比为2:1
B.溶液I呈黄色可能是由水解产物的颜色引起的
C.由上述实验现象可知平衡常数
D.与形成时,O提供孤对电子
6.实验室可用与浓硫酸反应制HF,反应方程式为。为阿伏加德罗常数的值。下列说法正确的是( )
A.1mol中含有的离子数为
B.中含有O原子的数目为
C.标准状况下,2.24LHF中含有的分子数为
D.该反应中每生成1molHF,转移电子数为
7.由下列事实或现象能得出相应结论的是( )
选项 事实或现象 结论
A 向水溶液中加入乙醇,析出蓝色晶体 乙醇的极性比水的极性
B 在中加入浓醋酸,并将反应后的气体通入苯酚钠溶液中,溶液变浑浊 弱酸性:碳酸>苯酚
C 向等物质的量浓度的混合溶液中滴加溶液,先生成AgCl白色沉淀
D 为基元反应,将盛有的密闭烧瓶浸入冷水,红棕色变浅 正反应活化能大于逆反应活化能
A.A B.B C.C D.D
8.下列实验操作、现象及对应目的或结论都正确的是( )
选项 实验操作、现象 目的或结论
A 将乙烯和甲烷的混合气体先通入酸性溶液,再依次通入浓NaOH溶液,浓硫酸 除去甲烷中的
B 向和KSCN的混合溶液中滴入酸化的溶液,溶液变红 乙烯氧化性:
C 向KI-淀粉溶液中加入,溶液先变蓝后褪色 淀粉发生胶体聚沉
D 以酸化的3%NaCl溶液作电解质溶液设计铁锌原电池。工作一段时间后,向Fe电极区域滴入2滴溶液,产生蓝色沉淀 验证牺牲阳极法
A.A B.B C.C D.D
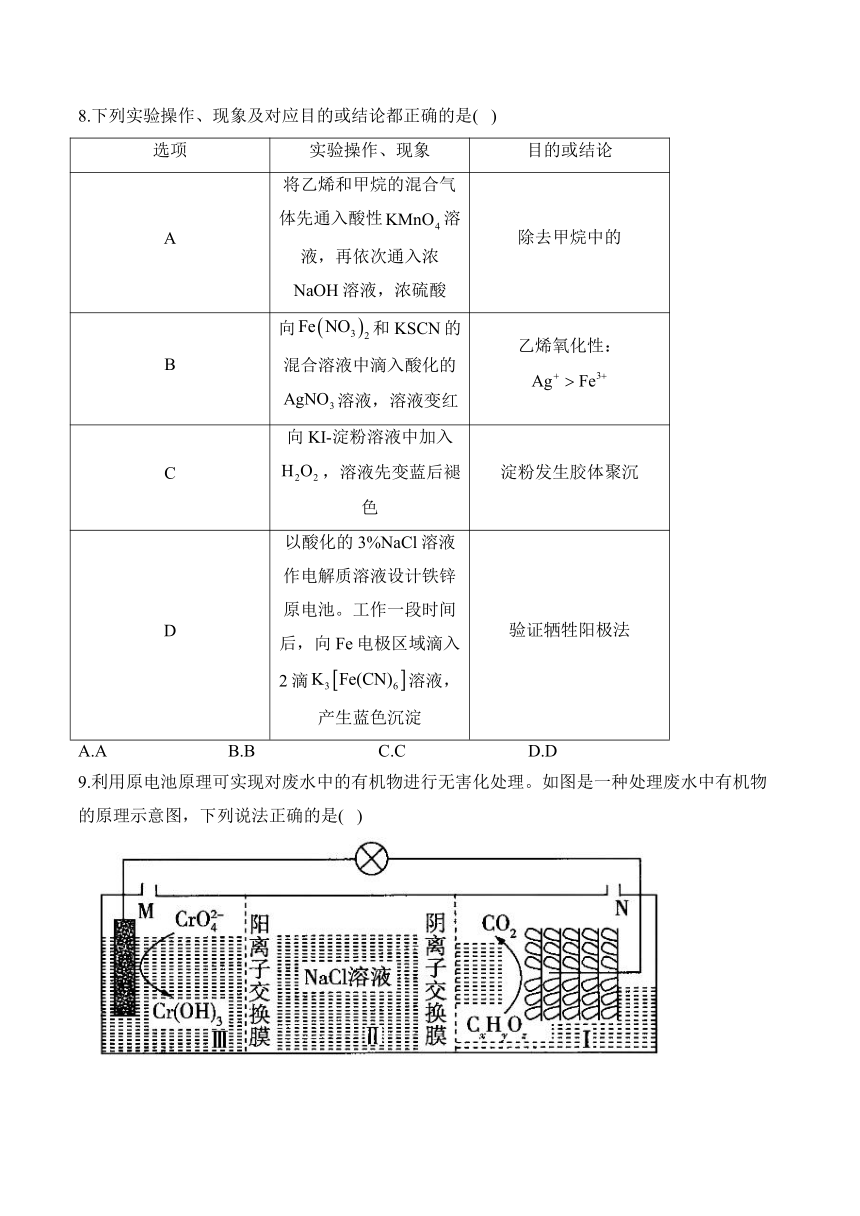
9.利用原电池原理可实现对废水中的有机物进行无害化处理。如图是一种处理废水中有机物的原理示意图,下列说法正确的是( )
A.M极发生的电极反应为
B.M极的电极电势低于N极的电极电势
C.若为正丙醇,每处理1mol正丙醇,M极消耗
D.若为乙酸,每生成,I区溶液质量减小44g
10.以、为原料合成涉及的主要反应如下:
I.
Ⅱ.
Ⅲ.
一定条件下,向恒容密闭容器中通入1 mol 和3 mol 发生上述反应。达平衡后,体系中、、CO的物质的量随温度的变化关系如图所示,下列说法不正确的是( )
A.
B.曲线a代表的气体为
C.低温、高压可以同时提高的平衡产率
D.温度为时,反应Ⅲ的平衡常数K=1
二、非选择题:本大题共4小题,共60分。
11.金属钒(V)被称为钢铁行业的“维生素”,以钒矿石焙砂(主要含,铁的氧化物等)为原料制备的工艺流程如下:
已知:①酸浸液中,钒的存在形式为;
②萃取时,发生反应:。
(1)浸渣的主要成分为_____________(填化学式)。
(2)加入足量铁粉进行还原时,含V微粒发生反应的离子方程式为_____________;还原时,消耗Fe粉量超过还原含V微粒所需的理论值,可能的原因是_____________。
(3)转化步骤的目的是_____________。
(4)无氧条件下煅烧得到的化学方程式为_____________。
(5)称取产品,用硫酸溶解后配成100mL溶液,取25.00mL溶液置于锥形瓶中,加入溶液还原(V元素转化为),后用标准溶液滴定至终点只氧化),消耗标准溶液的体积为。假设杂质不参与反应。则产品中的质量分数是_____________(列出计算式即可)。
(6)某超导含钒锑化物的晶胞及晶体中由V和Sb组成的二维平面如图。
基态V原子M能层电子排布式为_____________。该晶体的化学式为_______________。钒原子周围紧邻的锑原子数为_____________。
12.碘酸钙是一种无机精细与专用化学品。某兴趣小组进行了的制备和质量分数的测定实验。
I.的制备
实验室制备的流程和操作①②的实验装置如下所示。
已知:i.操作②中发生的反应为;
ii.相关物质的信息如表所示。
物质
摩尔质量 122.5 — 390
溶解性 可溶于热水 可溶于热水 难溶于水和乙醇
(1)仪器d的名称为_____________,仪器d中填充的试剂可以是_____________。
A. B. C.碱石灰 D.浓
(2)操作①中盐酸需逐滴滴加,主要原因是_____________
(3)写出判断操作②中反应已结束的操作和现象_____________
(4)关于制备过程,下列说法正确的是_____________。
A.操作②水浴加热温度不宜过高,避免挥发
B.操作③若调控时pH过高,易导致产品中杂质含量升高
C.操作⑤在溶液中加入少量晶体再冷却,可形成大颗粒
D.得到产品后,可依次用少量蒸馏水和乙醇洗涤
I.质量分数的测定
采用碘量法进行测定,已知滴定过程中不参与氧化还原反应,其他的反应为,;淀粉与碘易形成包合物。
(5)从下列选项中选择合适的操作补全:准确称取样品→_____________→移取25.00mL置于碘量瓶中→加入过量KI→_____________→_____________→_____________→_____________→平行滴定3次,平均消耗标准液20.00mL。
a.加入溶液溶解样品,并配成250mL溶液,使溶液呈弱酸性
b.加入溶液溶解样品,并配成250mL溶液,使溶液呈强酸性
c.加入淀粉溶液
d.用标准液滴定至溶液呈浅黄色
e.盖上瓶塞并置于暗处放置3min
f.继续滴定至锥形瓶中溶液蓝色褪去,且30s内不变色
g.继续滴定至锥形瓶中溶液出现蓝色,且30s内不变色
(6)样品中的质量分数为_____________(用含m的代数式表示)。
(7)卤素X的最高价含氧酸可看成是脱去若干形成的,I和Cl稳定的最高价含氧酸的结构如图所示,试分析I无法形成结构类似的最高价含氧酸的原因是_____________。
13.含氮物质与化工生产,环境保护密切相关,试回答下列问题。
(1)以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈和副产物丙烯醛的热化学方程式如下:
主反应:
副反应:
已知:丙烯腈的产率
丙烯腈的选择性
①一定条件下,丙烯腈产率与温度的关系如图甲所示,则460℃之后产率随温度升高而降低的原因是___________。
②一定条件下,平衡时丙烯腈选择性与温度、压强的关系如图乙所示,则由小到大的顺序为__________,判断依据是___________;相同压强下,丙烯腈选择性随温度升高而降低的可能原因是(不考虑催化剂失活)___________。
③某温度下,向压强恒为100 kPa的密闭容器中通入和7.5 mol空气(的体积分数为),发生上述反应。平衡时测得的转化率为90%,的物质的量为2.5 mol,则平衡时的分压为_________kPa,此温度下副反应的_________。
(2)只需一步即可完成的反应称为基元反应,基元反应如的速率方程,,。非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定,为非基元反应。一种可能的机理为
(ⅰ)快速平衡平衡常数为
(ⅱ)慢反应
①_______(用含的表达式表示)。
②是在无催化剂的条件下升高温度速率减慢的反应,目前研究认为和上述机理有关。如表为和在不同温度下的数值:
T/K 300 350 400 500
平衡常数()
速率常数() 2.5 25.8
根据表中数据推测:升高温度,该反应的反应速率反而减慢的原因可能是_____________。
14.雷西莫特具有抗病毒、抗肿瘤、抗过敏的作用,其中间体的合成路线如下:
已知:;含氮基团的碱性越强,越容易和酰氯(R—COCI)发生取代反应。
(1)的反应类型为_____________。
(2)过程中,_____________转化为_____________。(填官能团名称)
(3)的化学方程式为_____________,G中1处氨基的碱性_____________(填“强于”或“弱于”)2处氨基的碱性;反应过程中,最佳投料比n():n()=1:1.2,若投入量再增大,产率会下降,原因是_____________。
(4)化合物I的结构简式为_____________。
(5)符合下列条件的C的同分异构体共有_____________种(不考虑立体异构)。
①分子中只含有1个苯环,不含其他环状结构
②苯环上含有3个取代基,且其中2个为硝基
(6)已知Beckmann重排反应的机理如下:
则硝乙醛胺()发生Beckmann重排反应后的产物为_____________(填结构简式)。
答案以及解析
1.答案:D
解析:芯片的关键成分是单质硅,单质Si属于共价晶体,A正确;水分子可以形成分子间氢键,B正确;氦原子最外层被2个电子完全填满,结构非常稳定,C正确;光伏发电系统可将光能转化为电能,D错误。
2.答案:D
解析:化合物A和C的官能团不完全相同,可用红外光谱进行鉴别,A正确;中2个平面通过单键相连,单键可以旋转,故所有碳原子可能共平面,B正确;化合物B分子中与羟基相连的碳原子为手性碳原子,因此化合物B存在对映异构体,C正确;化合物C中含有氨基,能够与盐酸反应,但不能与氢氧化钠溶液反应,D错误。
3.答案:D
解析:N的2p电子处于半充满状态,第一电离能大于同周期相邻元素,则第一电离能,A错误;B原子核外有3个价电子,4个F提供4个电子,又带1个单位的负电荷,故中B满足8电子稳定结构,B错误;未说明是否为简单氢化物,不可比较沸点,且和的沸点可能小于C的氢化物的,C错误;HF为弱酸,可与反应,D正确。
4.答案:C
解析:Ag和Cu分别转化为银离子和铜离子,其中一个反应为,产生有毒气体NO,需要在通风 中进行,A正确;浓HCl和也可提供足够浓度的氯离子和硝酸根离子,能起到与王水同样的作用,使Au溶解,B正确;配离子是内界,在溶液中难电离出,C错误;步骤③中的转化,需加入还原剂,具有强还原性,可实现的转化,D正确。
5.答案:A
解析:1个中含有6个配位键和12个键,共价键数目为18,1个中含有6个配位键,共价键数目为6,故和中共价键数目之比为3:1,A错误;为浅紫色,但溶液I呈黄色,原因可能是发生水解反应生成红褐色,与浅紫色形成混合体系,使溶液呈黄色,B正确;溶液II呈红色,存在平衡,向溶液II中加入NaF溶液,溶液变为无色,说明转化成更难电离的,则平衡常数,C正确;与形成时,提供空轨道,O提供孤对电子,D正确。
6.答案:B
解析:中含和,中含有的离子数为,A错误;每个中含有4个O原子,则中含有O原子的数目为,B正确;标准状况下,HF不是气体,不能用计算其物质的量,C错误;该反应不是氧化还原反应,没有电子转移,D错误。
7.答案:A
解析:为离子化合物,属于强极性化合物,向其水溶液中加入乙醇,因为乙醇的极性比水的极性弱,在溶液中的溶解度减小,会析出蓝色晶体,A正确;醋酸易挥发,在中加入浓醋酸,反应生成的中混有醋酸,醋酸也能与苯酚钠反应生成苯酚,使溶液变浑浊,B错误;向等物质的量浓度的混合溶液中滴加溶液,先生成AgCl白色沉淀,说明AgCl的溶解度更小,但由于的沉淀类型不相同,不能得出的结论,C错误;将盛有的密闭烧瓶浸入冷水,红棕色变浅,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,,则正反应的活化能小于逆反应的活化能,D错误。
8.答案:A
解析:将和通入酸性溶液,不反应,被氧化成,再通入浓NaOH溶液除去,通入浓硫酸干燥,从而达到除去甲烷中乙烯的目的,A正确;酸性条件下能将氧化成,因此无法得出题中结论,B错误;可将生成的氧化成导致蓝色消失,C错误;Fe与Zn构成原电池时,Fe作正极被保护,不会产生,向Fe电极区域滴入溶液不会产生蓝色沉淀,D错误。
9.答案:C
解析:第一步,根据原理图判断正负极及电极反应。根据M极上转化为,元素化合价降低,可知M极发生还原反应,为正极,电极反应式为;N极为负极,有机物转化为。第二步,逐项判断。M极生成,可知体系为碱性,电极反应中不会出现,A错误;M极(正极)的电极电势高于N极(负极)的电极电势,B错误;当有机物为正丙醇时,(C的平均化合价为-2),化合价升高18,,化合价降低3,处理1mol正丙醇转移电子的物质的量为18mol,故M极消耗的物质的量为6mol,C正确;当有机物为乙酸时,每生成1mol,质量减少44g,但同时通过阴离子交换膜转移进的的物质的量为4mol,质量增加142g,故质量共增加98g,D错误。
10.答案:B
解析:反应Ⅱ=反应I-反应Ⅲ,根据盖斯定律,,A正确;反应I、Ⅱ均为气体分子数减少的放热反应,高压和低温均有利于平衡正向移动,提高的平衡产率,C正确;温度达平衡时,的物质的量为0.5 mol,CO的物质的量为0.3 mol,根据C元素守恒,的物质的量为(1-0.5-0.3)mol=0.2 mol,根据O元素守恒,的物质的量为(2-0.5-0.3-2×0.2)mol=0.8 mol,根据H元素反守恒,的物质的量为,反应Ⅲ的平衡常数,D正确。
11.答案:(1)
(2)溶液中会消耗Fe粉
(3)将+4价V氧化为+5价V
(4)
(5)
(6);;6
解析:(1)由流程梳理分析可知,浸渣的主要成分为。
(2)根据质量守恒,化合价升降守恒可写出反应的离子方程式为。酸浸时,溶液中含有,二者都会消耗Fe粉,导致Fe粉消耗量增多。
(3)反萃取后得到的中V的化合价为+4,用氨水沉钒后得到的中V的化合价为+5,则转化的目的是将+4价V氧化为+5价V。
(4)根据质量守恒和已知的反应物,生成物可写出煅烧的反应方程式为。
(5)第一步,根据滴定原理,找出相关物质的关系式。用硫酸溶解后转化为,加入溶液发生反应,反应后加入标准溶液发生反应。则可得关系式,。第二步,计算出25.00mL溶液中的物质的量。初始加入体系的,标准溶液消耗的,则25.00mL溶液中。第三步,计算产品中的质量分数。产品中的质量分数=。
(6)该晶胞中Cs的个数为,的个数为,V的个数为,则该晶体的化学式为。以位于体心的V原子为研究对象,钒原子周围紧邻的锑原子数为6。
12.答案:(1)干燥管;C
(2)避免过量的HCl与反应,额外消耗
(3)取样,滴加少量淀粉溶液,无蓝色出现
(4)
(5)a;e;d;c;f
(6)
(7)I半径大,-OH之间的排斥力小,键不易断开;I的半径远比O大,电子云重叠程度低,难以形成稳定的多重(双)键
解析:(1)仪器d为干燥管,干燥管中试剂要能够吸收尾气(等),只能选择碱石灰。
(2)盐酸过量容易造成与发生归中反应,导致被额外消耗,因此需要缓慢滴加。
(3)根据流程图中数据可以计算出,投料时少量,所以反应结束时,被消耗完,检验不存在即可。
(4)操作②温度过高,会挥发,降低产率,A正确;操作③若pH过高,后续易产生沉淀,造成杂质含量升高,B正确;本身难溶于水,直接过滤即可,不需要冷却结晶,C错误;难溶于水和乙醇,先用水洗涤再用乙醇洗涤,使乙醇挥发时带走沉淀表面的水,利于沉淀干燥,D正确。
(5)待测液不宜呈强酸性,否则用溶液滴定时会发生歧化反应;为了避免和淀粉之间的结合过于稳定,造成滴定误差,所以需要先滴定至浓度降低后,再加淀粉;滴定终点的颜色变化为由蓝色变为无色。
(6)KI并未消耗,根据氧化还原关系可得,则,根据的用量可以进行计算。
(7)和结构上的区别在于羟基的数目不同,双键的数目也不同,据此进行分析。
13.答案:(1)①460 ℃时反应已达到平衡状态,该反应为放热反应,升高温度,平衡逆向移动,丙烯腈的产率下降
②;主反应正方向为气体分子数增大的反应,减小压强,平衡正向移动,的产率增大,而的产率不变,则的选择性增大;主、副反应均为放热反应,但主反应放出热量多,压强相同时升高温度,主反应逆向移动程度更大,反应物浓度增大,可能促使副反应平衡正向移动,丙烯腈选择性下降
③8;12.5
(2)①
②温度升高,增大的程度小于(即)减小的程度
解析:(1)①生成丙烯腈的反应为放热反应,温度升高,平衡产率下降,由题图甲可知460 ℃之前,温度升高时丙烯腈的产率也升高,说明460 ℃之前反应还未达到平衡,温度升高,反应速率加快,产率增大;460 ℃之后反应达到平衡状态,随温度升高,平衡逆向移动。
③恒温恒压条件下,气体体积分数等于物质的量分数,则7.5 mol空气(的体积分数为20%)中的物质的量为,设平衡时生成,根据题中信息可列三段式:
平衡时测得的转化率为90%,的物质的量为2.5 mol,则,,则,平衡时的分压为,同理可得的分压分别为1 kPa、,则副反应的。
(2)①总反应的速率是由慢反应决定的,则,则,即,已知反应(ⅰ)可快速达到平衡,且平衡常数为,则几乎任意时刻均满足,即,则,。
②由题表数据知,温度升高,增大的程度小于(即)减小的程度,故总反应整体反应速率减慢。
14.答案:(1)还原反应
(2)羟基;碳氯键
(3);弱于;反应物中另一个氨基也能发生取代反应
(4)
(5)18
(6)、
解析:(1)A转化为B的过程中,硝基被还原为氨基。
(2)D→E过程中,羟基转化为碳氯键。
(3)根据题给已知信息,G、J的结构简式,G→H的反应试剂,及H的分子式,可推出G→H为取代反应,H为,则G→H的化学方程式为;因含氮基团的碱性越强,越容易和酰氯(R-COCI)发生取代反应,则G中1处氨基的碱性弱于2处氨基的碱性;G中含有2个氨基,若投入量再增大,另一个氨基参与取代反应,会导致副产物增多,产率下降。
(4)由分析可知,化合物I的结构简式为。
(5)根据C的分子结构判断,其同分异构体只含有1个苯环,不含其他环状结构,且苯环上含有3个取代基,其中2个为硝基,则另一个取代基可能为一,每种情况对应6种结构,共18种。
(6)根据Beckmann重排反应的机理分析,硝乙醛肟重排后的产物可能为、。
化学(福建专版) 分值:100分 时间:75分钟
可能用到的相对原子质量:H—1、C—12、O—16、V—51、Cr—52
一、选择题:本题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“天眸芯”、“梦想”号等彰显了我国科技发展的巨大成就。下列说法错误的是( )
A.首款基于原语的类脑互补视觉芯片“天眸芯”:用来制芯片的单质Si属于共价晶体
B.首艘大洋钻探船“梦想”号正式入列:勘探的天然气水合物中构成水分子笼的水分子之间以氢键连接
C.为无液氦极低温制冷提供新方案:氦原子稳定的原因是最外层电子完全填满,结构稳定
D.拟建立的太空发电站实验性平台“太原一号”卫星:其光伏发电系统可将化学能转化为电能
2.化合物C可由化合物A和B发生如下反应生成。下列说法错误的是( )
A.化合物A和C可由红外光谱进行鉴别
B.化合物C分子中所有碳原子可能在同一平面内
C.化合物B存在对映异构体
D.化合物C既能与盐酸反应,又能与氢氧化钠溶液反应
3.某离子液体的结构如图所示,其阴离子能与纤维素中的羟基形成氢键,对纤维素有很好的溶解性。W、X、Y、Z、Q是原子序数依次增大的短周期主族元素,其中Y是组成有机物的基本骨架元素。下列说法正确的是( )
A.第一电离能:Y>Z
B.阴离子中X不满足8电子稳定结构
C.氢化物的沸点:Z>Y
D.WQ属于酸,但能与某些酸性氧化物反应
4.金,银,铜是电脑,手机等电子线路中不可或缺的材料。从废旧电子材料中回收Au等可实现贵金属资源的再利用。如图是从废旧CPU中回收的一种工艺流程。已知:王水与Au的反应为。下列说法错误的是( )
A.在实验室中,步骤①应在通风橱中进行
B.步骤②用浓HCl和也可使Au溶解
C.配离子在溶液中能完全电离出
D.为实现步骤③中的转化,可尝试加入
5.可与等形成配离子使溶液显不同的颜色。如:为浅紫色,为红色,为无色。某同学按如下步骤进行实验并观察到的现象如下:
已知与在溶液中存在以下平衡,。
下列说法错误的是( )
A.和中共价键数目之比为2:1
B.溶液I呈黄色可能是由水解产物的颜色引起的
C.由上述实验现象可知平衡常数
D.与形成时,O提供孤对电子
6.实验室可用与浓硫酸反应制HF,反应方程式为。为阿伏加德罗常数的值。下列说法正确的是( )
A.1mol中含有的离子数为
B.中含有O原子的数目为
C.标准状况下,2.24LHF中含有的分子数为
D.该反应中每生成1molHF,转移电子数为
7.由下列事实或现象能得出相应结论的是( )
选项 事实或现象 结论
A 向水溶液中加入乙醇,析出蓝色晶体 乙醇的极性比水的极性
B 在中加入浓醋酸,并将反应后的气体通入苯酚钠溶液中,溶液变浑浊 弱酸性:碳酸>苯酚
C 向等物质的量浓度的混合溶液中滴加溶液,先生成AgCl白色沉淀
D 为基元反应,将盛有的密闭烧瓶浸入冷水,红棕色变浅 正反应活化能大于逆反应活化能
A.A B.B C.C D.D
8.下列实验操作、现象及对应目的或结论都正确的是( )
选项 实验操作、现象 目的或结论
A 将乙烯和甲烷的混合气体先通入酸性溶液,再依次通入浓NaOH溶液,浓硫酸 除去甲烷中的
B 向和KSCN的混合溶液中滴入酸化的溶液,溶液变红 乙烯氧化性:
C 向KI-淀粉溶液中加入,溶液先变蓝后褪色 淀粉发生胶体聚沉
D 以酸化的3%NaCl溶液作电解质溶液设计铁锌原电池。工作一段时间后,向Fe电极区域滴入2滴溶液,产生蓝色沉淀 验证牺牲阳极法
A.A B.B C.C D.D
9.利用原电池原理可实现对废水中的有机物进行无害化处理。如图是一种处理废水中有机物的原理示意图,下列说法正确的是( )
A.M极发生的电极反应为
B.M极的电极电势低于N极的电极电势
C.若为正丙醇,每处理1mol正丙醇,M极消耗
D.若为乙酸,每生成,I区溶液质量减小44g
10.以、为原料合成涉及的主要反应如下:
I.
Ⅱ.
Ⅲ.
一定条件下,向恒容密闭容器中通入1 mol 和3 mol 发生上述反应。达平衡后,体系中、、CO的物质的量随温度的变化关系如图所示,下列说法不正确的是( )
A.
B.曲线a代表的气体为
C.低温、高压可以同时提高的平衡产率
D.温度为时,反应Ⅲ的平衡常数K=1
二、非选择题:本大题共4小题,共60分。
11.金属钒(V)被称为钢铁行业的“维生素”,以钒矿石焙砂(主要含,铁的氧化物等)为原料制备的工艺流程如下:
已知:①酸浸液中,钒的存在形式为;
②萃取时,发生反应:。
(1)浸渣的主要成分为_____________(填化学式)。
(2)加入足量铁粉进行还原时,含V微粒发生反应的离子方程式为_____________;还原时,消耗Fe粉量超过还原含V微粒所需的理论值,可能的原因是_____________。
(3)转化步骤的目的是_____________。
(4)无氧条件下煅烧得到的化学方程式为_____________。
(5)称取产品,用硫酸溶解后配成100mL溶液,取25.00mL溶液置于锥形瓶中,加入溶液还原(V元素转化为),后用标准溶液滴定至终点只氧化),消耗标准溶液的体积为。假设杂质不参与反应。则产品中的质量分数是_____________(列出计算式即可)。
(6)某超导含钒锑化物的晶胞及晶体中由V和Sb组成的二维平面如图。
基态V原子M能层电子排布式为_____________。该晶体的化学式为_______________。钒原子周围紧邻的锑原子数为_____________。
12.碘酸钙是一种无机精细与专用化学品。某兴趣小组进行了的制备和质量分数的测定实验。
I.的制备
实验室制备的流程和操作①②的实验装置如下所示。
已知:i.操作②中发生的反应为;
ii.相关物质的信息如表所示。
物质
摩尔质量 122.5 — 390
溶解性 可溶于热水 可溶于热水 难溶于水和乙醇
(1)仪器d的名称为_____________,仪器d中填充的试剂可以是_____________。
A. B. C.碱石灰 D.浓
(2)操作①中盐酸需逐滴滴加,主要原因是_____________
(3)写出判断操作②中反应已结束的操作和现象_____________
(4)关于制备过程,下列说法正确的是_____________。
A.操作②水浴加热温度不宜过高,避免挥发
B.操作③若调控时pH过高,易导致产品中杂质含量升高
C.操作⑤在溶液中加入少量晶体再冷却,可形成大颗粒
D.得到产品后,可依次用少量蒸馏水和乙醇洗涤
I.质量分数的测定
采用碘量法进行测定,已知滴定过程中不参与氧化还原反应,其他的反应为,;淀粉与碘易形成包合物。
(5)从下列选项中选择合适的操作补全:准确称取样品→_____________→移取25.00mL置于碘量瓶中→加入过量KI→_____________→_____________→_____________→_____________→平行滴定3次,平均消耗标准液20.00mL。
a.加入溶液溶解样品,并配成250mL溶液,使溶液呈弱酸性
b.加入溶液溶解样品,并配成250mL溶液,使溶液呈强酸性
c.加入淀粉溶液
d.用标准液滴定至溶液呈浅黄色
e.盖上瓶塞并置于暗处放置3min
f.继续滴定至锥形瓶中溶液蓝色褪去,且30s内不变色
g.继续滴定至锥形瓶中溶液出现蓝色,且30s内不变色
(6)样品中的质量分数为_____________(用含m的代数式表示)。
(7)卤素X的最高价含氧酸可看成是脱去若干形成的,I和Cl稳定的最高价含氧酸的结构如图所示,试分析I无法形成结构类似的最高价含氧酸的原因是_____________。
13.含氮物质与化工生产,环境保护密切相关,试回答下列问题。
(1)以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈和副产物丙烯醛的热化学方程式如下:
主反应:
副反应:
已知:丙烯腈的产率
丙烯腈的选择性
①一定条件下,丙烯腈产率与温度的关系如图甲所示,则460℃之后产率随温度升高而降低的原因是___________。
②一定条件下,平衡时丙烯腈选择性与温度、压强的关系如图乙所示,则由小到大的顺序为__________,判断依据是___________;相同压强下,丙烯腈选择性随温度升高而降低的可能原因是(不考虑催化剂失活)___________。
③某温度下,向压强恒为100 kPa的密闭容器中通入和7.5 mol空气(的体积分数为),发生上述反应。平衡时测得的转化率为90%,的物质的量为2.5 mol,则平衡时的分压为_________kPa,此温度下副反应的_________。
(2)只需一步即可完成的反应称为基元反应,基元反应如的速率方程,,。非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定,为非基元反应。一种可能的机理为
(ⅰ)快速平衡平衡常数为
(ⅱ)慢反应
①_______(用含的表达式表示)。
②是在无催化剂的条件下升高温度速率减慢的反应,目前研究认为和上述机理有关。如表为和在不同温度下的数值:
T/K 300 350 400 500
平衡常数()
速率常数() 2.5 25.8
根据表中数据推测:升高温度,该反应的反应速率反而减慢的原因可能是_____________。
14.雷西莫特具有抗病毒、抗肿瘤、抗过敏的作用,其中间体的合成路线如下:
已知:;含氮基团的碱性越强,越容易和酰氯(R—COCI)发生取代反应。
(1)的反应类型为_____________。
(2)过程中,_____________转化为_____________。(填官能团名称)
(3)的化学方程式为_____________,G中1处氨基的碱性_____________(填“强于”或“弱于”)2处氨基的碱性;反应过程中,最佳投料比n():n()=1:1.2,若投入量再增大,产率会下降,原因是_____________。
(4)化合物I的结构简式为_____________。
(5)符合下列条件的C的同分异构体共有_____________种(不考虑立体异构)。
①分子中只含有1个苯环,不含其他环状结构
②苯环上含有3个取代基,且其中2个为硝基
(6)已知Beckmann重排反应的机理如下:
则硝乙醛胺()发生Beckmann重排反应后的产物为_____________(填结构简式)。
答案以及解析
1.答案:D
解析:芯片的关键成分是单质硅,单质Si属于共价晶体,A正确;水分子可以形成分子间氢键,B正确;氦原子最外层被2个电子完全填满,结构非常稳定,C正确;光伏发电系统可将光能转化为电能,D错误。
2.答案:D
解析:化合物A和C的官能团不完全相同,可用红外光谱进行鉴别,A正确;中2个平面通过单键相连,单键可以旋转,故所有碳原子可能共平面,B正确;化合物B分子中与羟基相连的碳原子为手性碳原子,因此化合物B存在对映异构体,C正确;化合物C中含有氨基,能够与盐酸反应,但不能与氢氧化钠溶液反应,D错误。
3.答案:D
解析:N的2p电子处于半充满状态,第一电离能大于同周期相邻元素,则第一电离能,A错误;B原子核外有3个价电子,4个F提供4个电子,又带1个单位的负电荷,故中B满足8电子稳定结构,B错误;未说明是否为简单氢化物,不可比较沸点,且和的沸点可能小于C的氢化物的,C错误;HF为弱酸,可与反应,D正确。
4.答案:C
解析:Ag和Cu分别转化为银离子和铜离子,其中一个反应为,产生有毒气体NO,需要在通风 中进行,A正确;浓HCl和也可提供足够浓度的氯离子和硝酸根离子,能起到与王水同样的作用,使Au溶解,B正确;配离子是内界,在溶液中难电离出,C错误;步骤③中的转化,需加入还原剂,具有强还原性,可实现的转化,D正确。
5.答案:A
解析:1个中含有6个配位键和12个键,共价键数目为18,1个中含有6个配位键,共价键数目为6,故和中共价键数目之比为3:1,A错误;为浅紫色,但溶液I呈黄色,原因可能是发生水解反应生成红褐色,与浅紫色形成混合体系,使溶液呈黄色,B正确;溶液II呈红色,存在平衡,向溶液II中加入NaF溶液,溶液变为无色,说明转化成更难电离的,则平衡常数,C正确;与形成时,提供空轨道,O提供孤对电子,D正确。
6.答案:B
解析:中含和,中含有的离子数为,A错误;每个中含有4个O原子,则中含有O原子的数目为,B正确;标准状况下,HF不是气体,不能用计算其物质的量,C错误;该反应不是氧化还原反应,没有电子转移,D错误。
7.答案:A
解析:为离子化合物,属于强极性化合物,向其水溶液中加入乙醇,因为乙醇的极性比水的极性弱,在溶液中的溶解度减小,会析出蓝色晶体,A正确;醋酸易挥发,在中加入浓醋酸,反应生成的中混有醋酸,醋酸也能与苯酚钠反应生成苯酚,使溶液变浑浊,B错误;向等物质的量浓度的混合溶液中滴加溶液,先生成AgCl白色沉淀,说明AgCl的溶解度更小,但由于的沉淀类型不相同,不能得出的结论,C错误;将盛有的密闭烧瓶浸入冷水,红棕色变浅,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,,则正反应的活化能小于逆反应的活化能,D错误。
8.答案:A
解析:将和通入酸性溶液,不反应,被氧化成,再通入浓NaOH溶液除去,通入浓硫酸干燥,从而达到除去甲烷中乙烯的目的,A正确;酸性条件下能将氧化成,因此无法得出题中结论,B错误;可将生成的氧化成导致蓝色消失,C错误;Fe与Zn构成原电池时,Fe作正极被保护,不会产生,向Fe电极区域滴入溶液不会产生蓝色沉淀,D错误。
9.答案:C
解析:第一步,根据原理图判断正负极及电极反应。根据M极上转化为,元素化合价降低,可知M极发生还原反应,为正极,电极反应式为;N极为负极,有机物转化为。第二步,逐项判断。M极生成,可知体系为碱性,电极反应中不会出现,A错误;M极(正极)的电极电势高于N极(负极)的电极电势,B错误;当有机物为正丙醇时,(C的平均化合价为-2),化合价升高18,,化合价降低3,处理1mol正丙醇转移电子的物质的量为18mol,故M极消耗的物质的量为6mol,C正确;当有机物为乙酸时,每生成1mol,质量减少44g,但同时通过阴离子交换膜转移进的的物质的量为4mol,质量增加142g,故质量共增加98g,D错误。
10.答案:B
解析:反应Ⅱ=反应I-反应Ⅲ,根据盖斯定律,,A正确;反应I、Ⅱ均为气体分子数减少的放热反应,高压和低温均有利于平衡正向移动,提高的平衡产率,C正确;温度达平衡时,的物质的量为0.5 mol,CO的物质的量为0.3 mol,根据C元素守恒,的物质的量为(1-0.5-0.3)mol=0.2 mol,根据O元素守恒,的物质的量为(2-0.5-0.3-2×0.2)mol=0.8 mol,根据H元素反守恒,的物质的量为,反应Ⅲ的平衡常数,D正确。
11.答案:(1)
(2)溶液中会消耗Fe粉
(3)将+4价V氧化为+5价V
(4)
(5)
(6);;6
解析:(1)由流程梳理分析可知,浸渣的主要成分为。
(2)根据质量守恒,化合价升降守恒可写出反应的离子方程式为。酸浸时,溶液中含有,二者都会消耗Fe粉,导致Fe粉消耗量增多。
(3)反萃取后得到的中V的化合价为+4,用氨水沉钒后得到的中V的化合价为+5,则转化的目的是将+4价V氧化为+5价V。
(4)根据质量守恒和已知的反应物,生成物可写出煅烧的反应方程式为。
(5)第一步,根据滴定原理,找出相关物质的关系式。用硫酸溶解后转化为,加入溶液发生反应,反应后加入标准溶液发生反应。则可得关系式,。第二步,计算出25.00mL溶液中的物质的量。初始加入体系的,标准溶液消耗的,则25.00mL溶液中。第三步,计算产品中的质量分数。产品中的质量分数=。
(6)该晶胞中Cs的个数为,的个数为,V的个数为,则该晶体的化学式为。以位于体心的V原子为研究对象,钒原子周围紧邻的锑原子数为6。
12.答案:(1)干燥管;C
(2)避免过量的HCl与反应,额外消耗
(3)取样,滴加少量淀粉溶液,无蓝色出现
(4)
(5)a;e;d;c;f
(6)
(7)I半径大,-OH之间的排斥力小,键不易断开;I的半径远比O大,电子云重叠程度低,难以形成稳定的多重(双)键
解析:(1)仪器d为干燥管,干燥管中试剂要能够吸收尾气(等),只能选择碱石灰。
(2)盐酸过量容易造成与发生归中反应,导致被额外消耗,因此需要缓慢滴加。
(3)根据流程图中数据可以计算出,投料时少量,所以反应结束时,被消耗完,检验不存在即可。
(4)操作②温度过高,会挥发,降低产率,A正确;操作③若pH过高,后续易产生沉淀,造成杂质含量升高,B正确;本身难溶于水,直接过滤即可,不需要冷却结晶,C错误;难溶于水和乙醇,先用水洗涤再用乙醇洗涤,使乙醇挥发时带走沉淀表面的水,利于沉淀干燥,D正确。
(5)待测液不宜呈强酸性,否则用溶液滴定时会发生歧化反应;为了避免和淀粉之间的结合过于稳定,造成滴定误差,所以需要先滴定至浓度降低后,再加淀粉;滴定终点的颜色变化为由蓝色变为无色。
(6)KI并未消耗,根据氧化还原关系可得,则,根据的用量可以进行计算。
(7)和结构上的区别在于羟基的数目不同,双键的数目也不同,据此进行分析。
13.答案:(1)①460 ℃时反应已达到平衡状态,该反应为放热反应,升高温度,平衡逆向移动,丙烯腈的产率下降
②;主反应正方向为气体分子数增大的反应,减小压强,平衡正向移动,的产率增大,而的产率不变,则的选择性增大;主、副反应均为放热反应,但主反应放出热量多,压强相同时升高温度,主反应逆向移动程度更大,反应物浓度增大,可能促使副反应平衡正向移动,丙烯腈选择性下降
③8;12.5
(2)①
②温度升高,增大的程度小于(即)减小的程度
解析:(1)①生成丙烯腈的反应为放热反应,温度升高,平衡产率下降,由题图甲可知460 ℃之前,温度升高时丙烯腈的产率也升高,说明460 ℃之前反应还未达到平衡,温度升高,反应速率加快,产率增大;460 ℃之后反应达到平衡状态,随温度升高,平衡逆向移动。
③恒温恒压条件下,气体体积分数等于物质的量分数,则7.5 mol空气(的体积分数为20%)中的物质的量为,设平衡时生成,根据题中信息可列三段式:
平衡时测得的转化率为90%,的物质的量为2.5 mol,则,,则,平衡时的分压为,同理可得的分压分别为1 kPa、,则副反应的。
(2)①总反应的速率是由慢反应决定的,则,则,即,已知反应(ⅰ)可快速达到平衡,且平衡常数为,则几乎任意时刻均满足,即,则,。
②由题表数据知,温度升高,增大的程度小于(即)减小的程度,故总反应整体反应速率减慢。
14.答案:(1)还原反应
(2)羟基;碳氯键
(3);弱于;反应物中另一个氨基也能发生取代反应
(4)
(5)18
(6)、
解析:(1)A转化为B的过程中,硝基被还原为氨基。
(2)D→E过程中,羟基转化为碳氯键。
(3)根据题给已知信息,G、J的结构简式,G→H的反应试剂,及H的分子式,可推出G→H为取代反应,H为,则G→H的化学方程式为;因含氮基团的碱性越强,越容易和酰氯(R-COCI)发生取代反应,则G中1处氨基的碱性弱于2处氨基的碱性;G中含有2个氨基,若投入量再增大,另一个氨基参与取代反应,会导致副产物增多,产率下降。
(4)由分析可知,化合物I的结构简式为。
(5)根据C的分子结构判断,其同分异构体只含有1个苯环,不含其他环状结构,且苯环上含有3个取代基,其中2个为硝基,则另一个取代基可能为一,每种情况对应6种结构,共18种。
(6)根据Beckmann重排反应的机理分析,硝乙醛肟重排后的产物可能为、。
同课章节目录
