安徽卷__2025届高考化学考前冲刺卷(含解析)
文档属性
| 名称 | 安徽卷__2025届高考化学考前冲刺卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 22:01:42 | ||
图片预览



文档简介
2025届高考化学考前冲刺卷
化学(安徽专版) 分值:100分 时间:75分钟
可能用到的相对原子质量:H—1、C—12、N—14、O—16、V—51
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.蛇是十二生肖之一,下列有关蛇的历史文物中,主要材质为金属材料的是( )
A商周石蛇 B春秋蛇纹铜提链罐
C唐彩绘生肖蛇陶俑 D清青玉十二辰-蛇
A.A B.B C.C D.D
2.下列实验事故的处理方法合理的是( )
选项 实验事故 处理方法
A 不慎将金属汞洒落地面 必须尽可能收集,然后用硫磺粉覆盖
B 金属钠着火 快速用二氧化碳灭火器灭火
C 稀释浓硫酸时,酸溅到皮肤上 用3%~5%的烧碱溶液冲洗
D 蒸馏操作时忘记加沸石 停止加热,立即加入沸石再加热
A.A B.B C.C D.D
3.下列物质的性质或用途说法正确的是( )
A.浓硫酸有酸性,遇蓝色石蕊试纸,试纸变红色
B.氨气不能用来作制冷剂
C.能杀菌消毒防腐,可用作食品添加剂
D.pH试纸能用来测定新制氯水的pH
4.化学反应中,量变可以引起质变。下列反应离子方程式书写错误的是( )
A.溶液中加入过量的盐酸:
B.溴水中加入过量的溶液:
C.溶液中通入过量的气体:
D.溶液中加入过量的氨水:
5.丹皮酚因其特殊的结构而具有显著的药理活性,常被作为先导物用于构建多种衍生物,一种丹皮酚查尔酮的合成路线如下。
下列说法正确的是( )
A.X分子中所有碳原子一定共平面
B.Y不能使溴水褪色
C.1 mol Z与溴水混合,最多能消耗4 mol
D.X、Y、Z均能使酸性溶液褪色
6.AlN是一种半导体材料,一种制备方法是,设为阿伏加德罗常数的值。下列说法正确的是( )
A.时,11.2LCO和的混合气体含中子数目为
B.12 gC(石墨)含非极性键数目为
C.该反应中固体质量每减少28g,转移电子数目为
D.溶于足量盐酸,溶液中的数目为
7.有研究认为,强碱性环境下反应可能按如下三步进行。
Ⅰ.
Ⅱ.
Ⅲ.
下列说法正确的是( )
A.Ⅱ的平衡常数表达式为
B.由平衡常数可以判断Ⅲ比Ⅰ快
C.升高温度会使变小,变大
D.是反应的催化剂
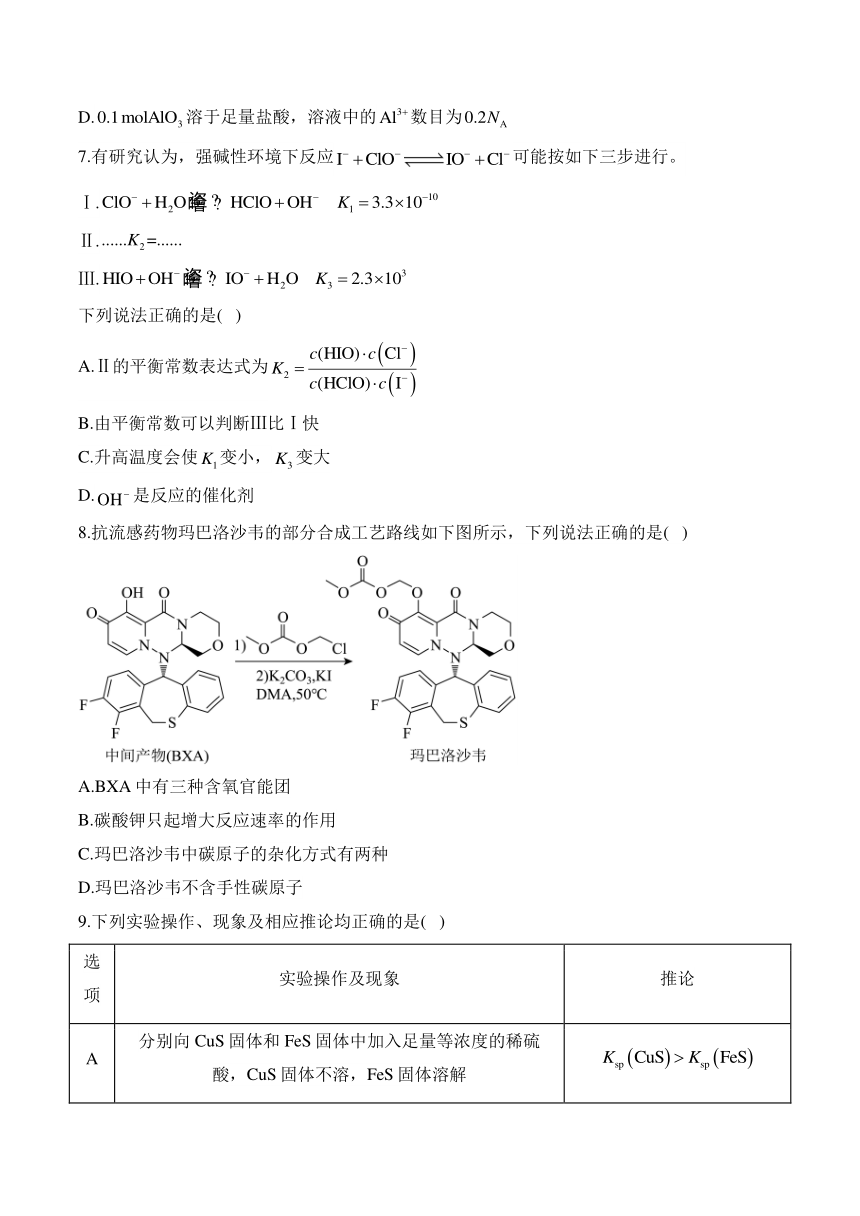
8.抗流感药物玛巴洛沙韦的部分合成工艺路线如下图所示,下列说法正确的是( )
A.BXA中有三种含氧官能团
B.碳酸钾只起增大反应速率的作用
C.玛巴洛沙韦中碳原子的杂化方式有两种
D.玛巴洛沙韦不含手性碳原子
9.下列实验操作、现象及相应推论均正确的是( )
选项 实验操作及现象 推论
A 分别向CuS固体和FeS固体中加入足量等浓度的稀硫酸,CuS固体不溶,FeS固体溶解
B 用试纸测定溶液为9.7 HClO为弱酸
C 用洁净的玻璃棒蘸取某溶液在外焰上灼烧,火焰呈黄色 溶液的溶质含Na元素
D 常温下,将等浓度溶液与氨水等体积混合,溶液呈中性 溶液中
A.A B.B C.C D.D
10.催化加氢制的反应体系中,发生的主要反应如下:
反应1:
反应2:
恒压下,将的混合气体以一定流速通过装有催化剂的反应管,测得出口处的转化率及和CO的选择性随温度的变化如图所示。下列说法正确的是( )
A.曲线③表示CO的选择性
B.时出口处CO的物质的量小于时
C.一定温度下,增大可提高平衡转化率
D.为提高产率,需研发转化率高和选择性高的催化剂
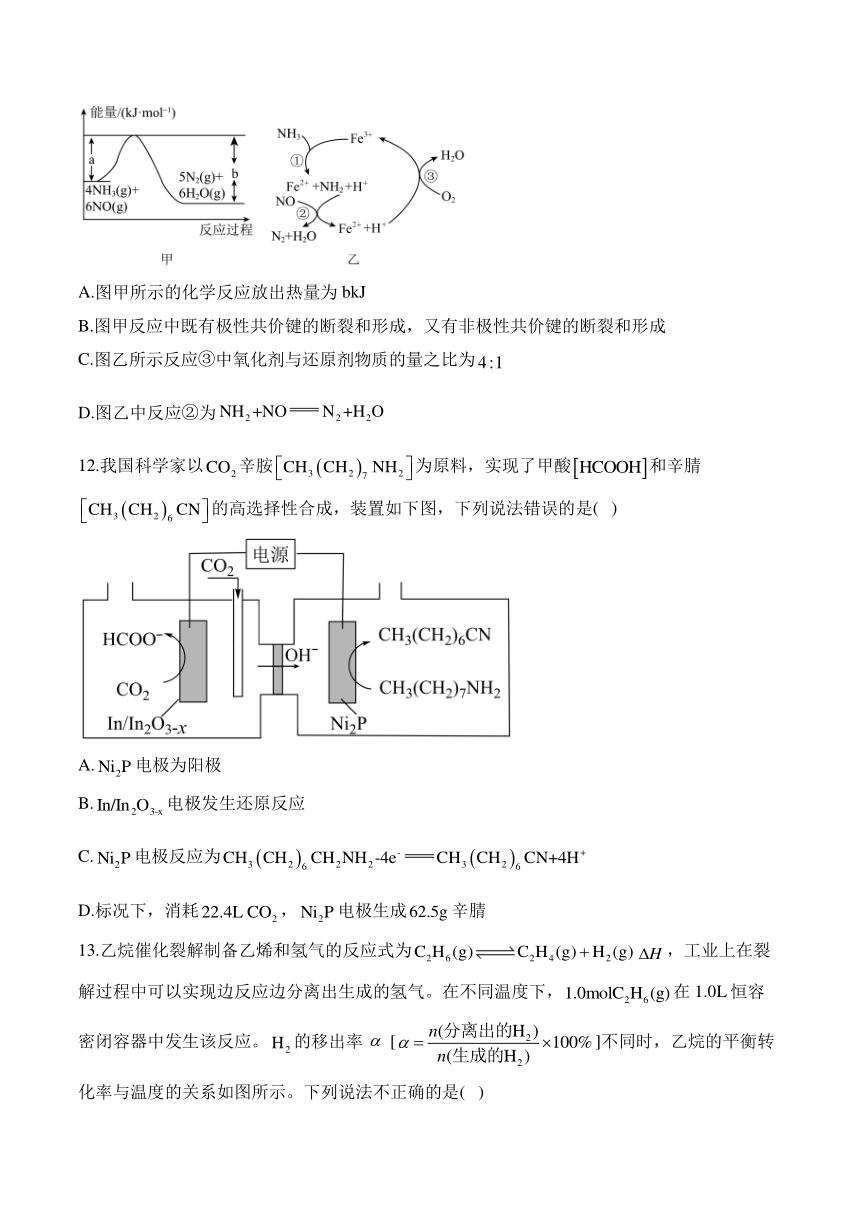
11.催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图甲所示。有氧条件下,催化还原NO的反应历程如图乙所示。下列说法正确的是( )
A.图甲所示的化学反应放出热量为bkJ
B.图甲反应中既有极性共价键的断裂和形成,又有非极性共价键的断裂和形成
C.图乙所示反应③中氧化剂与还原剂物质的量之比为
D.图乙中反应②为
12.我国科学家以辛胺为原料,实现了甲酸和辛腈的高选择性合成,装置如下图,下列说法错误的是( )
A.电极为阳极
B.电极发生还原反应
C.电极反应为
D.标况下,消耗,电极生成辛腈
13.乙烷催化裂解制备乙烯和氢气的反应式为,工业上在裂解过程中可以实现边反应边分离出生成的氢气。在不同温度下,在1.0L恒容密闭容器中发生该反应。的移出率[]不同时,乙烷的平衡转化率与温度的关系如图所示。下列说法不正确的是( )
A.由图可知:
B.加入催化剂增大了活化分子百分数,但该反应的不变
C.则B点体系中乙烯的体积分数约为50%
D.若A点,平衡常数,的移出率为20%
14.观察下列模型,判断下列说法错误的是( )
金刚石 碳化硅 二氧化硅 石墨烯
A.物质的量相同的金刚石和碳化硅,共价键个数之比为1∶1
B.晶体中Si和Si-O键个数比为1∶4
C.石墨烯中碳原子和六元环个数比为2∶1
D.晶体堆积属于分子密堆积
二、非选择题:本大题共4小题,共58分。
15.金属钒(V)被称为钢铁行业的“维生素”,以钒矿石焙砂(主要含,铁的氧化物等)为原料制备的工艺流程如下:
已知:①酸浸液中,钒的存在形式为;
②萃取时,发生反应:。
(1)浸渣的主要成分为_____________(填化学式)。
(2)加入足量铁粉进行还原时,含V微粒发生反应的离子方程式为_____________;还原时,消耗Fe粉量超过还原含V微粒所需的理论值,可能的原因是_____________。
(3)转化步骤的目的是_____________。
(4)无氧条件下煅烧得到的化学方程式为_____________。
(5)称取产品,用硫酸溶解后配成100mL溶液,取25.00mL溶液置于锥形瓶中,加入溶液还原(V元素转化为),后用标准溶液滴定至终点只氧化),消耗标准溶液的体积为。假设杂质不参与反应。则产品中的质量分数是_____________(列出计算式即可)。
(6)某超导含钒锑化物的晶胞及晶体中由V和Sb组成的二维平面如图。
基态V原子M能层电子排布式为_____________。该晶体的化学式为_______________。钒原子周围紧邻的锑原子数为_____________。
16.三氯三(四氢呋喃)合铬(Ⅲ)[]是有机反应中重要的固体催化剂,它易溶于四氢呋喃,极易水解。一种在非水体系中合成的步骤如下:
①制备无水:按图甲组装仪器,称取一定质量的放在反应管中央摊平,通入,打开管式炉加热至660 ℃,水浴加热,反应2 h,得到和光气。
②四氢呋喃除水处理:THF液体中加入干燥剂,蒸馏,收集66 ℃的馏分。
③合成:按图乙组装仪器,称取适量无水和锌粉放入纸质反应管内,双颈烧瓶中加入100 mL无水四氢呋喃,通入,5 min后停止通入,接通冷却水,加热至四氢呋喃沸腾,其蒸汽通过蒸汽导管进入提取管中,在冷凝管中冷凝回流到纸质反应管中,反应2.5 h后通入冷却至室温。在通风橱中处理掉多余的THF,冷却、抽滤、干燥得产品。
回答下列问题:
(1)制备无水的化学方程式是_______。将和一起加热也可制得无水,请解释的作用:_______。
(2)步骤③中四氢呋喃的作用是_______,处理多余的THF可采用的方法为____。
(3)结合平衡移动原理分析:将无水和锌粉放在纸质反应管内的好处是________。产品沿索氏提取器的管_____(填“2”或“3”)流入双颈烧瓶。
(4)已知:碱性条件下,能把Cr(Ⅲ)氧化为;酸性条件下,能把还原为;室温下开始形成沉淀时pH为5,完全沉淀时pH为8。以和为原料制备铬酸铅(,黄色固体,难溶于水),具体实验步骤:边搅拌边向晶体中加入的NaOH溶液至产生的沉淀完全溶解,得到溶液,_______。过滤、冷水洗涤、烘干,得到铬酸铅产品[实验中须使用的试剂:30%的溶液、的醋酸溶液、的溶液]。
17.将转化为HCOOH能有效减少排放。
(1)已知:Ⅰ.
Ⅱ.
Ⅲ.
则___________。
(2)时,水在Mn粉表面产生和再与反应产生甲酸。
①由制备甲酸的化学方程式为__________。
②直接加热与难以生成甲酸,该条件下能较快生成甲酸的原因是__________。
(3)科学家利用在Ru(与Fe同族)基催化剂上加氢成功制得甲酸,其过程如图甲所示。
①与通过加成反应形成中间体X,画出中间体X的结构式:________。
②反应过程中加入NaOH或的目的是________________。
(4)通过电解法转化为的反应机理如图乙所示,Pt电极上覆盖的Nafion膜是一种阳离子交换膜,对浓度不高的有较好的阻拦作用,可让自由通过。
①Sn电极上生成的电极反应式为_________。
②电路中通过的电量与产率的关系如图丙所示,相同条件下,Pt电极有Nafion膜时产率明显提高,但电量后又显著下降,可能原因是_________。
18.有机物H是一种癌症靶向药物的合成中间体,其合成路线如下。
已知:①
②
回答下列问题:
(1)A的化学名称为___________。
(2)C中含氧官能团的名称为___________。
(3)D的结构简式为___________。
(4)已知为平面结构,其中氮原子的孤电子对位于___________轨道上。
(5)试剂X为___________。
(6)B的同分异构体中同时满足下列条件的共有___________种(不考虑立体异构)。
①苯环上有两个取代基;②可发生银镜反应;③含有不存在键。
其中核磁共振氢谱显示有四组峰,峰面积比为3:2:2:1的结构简式为___________。
答案以及解析
1.答案:B
解析:A.商周石蛇的成分是硅酸盐,故不选A;
B.蛇纹铜提链罐是青铜器,铜是金属材料,故选B;
C.唐彩绘生肖蛇陶俑属于陶瓷,主要成分是硅酸盐,故不选C;
D.清青玉十二辰-蛇主要成分是玉石,故不选D;
选B。
2.答案:A
解析:A.金属汞有挥发性,不慎将金属汞洒落地面,必须尽可能收集,然后用硫磺粉覆盖,A正确;
B.金属钠着火时生成过氧化钠,过氧化钠与反应生成,不能用二氧化碳灭火器灭钠着火,B项错误;
C.稀释浓硫酸时,酸溅到皮肤上,先用干抹布擦拭,然后大量的水冲洗,最后用3%~5%的溶液冲洗,C错误;
D.蒸馏操作时若忘记加沸石,应立即停止加热,待溶液冷却后加入沸石再加热,D错误;
答案选A。
3.答案:C
解析:A.浓硫酸脱水性使纸张等有机物碳化变黑,故A错误;
B.氨气易液化,液氨气化时会从周围环境中吸收大量的热量,导致环境温度降低,故液氨常用作制冷剂,故B错误;
C.二氧化硫能杀菌消毒,具有还原性,具有抗氧化作用,如葡萄酒中可用二氧化硫抗氧化剂,故C正确;
D.氯水中含有次氯酸,次氯酸具有漂白性,能漂白试纸,不能用pH试纸测其pH,故D错误;
故选:C。
4.答案:C
解析:A.向溶液中加过量盐酸生成铝盐,其反应的离子方程式为,故A正确;
B.将少量溴水滴入过量的溶液中,过量的与结合生成,离子方程式为,故B正确;
C.溶液中通入过量气体生成和S,离子反应为,故C错误;
D.氨水过量,生成的氢氧化铜溶解生成,离子方程式为,故D正确;
答案选C。
5.答案:D
解析:由于单键能旋转,X分子中两个—中的碳原子不一定与苯环共平面,A错误;Y中含1个醛基,醛基有还原性,可与溴水发生氧化还原反应,使溴水褪色,B错误;Z中含有酚羟基和碳碳双键,酚羟基的对位氢和1个邻位氢能与溴水发生取代反应,碳碳双键可以和溴水发生加成反应,则1 mol Z与溴水混合,最多能消耗3 mol ,C错误;X中有酚羟基,Y中有醛基和与苯环直接相连的甲基,Z中有酚羟基、碳碳双键和与苯环直接相连的甲基,X、Y、Z均能使酸性溶液褪色,D正确。
6.答案:C
解析:、时,11.2LCO和的混合气体的总物质的量为[注意:标准状况是、],CO与的中子数均为14,故混合气体含有的中子数小于,7错误;石墨中每个碳原子形成3个键,每个键被2个碳原子共用,故每个碳原子平均形成1.5个键,12g石墨中含1mol碳原子,则所含非极性键数目为,B错误;由题给化学方程式知,该反应中每消耗,转移,减少的固体质量为,则固体质量每减少28g,转移电子数目为,C正确;中铝离子数目为,结合铝离子会发生水解,故该溶液中数目小于,D错误。
7.答案:A
解析:Ⅱ=总反应式-Ⅰ-Ⅲ,则反应Ⅱ为,,A正确;平衡常数只能体现反应进行的程度,无法表示反应的速率快慢,即由平衡常数不能确定Ⅲ比Ⅰ快,B错误;其他条件不变的情况下,升高温度,平衡向吸热反应方向移动,题中未给出反应Ⅰ、Ⅲ的反应热,则不能确定升高温度的变化,C错误;参与反应,在Ⅰ中生成,Ⅲ中被消耗,是中间产物,D错误。
8.答案:C
解析:A.BXA分子中含有酮羰基、羟基、酰胺基、醚键四种含氧官能团,A不正确;
B.反应生成HCl,碳酸钾既起增大反应速率的作用,又起减少生成物浓度,促进平衡正向移动的作用,B不正确;
C.玛巴洛沙韦分子中,有的碳原子形成1个双键(1个σ键和1个π键)和2个单键(或3个σ键和1个大π键),有的碳原子形成4个单键(都为σ键),碳原子的孤电子对数都为0,则碳原子的杂化方式有两种,C正确;
D.玛巴洛沙韦中,带“ ”的碳原子都为手性碳原子,D不正确;
故选C。
9.答案:D
解析:A.CuS不溶于稀硫酸而FeS溶解,说明FeS的溶度积()较大,能够与反应生成,而CuS的极小,难以反应。因此推论错误,实际应为,A错误;
B.NaClO溶液pH为9.7,说明水解使溶液呈碱性,间接证明HClO为弱酸;但实验操作存在问题:NaClO具有强氧化性,可能漂白pH试纸,导致结果不可靠,B错误;
C.玻璃棒含钠元素,直接灼烧会显示黄色火焰,干扰实验结果;正确的焰色反应应使用铂丝或光洁铁丝。因此现象无法证明溶液含,C错误;
D.等浓度等体积的与氨水混合后,生成;溶液呈中性时,结合电荷守恒可知,,推论正确,D正确;
故选D。
10.答案:D
解析:一定温度下,增大,等效于在原平衡中加入,虽然平衡正向移动,但是的平衡转化率减小,C错误;的选择性,需研发转化率高和选择性高的催化剂,D正确。
11.答案:D
解析:A.断裂化学键吸收能量,形成化学键释放能量,则图甲所示的化学反应放出热量为,A错误;
B.图甲反应中存在N-H和氮氧键的断裂、氢氧键的形成,即有极性共价键的断裂和形成;存在氮氮三键的形成,即有非极性共价键的形成,但没有非极性共价键的断裂,B错误;
C.图乙所示反应③中被氧化为,被还原生成,则为氧化剂,为还原剂,根据得失电子守恒可得关系式:,则氧化剂与还原剂物质的量之比为,C错误;
D.根据图乙可知,反应②为和NO反应生成和,其化学方程式为:,D正确;
故选D。
12.答案:C
解析:根据图示,二氧化碳在电极得电子生成,是阴极;在失电子发生氧化反应生成,是阳极。向电极移动,可知电解质溶液呈碱性。
A.在失电子发生氧化反应生成,电极为阳极,故A正确;
B.二氧化碳在电极得电子生成,电极发生还原反应,故B正确;
C.在失电子发生氧化反应生成,电解质溶液呈碱性,电极反应为,故C错误;
D.二氧化碳在电极得电子生成,碳元素化合价由+4降低为+2价,标况下,消耗,电路中转移2mol电子,根据,电极生成0.5mol辛腈,生成辛腈的质量为,故D正确;
选C。
13.答案:C
解析:A.分离出氢气会促进平衡正向移动,从而提高乙烷的转化率,因此氢气的移出率越高,乙烷的平衡转化率越大,则,故A正确;
B.催化剂可降低反应活化能,增大活化分子百分数,加快反应速率,但不影响,故B正确;
C.设乙烷的起始量为1mol,结合已知条件列三段式:,,则此时体系内剩余氢气的物质的量为0.9×(1-66.7%)=0.3,B点体系中乙烯的体积分数约为,故C错误;
D.A点时乙烷的转化率为60%,结合已知列三段式:,,,的移出率=,故D正确;
故选:C。
14.答案:A
解析:A.假设金刚石和碳化硅的物质的量均为1mol,金刚石中每个碳原子连接四根共价键,但每根共价键被两个环共用,因此每个碳原子实际连接根共价键,可知1mol金刚石中含有2molC-C键;1molSiC中有1mol碳原子和1mol硅原子,每个原子通过共价键连接到其他原子,形成Si-C键。由于每个共价键是两个原子共有的,因此每个原子独占的键数是总键数的一半,即2mol,由于碳原子和硅原子的数量相等,因此总共有4molSi-C键;可知物质的量相同的金刚石和碳化硅,共价键个数之比为1∶2,故A错误;
B.晶体中1个硅原子形成4个共价键,Si和Si-O键个数比为1∶4,故B正确;
C.石墨烯中1个六元环平均含有个碳,则碳原子和六元环个数比为2∶1,故C正确;
D.晶体为分子晶体,其堆积属于分子密堆积,故D正确;
故答案选A。
15.答案:(1)
(2)溶液中会消耗Fe粉
(3)将+4价V氧化为+5价V
(4)
(5)
(6);;6
解析:(1)由流程梳理分析可知,浸渣的主要成分为。
(2)根据质量守恒,化合价升降守恒可写出反应的离子方程式为。酸浸时,溶液中含有,二者都会消耗Fe粉,导致Fe粉消耗量增多。
(3)反萃取后得到的中V的化合价为+4,用氨水沉钒后得到的中V的化合价为+5,则转化的目的是将+4价V氧化为+5价V。
(4)根据质量守恒和已知的反应物,生成物可写出煅烧的反应方程式为。
(5)第一步,根据滴定原理,找出相关物质的关系式。用硫酸溶解后转化为,加入溶液发生反应,反应后加入标准溶液发生反应。则可得关系式,。第二步,计算出25.00mL溶液中的物质的量。初始加入体系的,标准溶液消耗的,则25.00mL溶液中。第三步,计算产品中的质量分数。产品中的质量分数=。
(6)该晶胞中Cs的个数为,的个数为,V的个数为,则该晶体的化学式为。以位于体心的V原子为研究对象,钒原子周围紧邻的锑原子数为6。
16.答案:(1);与反应生成的HCl可抑制水解
(2)反应物和萃取剂 蒸馏
(3)产物可及时脱离反应体系,促进平衡正向移动,有利于提高产率3
(4)边搅拌边向溶液中加足量30%的溶液,充分反应后煮沸(除去过量的),向溶液中滴加的醋酸溶液,调节溶液的pH略低于5,滴加的溶液,产生大量沉淀,静置后,向上层清液中继续滴加的溶液不出现黄色沉淀
解析:(1)在660 ℃下,和反应生成、COCl,化学方程式为;极易水解,而与反应生成的HCl可抑制水解。
(2)由题给信息可知,THF为反应物,另外不溶于四氢呋喃,易溶于四氢呋喃,四氢呋喃在双颈烧瓶和纸质反应管中循环,可实现四氢呋喃与CrCl 的连续反应以及产物的连续萃取,则THF还是萃取剂;根据步骤②的操作可知,THF的沸点低,因此处理多余的THF可采用蒸馏的方法。
(3)不溶于THF而目标产物易溶于THF,与锌粉留在纸质反应管中,而目标产物可及时脱离反应体系,促进平衡正向移动,有利于提高产率;根据虹吸原理,管3利用虹吸原理使产品与THF流入双颈烧瓶,管2是平衡气压的。
(4)由已知信息知,得到碱性溶液后,可加入将氧化为,为防止酸性条件下,转化为后被过量的还原,调pH前可通过加热煮沸的方法除去过量的,之后调节溶液pH略小于5,再加入溶液制得,具体操作见答案。
17.答案:(1)
(2)①
②反应生成的MnO是与反应的催化剂
(3)①
②降低HCOOH浓度,使正向进行程度增大
(4)①(或)
②Nafion膜可以阻止在阳极放电;电量>1000C后,增大,Nafion膜阻拦作用下降
解析:(1)反应Ⅱ反应Ⅰ反应Ⅲ可得反应,则。
(2)①由题意可知,条件下水与锰,二氧化碳反应生成氧化锰和甲酸,反应的化学方程式为;
②直接加热氢气与二氧化碳难以生成甲酸,而①中条件下能较快生成甲酸,说明氧化锰是氢气和二氧化碳反应生成甲酸的催化剂,催化剂能降低反应的活化能,加快反应速率。
(3)①Ru与F同族,催化时更易与显负电性的O相连,则二氧化碳与Ru—H发生加成反应生成HCOORu,X的结构式为;
(2)HCOOH为一元酸,反应过程中加入氢氧化钠或氨气可以将甲酸转化为,使反应正向进行程度增大。
(4)①由题图可知,铂电极是阳极,水在阳极失去电子发生氧化反应生成氧气和,锡电极是电解池的阴极,二氧化碳在阴极得到电子与作用生成和,则锡电极上生成甲酸根离子的电极反应式为,刚开始时,电解液中溶质为,溶液呈碱性,故得电子生成过程中的氢原子由提供,电极反应式为。
②已知Nafion膜对浓度不高的有较好的阻拦作用,则Nafion膜可以阻止甲酸根离子在阳极放电,电路中通过电量较低时,相同条件下,铂电极有Nafion膜时的产率大于无Nafion膜;电量大于1000 C后,的产率显著下降说明的浓度增大,Nafion膜阻拦作用下降,导致甲酸根离子在阳极放电使得甲酸根离子的产率下降。
18.答案:(1)3-氟苯胺或间氟苯胺
(2)酰胺基、醛基
(3)
(4)杂化或或杂化
(5)
(6)9;
解析:A与发生取代反应生成B,根据已知②,B在、DMF作用下生成C,根据E的结构可知,C在碱性条件下加热生成D(),再芳构化为E,E与发生取代反应生成F,F在、DMF作用下生成G,根据H的结构和已知①可知,F和生成H。
(1)根据A的结构,名称为3-氟苯胺或间氟苯胺。
(2)根据C的结构,含氧官能团为酰胺基、醛基。
(3)据分析,D的结构简式为。
(4)为平面结构,则所有C、N原子均为杂化,因此氮原子的孤电子对位于杂化轨道。
(5)据分析,试剂X为。
(6)根据已知,B的同分异构体为和、和-F、和-F二取代的苯环,则共有9种同分异构体,其中核磁共振氢谱显示有四组峰,峰面积比为3:2:2:1,则分子中有甲基、-CHO,且为对位取代苯环,则结构简式为。
化学(安徽专版) 分值:100分 时间:75分钟
可能用到的相对原子质量:H—1、C—12、N—14、O—16、V—51
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.蛇是十二生肖之一,下列有关蛇的历史文物中,主要材质为金属材料的是( )
A商周石蛇 B春秋蛇纹铜提链罐
C唐彩绘生肖蛇陶俑 D清青玉十二辰-蛇
A.A B.B C.C D.D
2.下列实验事故的处理方法合理的是( )
选项 实验事故 处理方法
A 不慎将金属汞洒落地面 必须尽可能收集,然后用硫磺粉覆盖
B 金属钠着火 快速用二氧化碳灭火器灭火
C 稀释浓硫酸时,酸溅到皮肤上 用3%~5%的烧碱溶液冲洗
D 蒸馏操作时忘记加沸石 停止加热,立即加入沸石再加热
A.A B.B C.C D.D
3.下列物质的性质或用途说法正确的是( )
A.浓硫酸有酸性,遇蓝色石蕊试纸,试纸变红色
B.氨气不能用来作制冷剂
C.能杀菌消毒防腐,可用作食品添加剂
D.pH试纸能用来测定新制氯水的pH
4.化学反应中,量变可以引起质变。下列反应离子方程式书写错误的是( )
A.溶液中加入过量的盐酸:
B.溴水中加入过量的溶液:
C.溶液中通入过量的气体:
D.溶液中加入过量的氨水:
5.丹皮酚因其特殊的结构而具有显著的药理活性,常被作为先导物用于构建多种衍生物,一种丹皮酚查尔酮的合成路线如下。
下列说法正确的是( )
A.X分子中所有碳原子一定共平面
B.Y不能使溴水褪色
C.1 mol Z与溴水混合,最多能消耗4 mol
D.X、Y、Z均能使酸性溶液褪色
6.AlN是一种半导体材料,一种制备方法是,设为阿伏加德罗常数的值。下列说法正确的是( )
A.时,11.2LCO和的混合气体含中子数目为
B.12 gC(石墨)含非极性键数目为
C.该反应中固体质量每减少28g,转移电子数目为
D.溶于足量盐酸,溶液中的数目为
7.有研究认为,强碱性环境下反应可能按如下三步进行。
Ⅰ.
Ⅱ.
Ⅲ.
下列说法正确的是( )
A.Ⅱ的平衡常数表达式为
B.由平衡常数可以判断Ⅲ比Ⅰ快
C.升高温度会使变小,变大
D.是反应的催化剂
8.抗流感药物玛巴洛沙韦的部分合成工艺路线如下图所示,下列说法正确的是( )
A.BXA中有三种含氧官能团
B.碳酸钾只起增大反应速率的作用
C.玛巴洛沙韦中碳原子的杂化方式有两种
D.玛巴洛沙韦不含手性碳原子
9.下列实验操作、现象及相应推论均正确的是( )
选项 实验操作及现象 推论
A 分别向CuS固体和FeS固体中加入足量等浓度的稀硫酸,CuS固体不溶,FeS固体溶解
B 用试纸测定溶液为9.7 HClO为弱酸
C 用洁净的玻璃棒蘸取某溶液在外焰上灼烧,火焰呈黄色 溶液的溶质含Na元素
D 常温下,将等浓度溶液与氨水等体积混合,溶液呈中性 溶液中
A.A B.B C.C D.D
10.催化加氢制的反应体系中,发生的主要反应如下:
反应1:
反应2:
恒压下,将的混合气体以一定流速通过装有催化剂的反应管,测得出口处的转化率及和CO的选择性随温度的变化如图所示。下列说法正确的是( )
A.曲线③表示CO的选择性
B.时出口处CO的物质的量小于时
C.一定温度下,增大可提高平衡转化率
D.为提高产率,需研发转化率高和选择性高的催化剂
11.催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图甲所示。有氧条件下,催化还原NO的反应历程如图乙所示。下列说法正确的是( )
A.图甲所示的化学反应放出热量为bkJ
B.图甲反应中既有极性共价键的断裂和形成,又有非极性共价键的断裂和形成
C.图乙所示反应③中氧化剂与还原剂物质的量之比为
D.图乙中反应②为
12.我国科学家以辛胺为原料,实现了甲酸和辛腈的高选择性合成,装置如下图,下列说法错误的是( )
A.电极为阳极
B.电极发生还原反应
C.电极反应为
D.标况下,消耗,电极生成辛腈
13.乙烷催化裂解制备乙烯和氢气的反应式为,工业上在裂解过程中可以实现边反应边分离出生成的氢气。在不同温度下,在1.0L恒容密闭容器中发生该反应。的移出率[]不同时,乙烷的平衡转化率与温度的关系如图所示。下列说法不正确的是( )
A.由图可知:
B.加入催化剂增大了活化分子百分数,但该反应的不变
C.则B点体系中乙烯的体积分数约为50%
D.若A点,平衡常数,的移出率为20%
14.观察下列模型,判断下列说法错误的是( )
金刚石 碳化硅 二氧化硅 石墨烯
A.物质的量相同的金刚石和碳化硅,共价键个数之比为1∶1
B.晶体中Si和Si-O键个数比为1∶4
C.石墨烯中碳原子和六元环个数比为2∶1
D.晶体堆积属于分子密堆积
二、非选择题:本大题共4小题,共58分。
15.金属钒(V)被称为钢铁行业的“维生素”,以钒矿石焙砂(主要含,铁的氧化物等)为原料制备的工艺流程如下:
已知:①酸浸液中,钒的存在形式为;
②萃取时,发生反应:。
(1)浸渣的主要成分为_____________(填化学式)。
(2)加入足量铁粉进行还原时,含V微粒发生反应的离子方程式为_____________;还原时,消耗Fe粉量超过还原含V微粒所需的理论值,可能的原因是_____________。
(3)转化步骤的目的是_____________。
(4)无氧条件下煅烧得到的化学方程式为_____________。
(5)称取产品,用硫酸溶解后配成100mL溶液,取25.00mL溶液置于锥形瓶中,加入溶液还原(V元素转化为),后用标准溶液滴定至终点只氧化),消耗标准溶液的体积为。假设杂质不参与反应。则产品中的质量分数是_____________(列出计算式即可)。
(6)某超导含钒锑化物的晶胞及晶体中由V和Sb组成的二维平面如图。
基态V原子M能层电子排布式为_____________。该晶体的化学式为_______________。钒原子周围紧邻的锑原子数为_____________。
16.三氯三(四氢呋喃)合铬(Ⅲ)[]是有机反应中重要的固体催化剂,它易溶于四氢呋喃,极易水解。一种在非水体系中合成的步骤如下:
①制备无水:按图甲组装仪器,称取一定质量的放在反应管中央摊平,通入,打开管式炉加热至660 ℃,水浴加热,反应2 h,得到和光气。
②四氢呋喃除水处理:THF液体中加入干燥剂,蒸馏,收集66 ℃的馏分。
③合成:按图乙组装仪器,称取适量无水和锌粉放入纸质反应管内,双颈烧瓶中加入100 mL无水四氢呋喃,通入,5 min后停止通入,接通冷却水,加热至四氢呋喃沸腾,其蒸汽通过蒸汽导管进入提取管中,在冷凝管中冷凝回流到纸质反应管中,反应2.5 h后通入冷却至室温。在通风橱中处理掉多余的THF,冷却、抽滤、干燥得产品。
回答下列问题:
(1)制备无水的化学方程式是_______。将和一起加热也可制得无水,请解释的作用:_______。
(2)步骤③中四氢呋喃的作用是_______,处理多余的THF可采用的方法为____。
(3)结合平衡移动原理分析:将无水和锌粉放在纸质反应管内的好处是________。产品沿索氏提取器的管_____(填“2”或“3”)流入双颈烧瓶。
(4)已知:碱性条件下,能把Cr(Ⅲ)氧化为;酸性条件下,能把还原为;室温下开始形成沉淀时pH为5,完全沉淀时pH为8。以和为原料制备铬酸铅(,黄色固体,难溶于水),具体实验步骤:边搅拌边向晶体中加入的NaOH溶液至产生的沉淀完全溶解,得到溶液,_______。过滤、冷水洗涤、烘干,得到铬酸铅产品[实验中须使用的试剂:30%的溶液、的醋酸溶液、的溶液]。
17.将转化为HCOOH能有效减少排放。
(1)已知:Ⅰ.
Ⅱ.
Ⅲ.
则___________。
(2)时,水在Mn粉表面产生和再与反应产生甲酸。
①由制备甲酸的化学方程式为__________。
②直接加热与难以生成甲酸,该条件下能较快生成甲酸的原因是__________。
(3)科学家利用在Ru(与Fe同族)基催化剂上加氢成功制得甲酸,其过程如图甲所示。
①与通过加成反应形成中间体X,画出中间体X的结构式:________。
②反应过程中加入NaOH或的目的是________________。
(4)通过电解法转化为的反应机理如图乙所示,Pt电极上覆盖的Nafion膜是一种阳离子交换膜,对浓度不高的有较好的阻拦作用,可让自由通过。
①Sn电极上生成的电极反应式为_________。
②电路中通过的电量与产率的关系如图丙所示,相同条件下,Pt电极有Nafion膜时产率明显提高,但电量后又显著下降,可能原因是_________。
18.有机物H是一种癌症靶向药物的合成中间体,其合成路线如下。
已知:①
②
回答下列问题:
(1)A的化学名称为___________。
(2)C中含氧官能团的名称为___________。
(3)D的结构简式为___________。
(4)已知为平面结构,其中氮原子的孤电子对位于___________轨道上。
(5)试剂X为___________。
(6)B的同分异构体中同时满足下列条件的共有___________种(不考虑立体异构)。
①苯环上有两个取代基;②可发生银镜反应;③含有不存在键。
其中核磁共振氢谱显示有四组峰,峰面积比为3:2:2:1的结构简式为___________。
答案以及解析
1.答案:B
解析:A.商周石蛇的成分是硅酸盐,故不选A;
B.蛇纹铜提链罐是青铜器,铜是金属材料,故选B;
C.唐彩绘生肖蛇陶俑属于陶瓷,主要成分是硅酸盐,故不选C;
D.清青玉十二辰-蛇主要成分是玉石,故不选D;
选B。
2.答案:A
解析:A.金属汞有挥发性,不慎将金属汞洒落地面,必须尽可能收集,然后用硫磺粉覆盖,A正确;
B.金属钠着火时生成过氧化钠,过氧化钠与反应生成,不能用二氧化碳灭火器灭钠着火,B项错误;
C.稀释浓硫酸时,酸溅到皮肤上,先用干抹布擦拭,然后大量的水冲洗,最后用3%~5%的溶液冲洗,C错误;
D.蒸馏操作时若忘记加沸石,应立即停止加热,待溶液冷却后加入沸石再加热,D错误;
答案选A。
3.答案:C
解析:A.浓硫酸脱水性使纸张等有机物碳化变黑,故A错误;
B.氨气易液化,液氨气化时会从周围环境中吸收大量的热量,导致环境温度降低,故液氨常用作制冷剂,故B错误;
C.二氧化硫能杀菌消毒,具有还原性,具有抗氧化作用,如葡萄酒中可用二氧化硫抗氧化剂,故C正确;
D.氯水中含有次氯酸,次氯酸具有漂白性,能漂白试纸,不能用pH试纸测其pH,故D错误;
故选:C。
4.答案:C
解析:A.向溶液中加过量盐酸生成铝盐,其反应的离子方程式为,故A正确;
B.将少量溴水滴入过量的溶液中,过量的与结合生成,离子方程式为,故B正确;
C.溶液中通入过量气体生成和S,离子反应为,故C错误;
D.氨水过量,生成的氢氧化铜溶解生成,离子方程式为,故D正确;
答案选C。
5.答案:D
解析:由于单键能旋转,X分子中两个—中的碳原子不一定与苯环共平面,A错误;Y中含1个醛基,醛基有还原性,可与溴水发生氧化还原反应,使溴水褪色,B错误;Z中含有酚羟基和碳碳双键,酚羟基的对位氢和1个邻位氢能与溴水发生取代反应,碳碳双键可以和溴水发生加成反应,则1 mol Z与溴水混合,最多能消耗3 mol ,C错误;X中有酚羟基,Y中有醛基和与苯环直接相连的甲基,Z中有酚羟基、碳碳双键和与苯环直接相连的甲基,X、Y、Z均能使酸性溶液褪色,D正确。
6.答案:C
解析:、时,11.2LCO和的混合气体的总物质的量为[注意:标准状况是、],CO与的中子数均为14,故混合气体含有的中子数小于,7错误;石墨中每个碳原子形成3个键,每个键被2个碳原子共用,故每个碳原子平均形成1.5个键,12g石墨中含1mol碳原子,则所含非极性键数目为,B错误;由题给化学方程式知,该反应中每消耗,转移,减少的固体质量为,则固体质量每减少28g,转移电子数目为,C正确;中铝离子数目为,结合铝离子会发生水解,故该溶液中数目小于,D错误。
7.答案:A
解析:Ⅱ=总反应式-Ⅰ-Ⅲ,则反应Ⅱ为,,A正确;平衡常数只能体现反应进行的程度,无法表示反应的速率快慢,即由平衡常数不能确定Ⅲ比Ⅰ快,B错误;其他条件不变的情况下,升高温度,平衡向吸热反应方向移动,题中未给出反应Ⅰ、Ⅲ的反应热,则不能确定升高温度的变化,C错误;参与反应,在Ⅰ中生成,Ⅲ中被消耗,是中间产物,D错误。
8.答案:C
解析:A.BXA分子中含有酮羰基、羟基、酰胺基、醚键四种含氧官能团,A不正确;
B.反应生成HCl,碳酸钾既起增大反应速率的作用,又起减少生成物浓度,促进平衡正向移动的作用,B不正确;
C.玛巴洛沙韦分子中,有的碳原子形成1个双键(1个σ键和1个π键)和2个单键(或3个σ键和1个大π键),有的碳原子形成4个单键(都为σ键),碳原子的孤电子对数都为0,则碳原子的杂化方式有两种,C正确;
D.玛巴洛沙韦中,带“ ”的碳原子都为手性碳原子,D不正确;
故选C。
9.答案:D
解析:A.CuS不溶于稀硫酸而FeS溶解,说明FeS的溶度积()较大,能够与反应生成,而CuS的极小,难以反应。因此推论错误,实际应为,A错误;
B.NaClO溶液pH为9.7,说明水解使溶液呈碱性,间接证明HClO为弱酸;但实验操作存在问题:NaClO具有强氧化性,可能漂白pH试纸,导致结果不可靠,B错误;
C.玻璃棒含钠元素,直接灼烧会显示黄色火焰,干扰实验结果;正确的焰色反应应使用铂丝或光洁铁丝。因此现象无法证明溶液含,C错误;
D.等浓度等体积的与氨水混合后,生成;溶液呈中性时,结合电荷守恒可知,,推论正确,D正确;
故选D。
10.答案:D
解析:一定温度下,增大,等效于在原平衡中加入,虽然平衡正向移动,但是的平衡转化率减小,C错误;的选择性,需研发转化率高和选择性高的催化剂,D正确。
11.答案:D
解析:A.断裂化学键吸收能量,形成化学键释放能量,则图甲所示的化学反应放出热量为,A错误;
B.图甲反应中存在N-H和氮氧键的断裂、氢氧键的形成,即有极性共价键的断裂和形成;存在氮氮三键的形成,即有非极性共价键的形成,但没有非极性共价键的断裂,B错误;
C.图乙所示反应③中被氧化为,被还原生成,则为氧化剂,为还原剂,根据得失电子守恒可得关系式:,则氧化剂与还原剂物质的量之比为,C错误;
D.根据图乙可知,反应②为和NO反应生成和,其化学方程式为:,D正确;
故选D。
12.答案:C
解析:根据图示,二氧化碳在电极得电子生成,是阴极;在失电子发生氧化反应生成,是阳极。向电极移动,可知电解质溶液呈碱性。
A.在失电子发生氧化反应生成,电极为阳极,故A正确;
B.二氧化碳在电极得电子生成,电极发生还原反应,故B正确;
C.在失电子发生氧化反应生成,电解质溶液呈碱性,电极反应为,故C错误;
D.二氧化碳在电极得电子生成,碳元素化合价由+4降低为+2价,标况下,消耗,电路中转移2mol电子,根据,电极生成0.5mol辛腈,生成辛腈的质量为,故D正确;
选C。
13.答案:C
解析:A.分离出氢气会促进平衡正向移动,从而提高乙烷的转化率,因此氢气的移出率越高,乙烷的平衡转化率越大,则,故A正确;
B.催化剂可降低反应活化能,增大活化分子百分数,加快反应速率,但不影响,故B正确;
C.设乙烷的起始量为1mol,结合已知条件列三段式:,,则此时体系内剩余氢气的物质的量为0.9×(1-66.7%)=0.3,B点体系中乙烯的体积分数约为,故C错误;
D.A点时乙烷的转化率为60%,结合已知列三段式:,,,的移出率=,故D正确;
故选:C。
14.答案:A
解析:A.假设金刚石和碳化硅的物质的量均为1mol,金刚石中每个碳原子连接四根共价键,但每根共价键被两个环共用,因此每个碳原子实际连接根共价键,可知1mol金刚石中含有2molC-C键;1molSiC中有1mol碳原子和1mol硅原子,每个原子通过共价键连接到其他原子,形成Si-C键。由于每个共价键是两个原子共有的,因此每个原子独占的键数是总键数的一半,即2mol,由于碳原子和硅原子的数量相等,因此总共有4molSi-C键;可知物质的量相同的金刚石和碳化硅,共价键个数之比为1∶2,故A错误;
B.晶体中1个硅原子形成4个共价键,Si和Si-O键个数比为1∶4,故B正确;
C.石墨烯中1个六元环平均含有个碳,则碳原子和六元环个数比为2∶1,故C正确;
D.晶体为分子晶体,其堆积属于分子密堆积,故D正确;
故答案选A。
15.答案:(1)
(2)溶液中会消耗Fe粉
(3)将+4价V氧化为+5价V
(4)
(5)
(6);;6
解析:(1)由流程梳理分析可知,浸渣的主要成分为。
(2)根据质量守恒,化合价升降守恒可写出反应的离子方程式为。酸浸时,溶液中含有,二者都会消耗Fe粉,导致Fe粉消耗量增多。
(3)反萃取后得到的中V的化合价为+4,用氨水沉钒后得到的中V的化合价为+5,则转化的目的是将+4价V氧化为+5价V。
(4)根据质量守恒和已知的反应物,生成物可写出煅烧的反应方程式为。
(5)第一步,根据滴定原理,找出相关物质的关系式。用硫酸溶解后转化为,加入溶液发生反应,反应后加入标准溶液发生反应。则可得关系式,。第二步,计算出25.00mL溶液中的物质的量。初始加入体系的,标准溶液消耗的,则25.00mL溶液中。第三步,计算产品中的质量分数。产品中的质量分数=。
(6)该晶胞中Cs的个数为,的个数为,V的个数为,则该晶体的化学式为。以位于体心的V原子为研究对象,钒原子周围紧邻的锑原子数为6。
16.答案:(1);与反应生成的HCl可抑制水解
(2)反应物和萃取剂 蒸馏
(3)产物可及时脱离反应体系,促进平衡正向移动,有利于提高产率3
(4)边搅拌边向溶液中加足量30%的溶液,充分反应后煮沸(除去过量的),向溶液中滴加的醋酸溶液,调节溶液的pH略低于5,滴加的溶液,产生大量沉淀,静置后,向上层清液中继续滴加的溶液不出现黄色沉淀
解析:(1)在660 ℃下,和反应生成、COCl,化学方程式为;极易水解,而与反应生成的HCl可抑制水解。
(2)由题给信息可知,THF为反应物,另外不溶于四氢呋喃,易溶于四氢呋喃,四氢呋喃在双颈烧瓶和纸质反应管中循环,可实现四氢呋喃与CrCl 的连续反应以及产物的连续萃取,则THF还是萃取剂;根据步骤②的操作可知,THF的沸点低,因此处理多余的THF可采用蒸馏的方法。
(3)不溶于THF而目标产物易溶于THF,与锌粉留在纸质反应管中,而目标产物可及时脱离反应体系,促进平衡正向移动,有利于提高产率;根据虹吸原理,管3利用虹吸原理使产品与THF流入双颈烧瓶,管2是平衡气压的。
(4)由已知信息知,得到碱性溶液后,可加入将氧化为,为防止酸性条件下,转化为后被过量的还原,调pH前可通过加热煮沸的方法除去过量的,之后调节溶液pH略小于5,再加入溶液制得,具体操作见答案。
17.答案:(1)
(2)①
②反应生成的MnO是与反应的催化剂
(3)①
②降低HCOOH浓度,使正向进行程度增大
(4)①(或)
②Nafion膜可以阻止在阳极放电;电量>1000C后,增大,Nafion膜阻拦作用下降
解析:(1)反应Ⅱ反应Ⅰ反应Ⅲ可得反应,则。
(2)①由题意可知,条件下水与锰,二氧化碳反应生成氧化锰和甲酸,反应的化学方程式为;
②直接加热氢气与二氧化碳难以生成甲酸,而①中条件下能较快生成甲酸,说明氧化锰是氢气和二氧化碳反应生成甲酸的催化剂,催化剂能降低反应的活化能,加快反应速率。
(3)①Ru与F同族,催化时更易与显负电性的O相连,则二氧化碳与Ru—H发生加成反应生成HCOORu,X的结构式为;
(2)HCOOH为一元酸,反应过程中加入氢氧化钠或氨气可以将甲酸转化为,使反应正向进行程度增大。
(4)①由题图可知,铂电极是阳极,水在阳极失去电子发生氧化反应生成氧气和,锡电极是电解池的阴极,二氧化碳在阴极得到电子与作用生成和,则锡电极上生成甲酸根离子的电极反应式为,刚开始时,电解液中溶质为,溶液呈碱性,故得电子生成过程中的氢原子由提供,电极反应式为。
②已知Nafion膜对浓度不高的有较好的阻拦作用,则Nafion膜可以阻止甲酸根离子在阳极放电,电路中通过电量较低时,相同条件下,铂电极有Nafion膜时的产率大于无Nafion膜;电量大于1000 C后,的产率显著下降说明的浓度增大,Nafion膜阻拦作用下降,导致甲酸根离子在阳极放电使得甲酸根离子的产率下降。
18.答案:(1)3-氟苯胺或间氟苯胺
(2)酰胺基、醛基
(3)
(4)杂化或或杂化
(5)
(6)9;
解析:A与发生取代反应生成B,根据已知②,B在、DMF作用下生成C,根据E的结构可知,C在碱性条件下加热生成D(),再芳构化为E,E与发生取代反应生成F,F在、DMF作用下生成G,根据H的结构和已知①可知,F和生成H。
(1)根据A的结构,名称为3-氟苯胺或间氟苯胺。
(2)根据C的结构,含氧官能团为酰胺基、醛基。
(3)据分析,D的结构简式为。
(4)为平面结构,则所有C、N原子均为杂化,因此氮原子的孤电子对位于杂化轨道。
(5)据分析,试剂X为。
(6)根据已知,B的同分异构体为和、和-F、和-F二取代的苯环,则共有9种同分异构体,其中核磁共振氢谱显示有四组峰,峰面积比为3:2:2:1,则分子中有甲基、-CHO,且为对位取代苯环,则结构简式为。
同课章节目录
