湖南省岳阳市岳阳县第一中学2024-2025学年高二下学期4月月考 化学试题(含答案)
文档属性
| 名称 | 湖南省岳阳市岳阳县第一中学2024-2025学年高二下学期4月月考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 21:19:58 | ||
图片预览


文档简介
2025年4月高二下学期化学月考试题
一、单选题(每题3分,共48分)
1.文物记载中华文明的灿烂成就。下列珍贵文物的主要材料属于共价晶体的是
A.宋蕉叶形水晶杯 B.清白玻璃盖罐
C.商青铜龙鼎 D.宋彩绘木雕观音
A.A B.B C.C D.D
2.下列关于粒子结构的描述错误的是
A.CS2、C2H2、BeCl2都是直线形分子
B.CCl4和CH2Cl2均是四面体构型的非极性分子
C.H2S和NH3均是由极性键构成的极性分子
D.HCl和HS-均是含有一个极性键的18电子粒子
3.下列关于有机物同分异构体数目的分析不正确的是
A.C6H14含四个甲基的同分异构体有2种
B.(CH3CH2)2CHCH3的一氯代物有4种
C.分子式为C4H10的有机物的二氯取代物有12种
D.“立方烷”C8H8,如图所示,呈正六面体结构,其六氯代物有3种
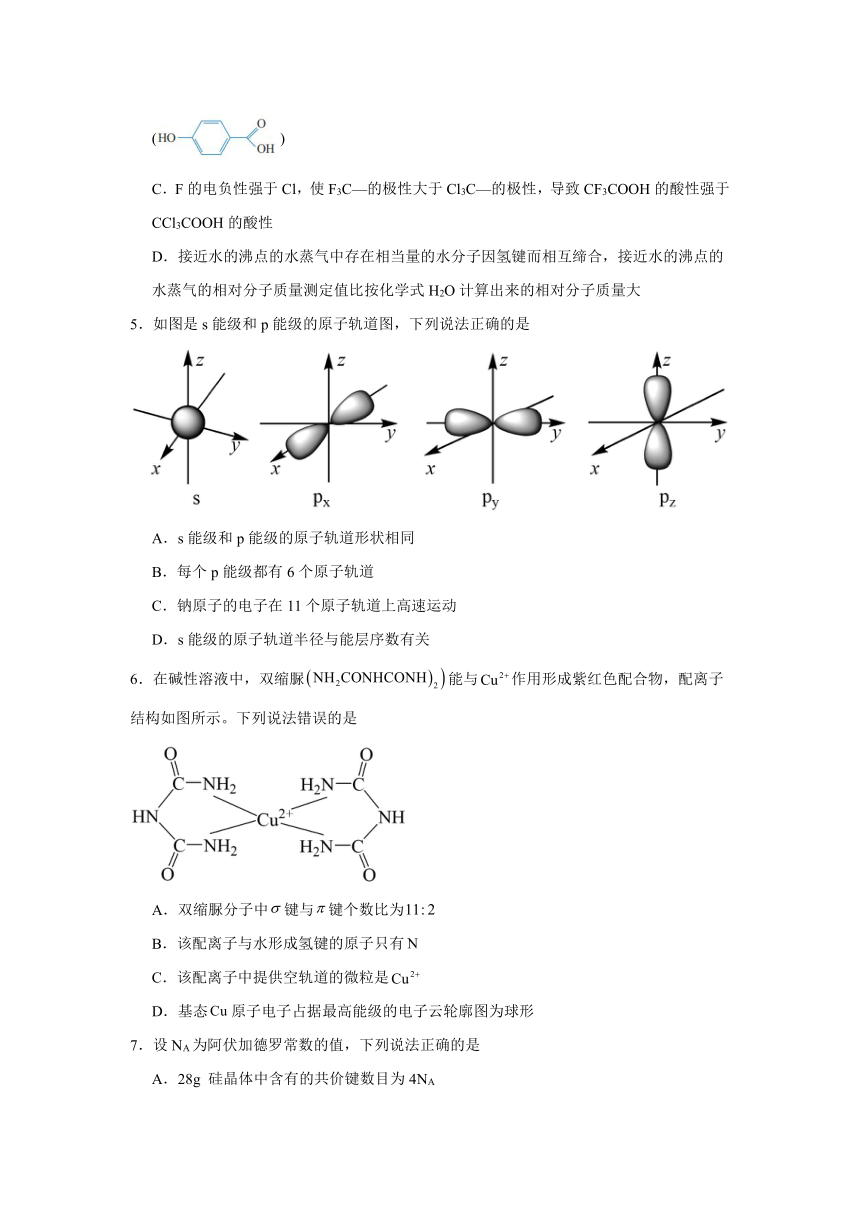
4.物质结构决定其性质,下列有关物质结构与性质的描述中,错误的是
A.臭氧的极性很微弱,它在四氯化碳中的溶解度高于在水中的溶解度
B.邻羟基苯甲酸()含分子内氢键,其熔沸点高于对羟基苯甲酸()
C.F的电负性强于Cl,使F3C—的极性大于Cl3C—的极性,导致CF3COOH的酸性强于CCl3COOH的酸性
D.接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,接近水的沸点的水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大
5.如图是s能级和p能级的原子轨道图,下列说法正确的是
A.s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.钠原子的电子在11个原子轨道上高速运动
D.s能级的原子轨道半径与能层序数有关
6.在碱性溶液中,双缩脲能与作用形成紫红色配合物,配离子结构如图所示。下列说法错误的是
A.双缩脲分子中键与键个数比为
B.该配离子与水形成氢键的原子只有
C.该配离子中提供空轨道的微粒是
D.基态原子电子占据最高能级的电子云轮廓图为球形
7.设NA为阿伏加德罗常数的值,下列说法正确的是
A.28g 硅晶体中含有的共价键数目为4NA
B.常温常压下,23g乙醇(CH3CH2OH)中所含sp3杂化的原子数目为NA
C.标准状况下,22.4L乙炔含有π键数目为2NA
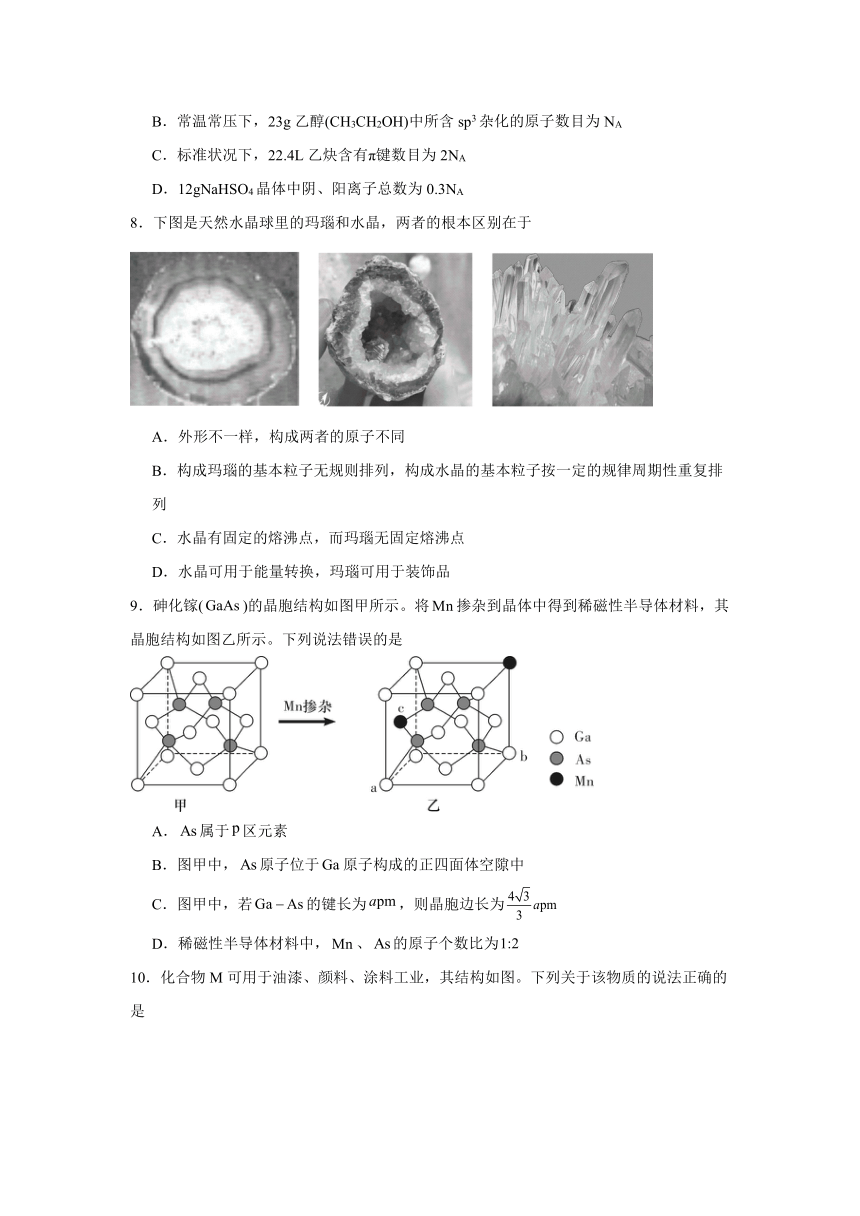
D.12gNaHSO4晶体中阴、阳离子总数为0.3NA
8.下图是天然水晶球里的玛瑙和水晶,两者的根本区别在于
A.外形不一样,构成两者的原子不同
B.构成玛瑙的基本粒子无规则排列,构成水晶的基本粒子按一定的规律周期性重复排列
C.水晶有固定的熔沸点,而玛瑙无固定熔沸点
D.水晶可用于能量转换,玛瑙可用于装饰品
9.砷化镓()的晶胞结构如图甲所示。将掺杂到晶体中得到稀磁性半导体材料,其晶胞结构如图乙所示。下列说法错误的是
A.属于区元素
B.图甲中,原子位于原子构成的正四面体空隙中
C.图甲中,若的键长为,则晶胞边长为
D.稀磁性半导体材料中,、的原子个数比为
10.化合物M可用于油漆、颜料、涂料工业,其结构如图。下列关于该物质的说法正确的是
A.分子式为C14H10O3
B.分子中碳的杂化方式有2种
C.分子中含有4种官能团
D.苯环上的一氯代物有5种
11.如图所示为一种由钛原子和碳原子构成的气态团簇分子的结构模型,则它的化学式为
A. B.TiC C. D.
12.20世纪20年代中期建立的量子力学理论不仅能够较圆满的解释原子光谱的实验事实,而且为解释和预测物质结构和性质提供了全新的理论支持,已经成为现代化学理论的基础。依据该理论,下列各项叙述中正确的是
A.所有原子任一能层的s电子云轮廓图都是球形,电子绕核运动,其轨道为球面
B.钠的焰色试验呈现黄色,是电子由激发态转化成基态时吸收能量产生的
C.4s轨道电子能量较高,总是在比3s轨道电子离核更远的地方运动
D.s轨道电子能量可能高于p轨道电子能量
13.西沙群岛软珊瑚中存在多种朵蕾烷二萜类海洋天然产物,结构简式如图所示,具有较强抗菌、抗肿瘤等生物活性。下列关于该二萜类化合物的说法正确的是
A.化合物Ⅰ、Ⅱ、Ⅲ均属于芳香族化合物
B.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ最多消耗的物质的量之比为3:2:2
C.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ中含有手性碳原子的个数比为1:3:2
D.化合物Ⅱ、Ⅲ均能发生加成反应、氧化反应、取代反应和消去反应
14.下列分子属于极性分子的是
A. B. C. D.
15.已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
A.分子中处于同一直线上的碳原子最多有6个
B.该烃苯环上的二氯代物共有13种
C.该烃的一氯代物共有8种
D.分子中至少有12个碳原子处于同一平面上
16.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的是
A.硝基胍分子中只含极性键,不含非极性键
B.原子间只能形成σ键
C.硝基胍分子中σ键与π键的个数比是5:1
D.10.4g硝基胍中含有11×6.02×1023个原子
二、解答题(共52分)
17.(本题12分)《Nature Energy》报道了中科院大连化学物理研究所科学家用Ni-BaH2/Al2O3、Ni-LiH等作催化剂,实现了在常压、100℃-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 ;基态Ni2+的核外电子排布式为 。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液的空间构型为 。
②甘氨酸中N原子的杂化类型为 ,晶体类型是 ,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是 。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图所示,导致这种变化的原因是 。
18.(本题14分)热敏电阻的主要成分——钡钛矿晶体的晶胞结构如图所示,晶胞棱长为a cm。顶角位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被O2-所占据。(已知相对原子质量——O:16 Ti:48 Ba:137)
(1)写出该晶体的化学式: 。
(2)若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶角,则O2-处于立方体的 位置。
(3)在该物质的晶体中,每个Ti4+周围距离相等且最近的Ti4+有 个;若将它们连接起来,形成的空间结构为 。
(4)若晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则a= 。
(5)重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是 (填元素符号),1 mol该物质中含σ键的数目为 NA。
19.(本题14分)A、B、C、D、E五种元素的原子序数依次增大。A是原子半径最小的元素;B的最外层电子数是次外层电子数的2倍;D的L能层有两对成对电子;的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态E原子核外电子的排布式为 。
(2)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(3)离子的颜色是. ;含有化学键类型是 。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。若甲的密度为pg/cm3,NA表示阿伏伽德罗常数,则甲晶胞的边长可表示为 cm。
20.(本题12分)As2O3既是致命的毒药,又能拯救生命,它在诱导癌细胞凋亡、治疗急性早幼粒细胞性白血病(APL)等方面表现出显著疗效。对某雌黄矿处理后得到一种含砷矿渣(主要成分为As2S3和FeS),由该矿渣生产As2O3的工艺流程如下:
已知:①
②砷存在两种常见的含氧酸根离子,AsO和AsO,前者易被氧化
回答下列问题:
(1)As位于第四周期,且与N同主族,基态As原子的价电子轨道表示式为 。
(2)As2O3和As2S3中沸点较高的是 ,原因为 。
(3)“浸取”产生的AsO和AsS中As的杂化方式一致,均为 杂化,浸渣的成分为 。
(4)“脱硫”时,Na3AsS3和Na3AsO3均会被NaClO氧化,其中AsS反应的离子方程式为 。
(5)“酸化”后,砷以H3AsO4的形式存在,则“还原”时H3AsO4参与反应的化学方程式为 。
(6)As、Bi、Li经掺杂可得到六方晶系催化剂X:
如图所示,晶胞参数为a=b≠c,α=β=90°,γ=120°,该晶胞中,粒子个数最简比As∶Bi∶Li= 。
题号 1 2 3 4 5 6 7 8 9 10
答案 A B C B D B C B D B
题号 11 12 13 14 15 16
答案 C D B B D C
17.(1) F>N>O [Ar]3d8
(2) 平面三角形 sp3 分子晶体 甘氨酸分子间形成的氢键数目比丙酸分子间形成的氢键数目多或甘氨酸中氨基的存在也会形成分子间氢键
(3)形成配合离子后,配位键与NH3中N-H键之间的排斥力小于原孤对电子与NH3中N-H键之间的排斥力
18.(1)BaTiO3
(2)面心
(3) 6 正八面体
(4)
(5) N>O>Cr 16
19.(1)
(2) O>N>C 正四面体 sp2
(3) 深蓝色 共价键,配位键
(4)
20.(1)
(2) As2S3 两者均形成分子晶体,且分子结构相似,分子量越大,分子间作用力越强,沸点越高
(3) sp3 FeS
(4)AsS+4ClO-= AsO+3S↓+4Cl-
(5)2H3AsO4+2SO2=2H2SO4+As2O3+H2O
(6)1∶1∶2
一、单选题(每题3分,共48分)
1.文物记载中华文明的灿烂成就。下列珍贵文物的主要材料属于共价晶体的是
A.宋蕉叶形水晶杯 B.清白玻璃盖罐
C.商青铜龙鼎 D.宋彩绘木雕观音
A.A B.B C.C D.D
2.下列关于粒子结构的描述错误的是
A.CS2、C2H2、BeCl2都是直线形分子
B.CCl4和CH2Cl2均是四面体构型的非极性分子
C.H2S和NH3均是由极性键构成的极性分子
D.HCl和HS-均是含有一个极性键的18电子粒子
3.下列关于有机物同分异构体数目的分析不正确的是
A.C6H14含四个甲基的同分异构体有2种
B.(CH3CH2)2CHCH3的一氯代物有4种
C.分子式为C4H10的有机物的二氯取代物有12种
D.“立方烷”C8H8,如图所示,呈正六面体结构,其六氯代物有3种
4.物质结构决定其性质,下列有关物质结构与性质的描述中,错误的是
A.臭氧的极性很微弱,它在四氯化碳中的溶解度高于在水中的溶解度
B.邻羟基苯甲酸()含分子内氢键,其熔沸点高于对羟基苯甲酸()
C.F的电负性强于Cl,使F3C—的极性大于Cl3C—的极性,导致CF3COOH的酸性强于CCl3COOH的酸性
D.接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,接近水的沸点的水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大
5.如图是s能级和p能级的原子轨道图,下列说法正确的是
A.s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.钠原子的电子在11个原子轨道上高速运动
D.s能级的原子轨道半径与能层序数有关
6.在碱性溶液中,双缩脲能与作用形成紫红色配合物,配离子结构如图所示。下列说法错误的是
A.双缩脲分子中键与键个数比为
B.该配离子与水形成氢键的原子只有
C.该配离子中提供空轨道的微粒是
D.基态原子电子占据最高能级的电子云轮廓图为球形
7.设NA为阿伏加德罗常数的值,下列说法正确的是
A.28g 硅晶体中含有的共价键数目为4NA
B.常温常压下,23g乙醇(CH3CH2OH)中所含sp3杂化的原子数目为NA
C.标准状况下,22.4L乙炔含有π键数目为2NA
D.12gNaHSO4晶体中阴、阳离子总数为0.3NA
8.下图是天然水晶球里的玛瑙和水晶,两者的根本区别在于
A.外形不一样,构成两者的原子不同
B.构成玛瑙的基本粒子无规则排列,构成水晶的基本粒子按一定的规律周期性重复排列
C.水晶有固定的熔沸点,而玛瑙无固定熔沸点
D.水晶可用于能量转换,玛瑙可用于装饰品
9.砷化镓()的晶胞结构如图甲所示。将掺杂到晶体中得到稀磁性半导体材料,其晶胞结构如图乙所示。下列说法错误的是
A.属于区元素
B.图甲中,原子位于原子构成的正四面体空隙中
C.图甲中,若的键长为,则晶胞边长为
D.稀磁性半导体材料中,、的原子个数比为
10.化合物M可用于油漆、颜料、涂料工业,其结构如图。下列关于该物质的说法正确的是
A.分子式为C14H10O3
B.分子中碳的杂化方式有2种
C.分子中含有4种官能团
D.苯环上的一氯代物有5种
11.如图所示为一种由钛原子和碳原子构成的气态团簇分子的结构模型,则它的化学式为
A. B.TiC C. D.
12.20世纪20年代中期建立的量子力学理论不仅能够较圆满的解释原子光谱的实验事实,而且为解释和预测物质结构和性质提供了全新的理论支持,已经成为现代化学理论的基础。依据该理论,下列各项叙述中正确的是
A.所有原子任一能层的s电子云轮廓图都是球形,电子绕核运动,其轨道为球面
B.钠的焰色试验呈现黄色,是电子由激发态转化成基态时吸收能量产生的
C.4s轨道电子能量较高,总是在比3s轨道电子离核更远的地方运动
D.s轨道电子能量可能高于p轨道电子能量
13.西沙群岛软珊瑚中存在多种朵蕾烷二萜类海洋天然产物,结构简式如图所示,具有较强抗菌、抗肿瘤等生物活性。下列关于该二萜类化合物的说法正确的是
A.化合物Ⅰ、Ⅱ、Ⅲ均属于芳香族化合物
B.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ最多消耗的物质的量之比为3:2:2
C.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ中含有手性碳原子的个数比为1:3:2
D.化合物Ⅱ、Ⅲ均能发生加成反应、氧化反应、取代反应和消去反应
14.下列分子属于极性分子的是
A. B. C. D.
15.已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
A.分子中处于同一直线上的碳原子最多有6个
B.该烃苯环上的二氯代物共有13种
C.该烃的一氯代物共有8种
D.分子中至少有12个碳原子处于同一平面上
16.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的是
A.硝基胍分子中只含极性键,不含非极性键
B.原子间只能形成σ键
C.硝基胍分子中σ键与π键的个数比是5:1
D.10.4g硝基胍中含有11×6.02×1023个原子
二、解答题(共52分)
17.(本题12分)《Nature Energy》报道了中科院大连化学物理研究所科学家用Ni-BaH2/Al2O3、Ni-LiH等作催化剂,实现了在常压、100℃-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 ;基态Ni2+的核外电子排布式为 。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液的空间构型为 。
②甘氨酸中N原子的杂化类型为 ,晶体类型是 ,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是 。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图所示,导致这种变化的原因是 。
18.(本题14分)热敏电阻的主要成分——钡钛矿晶体的晶胞结构如图所示,晶胞棱长为a cm。顶角位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被O2-所占据。(已知相对原子质量——O:16 Ti:48 Ba:137)
(1)写出该晶体的化学式: 。
(2)若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶角,则O2-处于立方体的 位置。
(3)在该物质的晶体中,每个Ti4+周围距离相等且最近的Ti4+有 个;若将它们连接起来,形成的空间结构为 。
(4)若晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则a= 。
(5)重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是 (填元素符号),1 mol该物质中含σ键的数目为 NA。
19.(本题14分)A、B、C、D、E五种元素的原子序数依次增大。A是原子半径最小的元素;B的最外层电子数是次外层电子数的2倍;D的L能层有两对成对电子;的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态E原子核外电子的排布式为 。
(2)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(3)离子的颜色是. ;含有化学键类型是 。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。若甲的密度为pg/cm3,NA表示阿伏伽德罗常数,则甲晶胞的边长可表示为 cm。
20.(本题12分)As2O3既是致命的毒药,又能拯救生命,它在诱导癌细胞凋亡、治疗急性早幼粒细胞性白血病(APL)等方面表现出显著疗效。对某雌黄矿处理后得到一种含砷矿渣(主要成分为As2S3和FeS),由该矿渣生产As2O3的工艺流程如下:
已知:①
②砷存在两种常见的含氧酸根离子,AsO和AsO,前者易被氧化
回答下列问题:
(1)As位于第四周期,且与N同主族,基态As原子的价电子轨道表示式为 。
(2)As2O3和As2S3中沸点较高的是 ,原因为 。
(3)“浸取”产生的AsO和AsS中As的杂化方式一致,均为 杂化,浸渣的成分为 。
(4)“脱硫”时,Na3AsS3和Na3AsO3均会被NaClO氧化,其中AsS反应的离子方程式为 。
(5)“酸化”后,砷以H3AsO4的形式存在,则“还原”时H3AsO4参与反应的化学方程式为 。
(6)As、Bi、Li经掺杂可得到六方晶系催化剂X:
如图所示,晶胞参数为a=b≠c,α=β=90°,γ=120°,该晶胞中,粒子个数最简比As∶Bi∶Li= 。
题号 1 2 3 4 5 6 7 8 9 10
答案 A B C B D B C B D B
题号 11 12 13 14 15 16
答案 C D B B D C
17.(1) F>N>O [Ar]3d8
(2) 平面三角形 sp3 分子晶体 甘氨酸分子间形成的氢键数目比丙酸分子间形成的氢键数目多或甘氨酸中氨基的存在也会形成分子间氢键
(3)形成配合离子后,配位键与NH3中N-H键之间的排斥力小于原孤对电子与NH3中N-H键之间的排斥力
18.(1)BaTiO3
(2)面心
(3) 6 正八面体
(4)
(5) N>O>Cr 16
19.(1)
(2) O>N>C 正四面体 sp2
(3) 深蓝色 共价键,配位键
(4)
20.(1)
(2) As2S3 两者均形成分子晶体,且分子结构相似,分子量越大,分子间作用力越强,沸点越高
(3) sp3 FeS
(4)AsS+4ClO-= AsO+3S↓+4Cl-
(5)2H3AsO4+2SO2=2H2SO4+As2O3+H2O
(6)1∶1∶2
同课章节目录
