江苏省无锡市辅仁高级中学2024-2025学年高二下学期期中考试 化学试题(含答案)
文档属性
| 名称 | 江苏省无锡市辅仁高级中学2024-2025学年高二下学期期中考试 化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 916.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 19:57:07 | ||
图片预览

文档简介
江苏省江阴高级中学2024—2025学年度第二学期期中考试
高二化学试卷
本试卷满分100分 考试时间75分钟
可能用到的相对原子质量:K 39 Cl35.5 O16
选择题(共 39分)
一、单项选择题(本题包括 13小题,每小题3分,共 39分。每小题只有一个选项符合题意)
1.下列说法与实现碳达峰、碳中和相符合的是
A.大规模开采可燃冰作为新能源
B.光催化CO2和H2O合成甲醇是实现碳中和的有效手段
C.通过清洁煤技术减少煤燃烧污染
D.利用火力发电产生的电能电解水制氢有利于实现碳中和
2.我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,
在低温下获得高转化率与高反应速率。反应过程示意图如下,则下列说法正确的是
A.过程Ⅰ、过程Ⅱ均为放热过程
B.使用催化剂降低了水煤气变换反应的ΔH
C.图示显示:起始时的2个H2O最终都参与了反应
D.使用催化剂能大大提高该反应的平衡转化率
3.室温下,某无色透明溶液中水电离出的 H+和 OH- 的物质的量浓度乘积为 1×10-26,一定能大量共存的离子组是
A.Cl-、HCO3-、Na+、K+ B.Fe3+、NO3-、K+、H+
C.NO3-、Ba2+、K+、Cl- D.Al3+、SO42-、NH4+、Cl-
4.下列各项中的两个量,其比值一定为 2∶1 的是
A.液面在“0”刻度时,50 mL 碱式滴定管和 25 mL 碱式滴定管所盛液体的体积
B.相同温度下,0.2 mol·L-1 醋酸溶液和 0.1 mol·L-1 醋酸溶液中的c(H+)
C.(NH4)2SO4 溶液中,c(NH4+)和 c(SO42-)
D.相同温度下,0.1 mol·L-1 Na2CO3 溶液和 0.1 mol·L-1 CH3COONa 溶液中的 c(Na+)
阅读下列资料,完成5~7题。
铜、银位于周期表中第ⅠB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有H+、Ag(S2O3)、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。
5. 下列有关物质的性质与用途具有对应关系的是( )
A. 铜具有良好导热性,可用作印刷电路板
B. 硫酸铜溶液显酸性,可用作泳池杀菌剂
C. 溴化银呈淡黄色,可用于制作相机胶片
D. 银氨溶液具有弱氧化性,可用于制作银镜
6. 下列有关从废定影液中回收Ag和Br2的说法正确的是( )
A. 过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体
B. 配制Na2S溶液时,向其中加入少量NaOH溶液,的值增大
C. 灼烧Ag2S生成Ag和SO2,该反应每生成1 mol Ag转移3 mol电子
D. 分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层
7. 下列化学反应表示正确的是( )
A. 硫酸铜溶液中加入小粒金属钠:Cu2++2Na===Cu+2Na+
B. 用铜电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+
C. 稀硝酸洗涤做过银镜反应的试管:Ag+2H++N===Ag++NO↑+H2O
D. 多余的[Ag(NH3)2]OH用硝酸处理:[Ag(NH3)2]++OH-+3H+===Ag++2N+H2O
8. 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应,下列说法错误的是
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用硫氰化钾(KSCN)溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:O2>Fe3+>SO
D.能循环利用的物质Fe2(SO4)3
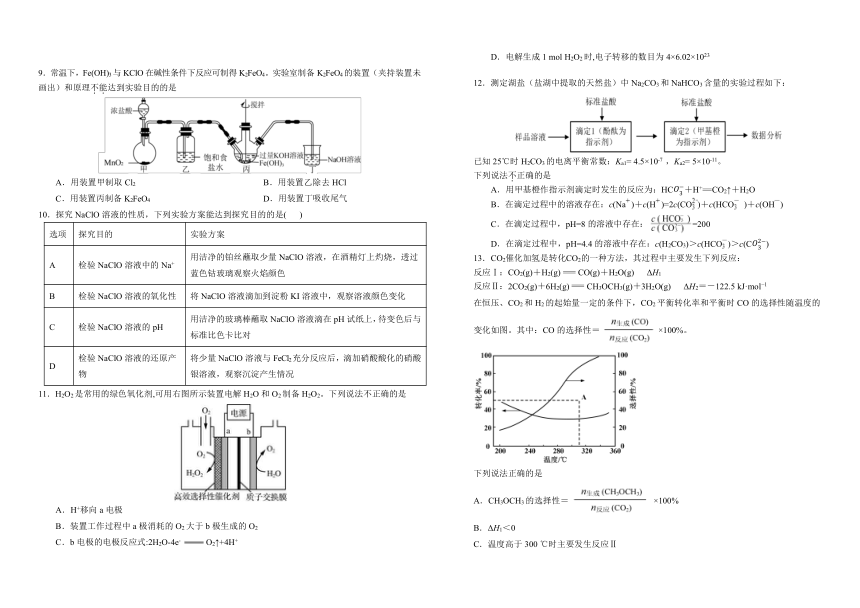
9.常温下,Fe(OH)3与KClO在碱性条件下反应可制得K2FeO4。实验室制备K2FeO4的装置(夹持装置未画出)和原理不能达到实验目的的是
A.用装置甲制取Cl2 B.用装置乙除去HCl
C.用装置丙制备K2FeO4 D.用装置丁吸收尾气
10.探究NaClO溶液的性质,下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 检验NaClO溶液中的Na+ 用洁净的铂丝蘸取少量NaClO溶液,在酒精灯上灼烧,透过蓝色钴玻璃观察火焰颜色
B 检验NaClO溶液的氧化性 将NaClO溶液滴加到淀粉KI溶液中,观察溶液颜色变化
C 检验NaClO溶液的pH 用洁净的玻璃棒蘸取NaClO溶液滴在pH试纸上,待变色后与标准比色卡比对
D 检验NaClO溶液的还原产物 将少量NaClO溶液与FeCl2充分反应后,滴加硝酸酸化的硝酸银溶液,观察沉淀产生情况
11.H2O2是常用的绿色氧化剂,可用右图所示装置电解H2O和O2制备H2O2。下列说法不正确的是
A.H+移向a电极
B.装置工作过程中a极消耗的O2大于b极生成的O2
C.b电极的电极反应式:2H2O-4e- O2↑+4H+
D.电解生成1 mol H2O2时,电子转移的数目为4×6.02×1023
12.测定湖盐(盐湖中提取的天然盐)中Na2CO3和NaHCO3含量的实验过程如下:
已知25℃时H2CO3的电离平衡常数:Ka1= 4.5×10-7 ,Ka2= 5×10-11。
下列说法不正确的是
A.用甲基橙作指示剂滴定时发生的反应为:HC+H+=CO2↑+H2O
B.在滴定过程中的溶液存在:c(Na)+c(H)=2c(CO)+c(HCO )+c(OH)
C.在滴定过程中,pH=8的溶液中存在:=200
D.在滴定过程中,pH=4.4的溶液中存在:c(H2CO3)>c(HCO)>c(C)
13.CO2催化加氢是转化CO2的一种方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH2=-122.5 kJ·mol 1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CO的选择性随温度的变化如图。其中:CO的选择性=×100%。
下列说法正确的是
A.CH3OCH3的选择性=×100%
B.ΔH1<0
C.温度高于300 ℃时主要发生反应Ⅱ
D.其他条件不变,图中A点选择合适催化剂可提高CO的选择性
二、非选择题:(本题包括4小题,共61分。)
14.(18分)二氧化氯(ClO2)是一种高效消毒灭菌剂。但稳定性较差,可将其用吸收法和电解法两种方法得到较稳定的NaClO2加以保存。其工艺流程示意图如下图所示:
已知:
ⅰ.纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
ⅱ.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl。
(1)步骤1中,生成ClO2的离子方程式是 ▲ ,通入空气的作用是 ▲ 。
(2)方法1中,反应的离子方程式是 ▲ ,利用方法1制NaClO2时,温度不能超过20℃,可能的原因是 ▲ 。
(3)方法2中,利用下图所示装置制备NaClO2, a电极(左侧电极)处发生的电极反应式为 ▲ ,b电极(右侧电极)处发生的电极反应式为 ▲ 。溶液中的溶质浓度:f处 ▲ d处(填“>”、“<”或“=”)。
(4) NaClO2使用时,加入稀盐酸即可迅速得到ClO2,写出反应的离子方程式: ▲ 。若加入盐酸浓度过大,则气体产物中Cl2含量会增大,原因是 ▲ 。
15.(12分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
Ⅰ 一定条件下烟气中的SO2经氧化生成SO3,若用硫酸吸收SO3,经研究发现SO3吸收率与进入吸收塔的硫酸浓度和温度关系如题15-1图所示。则吸收SO3所用硫酸的适宜浓度为98.3%,温度为 ▲ ,而工业生产中一般采用60℃的可能原因是 ▲ 。
题15-1图 题15-2图
Ⅱ 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
(1)则 ③CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH= ▲ kJ·mol-1。
(2)在一定温度和压强下,向恒容密闭容器中充入一定量的CH4和NO2达到平衡后,下列有关说法正确的是 ▲ (填字母)。
a.及时液化移走H2O,可以提高反应①的正反应速率
b.适当再充入CH4气体,可以提高反应③中NO2的去除率
c.升高温度,可以同时提高各反应的正逆反应速率,但反应物转化率均降低
Ⅲ 电解法处理含氮氧化物废气可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如题15-2图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
(1)写出电解时NO2发生反应的电极反应式 ▲ 。
(2)标准状况下2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 ▲ mol。16.(16分)实验室以含锰废液为原料可以制取MnSO4,部分实验过程如下:
已知室温下,部分难溶电解质的溶度积常数如下表:
难溶电解质 Fe(OH)3 Mn(OH)2 MnF2 CaF2 MgF2
Ksp 4.0×10 38 4×10 14 1.2×10 3 1.6×10 10 6.4×10 9
(1)经检测,含锰废液中c(Mn2+)=0.2 mol·L 1、c(Na+)=0.6 mol·L 1、c(Fe2+)=0.2 mol·L 1,
还含SO42-及少量Ca2+、Mg2+。“氧化”阶段,H2O2用量为理论用量的1.1倍。
①“氧化”1L该废液,需要加入H2O2的物质的量为 ▲ mol。
②检验Fe2+已经完全被氧化的方法是 ▲ 。
(2)“除杂I”加入MnCO3调节溶液pH=4。该过程中发生反应的离子方程式为 ▲ 。
(3)“除杂Ⅱ”中反应之一为MnF2+Ca2+CaF2+Mn2+。结合反应的平衡常数解释用MnF2能除去Ca2+的原因: ▲ 。
(4)已知MnSO4和Na2SO4的溶解度如题16图-1所示。请补充完整由粗MnSO4溶液制取MnSO4·H2O晶体的实验方案:取实验所得粗MnSO4溶液, ▲ ,得到MnSO4·H2O晶体。(可选用的试剂:1 mol·L 1 NaHCO3溶液,1 mol·L 1 H2SO4溶液,1 mol·L 1 盐酸)
题16图- 2为不同温度下硫酸锰焙烧2小时后残留固体的X-射线衍射图。由MnSO4固体制取活性Mn2O3的方案为:将MnSO4固体置于可控温度的反应管中, ▲ ,将Mn2O3冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1 BaCl2溶液,1 mol·L-1 NaOH溶液)
17.(15分)工业废渣中Ca(OH)2的综合利用。
(1) 用工业钢渣处理酸性废水
工业钢渣主要含Ca(OH)2,还含有CaCO3、aCaO·bAl2O3·cSiO2、xFe2O3·ySiO2、mMgO·nSiO2等。工业钢渣加水后搅拌得钢渣浆液,向钢渣浆液中逐渐加入硫酸溶液(模拟酸性废水)酸化,浆液pH以及浸出液中金属离子的
质量浓度随时间变化情况如图所示。
① pH=4时,浸出液中质量浓度最大的金属离子是_ ▲ 。
② 随硫酸溶液逐渐加入,Ca2+浓度先增大后减小,原因是 ▲ 。
(2) 以电石渣制备KClO3
电石渣主要成分为Ca(OH)2,制备KClO3的流程如下:
已知:氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2热分解为CaCl2和O2。
① 生成Ca(ClO)2的化学方程式为 ▲ 。
② “分解比”是衡量氯化程度的标准,氯化后溶液中CaCl2总质量与Ca(ClO3)2总质量的比值称为“分解比”,随氯化温度升高,分解比的实际值增大的原因可能是 ▲ 。
③ “转化”时向滤液中加入KCl固体将Ca(ClO3)2转化为KClO3,可能的原因是 ▲ 。
④ 该流程制得的KClO3样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.049 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使Cl全部转化为Cl-,加入少量K2CrO4溶液作指示剂,用0.20 mol·L-1 AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00 mL。计算KClO3样品的纯度(写出计算过程)。
高二化学试卷
本试卷满分100分 考试时间75分钟
可能用到的相对原子质量:K 39 Cl35.5 O16
选择题(共 39分)
一、单项选择题(本题包括 13小题,每小题3分,共 39分。每小题只有一个选项符合题意)
1.下列说法与实现碳达峰、碳中和相符合的是
A.大规模开采可燃冰作为新能源
B.光催化CO2和H2O合成甲醇是实现碳中和的有效手段
C.通过清洁煤技术减少煤燃烧污染
D.利用火力发电产生的电能电解水制氢有利于实现碳中和
2.我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,
在低温下获得高转化率与高反应速率。反应过程示意图如下,则下列说法正确的是
A.过程Ⅰ、过程Ⅱ均为放热过程
B.使用催化剂降低了水煤气变换反应的ΔH
C.图示显示:起始时的2个H2O最终都参与了反应
D.使用催化剂能大大提高该反应的平衡转化率
3.室温下,某无色透明溶液中水电离出的 H+和 OH- 的物质的量浓度乘积为 1×10-26,一定能大量共存的离子组是
A.Cl-、HCO3-、Na+、K+ B.Fe3+、NO3-、K+、H+
C.NO3-、Ba2+、K+、Cl- D.Al3+、SO42-、NH4+、Cl-
4.下列各项中的两个量,其比值一定为 2∶1 的是
A.液面在“0”刻度时,50 mL 碱式滴定管和 25 mL 碱式滴定管所盛液体的体积
B.相同温度下,0.2 mol·L-1 醋酸溶液和 0.1 mol·L-1 醋酸溶液中的c(H+)
C.(NH4)2SO4 溶液中,c(NH4+)和 c(SO42-)
D.相同温度下,0.1 mol·L-1 Na2CO3 溶液和 0.1 mol·L-1 CH3COONa 溶液中的 c(Na+)
阅读下列资料,完成5~7题。
铜、银位于周期表中第ⅠB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有H+、Ag(S2O3)、H2SO3、Br-等微粒]中回收Ag和Br2的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;滤液中通入Cl2氧化Br-,用苯萃取分液。
5. 下列有关物质的性质与用途具有对应关系的是( )
A. 铜具有良好导热性,可用作印刷电路板
B. 硫酸铜溶液显酸性,可用作泳池杀菌剂
C. 溴化银呈淡黄色,可用于制作相机胶片
D. 银氨溶液具有弱氧化性,可用于制作银镜
6. 下列有关从废定影液中回收Ag和Br2的说法正确的是( )
A. 过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体
B. 配制Na2S溶液时,向其中加入少量NaOH溶液,的值增大
C. 灼烧Ag2S生成Ag和SO2,该反应每生成1 mol Ag转移3 mol电子
D. 分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层
7. 下列化学反应表示正确的是( )
A. 硫酸铜溶液中加入小粒金属钠:Cu2++2Na===Cu+2Na+
B. 用铜电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+
C. 稀硝酸洗涤做过银镜反应的试管:Ag+2H++N===Ag++NO↑+H2O
D. 多余的[Ag(NH3)2]OH用硝酸处理:[Ag(NH3)2]++OH-+3H+===Ag++2N+H2O
8. 如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应,下列说法错误的是
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用硫氰化钾(KSCN)溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:O2>Fe3+>SO
D.能循环利用的物质Fe2(SO4)3
9.常温下,Fe(OH)3与KClO在碱性条件下反应可制得K2FeO4。实验室制备K2FeO4的装置(夹持装置未画出)和原理不能达到实验目的的是
A.用装置甲制取Cl2 B.用装置乙除去HCl
C.用装置丙制备K2FeO4 D.用装置丁吸收尾气
10.探究NaClO溶液的性质,下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A 检验NaClO溶液中的Na+ 用洁净的铂丝蘸取少量NaClO溶液,在酒精灯上灼烧,透过蓝色钴玻璃观察火焰颜色
B 检验NaClO溶液的氧化性 将NaClO溶液滴加到淀粉KI溶液中,观察溶液颜色变化
C 检验NaClO溶液的pH 用洁净的玻璃棒蘸取NaClO溶液滴在pH试纸上,待变色后与标准比色卡比对
D 检验NaClO溶液的还原产物 将少量NaClO溶液与FeCl2充分反应后,滴加硝酸酸化的硝酸银溶液,观察沉淀产生情况
11.H2O2是常用的绿色氧化剂,可用右图所示装置电解H2O和O2制备H2O2。下列说法不正确的是
A.H+移向a电极
B.装置工作过程中a极消耗的O2大于b极生成的O2
C.b电极的电极反应式:2H2O-4e- O2↑+4H+
D.电解生成1 mol H2O2时,电子转移的数目为4×6.02×1023
12.测定湖盐(盐湖中提取的天然盐)中Na2CO3和NaHCO3含量的实验过程如下:
已知25℃时H2CO3的电离平衡常数:Ka1= 4.5×10-7 ,Ka2= 5×10-11。
下列说法不正确的是
A.用甲基橙作指示剂滴定时发生的反应为:HC+H+=CO2↑+H2O
B.在滴定过程中的溶液存在:c(Na)+c(H)=2c(CO)+c(HCO )+c(OH)
C.在滴定过程中,pH=8的溶液中存在:=200
D.在滴定过程中,pH=4.4的溶液中存在:c(H2CO3)>c(HCO)>c(C)
13.CO2催化加氢是转化CO2的一种方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH2=-122.5 kJ·mol 1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CO的选择性随温度的变化如图。其中:CO的选择性=×100%。
下列说法正确的是
A.CH3OCH3的选择性=×100%
B.ΔH1<0
C.温度高于300 ℃时主要发生反应Ⅱ
D.其他条件不变,图中A点选择合适催化剂可提高CO的选择性
二、非选择题:(本题包括4小题,共61分。)
14.(18分)二氧化氯(ClO2)是一种高效消毒灭菌剂。但稳定性较差,可将其用吸收法和电解法两种方法得到较稳定的NaClO2加以保存。其工艺流程示意图如下图所示:
已知:
ⅰ.纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
ⅱ.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl。
(1)步骤1中,生成ClO2的离子方程式是 ▲ ,通入空气的作用是 ▲ 。
(2)方法1中,反应的离子方程式是 ▲ ,利用方法1制NaClO2时,温度不能超过20℃,可能的原因是 ▲ 。
(3)方法2中,利用下图所示装置制备NaClO2, a电极(左侧电极)处发生的电极反应式为 ▲ ,b电极(右侧电极)处发生的电极反应式为 ▲ 。溶液中的溶质浓度:f处 ▲ d处(填“>”、“<”或“=”)。
(4) NaClO2使用时,加入稀盐酸即可迅速得到ClO2,写出反应的离子方程式: ▲ 。若加入盐酸浓度过大,则气体产物中Cl2含量会增大,原因是 ▲ 。
15.(12分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
Ⅰ 一定条件下烟气中的SO2经氧化生成SO3,若用硫酸吸收SO3,经研究发现SO3吸收率与进入吸收塔的硫酸浓度和温度关系如题15-1图所示。则吸收SO3所用硫酸的适宜浓度为98.3%,温度为 ▲ ,而工业生产中一般采用60℃的可能原因是 ▲ 。
题15-1图 题15-2图
Ⅱ 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
(1)则 ③CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH= ▲ kJ·mol-1。
(2)在一定温度和压强下,向恒容密闭容器中充入一定量的CH4和NO2达到平衡后,下列有关说法正确的是 ▲ (填字母)。
a.及时液化移走H2O,可以提高反应①的正反应速率
b.适当再充入CH4气体,可以提高反应③中NO2的去除率
c.升高温度,可以同时提高各反应的正逆反应速率,但反应物转化率均降低
Ⅲ 电解法处理含氮氧化物废气可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如题15-2图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
(1)写出电解时NO2发生反应的电极反应式 ▲ 。
(2)标准状况下2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 ▲ mol。16.(16分)实验室以含锰废液为原料可以制取MnSO4,部分实验过程如下:
已知室温下,部分难溶电解质的溶度积常数如下表:
难溶电解质 Fe(OH)3 Mn(OH)2 MnF2 CaF2 MgF2
Ksp 4.0×10 38 4×10 14 1.2×10 3 1.6×10 10 6.4×10 9
(1)经检测,含锰废液中c(Mn2+)=0.2 mol·L 1、c(Na+)=0.6 mol·L 1、c(Fe2+)=0.2 mol·L 1,
还含SO42-及少量Ca2+、Mg2+。“氧化”阶段,H2O2用量为理论用量的1.1倍。
①“氧化”1L该废液,需要加入H2O2的物质的量为 ▲ mol。
②检验Fe2+已经完全被氧化的方法是 ▲ 。
(2)“除杂I”加入MnCO3调节溶液pH=4。该过程中发生反应的离子方程式为 ▲ 。
(3)“除杂Ⅱ”中反应之一为MnF2+Ca2+CaF2+Mn2+。结合反应的平衡常数解释用MnF2能除去Ca2+的原因: ▲ 。
(4)已知MnSO4和Na2SO4的溶解度如题16图-1所示。请补充完整由粗MnSO4溶液制取MnSO4·H2O晶体的实验方案:取实验所得粗MnSO4溶液, ▲ ,得到MnSO4·H2O晶体。(可选用的试剂:1 mol·L 1 NaHCO3溶液,1 mol·L 1 H2SO4溶液,1 mol·L 1 盐酸)
题16图- 2为不同温度下硫酸锰焙烧2小时后残留固体的X-射线衍射图。由MnSO4固体制取活性Mn2O3的方案为:将MnSO4固体置于可控温度的反应管中, ▲ ,将Mn2O3冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1 BaCl2溶液,1 mol·L-1 NaOH溶液)
17.(15分)工业废渣中Ca(OH)2的综合利用。
(1) 用工业钢渣处理酸性废水
工业钢渣主要含Ca(OH)2,还含有CaCO3、aCaO·bAl2O3·cSiO2、xFe2O3·ySiO2、mMgO·nSiO2等。工业钢渣加水后搅拌得钢渣浆液,向钢渣浆液中逐渐加入硫酸溶液(模拟酸性废水)酸化,浆液pH以及浸出液中金属离子的
质量浓度随时间变化情况如图所示。
① pH=4时,浸出液中质量浓度最大的金属离子是_ ▲ 。
② 随硫酸溶液逐渐加入,Ca2+浓度先增大后减小,原因是 ▲ 。
(2) 以电石渣制备KClO3
电石渣主要成分为Ca(OH)2,制备KClO3的流程如下:
已知:氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2热分解为CaCl2和O2。
① 生成Ca(ClO)2的化学方程式为 ▲ 。
② “分解比”是衡量氯化程度的标准,氯化后溶液中CaCl2总质量与Ca(ClO3)2总质量的比值称为“分解比”,随氯化温度升高,分解比的实际值增大的原因可能是 ▲ 。
③ “转化”时向滤液中加入KCl固体将Ca(ClO3)2转化为KClO3,可能的原因是 ▲ 。
④ 该流程制得的KClO3样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.049 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使Cl全部转化为Cl-,加入少量K2CrO4溶液作指示剂,用0.20 mol·L-1 AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00 mL。计算KClO3样品的纯度(写出计算过程)。
同课章节目录
