江苏省扬州市扬州中学2024-2025学年高二下学期4月期中考试 化学试题(含答案)
文档属性
| 名称 | 江苏省扬州市扬州中学2024-2025学年高二下学期4月期中考试 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 595.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-08 20:10:38 | ||
图片预览


文档简介
江苏省扬州中学2024-2025学年第二学期期中考试
高二化学(选修) 2025.4
试卷满分:100分,考试时间:75分钟
注意事项:
作答第1卷前,请考生务必将自己的姓名、考试证号等写在答题卡上并贴上条形码
将选择题答案填写在答题卡的指定位置上(使用机读卡的用2B铅笔在机读卡上填涂),非选择题一律在答题卡上作答,在试卷上答题无效。
考试结束后,请将机读卡和答题卡交监考人员。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Br-80
第I卷(选择题 共39分)
单项选择题:本题包括13小题,每题3分,共39分。在每题给出的四个选项中只有一
项是最符合题意的。(请将所有选择题答案填到答题卡的指定位置中.)
1.2025央视春晚舞台上,创意融合舞蹈《秧BOT》,不仅仅是一场视觉盛宴,更是科技与传统文化的完美结合。下列说法不正确的是
A.机器人穿着喜庆的红色棉袄,其中棉花属于天然有机高分子
B.为机器人提供续航的锂电池,轻便稳定,比能量较低
C.机器人的机身应用了碳纤维,是一种含碳量在90%以上的高强度纤维
D.铝合金和钛合金也是制造机器人的重要原材料,钛合金强度高耐腐蚀,铝合金轻质成本低,都是极为重要的金属材料
2.下列表示不正确的是
A.质子数为35、中子数为46的Br原子:
B.的形成过程:
C.的名称:2,2,4,5-四甲基己烷
D.福尔马林溶液中的氢键:
3.认知、推理能力是培养化学学科思维的方法之一,下列说法不正确的是
A.与H2完全加成之后的产物,其一氯代物有7种
B.环戊二烯()分子中最多有9个原子在同一平面上
C.按系统命名法,化合物的名称是2–甲基苯酚
D.可使酸性高锰酸钾溶液褪色
4.W、X、Y、Z、Q是核电荷数依次增大的短周期元素,这5种元素形成的一种阴离子结构如图所示。W、Y的核电荷数之和等于Z的核电荷数,Y原子价电子数是Q原子价电子数的2倍。下列说法不正确的是
A.W与X形成的化合物均为极性分子 B.Y的简单气态氢化物的沸点比X的高
C.Q的氧化物是两性氧化物 D.该阴离子中含有配位键
5.NaOH活化过的催化剂对甲醛氧化为具有较好的催化效果,有学者提出该催化反应的机理如下。下列说法不正确的是
A.步骤Ⅰ中存在非极性键的断裂
B.步骤Ⅰ可理解为HCHO中带部分负电荷的O与催化剂表面的-OH发生作用
C.步骤Ⅱ中发生的反应可表示为
D.该催化剂对苯的催化氧化效果优于对HCHO的催化氧化效果
6.甲氧苄啶是一种广谱抗菌药,其合成路线中的一步反应如下:
下列说法中正确的是
A.X分子中含有的sp2杂化的碳原子数为6
B.X分子能与FeCl3溶液反应
C.Y分子存在顺反异构
D.X→Y分两步进行,先发生取代反应,后发生消去反应
7.室温下,下列实验探究方案能达到探究目的的是
选项 探究目的 探究方案
A Ka(HClO)与Ka(HCN)的大小关系 用pH计测量NaClO溶液和NaCN溶液的pH,比较HClO和HCN的Ka大小
B 碘在浓KI溶液中与CCl4中的溶解能力比较 向碘的CCl4溶液中加入等体积浓KI溶液,振荡,观察有机层颜色的变化
C SO2是否具有漂白性 向盛有SO2水溶液的试管中滴加几滴KMnO4溶液,振荡,观察溶液颜色变化
D 探究1—溴丁烷的消去产物 向圆底烧瓶中加入2.0gNaOH、15mL无水乙醇、碎瓷片和5mL1-溴丁烷,微热,将产生的气体通入酸性KMnO4溶液,观察现象
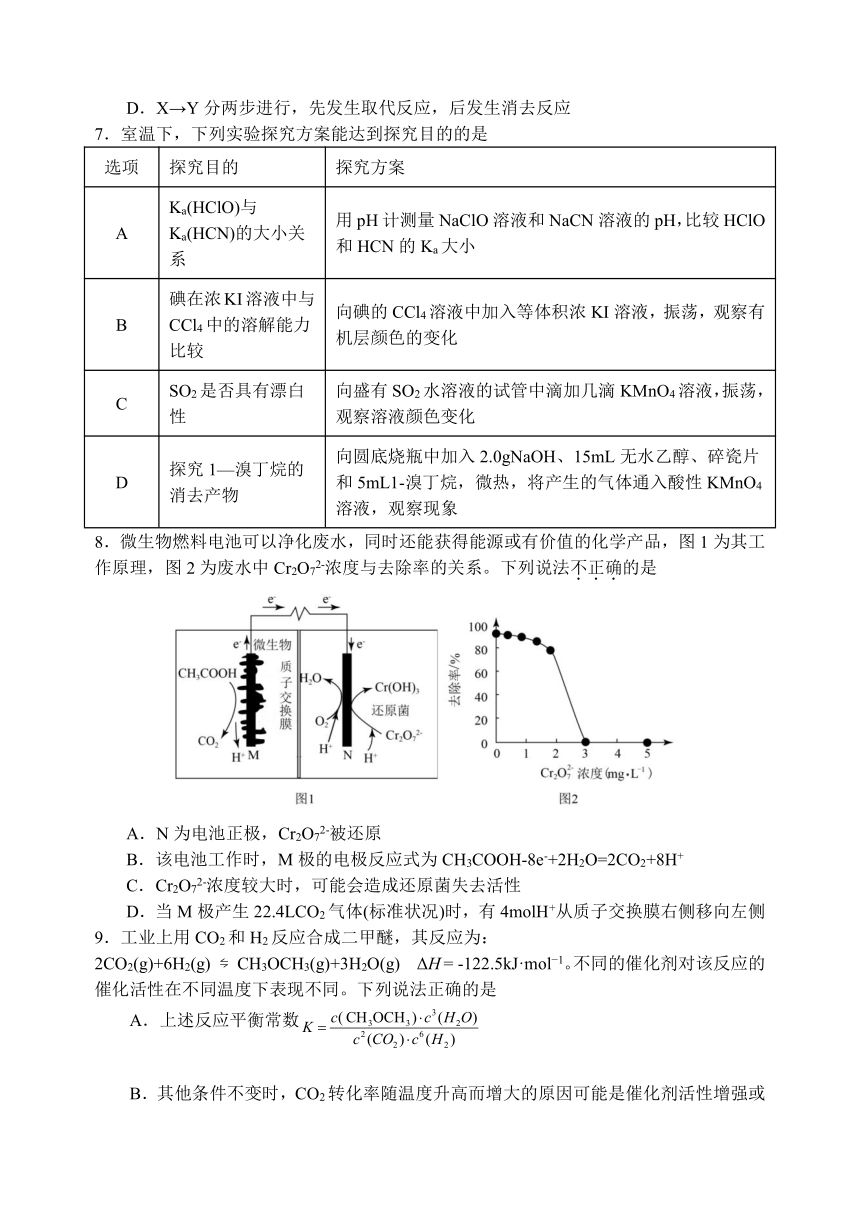
8.微生物燃料电池可以净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是
A.N为电池正极,Cr2O72-被还原
B.该电池工作时,M极的电极反应式为CH3COOH-8e-+2H2O=2CO2+8H+
C.Cr2O72-浓度较大时,可能会造成还原菌失去活性
D.当M极产生22.4LCO2气体(标准状况)时,有4molH+从质子交换膜右侧移向左侧
9.工业上用CO2和H2反应合成二甲醚,其反应为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH = -122.5kJ·mol 1。不同的催化剂对该反应的催化活性在不同温度下表现不同。下列说法正确的是
A.上述反应平衡常数
B.其他条件不变时,CO2转化率随温度升高而增大的原因可能是催化剂活性增强或平衡常数增大
C.其他条件不变时,在恒压条件下通入一定量的惰性气体,H2的平衡转化率提高
D.若反应中及时分离出二甲醚,正反应速率增大,CO2转化率增大
10.化学与生产、生活密切相关,下列事实与盐类水解无关的是
A.用热的纯碱溶液去除炊具上的油污
B.为了除去锅炉水垢中的CaSO4,先用Na2CO3溶液处理,而后用酸溶解
C.NH4Cl或ZnCl2溶液用作金属焊接的除锈剂
D.配制FeCl3溶液时,先将FeCl3固体溶于浓盐酸,再加水稀释到所需浓度
11.从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。
下列说法不正确的是
A.“碱浸”时,温度保持在的目的是提高“碱浸”速率,同时防止H2O2过度分解
B.“碱浸”时,GaAs被H2O2氧化,每反应1mol GaAs,转移电子的数目为5mol
C.“旋流电积”所得“尾液”溶质主要是H2SO4,可进行循环利用,提高经济效益
D.GaAs晶胞如上图,距离As最近的As原子数为12
12.草酸亚铁是生产磷酸铁锂电池的原料,实验室可通过如图反应制取FeC2O4:
已知室温时:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=1.5×10-4、Ksp(FeC2O4)=2.1×10-7。
下列说法正确的是
A.室温下,0.10molL-1NaHC2O4溶液中存在:c(C2O42-)B.酸化、溶解后的溶液中存在:c(NH4+)+2c(Fe2+)>2c(SO42-)
C.室温时,反应Fe2++H2C2O4=FeC2O4↓+2H+的平衡常数K=40
D.过滤后的上层清液中:c(Fe2+)c(C2O42-)≥2.1×10-7
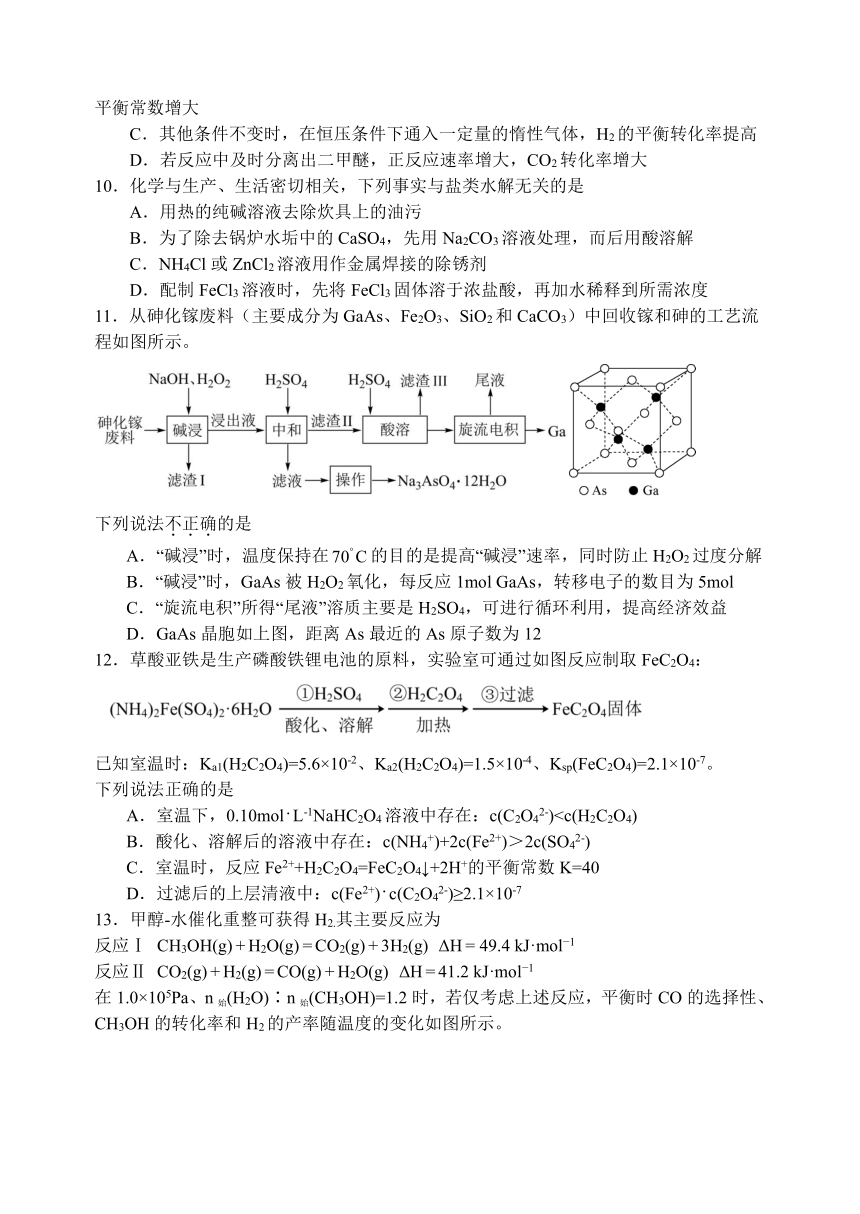
13.甲醇-水催化重整可获得H2.其主要反应为
反应Ⅰ CH3OH(g) + H2O(g) = CO2(g) + 3H2(g) ΔH = 49.4 kJ·mol 1
反应Ⅱ CO2(g) + H2(g) = CO(g) + H2O(g) ΔH = 41.2 kJ·mol 1
在1.0×105Pa、n始(H2O)∶n始(CH3OH)=1.2时,若仅考虑上述反应,平衡时CO的选择性、CH3OH的转化率和H2的产率随温度的变化如图所示。
CO的选择性= × 100%
下列说法正确的是
A.一定温度下,增大可提高CO的选择性
B.平衡时CH3OH的转化率一定大于H2O的转化率
C.图中曲线①表示平衡时H2产率随温度的变化
D.一定温度下,降低体系压强,反应Ⅰ的平衡常数增大
第Ⅱ卷(非选择题 共61分)
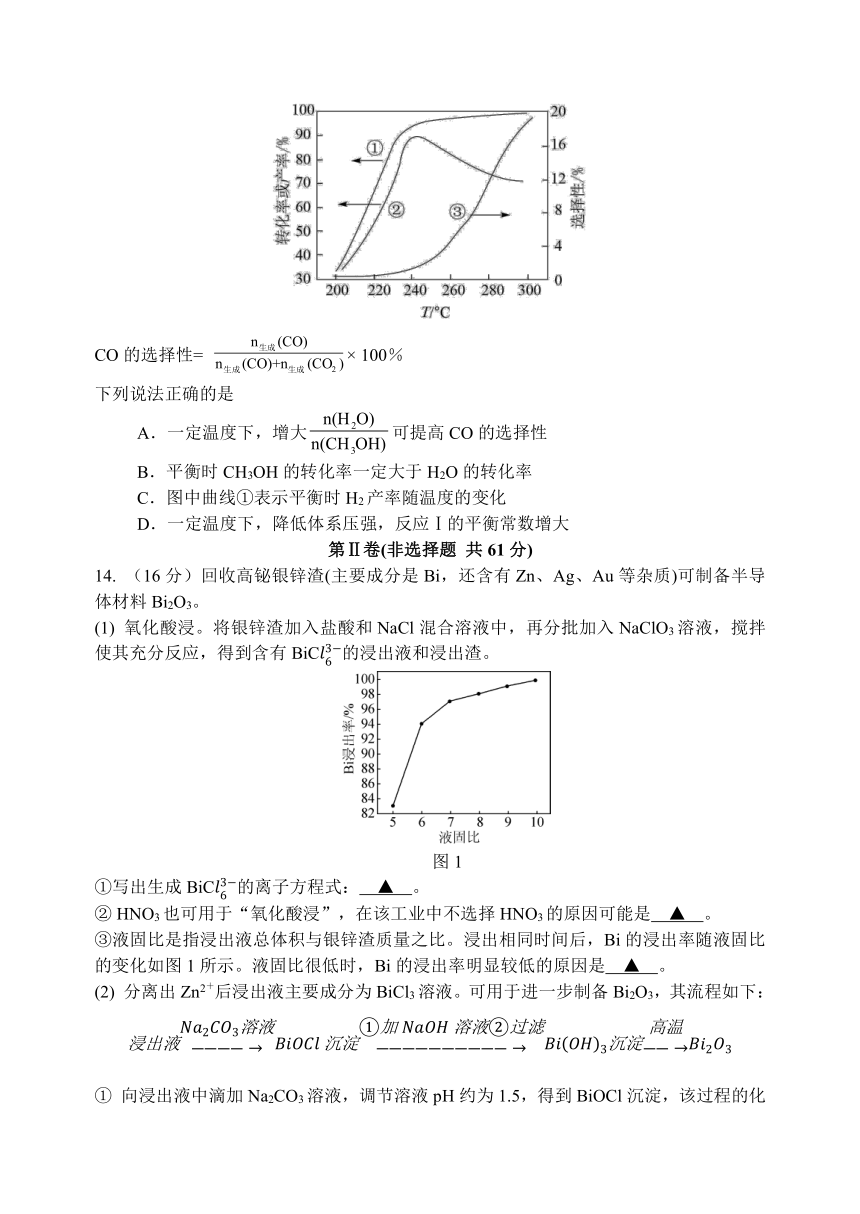
14. (16分)回收高铋银锌渣(主要成分是Bi,还含有Zn、Ag、Au等杂质)可制备半导体材料Bi2O3。
(1) 氧化酸浸。将银锌渣加入盐酸和NaCl混合溶液中,再分批加入NaClO3溶液,搅拌使其充分反应,得到含有BiC的浸出液和浸出渣。
图1
①写出生成BiC的离子方程式: ▲ 。
② HNO3也可用于“氧化酸浸”,在该工业中不选择HNO3的原因可能是 ▲ 。
③液固比是指浸出液总体积与银锌渣质量之比。浸出相同时间后,Bi的浸出率随液固比的变化如图1所示。液固比很低时,Bi的浸出率明显较低的原因是 ▲ 。
(2) 分离出Zn2+后浸出液主要成分为BiCl3溶液。可用于进一步制备Bi2O3,其流程如下:
① 向浸出液中滴加Na2CO3溶液,调节溶液pH约为1.5,得到BiOCl沉淀,该过程的化学方程式为 ▲ 。
图2
② 我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图2所示。该材料的化学式为 ▲ 。
(3) 从浸出渣中可回收银和金。已知Ag2SO4可溶于氨水,[Ag(NH3)2]+具有较强的氧化性。补充完整以浸出渣为原料制备单质银的实验方案:向浸出渣中加入硫酸后焙烧,得硫酸银烧渣, ▲ ,得单质银。
(实验中须使用的试剂有氨水、水合肼溶液、BaCl2溶液)
15. (13分)化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如下:
(1)化合物D中含氧官能团的名称为 ▲ 。
(2)化合物A分子中发生sp2、sp3杂化的碳原子数目之比为 ▲ 。
(3)A→B、B→C的反应类型分别为 ▲ 、 ▲ 。
(4)化合物C还可以继续与HBr反应生成副产物X(C7H7OBr),X的结构简式为 ▲ 。
(5)D的某同分异构体同时满足下列条件,写出其中一种符合要求的同分异构体的结构简
式 ▲ 。
①分子中含有苯环,且核磁共振氢谱证明只含有两种不同化学环境的氢原子;
②该物质只含有一种官能团。
(15分)实验室常用正丁醇、浓硫酸在加热条件下制备正丁醚,反应原理如下:2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。
反应装置如图所示。反应流程如下:
i:在100mL烧瓶中,先加入31mL正丁醇,再将4.5mL浓硫酸加入瓶内并投入沸石。将分水器、温度计和烧瓶组装好。
ii:沿分水器支管口对面的内壁小心的贴壁加水,待水面上升至恰与分水器支管口下沿相平时为止,小心开启活塞放出水。
iii:在分水器上口接一仪器a,小火加热,使反应物微沸并开始回流,随反应进行,回流液经冷凝管收集于分水器中。
iv:平稳回流至烧瓶内反应温度达135°C至137°C左右,分水器中水面上升至支管口即可停止反应,反应液稍冷后开启活塞放出水,然后拆除装置。
v:将反应液倒入盛有50mL水的分液漏斗中,充分振荡,静置分层,弃去下层水溶液,上层粗产物依次用25mL水、15mL5%的NaOH溶液、15mL水洗涤并分液,在有机相中加入氯化钙,干燥后过滤。
vi:干燥后粗产物置于蒸馏瓶中,蒸馏收集140.1℃至144℃馏分,产量为7.84g。
已知:正丁醇(M=74g/mol)的密度为,正丁醚(M=130g/mol)微溶于水。
(1)仪器a的名称是 ▲ 。
(2)分水器的主要作用是 ▲ 。
(3)步骤i中,为使浓硫酸与正丁醇混合均匀,应如何加入浓硫酸: ▲ 。(填字母)
a.分批加入浓硫酸,每次加入都充分振摇
b.一次性快速加入浓硫酸,加入后再充分振摇
(4)写出制备过程中主要伴随的有机副反应产物的结构简式 ▲ 。
(5)“步骤v”中,水洗涤的目的是 ▲ 。
(6)制备过程中,正丁醇与水可以形成共沸物,其主要原因是 ▲ 。
(7)本实验中正丁醚的产率为 ▲ (写出计算过程,结果保留3位有效数字)。
17. (17分)储能材料是当前研究的热点。
(1) AlH3易分解反应释放出活性H,且可与固体氧化物混合作固体燃料推进剂。AlH3与Fe2O3的反应过程如下:
Ⅰ. AlH3(s)===Al(s)+3H(g);ΔH=521.1 kJ·mol-1
Ⅱ. 6H(g)+Fe2O3(s)===2Fe(s)+3H2O(g);ΔH=-1 209.2 kJ·mol-1
Ⅲ. 2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s);ΔH=-851.5 kJ·mol-1
① LiAlH4和AlCl3在无水乙醚中反应可以生成AlH3和LiCl,该反应的化学方程式为 ▲ 。
② 反应2AlH3(s)+2Fe2O3(s)===4Fe(s)+3H2O(g)+Al2O3(s)的ΔH= ▲ 。
③ AlH3与普通铝粉相比,AlH3与Fe2O3反应更容易引发的原因是 ▲ 。
(2) NaBH4是一种储氢材料,CoB催化剂催化NaBH4释氢的原理是OH-使催化剂表面的B释放H-,催化剂表面的H-与H+结合生成H2。在CoB催化剂中掺有MoO3会提高NaBH4释氢速率,其部分机理如图1所示。
图1
图2
① NaBH4水解生成H2和B(OH)的离子方程式为 ▲ 。
② 用重水(D2O)代替H2O,通过检测反应生成的 ▲ 可以判断制氢的机理。
③ 掺有MoO3能提高催化效率的原理是 ▲ 。
④ 已知:Co容易吸附阴离子。产氢速率与NaBH4浓度的关系如图2所示。当NaBH4浓度大于1 mol·L-1时,产氢速率下降的原因是 ▲ 。
扬州中学高二化学(下)期中测试参考答案 2025.4
1 2 3 4 5 6 7 8 9 10 11 12 13
B D A A D C B D A B B C B
14.(16分) (1) ① 2Bi+11Cl-+Cl+6H+===2BiC+3H2O(3分)
② 生成氮氧化物,污染环境(2分)
③ 溶液黏度较大,流动性差,浸出剂与固体接触不充分,浸出反应速率低(2分)
(2) ① BiCl3+Na2CO3===BiOCl↓+CO2↑+2NaCl(3分)
② Bi2SeO2(2分)
(3) 边搅拌边向烧渣中加入氨水至固体不再溶解,过滤,向滤液中加入水合肼溶液至不再有气泡生成(至沉淀不再产生),过滤,用蒸馏水洗涤沉淀,取最后一次洗涤滤液滴加BaCl2溶液无浑浊生成,干燥(4分)
15.(13分) (1)醚键、酮羰基、酯基(2分)
(2)7∶3(2分)
(3)还原反应(2分) 取代反应(2分)
(4)(2分)
(5)(3分)
16.(15分)(1)(球形)冷凝管(2分)
(2)分离出水,使反应正向进行,提高反应物转化率(或利用率)(2分)
(3)a(2分)
(4)CH3CH2CH=CH2(2分)
(5)除去有机相中残留的碱及盐(2分)
(6)正丁醇与水形成分子间氢键(2分)
(7)35.5%(3分)
正丁醇加入31mL,密度为,正丁醇相对分子质量为M=74g/mol,得质量为31mL×=25.11g,物质的量为25.11g÷74g/mol=0.34mol,根据关系式可知正丁醚为0.17mol,M=130g/mol,故质量为22.1g,产量为7.84g,正丁醚的产率为
17. (17分)(1) ① 3LiAlH4+AlCl3===4AlH3+3LiCl(3分)
② -1 018.5 kJ·mol-1(2分)
③ AlH3分解得到活性H与Fe2O3反应大量放热引发铝热反应Ⅲ;AlH3分解得到Al更容易与Fe2O3反应(颗粒小、无氧化膜)(3分)
(2) ①B+4H2O===B(OH)+4H2↑(3分)
② HD、B(OD)(D3BO3亦可)(2分)
③ MoO3促进H2O的电离产生H+和OH-(2分)
④ 反应生成大量B(OH)吸附在Co表面,阻止B的吸附反应(2分)
高二化学(选修) 2025.4
试卷满分:100分,考试时间:75分钟
注意事项:
作答第1卷前,请考生务必将自己的姓名、考试证号等写在答题卡上并贴上条形码
将选择题答案填写在答题卡的指定位置上(使用机读卡的用2B铅笔在机读卡上填涂),非选择题一律在答题卡上作答,在试卷上答题无效。
考试结束后,请将机读卡和答题卡交监考人员。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Br-80
第I卷(选择题 共39分)
单项选择题:本题包括13小题,每题3分,共39分。在每题给出的四个选项中只有一
项是最符合题意的。(请将所有选择题答案填到答题卡的指定位置中.)
1.2025央视春晚舞台上,创意融合舞蹈《秧BOT》,不仅仅是一场视觉盛宴,更是科技与传统文化的完美结合。下列说法不正确的是
A.机器人穿着喜庆的红色棉袄,其中棉花属于天然有机高分子
B.为机器人提供续航的锂电池,轻便稳定,比能量较低
C.机器人的机身应用了碳纤维,是一种含碳量在90%以上的高强度纤维
D.铝合金和钛合金也是制造机器人的重要原材料,钛合金强度高耐腐蚀,铝合金轻质成本低,都是极为重要的金属材料
2.下列表示不正确的是
A.质子数为35、中子数为46的Br原子:
B.的形成过程:
C.的名称:2,2,4,5-四甲基己烷
D.福尔马林溶液中的氢键:
3.认知、推理能力是培养化学学科思维的方法之一,下列说法不正确的是
A.与H2完全加成之后的产物,其一氯代物有7种
B.环戊二烯()分子中最多有9个原子在同一平面上
C.按系统命名法,化合物的名称是2–甲基苯酚
D.可使酸性高锰酸钾溶液褪色
4.W、X、Y、Z、Q是核电荷数依次增大的短周期元素,这5种元素形成的一种阴离子结构如图所示。W、Y的核电荷数之和等于Z的核电荷数,Y原子价电子数是Q原子价电子数的2倍。下列说法不正确的是
A.W与X形成的化合物均为极性分子 B.Y的简单气态氢化物的沸点比X的高
C.Q的氧化物是两性氧化物 D.该阴离子中含有配位键
5.NaOH活化过的催化剂对甲醛氧化为具有较好的催化效果,有学者提出该催化反应的机理如下。下列说法不正确的是
A.步骤Ⅰ中存在非极性键的断裂
B.步骤Ⅰ可理解为HCHO中带部分负电荷的O与催化剂表面的-OH发生作用
C.步骤Ⅱ中发生的反应可表示为
D.该催化剂对苯的催化氧化效果优于对HCHO的催化氧化效果
6.甲氧苄啶是一种广谱抗菌药,其合成路线中的一步反应如下:
下列说法中正确的是
A.X分子中含有的sp2杂化的碳原子数为6
B.X分子能与FeCl3溶液反应
C.Y分子存在顺反异构
D.X→Y分两步进行,先发生取代反应,后发生消去反应
7.室温下,下列实验探究方案能达到探究目的的是
选项 探究目的 探究方案
A Ka(HClO)与Ka(HCN)的大小关系 用pH计测量NaClO溶液和NaCN溶液的pH,比较HClO和HCN的Ka大小
B 碘在浓KI溶液中与CCl4中的溶解能力比较 向碘的CCl4溶液中加入等体积浓KI溶液,振荡,观察有机层颜色的变化
C SO2是否具有漂白性 向盛有SO2水溶液的试管中滴加几滴KMnO4溶液,振荡,观察溶液颜色变化
D 探究1—溴丁烷的消去产物 向圆底烧瓶中加入2.0gNaOH、15mL无水乙醇、碎瓷片和5mL1-溴丁烷,微热,将产生的气体通入酸性KMnO4溶液,观察现象
8.微生物燃料电池可以净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是
A.N为电池正极,Cr2O72-被还原
B.该电池工作时,M极的电极反应式为CH3COOH-8e-+2H2O=2CO2+8H+
C.Cr2O72-浓度较大时,可能会造成还原菌失去活性
D.当M极产生22.4LCO2气体(标准状况)时,有4molH+从质子交换膜右侧移向左侧
9.工业上用CO2和H2反应合成二甲醚,其反应为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH = -122.5kJ·mol 1。不同的催化剂对该反应的催化活性在不同温度下表现不同。下列说法正确的是
A.上述反应平衡常数
B.其他条件不变时,CO2转化率随温度升高而增大的原因可能是催化剂活性增强或平衡常数增大
C.其他条件不变时,在恒压条件下通入一定量的惰性气体,H2的平衡转化率提高
D.若反应中及时分离出二甲醚,正反应速率增大,CO2转化率增大
10.化学与生产、生活密切相关,下列事实与盐类水解无关的是
A.用热的纯碱溶液去除炊具上的油污
B.为了除去锅炉水垢中的CaSO4,先用Na2CO3溶液处理,而后用酸溶解
C.NH4Cl或ZnCl2溶液用作金属焊接的除锈剂
D.配制FeCl3溶液时,先将FeCl3固体溶于浓盐酸,再加水稀释到所需浓度
11.从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示。
下列说法不正确的是
A.“碱浸”时,温度保持在的目的是提高“碱浸”速率,同时防止H2O2过度分解
B.“碱浸”时,GaAs被H2O2氧化,每反应1mol GaAs,转移电子的数目为5mol
C.“旋流电积”所得“尾液”溶质主要是H2SO4,可进行循环利用,提高经济效益
D.GaAs晶胞如上图,距离As最近的As原子数为12
12.草酸亚铁是生产磷酸铁锂电池的原料,实验室可通过如图反应制取FeC2O4:
已知室温时:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=1.5×10-4、Ksp(FeC2O4)=2.1×10-7。
下列说法正确的是
A.室温下,0.10molL-1NaHC2O4溶液中存在:c(C2O42-)
C.室温时,反应Fe2++H2C2O4=FeC2O4↓+2H+的平衡常数K=40
D.过滤后的上层清液中:c(Fe2+)c(C2O42-)≥2.1×10-7
13.甲醇-水催化重整可获得H2.其主要反应为
反应Ⅰ CH3OH(g) + H2O(g) = CO2(g) + 3H2(g) ΔH = 49.4 kJ·mol 1
反应Ⅱ CO2(g) + H2(g) = CO(g) + H2O(g) ΔH = 41.2 kJ·mol 1
在1.0×105Pa、n始(H2O)∶n始(CH3OH)=1.2时,若仅考虑上述反应,平衡时CO的选择性、CH3OH的转化率和H2的产率随温度的变化如图所示。
CO的选择性= × 100%
下列说法正确的是
A.一定温度下,增大可提高CO的选择性
B.平衡时CH3OH的转化率一定大于H2O的转化率
C.图中曲线①表示平衡时H2产率随温度的变化
D.一定温度下,降低体系压强,反应Ⅰ的平衡常数增大
第Ⅱ卷(非选择题 共61分)
14. (16分)回收高铋银锌渣(主要成分是Bi,还含有Zn、Ag、Au等杂质)可制备半导体材料Bi2O3。
(1) 氧化酸浸。将银锌渣加入盐酸和NaCl混合溶液中,再分批加入NaClO3溶液,搅拌使其充分反应,得到含有BiC的浸出液和浸出渣。
图1
①写出生成BiC的离子方程式: ▲ 。
② HNO3也可用于“氧化酸浸”,在该工业中不选择HNO3的原因可能是 ▲ 。
③液固比是指浸出液总体积与银锌渣质量之比。浸出相同时间后,Bi的浸出率随液固比的变化如图1所示。液固比很低时,Bi的浸出率明显较低的原因是 ▲ 。
(2) 分离出Zn2+后浸出液主要成分为BiCl3溶液。可用于进一步制备Bi2O3,其流程如下:
① 向浸出液中滴加Na2CO3溶液,调节溶液pH约为1.5,得到BiOCl沉淀,该过程的化学方程式为 ▲ 。
图2
② 我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图2所示。该材料的化学式为 ▲ 。
(3) 从浸出渣中可回收银和金。已知Ag2SO4可溶于氨水,[Ag(NH3)2]+具有较强的氧化性。补充完整以浸出渣为原料制备单质银的实验方案:向浸出渣中加入硫酸后焙烧,得硫酸银烧渣, ▲ ,得单质银。
(实验中须使用的试剂有氨水、水合肼溶液、BaCl2溶液)
15. (13分)化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如下:
(1)化合物D中含氧官能团的名称为 ▲ 。
(2)化合物A分子中发生sp2、sp3杂化的碳原子数目之比为 ▲ 。
(3)A→B、B→C的反应类型分别为 ▲ 、 ▲ 。
(4)化合物C还可以继续与HBr反应生成副产物X(C7H7OBr),X的结构简式为 ▲ 。
(5)D的某同分异构体同时满足下列条件,写出其中一种符合要求的同分异构体的结构简
式 ▲ 。
①分子中含有苯环,且核磁共振氢谱证明只含有两种不同化学环境的氢原子;
②该物质只含有一种官能团。
(15分)实验室常用正丁醇、浓硫酸在加热条件下制备正丁醚,反应原理如下:2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O。
反应装置如图所示。反应流程如下:
i:在100mL烧瓶中,先加入31mL正丁醇,再将4.5mL浓硫酸加入瓶内并投入沸石。将分水器、温度计和烧瓶组装好。
ii:沿分水器支管口对面的内壁小心的贴壁加水,待水面上升至恰与分水器支管口下沿相平时为止,小心开启活塞放出水。
iii:在分水器上口接一仪器a,小火加热,使反应物微沸并开始回流,随反应进行,回流液经冷凝管收集于分水器中。
iv:平稳回流至烧瓶内反应温度达135°C至137°C左右,分水器中水面上升至支管口即可停止反应,反应液稍冷后开启活塞放出水,然后拆除装置。
v:将反应液倒入盛有50mL水的分液漏斗中,充分振荡,静置分层,弃去下层水溶液,上层粗产物依次用25mL水、15mL5%的NaOH溶液、15mL水洗涤并分液,在有机相中加入氯化钙,干燥后过滤。
vi:干燥后粗产物置于蒸馏瓶中,蒸馏收集140.1℃至144℃馏分,产量为7.84g。
已知:正丁醇(M=74g/mol)的密度为,正丁醚(M=130g/mol)微溶于水。
(1)仪器a的名称是 ▲ 。
(2)分水器的主要作用是 ▲ 。
(3)步骤i中,为使浓硫酸与正丁醇混合均匀,应如何加入浓硫酸: ▲ 。(填字母)
a.分批加入浓硫酸,每次加入都充分振摇
b.一次性快速加入浓硫酸,加入后再充分振摇
(4)写出制备过程中主要伴随的有机副反应产物的结构简式 ▲ 。
(5)“步骤v”中,水洗涤的目的是 ▲ 。
(6)制备过程中,正丁醇与水可以形成共沸物,其主要原因是 ▲ 。
(7)本实验中正丁醚的产率为 ▲ (写出计算过程,结果保留3位有效数字)。
17. (17分)储能材料是当前研究的热点。
(1) AlH3易分解反应释放出活性H,且可与固体氧化物混合作固体燃料推进剂。AlH3与Fe2O3的反应过程如下:
Ⅰ. AlH3(s)===Al(s)+3H(g);ΔH=521.1 kJ·mol-1
Ⅱ. 6H(g)+Fe2O3(s)===2Fe(s)+3H2O(g);ΔH=-1 209.2 kJ·mol-1
Ⅲ. 2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s);ΔH=-851.5 kJ·mol-1
① LiAlH4和AlCl3在无水乙醚中反应可以生成AlH3和LiCl,该反应的化学方程式为 ▲ 。
② 反应2AlH3(s)+2Fe2O3(s)===4Fe(s)+3H2O(g)+Al2O3(s)的ΔH= ▲ 。
③ AlH3与普通铝粉相比,AlH3与Fe2O3反应更容易引发的原因是 ▲ 。
(2) NaBH4是一种储氢材料,CoB催化剂催化NaBH4释氢的原理是OH-使催化剂表面的B释放H-,催化剂表面的H-与H+结合生成H2。在CoB催化剂中掺有MoO3会提高NaBH4释氢速率,其部分机理如图1所示。
图1
图2
① NaBH4水解生成H2和B(OH)的离子方程式为 ▲ 。
② 用重水(D2O)代替H2O,通过检测反应生成的 ▲ 可以判断制氢的机理。
③ 掺有MoO3能提高催化效率的原理是 ▲ 。
④ 已知:Co容易吸附阴离子。产氢速率与NaBH4浓度的关系如图2所示。当NaBH4浓度大于1 mol·L-1时,产氢速率下降的原因是 ▲ 。
扬州中学高二化学(下)期中测试参考答案 2025.4
1 2 3 4 5 6 7 8 9 10 11 12 13
B D A A D C B D A B B C B
14.(16分) (1) ① 2Bi+11Cl-+Cl+6H+===2BiC+3H2O(3分)
② 生成氮氧化物,污染环境(2分)
③ 溶液黏度较大,流动性差,浸出剂与固体接触不充分,浸出反应速率低(2分)
(2) ① BiCl3+Na2CO3===BiOCl↓+CO2↑+2NaCl(3分)
② Bi2SeO2(2分)
(3) 边搅拌边向烧渣中加入氨水至固体不再溶解,过滤,向滤液中加入水合肼溶液至不再有气泡生成(至沉淀不再产生),过滤,用蒸馏水洗涤沉淀,取最后一次洗涤滤液滴加BaCl2溶液无浑浊生成,干燥(4分)
15.(13分) (1)醚键、酮羰基、酯基(2分)
(2)7∶3(2分)
(3)还原反应(2分) 取代反应(2分)
(4)(2分)
(5)(3分)
16.(15分)(1)(球形)冷凝管(2分)
(2)分离出水,使反应正向进行,提高反应物转化率(或利用率)(2分)
(3)a(2分)
(4)CH3CH2CH=CH2(2分)
(5)除去有机相中残留的碱及盐(2分)
(6)正丁醇与水形成分子间氢键(2分)
(7)35.5%(3分)
正丁醇加入31mL,密度为,正丁醇相对分子质量为M=74g/mol,得质量为31mL×=25.11g,物质的量为25.11g÷74g/mol=0.34mol,根据关系式可知正丁醚为0.17mol,M=130g/mol,故质量为22.1g,产量为7.84g,正丁醚的产率为
17. (17分)(1) ① 3LiAlH4+AlCl3===4AlH3+3LiCl(3分)
② -1 018.5 kJ·mol-1(2分)
③ AlH3分解得到活性H与Fe2O3反应大量放热引发铝热反应Ⅲ;AlH3分解得到Al更容易与Fe2O3反应(颗粒小、无氧化膜)(3分)
(2) ①B+4H2O===B(OH)+4H2↑(3分)
② HD、B(OD)(D3BO3亦可)(2分)
③ MoO3促进H2O的电离产生H+和OH-(2分)
④ 反应生成大量B(OH)吸附在Co表面,阻止B的吸附反应(2分)
同课章节目录
