鲁科版高中化学选择性必修2第1章原子结构与元素性质第2节原子结构与元素周期表第2课时核外电子排布与元素周期表课件(共45张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质第2节原子结构与元素周期表第2课时核外电子排布与元素周期表课件(共45张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:08:28 | ||
图片预览










文档简介
(共45张PPT)
第1章 原子结构与元素性质
第2节 原子结构与元素周期表
第2课时 核外电子排布与元素周期表
第*页
研习任务 核外电子排布与周期、族的划分
[目标导航]1.了解元素周期表中周期、族的划分及其与原子核外电子排布的关系。2. 了解元素周期表区的划分与原子核外电子排布的关系。
教材 认知
一、核外电子排布与周期的划分
1. 价电子
(1)定义:与元素的 密切相关的 轨道上的电子,称为价 电子。
(2)规律:主族元素原子的价电子数 主族族序数。
(3)举例:写出下列基态原子的价电子的排布式。
Na: ,Cl: ,Fe: 。
化学性质
外层
等于
3s1
3s23p5
3d64s2
2. 近似能级图与周期
3. 原子核外电子排布与元素周期表中周期划分的本质联系
4. 周期数与电子层数关系的一般规律
周期数=最外层电子所在轨道所处的 。
电子层数
元素种数
二、核外电子排布与族的划分
1. 划分依据
族的划分与原子的价电子 和价电子 密切相关。
2. 特点
一般来说,同族元素原子的价电子数目 。
数目
排布
相同
3. 一般规律
(1)
(2)
(3)稀有气体→最外层电子排布:ns2np6(He除外)。
ns1~2
ns2np1~5
价电子数
(n-1)d1~10ns1~2
价电子数
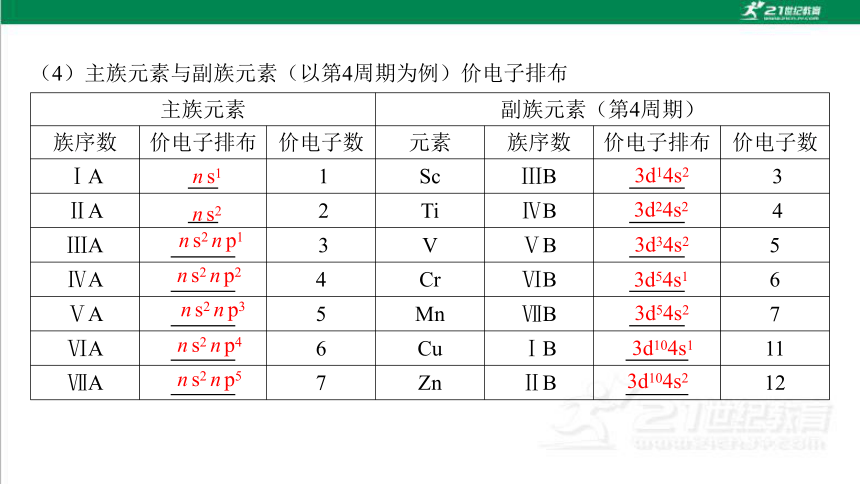
(4)主族元素与副族元素(以第4周期为例)价电子排布
主族元素 副族元素(第4周期)
族序数 价电子排布 价电子数 元素 族序数 价电子排布 价电子数
ⅠA 1 Sc ⅢB 3
ⅡA 2 Ti ⅣB 4
ⅢA 3 V ⅤB 5
ⅣA 4 Cr ⅥB 6
ⅤA 5 Mn ⅦB 7
ⅥA 6 Cu ⅠB 11
ⅦA 7 Zn ⅡB 12
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
3d14s2
3d24s2
3d34s2
3d54s1
3d54s2
3d104s1
ns2np5
3d104s2
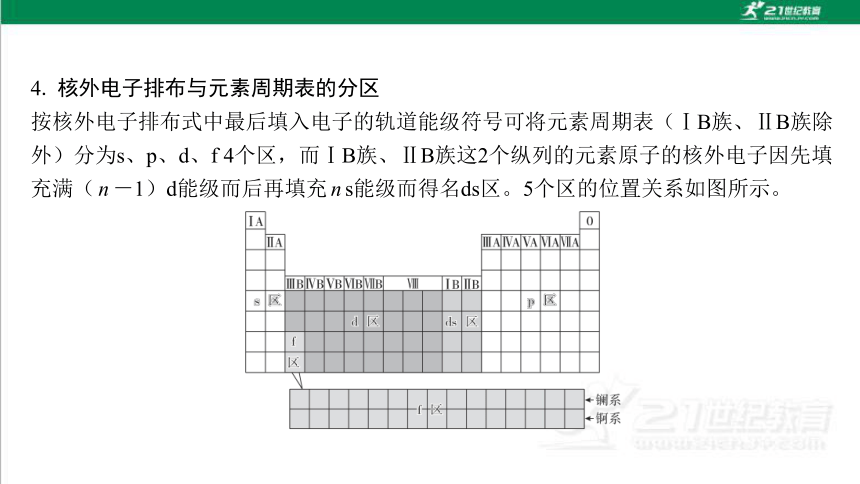
4. 核外电子排布与元素周期表的分区
按核外电子排布式中最后填入电子的轨道能级符号可将元素周期表(ⅠB族、ⅡB族除 外)分为s、p、d、f 4个区,而ⅠB族、ⅡB族这2个纵列的元素原子的核外电子因先填 充满(n-1)d能级而后再填充ns能级而得名ds区。5个区的位置关系如图所示。
[思考1] (1)哪些族元素的族序数等于价电子数?
提示:主族及ⅢB~ⅦB族的族序数=价电子数(镧系、锕系除外)。
(2)试分析原子序数为21的元素Sc位于哪一周期,哪一族?
提示:基态Sc原子核外电子排布式为1s22s22p63s23p63d14s2,价电子排布式为3d14s2,根据最外层电子数=电子层数=周期数,副族序数=价电子数,可知Sc位于第4周期ⅢB族。
[思考2] (1)稀有气体元素原子具有特殊稳定性的原因是什么?
提示:稀有气体原子最外层为全充满电子的结构是稀有气体元素原子具有特殊 稳定性的原因。
(2)举例说明电子层结构相同的微粒,其微粒半径大小的比较有什么规律?
提示:电子层结构相同的微粒,核电荷数越大,原子核对电子的引力越大,其微粒半径越小。例如:r(N3-)>r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
×
×
√
×
×
×
探究 活动
现代化学的元素周期律是1869年门捷列夫发现的,他将当时已知的元素按相对原子质 量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的 雏形,经过多年修订后才成为当代的周期表。元素周期表与原子结构密切相关。
1. 元素周期表中的周期是依据什么划分的?
提示:按照构造原理共分7个能级组,每一个能级组对应一个周期,每一个能级组容 纳的最多电子数为该周期含有的元素种类数。
2. 元素周期表中的族是依据什么划分的?同主族元素原子的价电子排布有何特点?
提示:价电子排布。同主族元素原子的价电子排布相同,全部排布在ns或ns、np轨 道上。
3. 价电子排布为4s24p1的元素,在元素周期表中处于什么位置?
提示:第4周期ⅢA族。
4. 某元素位于周期表中第4周期ⅥA族,试写出该元素的价电子排布式和电子排 布式。
提示:该元素的价电子排布式为4s24p4,电子排布式为1s22s22p63s23p63d104s24p4。
5. 原子序数1~36的某元素基态原子的最外层电子排布式为ns2,该元素可能属于哪 一族?
提示:0族(He)、ⅡA族、ⅡB族、ⅢB族、ⅣB族、ⅤB族、ⅦB族、Ⅷ族。
重点 讲解
1. 元素周期系
(1)含义:元素按其原子核电荷数递增排列的序列称为元素周期系。这个序列中的 元素性质随着核电荷数的递增发生周期性的递变。
(2)特点
2. 元素周期表——门捷列夫周期表
(1)原子的结构决定了它在周期表中的位置:
①核内质子数 →原子序数(118种)。
②电子层数 →周期数(7个)。
③价电子数 →族序数(16个)。
(2)元素周期表的结构
记忆口诀:横行叫周期,现有一至七,四长三个短,第七已排满。纵列称为族,共有 十六族,一八依次现①,一零再一遍②。一纵一个族,Ⅷ族搞特殊,三纵算一族,占 去8、9、10。镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ。
②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
研习 经典
A. 基态原子的N层上只有一个电子的元素,不一定是ⅠA族元素
B. 原子的价电子排布式为(n-1)d6~8ns2的元素是Ⅷ族元素
C. 基态原子的p能级上半充满的元素一定位于p区
D. 基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
D
解析:基态原子的N层上只有一个电子的元素,其基态原子电子排布式可能为 1s22s22p63s23p64s1、1s22s22p63s23p63d54s1或1s22s22p63s23p63d104s1,即该元素可能在ⅠA 族、ⅥB族或ⅠB族,故A正确;原子的价电子排布式为(n-1)d6~8ns2的元素是Ⅷ 族元素,故B正确;基态原子的p能级上半充满,电子最后填充p能级,该元素属于p 区,故C正确;基态原子的价电子排布式为(n-1)dxnsy的元素的族序数可能为x +y(x+y≤7),也可能为y(x=10,y=1或2),该元素还可能在Ⅷ族(7<x +y≤10),故D错误。
A. 所有非金属元素都分布在p区
B. s区元素的最后一个电子进入p轨道
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. 所有金属元素都是过渡元素
解析:氢元素分布在s区,故A错误;s区元素的最后一个电子进入s轨道,故B错误; 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是过渡元素,均是金属元素,故C正 确;主族元素也有金属元素,如钠、钾元素,故D错误。
C
A. 元素②和⑤位于同一区
B. 元素③的基态原子中,未成对电子数为5
C. 与元素④具有相同最外层电子数的元素只可能处于ds区
D. s区(除元素①外)、d区和ds区的元素都是金属元素
C
解析:根据元素在周期表的位置,5种元素分别为H、O、Mn、Zn、Ge。O元素的价 电子排布式为2s22p4,Ge元素的价电子排布式为4s24p2,最后一个电子均填充到p能 级,两种元素均位于p区,故A说法正确;Mn元素价电子排布式为3d54s2,因此Mn元 素基态原子未成对电子数为5,故B说法正确;元素④的价电子排布式为3d104s2,最外 层有2个电子的元素还包括s区的Be、Mg等,d区的Ti、Mn、Fe等,p区的He等,故C 说法错误;d区和ds区均为金属元素,故D说法正确。
A. 第4周期ⅤA族 B. 第5周期ⅢA族
C. 第5周期ⅠA族 D. 第4周期ⅢA族
解析:电子层数=周期数,价电子数=主族序数,所以该元素位于第5周期ⅢA族。
B
A. 3p64s1 B. 4s1 C. 3d54s1 D. 3d104s1
解析:基态原子4s轨道上有1个电子,若该元素位于s区,则其基态原子价电子排布式 为4s1;若该元素位于d区,则其基态原子价电子排布式为3d54s1;若该元素位于ds 区,则其基态原子价电子排布式为3d104s1;在p区不存在4s轨道上有1个电子的原子, 故A符合题意。
A
方法规律
根据原子结构特征判断元素在元素周期表中的位置
电子排布式 价电子排布式
A. 第9列元素中有非金属元素
B. 只有第2列的元素原子最外层电子排布式为ns2
C. 第4周期第8列元素是铁元素
D. 第15列元素原子的最外层电子排布式为ns2np5
解析:根据元素周期表的结构可知,第9列为d区元素,全部为金属元素,A项错误; 最外层电子排布式为ns2的不只是第2列元素的原子,如第12列元素即ⅡB族的原子最 外层电子排布式也是ns2,B项错误;第4周期第8列元素为Fe,C正确;第15列元素即 ⅤA族原子的最外层电子排布式为ns2np3,D项错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 稀有气体元素区域
B. 过渡元素区域
C. 右上方的非金属元素区域
D. 金属元素和非金属元素分界线附近的元素区域
解析:元素周期表中位置相近的元素性质相似,因此人们可以在元素周期表中一定的 区域内研究合成有特定性质的新物质。如在金属和非金属的分界线附近寻找半导体材 料(如锗、硅、硒等),在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材 料(如制造火箭、飞机的钛、钼等元素)。故选B。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 它位于周期表的第4周期ⅡA族
B. 它的基态核外电子排布式可简写为[Ar]4s2
C. Co2+的核外价电子排布式为 3d54s2
D. Co 位于元素周期表中的d区
解析:Co为过渡元素,位于元素周期表中第4周期Ⅷ族,A错误;3d74s2表示价电子 排布式,所以Co的基态核外电子排布式可简写为[Ar]3d74s2,B错误;失电子时,应先 失去最外层的电子,即先失去4s上的电子,Co2+的价电子排布式为3d7,C错误;根据 价电子排布式为3d74s2可知,它位于元素周期表的第9列,位于元素周期表中的d区, D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. s区均为金属元素
B. 最外层电子数为2的元素都分布在s区
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. 所有金属元素都分布在d区和ds区
解析:氢元素在s区,属于非金属元素,A错误;He原子最外层电子数为2,位于0 族,ⅡB族最外层电子数为2,在ds区,B错误;元素周期表中ⅢB族到第ⅡB族10个纵 列的元素,称为过渡元素,全部为金属元素,C正确;大部分金属元素都分布在d区 和ds区,少数金属分布在s区和p区,D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 同一原子的能层越高,s电子云半径越大
B. 在元素周期表中,s区、d区和ds区的元素都是金属(氢元素除外)
C. Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
D. 某价电子排布式为 4f75d16s2基态原子,该元素位于元素周期表中第6周期ⅢB 族
解析:能量越高,离原子核越远,则同一原子的能层越高,s电子云半径越大,A说法 正确;s区、d区和ds区的元素的最外层电子数都小于4,则s区、d区和ds区的元素都是 金属(氢元素除外),B说法正确;Xe位于0族,同族的He只有2个电子,其价电子排 布式为1s2,C说法错误;价电子排布式为4f75d16s2基态原子,为64号元素,原子结构 中有6个电子层,为副族元素,位于元素周期表中第6周期ⅢB族,D说法正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. Y元素原子的价电子排布式为4s24p4
B. Y元素在元素周期表的第3周期ⅥA族
C. X元素所在周期中所含非金属元素种数最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
解析:因为Y元素原子的价电子排布式中出现了np能级,所以其ns能级已经充满且 只能为2个电子,则n-1=2,n=3,即Y元素原子的价电子排布式为3s23p4,位于元 素周期表中的第3周期ⅥA族,A项错误,B项正确;Y为S元素,X为F元素,第2周期 所含非金属元素种数最多,C项正确;Z为As元素,核外电子排布式为 1s22s22p63s23p63d104s24p3,D项正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 某元素原子的第二电子层的轨道表示式为
B. 某元素在某种化合物中的化合价为+4价
C. 某元素原子的最外层上电子数为6
D. 某元素原子的价电子排布式为5s25p1
解析:A项,只能说明该元素的L层有8个电子,无法确定其在元素周期表中的位置; B项,仅通过化合价无法确定元素在元素周期表中的位置;C项,根据最外层电子数 只能确定其族序数,无法确定周期序数;D项,根据该元素原子的价电子排布式可确 定该元素在第5周期ⅢA族。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. p区不包含副族元素
B. 第5周期有15种f区元素
C. d区、ds区均不存在非金属元素
D. s区所有元素的p能级电子均为全满或全空状态
解析:p区是最后一个电子填充到p能级上(He除外),包括ⅡA至0族,不包括副族元 素,故A说法正确;f区指的是镧系和锕系,镧系和锕系在第6、7周期的ⅢB族,第5 周期不含有f区,故B说法错误;d区和ds区元素均属过渡元素,过渡元素都是金属元 素,故C说法正确;s区的价电子构型为ns1~2,s区所有元素的p能级电子均为全满或 全空状态,故D说法正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
A. X原子的核外电子排布式为1s1,Y原子的价电子排布式为3d104s1
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子2p能级上有3个电子,Y原子的3p能级上有3个电子
D. X原子核外M层上仅有2个电子,Y原子核外N层上也仅有2个电子
解析:X原子的核外电子排布式为1s1,则X为H,为ⅠA族元素,Y原子的价电子排布 式为3d104s1,则Y为Cu,为ⅠB族元素,故A错误;X为He,Y为Be,分别为0族、ⅡA族 元素,故B错误;2p轨道上只有3个电子的为N,3p轨道上只有3个电子的为P,二者位 于周期表ⅤA族,故C正确;原子核外M层上仅有2个电子的X为Mg元素,原子核外N 层上仅有2个电子的Y可能为Ca、Sc、Ti、V、Fe、Co、Ni、Zn等元素,不一定位于 同一族,故D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. d区中,族序数最大、原子序数最小的元素,它+2价离子比+3价离子稳定
B. 第2周期p区内,p轨道内电子最多的原子,半径最小
C. 在ds区中,族序数最小、原子序数也最小的元素单质与铅用导线相连,不能起到 保护铅不被氧化的作用
D. s、d、ds和f四区中的所有元素单质(氢除外),常温下均为固态
C
解析:d区中,族序数最大、原子序数最小的元素是Fe,其+3价离子的价电子排布式 为3d5,+2价离子的价电子排布式为3d6,所以+3价离子比+2价离子稳定,故A错 误;第2周期p区内,p轨道内电子最多的原子是Ne,半径最小的是F,故B错误;在ds 区中,族序数最小、原子序数也最小的元素是Cu,Pb的活泼性大于Cu,Cu与铅用导 线相连,Pb作负极,不能保护铅不被氧化,故C正确;Hg是ds区元素,金属汞在常温 下均为液态,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 表中五种元素位于5个不同的区
B. 与元素4具有相同最外层电子数的元素只可能处于ds区
C. 元素1、2、3的基态原子中,未成对电子数之比为1∶3∶5
D. 元素5的简化电子排布式为[Ar]3d104s24p2
D
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:元素1处于s区,元素3处于d区,元素4处于ds区,元素2和元素5均处于p区,共 4个不同的区,故A错误;元素4处于第4周期ⅡB族,最外层电子数为2,属于ds区元 素,Be、Mg的最外层电子数均为2,属于s区元素,Ti、Mn最外层电子数也是2,属于 d区元素,故B错误;元素1、2、3分别是H、O、Mn,它们的基态原子的价电子排布 式分别为1s1、2s22p4、3d54s2,故未成对电子数之比为1∶2∶5,故C错误;元素5位于第4 周期ⅣA族,为32号元素锗(Ge),简化电子排布式为[Ar]3d104s24p2,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
12. 原子结构与元素周期表存在内在联系,按要求回答下列问题:
(1)根据元素在周期表中的位置,写出下列元素基态原子的价电子排布式。
①第4周期ⅥB族 ;
②第5周期ⅠB族 ;
③第5周期ⅣA族 ;
④第6周期ⅡA族 。
解析:ⅢB族~ⅦB族元素的价电子排布式分别为(n-1)d1~5ns2,且价电子 数等于族序数,故①为3d44s2,但据洪特规则应为3d54s1。ⅠB族和ⅡB族的价电子排布 式分别为(n-1)d10ns1和(n-1)d10ns2,故②为4d105s1。主族元素的价电子全都 排布在最外层的ns或np上,且价电子数等于族序数,故③为5s25p2,④为6s2。
3d54s1
4d105s1
5s25p2
6s2
1
2
3
4
5
6
7
8
9
10
11
12
13
(2)根据元素电子排布可以确定元素在周期表中的位置。
①具有(n-1)d10ns2电子排布的元素位于周期表中的 族。
②已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d3。该元素位于元素周 期表 (填字母)。
ⅡB
C
A. 第2周期ⅡB族 B. 第4周期ⅡA族
C. 第4周期ⅤB族 D. 第5周期ⅡB族
③某元素原子的核电荷数为33,则其原子的价电子排布式为 ,其位于元素 周期表中的 ,属于 区的元素。
4s24p3
第4周期ⅤA族
p
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:①具有(n-1)d10ns2电子排布的元素应该在ds区,根据其电子排布式 可知,该元素位于周期表中ⅡB族。②该元素基态原子价电子排布式为3d34s2,该元素 为d区元素(价电子排在d轨道和s轨道上),根据周期数=能层序数,族序数=价电 子数可知,该元素位于第4周期ⅤB族,故选C。③根据构造原理可知,该元素基态原 子核外电子排布式为1s22s22p63s23p63d104s24p3,则其原子的价电子排布式为4s24p3,故 该元素在周期表中位于第4周期ⅤA族,属于p区元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti)元素,基态原子价电子轨道表示式 为 ,Ti元素形成的化合物中,Ti呈现的最高价态为 价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子 的价电子排布式为3d54s1,该元素的名称是 。
解析:(3)①钛位于第4周期ⅣB族,价电子总数为4,则价电子排布式为3d24s2,其 价电子轨道表示式为 ;Ti的最高化合价=价电子数=+4。②价 电子排布式为3d54s1的元素为铬元素。
+4
铬
1
2
3
4
5
6
7
8
9
10
11
12
13
13. (1)某元素原子的价电子构型为4s24p1,它属于第 周期 族,属 于 区元素。
解析:某元素的原子的价电子构型为4s24p1,它在周期表中位于第4周期ⅢA 族,属于p区元素。
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是 (用元 素符号表示,下同),第3周期原子半径最小的主族元素的价电子排布式 为 。
解析:在1~18号元素中,除稀有气体元素外,原子半径最大的元素是Na,第3周期原子半径最小的元素为Cl,其价电子排布式为3s23p5。
4
ⅢA
p
Na
3s23p5
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)Cu+的核外电子排布式为 。按电子排布, 可将周期表中的元素划分成五个区域,第4周期元素中属于s区的元素有 种。
解析:Cu的原子序数为29,基态原子电子排布式为1s22s22p63s23p63d104s1,Cu+失去最外层电子,即失去4s轨道的电子,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;s区包括ⅠA、ⅡA族,第4周期只有K、Ca两种元素。
(4)某元素原子的3p轨道有1个未成对电子,该元素为 (用元素符号 表示)。
解析:某元素原子的3p轨道有1个未成对电子的元素的电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为Al或Cl元素。
1s22s22p63s23p63d10(或[Ar]3d10)
2
Al(或Cl)
1
2
3
4
5
6
7
8
9
10
11
12
13
第1章 原子结构与元素性质
第2节 原子结构与元素周期表
第2课时 核外电子排布与元素周期表
第*页
研习任务 核外电子排布与周期、族的划分
[目标导航]1.了解元素周期表中周期、族的划分及其与原子核外电子排布的关系。2. 了解元素周期表区的划分与原子核外电子排布的关系。
教材 认知
一、核外电子排布与周期的划分
1. 价电子
(1)定义:与元素的 密切相关的 轨道上的电子,称为价 电子。
(2)规律:主族元素原子的价电子数 主族族序数。
(3)举例:写出下列基态原子的价电子的排布式。
Na: ,Cl: ,Fe: 。
化学性质
外层
等于
3s1
3s23p5
3d64s2
2. 近似能级图与周期
3. 原子核外电子排布与元素周期表中周期划分的本质联系
4. 周期数与电子层数关系的一般规律
周期数=最外层电子所在轨道所处的 。
电子层数
元素种数
二、核外电子排布与族的划分
1. 划分依据
族的划分与原子的价电子 和价电子 密切相关。
2. 特点
一般来说,同族元素原子的价电子数目 。
数目
排布
相同
3. 一般规律
(1)
(2)
(3)稀有气体→最外层电子排布:ns2np6(He除外)。
ns1~2
ns2np1~5
价电子数
(n-1)d1~10ns1~2
价电子数
(4)主族元素与副族元素(以第4周期为例)价电子排布
主族元素 副族元素(第4周期)
族序数 价电子排布 价电子数 元素 族序数 价电子排布 价电子数
ⅠA 1 Sc ⅢB 3
ⅡA 2 Ti ⅣB 4
ⅢA 3 V ⅤB 5
ⅣA 4 Cr ⅥB 6
ⅤA 5 Mn ⅦB 7
ⅥA 6 Cu ⅠB 11
ⅦA 7 Zn ⅡB 12
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
3d14s2
3d24s2
3d34s2
3d54s1
3d54s2
3d104s1
ns2np5
3d104s2
4. 核外电子排布与元素周期表的分区
按核外电子排布式中最后填入电子的轨道能级符号可将元素周期表(ⅠB族、ⅡB族除 外)分为s、p、d、f 4个区,而ⅠB族、ⅡB族这2个纵列的元素原子的核外电子因先填 充满(n-1)d能级而后再填充ns能级而得名ds区。5个区的位置关系如图所示。
[思考1] (1)哪些族元素的族序数等于价电子数?
提示:主族及ⅢB~ⅦB族的族序数=价电子数(镧系、锕系除外)。
(2)试分析原子序数为21的元素Sc位于哪一周期,哪一族?
提示:基态Sc原子核外电子排布式为1s22s22p63s23p63d14s2,价电子排布式为3d14s2,根据最外层电子数=电子层数=周期数,副族序数=价电子数,可知Sc位于第4周期ⅢB族。
[思考2] (1)稀有气体元素原子具有特殊稳定性的原因是什么?
提示:稀有气体原子最外层为全充满电子的结构是稀有气体元素原子具有特殊 稳定性的原因。
(2)举例说明电子层结构相同的微粒,其微粒半径大小的比较有什么规律?
提示:电子层结构相同的微粒,核电荷数越大,原子核对电子的引力越大,其微粒半径越小。例如:r(N3-)>r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
×
×
√
×
×
×
探究 活动
现代化学的元素周期律是1869年门捷列夫发现的,他将当时已知的元素按相对原子质 量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的 雏形,经过多年修订后才成为当代的周期表。元素周期表与原子结构密切相关。
1. 元素周期表中的周期是依据什么划分的?
提示:按照构造原理共分7个能级组,每一个能级组对应一个周期,每一个能级组容 纳的最多电子数为该周期含有的元素种类数。
2. 元素周期表中的族是依据什么划分的?同主族元素原子的价电子排布有何特点?
提示:价电子排布。同主族元素原子的价电子排布相同,全部排布在ns或ns、np轨 道上。
3. 价电子排布为4s24p1的元素,在元素周期表中处于什么位置?
提示:第4周期ⅢA族。
4. 某元素位于周期表中第4周期ⅥA族,试写出该元素的价电子排布式和电子排 布式。
提示:该元素的价电子排布式为4s24p4,电子排布式为1s22s22p63s23p63d104s24p4。
5. 原子序数1~36的某元素基态原子的最外层电子排布式为ns2,该元素可能属于哪 一族?
提示:0族(He)、ⅡA族、ⅡB族、ⅢB族、ⅣB族、ⅤB族、ⅦB族、Ⅷ族。
重点 讲解
1. 元素周期系
(1)含义:元素按其原子核电荷数递增排列的序列称为元素周期系。这个序列中的 元素性质随着核电荷数的递增发生周期性的递变。
(2)特点
2. 元素周期表——门捷列夫周期表
(1)原子的结构决定了它在周期表中的位置:
①核内质子数 →原子序数(118种)。
②电子层数 →周期数(7个)。
③价电子数 →族序数(16个)。
(2)元素周期表的结构
记忆口诀:横行叫周期,现有一至七,四长三个短,第七已排满。纵列称为族,共有 十六族,一八依次现①,一零再一遍②。一纵一个族,Ⅷ族搞特殊,三纵算一族,占 去8、9、10。镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ。
②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
研习 经典
A. 基态原子的N层上只有一个电子的元素,不一定是ⅠA族元素
B. 原子的价电子排布式为(n-1)d6~8ns2的元素是Ⅷ族元素
C. 基态原子的p能级上半充满的元素一定位于p区
D. 基态原子的价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
D
解析:基态原子的N层上只有一个电子的元素,其基态原子电子排布式可能为 1s22s22p63s23p64s1、1s22s22p63s23p63d54s1或1s22s22p63s23p63d104s1,即该元素可能在ⅠA 族、ⅥB族或ⅠB族,故A正确;原子的价电子排布式为(n-1)d6~8ns2的元素是Ⅷ 族元素,故B正确;基态原子的p能级上半充满,电子最后填充p能级,该元素属于p 区,故C正确;基态原子的价电子排布式为(n-1)dxnsy的元素的族序数可能为x +y(x+y≤7),也可能为y(x=10,y=1或2),该元素还可能在Ⅷ族(7<x +y≤10),故D错误。
A. 所有非金属元素都分布在p区
B. s区元素的最后一个电子进入p轨道
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. 所有金属元素都是过渡元素
解析:氢元素分布在s区,故A错误;s区元素的最后一个电子进入s轨道,故B错误; 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是过渡元素,均是金属元素,故C正 确;主族元素也有金属元素,如钠、钾元素,故D错误。
C
A. 元素②和⑤位于同一区
B. 元素③的基态原子中,未成对电子数为5
C. 与元素④具有相同最外层电子数的元素只可能处于ds区
D. s区(除元素①外)、d区和ds区的元素都是金属元素
C
解析:根据元素在周期表的位置,5种元素分别为H、O、Mn、Zn、Ge。O元素的价 电子排布式为2s22p4,Ge元素的价电子排布式为4s24p2,最后一个电子均填充到p能 级,两种元素均位于p区,故A说法正确;Mn元素价电子排布式为3d54s2,因此Mn元 素基态原子未成对电子数为5,故B说法正确;元素④的价电子排布式为3d104s2,最外 层有2个电子的元素还包括s区的Be、Mg等,d区的Ti、Mn、Fe等,p区的He等,故C 说法错误;d区和ds区均为金属元素,故D说法正确。
A. 第4周期ⅤA族 B. 第5周期ⅢA族
C. 第5周期ⅠA族 D. 第4周期ⅢA族
解析:电子层数=周期数,价电子数=主族序数,所以该元素位于第5周期ⅢA族。
B
A. 3p64s1 B. 4s1 C. 3d54s1 D. 3d104s1
解析:基态原子4s轨道上有1个电子,若该元素位于s区,则其基态原子价电子排布式 为4s1;若该元素位于d区,则其基态原子价电子排布式为3d54s1;若该元素位于ds 区,则其基态原子价电子排布式为3d104s1;在p区不存在4s轨道上有1个电子的原子, 故A符合题意。
A
方法规律
根据原子结构特征判断元素在元素周期表中的位置
电子排布式 价电子排布式
A. 第9列元素中有非金属元素
B. 只有第2列的元素原子最外层电子排布式为ns2
C. 第4周期第8列元素是铁元素
D. 第15列元素原子的最外层电子排布式为ns2np5
解析:根据元素周期表的结构可知,第9列为d区元素,全部为金属元素,A项错误; 最外层电子排布式为ns2的不只是第2列元素的原子,如第12列元素即ⅡB族的原子最 外层电子排布式也是ns2,B项错误;第4周期第8列元素为Fe,C正确;第15列元素即 ⅤA族原子的最外层电子排布式为ns2np3,D项错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 稀有气体元素区域
B. 过渡元素区域
C. 右上方的非金属元素区域
D. 金属元素和非金属元素分界线附近的元素区域
解析:元素周期表中位置相近的元素性质相似,因此人们可以在元素周期表中一定的 区域内研究合成有特定性质的新物质。如在金属和非金属的分界线附近寻找半导体材 料(如锗、硅、硒等),在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材 料(如制造火箭、飞机的钛、钼等元素)。故选B。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 它位于周期表的第4周期ⅡA族
B. 它的基态核外电子排布式可简写为[Ar]4s2
C. Co2+的核外价电子排布式为 3d54s2
D. Co 位于元素周期表中的d区
解析:Co为过渡元素,位于元素周期表中第4周期Ⅷ族,A错误;3d74s2表示价电子 排布式,所以Co的基态核外电子排布式可简写为[Ar]3d74s2,B错误;失电子时,应先 失去最外层的电子,即先失去4s上的电子,Co2+的价电子排布式为3d7,C错误;根据 价电子排布式为3d74s2可知,它位于元素周期表的第9列,位于元素周期表中的d区, D正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. s区均为金属元素
B. 最外层电子数为2的元素都分布在s区
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. 所有金属元素都分布在d区和ds区
解析:氢元素在s区,属于非金属元素,A错误;He原子最外层电子数为2,位于0 族,ⅡB族最外层电子数为2,在ds区,B错误;元素周期表中ⅢB族到第ⅡB族10个纵 列的元素,称为过渡元素,全部为金属元素,C正确;大部分金属元素都分布在d区 和ds区,少数金属分布在s区和p区,D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 同一原子的能层越高,s电子云半径越大
B. 在元素周期表中,s区、d区和ds区的元素都是金属(氢元素除外)
C. Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
D. 某价电子排布式为 4f75d16s2基态原子,该元素位于元素周期表中第6周期ⅢB 族
解析:能量越高,离原子核越远,则同一原子的能层越高,s电子云半径越大,A说法 正确;s区、d区和ds区的元素的最外层电子数都小于4,则s区、d区和ds区的元素都是 金属(氢元素除外),B说法正确;Xe位于0族,同族的He只有2个电子,其价电子排 布式为1s2,C说法错误;价电子排布式为4f75d16s2基态原子,为64号元素,原子结构 中有6个电子层,为副族元素,位于元素周期表中第6周期ⅢB族,D说法正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. Y元素原子的价电子排布式为4s24p4
B. Y元素在元素周期表的第3周期ⅥA族
C. X元素所在周期中所含非金属元素种数最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
解析:因为Y元素原子的价电子排布式中出现了np能级,所以其ns能级已经充满且 只能为2个电子,则n-1=2,n=3,即Y元素原子的价电子排布式为3s23p4,位于元 素周期表中的第3周期ⅥA族,A项错误,B项正确;Y为S元素,X为F元素,第2周期 所含非金属元素种数最多,C项正确;Z为As元素,核外电子排布式为 1s22s22p63s23p63d104s24p3,D项正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 某元素原子的第二电子层的轨道表示式为
B. 某元素在某种化合物中的化合价为+4价
C. 某元素原子的最外层上电子数为6
D. 某元素原子的价电子排布式为5s25p1
解析:A项,只能说明该元素的L层有8个电子,无法确定其在元素周期表中的位置; B项,仅通过化合价无法确定元素在元素周期表中的位置;C项,根据最外层电子数 只能确定其族序数,无法确定周期序数;D项,根据该元素原子的价电子排布式可确 定该元素在第5周期ⅢA族。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
A. p区不包含副族元素
B. 第5周期有15种f区元素
C. d区、ds区均不存在非金属元素
D. s区所有元素的p能级电子均为全满或全空状态
解析:p区是最后一个电子填充到p能级上(He除外),包括ⅡA至0族,不包括副族元 素,故A说法正确;f区指的是镧系和锕系,镧系和锕系在第6、7周期的ⅢB族,第5 周期不含有f区,故B说法错误;d区和ds区元素均属过渡元素,过渡元素都是金属元 素,故C说法正确;s区的价电子构型为ns1~2,s区所有元素的p能级电子均为全满或 全空状态,故D说法正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
A. X原子的核外电子排布式为1s1,Y原子的价电子排布式为3d104s1
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子2p能级上有3个电子,Y原子的3p能级上有3个电子
D. X原子核外M层上仅有2个电子,Y原子核外N层上也仅有2个电子
解析:X原子的核外电子排布式为1s1,则X为H,为ⅠA族元素,Y原子的价电子排布 式为3d104s1,则Y为Cu,为ⅠB族元素,故A错误;X为He,Y为Be,分别为0族、ⅡA族 元素,故B错误;2p轨道上只有3个电子的为N,3p轨道上只有3个电子的为P,二者位 于周期表ⅤA族,故C正确;原子核外M层上仅有2个电子的X为Mg元素,原子核外N 层上仅有2个电子的Y可能为Ca、Sc、Ti、V、Fe、Co、Ni、Zn等元素,不一定位于 同一族,故D错误。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
A. d区中,族序数最大、原子序数最小的元素,它+2价离子比+3价离子稳定
B. 第2周期p区内,p轨道内电子最多的原子,半径最小
C. 在ds区中,族序数最小、原子序数也最小的元素单质与铅用导线相连,不能起到 保护铅不被氧化的作用
D. s、d、ds和f四区中的所有元素单质(氢除外),常温下均为固态
C
解析:d区中,族序数最大、原子序数最小的元素是Fe,其+3价离子的价电子排布式 为3d5,+2价离子的价电子排布式为3d6,所以+3价离子比+2价离子稳定,故A错 误;第2周期p区内,p轨道内电子最多的原子是Ne,半径最小的是F,故B错误;在ds 区中,族序数最小、原子序数也最小的元素是Cu,Pb的活泼性大于Cu,Cu与铅用导 线相连,Pb作负极,不能保护铅不被氧化,故C正确;Hg是ds区元素,金属汞在常温 下均为液态,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 表中五种元素位于5个不同的区
B. 与元素4具有相同最外层电子数的元素只可能处于ds区
C. 元素1、2、3的基态原子中,未成对电子数之比为1∶3∶5
D. 元素5的简化电子排布式为[Ar]3d104s24p2
D
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:元素1处于s区,元素3处于d区,元素4处于ds区,元素2和元素5均处于p区,共 4个不同的区,故A错误;元素4处于第4周期ⅡB族,最外层电子数为2,属于ds区元 素,Be、Mg的最外层电子数均为2,属于s区元素,Ti、Mn最外层电子数也是2,属于 d区元素,故B错误;元素1、2、3分别是H、O、Mn,它们的基态原子的价电子排布 式分别为1s1、2s22p4、3d54s2,故未成对电子数之比为1∶2∶5,故C错误;元素5位于第4 周期ⅣA族,为32号元素锗(Ge),简化电子排布式为[Ar]3d104s24p2,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
12. 原子结构与元素周期表存在内在联系,按要求回答下列问题:
(1)根据元素在周期表中的位置,写出下列元素基态原子的价电子排布式。
①第4周期ⅥB族 ;
②第5周期ⅠB族 ;
③第5周期ⅣA族 ;
④第6周期ⅡA族 。
解析:ⅢB族~ⅦB族元素的价电子排布式分别为(n-1)d1~5ns2,且价电子 数等于族序数,故①为3d44s2,但据洪特规则应为3d54s1。ⅠB族和ⅡB族的价电子排布 式分别为(n-1)d10ns1和(n-1)d10ns2,故②为4d105s1。主族元素的价电子全都 排布在最外层的ns或np上,且价电子数等于族序数,故③为5s25p2,④为6s2。
3d54s1
4d105s1
5s25p2
6s2
1
2
3
4
5
6
7
8
9
10
11
12
13
(2)根据元素电子排布可以确定元素在周期表中的位置。
①具有(n-1)d10ns2电子排布的元素位于周期表中的 族。
②已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d3。该元素位于元素周 期表 (填字母)。
ⅡB
C
A. 第2周期ⅡB族 B. 第4周期ⅡA族
C. 第4周期ⅤB族 D. 第5周期ⅡB族
③某元素原子的核电荷数为33,则其原子的价电子排布式为 ,其位于元素 周期表中的 ,属于 区的元素。
4s24p3
第4周期ⅤA族
p
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:①具有(n-1)d10ns2电子排布的元素应该在ds区,根据其电子排布式 可知,该元素位于周期表中ⅡB族。②该元素基态原子价电子排布式为3d34s2,该元素 为d区元素(价电子排在d轨道和s轨道上),根据周期数=能层序数,族序数=价电 子数可知,该元素位于第4周期ⅤB族,故选C。③根据构造原理可知,该元素基态原 子核外电子排布式为1s22s22p63s23p63d104s24p3,则其原子的价电子排布式为4s24p3,故 该元素在周期表中位于第4周期ⅤA族,属于p区元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti)元素,基态原子价电子轨道表示式 为 ,Ti元素形成的化合物中,Ti呈现的最高价态为 价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子 的价电子排布式为3d54s1,该元素的名称是 。
解析:(3)①钛位于第4周期ⅣB族,价电子总数为4,则价电子排布式为3d24s2,其 价电子轨道表示式为 ;Ti的最高化合价=价电子数=+4。②价 电子排布式为3d54s1的元素为铬元素。
+4
铬
1
2
3
4
5
6
7
8
9
10
11
12
13
13. (1)某元素原子的价电子构型为4s24p1,它属于第 周期 族,属 于 区元素。
解析:某元素的原子的价电子构型为4s24p1,它在周期表中位于第4周期ⅢA 族,属于p区元素。
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是 (用元 素符号表示,下同),第3周期原子半径最小的主族元素的价电子排布式 为 。
解析:在1~18号元素中,除稀有气体元素外,原子半径最大的元素是Na,第3周期原子半径最小的元素为Cl,其价电子排布式为3s23p5。
4
ⅢA
p
Na
3s23p5
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)Cu+的核外电子排布式为 。按电子排布, 可将周期表中的元素划分成五个区域,第4周期元素中属于s区的元素有 种。
解析:Cu的原子序数为29,基态原子电子排布式为1s22s22p63s23p63d104s1,Cu+失去最外层电子,即失去4s轨道的电子,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;s区包括ⅠA、ⅡA族,第4周期只有K、Ca两种元素。
(4)某元素原子的3p轨道有1个未成对电子,该元素为 (用元素符号 表示)。
解析:某元素原子的3p轨道有1个未成对电子的元素的电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为Al或Cl元素。
1s22s22p63s23p63d10(或[Ar]3d10)
2
Al(或Cl)
1
2
3
4
5
6
7
8
9
10
11
12
13
