鲁科版高中化学选择性必修2第1章原子结构与元素性质第1节原子结构模型第1课时氢原子光谱和玻尔的原子结构模型课件(共38张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质第1节原子结构模型第1课时氢原子光谱和玻尔的原子结构模型课件(共38张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:09:39 | ||
图片预览










文档简介
(共38张PPT)
第1章 原子结构与元素性质
第1节 原子结构模型
第1课时 氢原子光谱和玻尔的原子结构模型
第*页
研习任务一 原子结构模型的演变
[目标导航]1.了解原子结构模型的演变历程和玻尔的原子结构模型的内容。2.理解基 态、激发态和原子光谱等概念,认识原子光谱分析的应用。
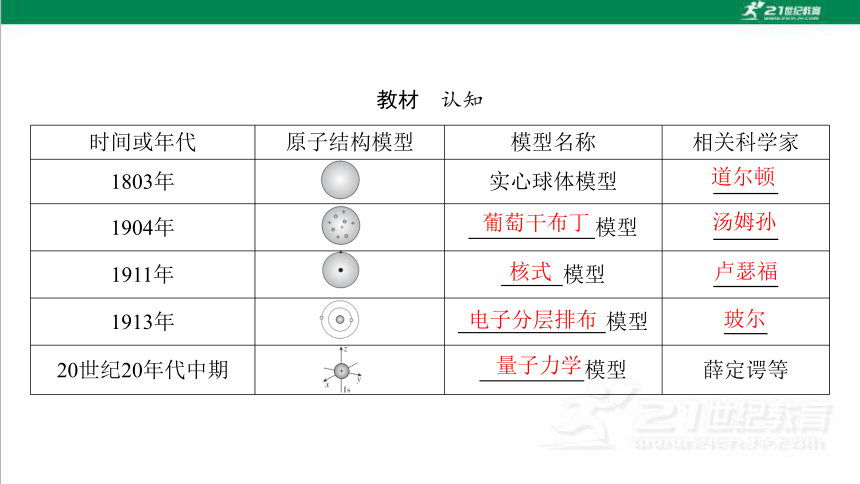
教材 认知
时间或年代 原子结构模型 模型名称 相关科学家
1803年 实心球体模型
1904年 模型
1911年 模型
1913年 模型
20世纪20年代中期 模型 薛定谔等
道尔顿
葡萄干布丁
汤姆孙
核式
卢瑟福
电子分层排布
玻尔
量子力学
[思考] 道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:①原子 是不能再分的粒子;②同种元素原子的各种性质和质量都相同;③原子是微小的实心 球体。从现代的观点看,你认为三个论点是否确切?请说明理由。
提示:①②③都不确切。从现代化学理论看:①原子是由原子核和核外电子构成的, 因此原子是能再分的粒子;②由于元素存在同位素,因此质子数相同的同种元素的原 子也会因中子数不同而导致其质量和物理性质不同,因此同种元素的原子的各种性质 和质量不一定相同;③原子核的体积很小,原子中大部分为空隙,电子在核外做高速 运动,因此原子不是微小的实心球体。
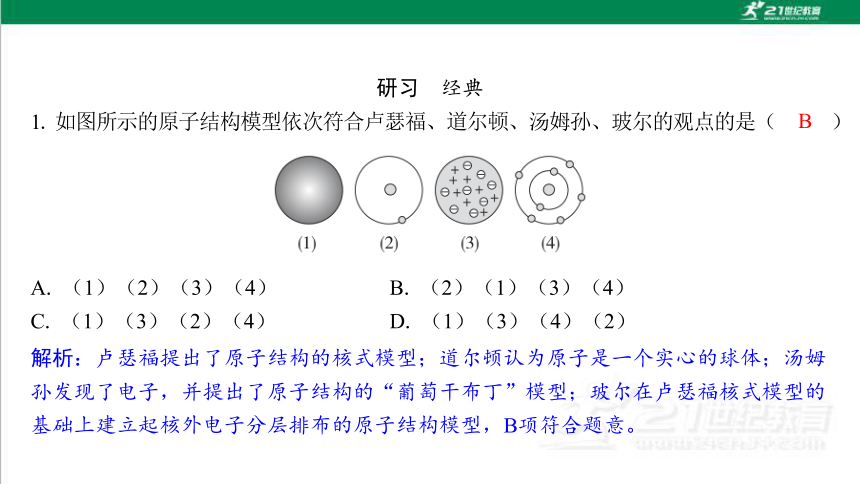
研习 经典
A. (1)(2)(3)(4) B. (2)(1)(3)(4)
C. (1)(3)(2)(4) D. (1)(3)(4)(2)
解析:卢瑟福提出了原子结构的核式模型;道尔顿认为原子是一个实心的球体;汤姆 孙发现了电子,并提出了原子结构的“葡萄干布丁”模型;玻尔在卢瑟福核式模型的 基础上建立起核外电子分层排布的原子结构模型,B项符合题意。
B
A. 阴极射线实验发现电子:道尔顿原子结构模型
B. α粒子散射实验发现原子核:卢瑟福原子结构模型
C. 氢原子光谱发现电子分层排布:卢瑟福原子结构模型
D. α粒子散射实验发现电子:汤姆孙原子结构模型
解析:汤姆孙通过阴极射线实验发现电子,故A错误;卢瑟福根据α粒子散射实验提 出了原子结构的核式模型,故B正确;玻尔为了解释氢原子光谱,提出了核外电子分 层排布的原子结构模型,即玻尔原子结构模型,故C错误;汤姆孙发现电子,并提出 “葡萄干布丁”模型,故D错误。
B
第*页
研习任务二 氢原子光谱和玻尔的原子结构模型
教材 认知
一、氢原子光谱
1. 光谱
(1)光谱的含义:利用原子光谱仪将物质吸收的光或发射的光的 (或波 长)和 分布记录下来,得到光谱。
(2)形成原因:电子在能量不同的轨道之间 时,会辐射或吸收能量。
(3)光谱的类型
①连续光谱:若光谱是由各种波长的光所组成,波长的变化呈 ,则这种 光谱为连续光谱。例如,阳光形成的光谱即连续光谱。
②线状光谱:若光谱是由具有 、彼此分立的谱线组成,则所得光谱为线状光谱。
频率
强度
跃迁
连续分布
特定波长
2. 氢原子光谱特点
氢原子光谱是 光谱。
线状
二、玻尔的原子结构模型
1. 基本观点
原子核
不同
不连
续
升高
基
态
激发态
光谱
2. 贡献
(1)成功地解释了氢原子光谱是 的实验事实。
(2)阐明了原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的轨 道的能量是 的。
线状光谱
量子化
[思考] 根据玻尔原子结构模型解释为什么氢原子光谱是线状光谱?
提示:根据玻尔理论,氢原子核外电子所处的轨道的能量是量子化的,不连续 的,轨道的能量差也是不连续的,电子从一个轨道跃迁到另一个轨道时,辐射 或吸收的能量是不连续的,以光的形式表现出来的光的波长是不连续的,所以 氢原子光谱是线状光谱。
√
×
√
×
×
探究 活动
每到夜幕降临的时候,大街上的霓虹灯就会渐渐亮起来,整个城市也变得那么迷人。 霓虹灯内因为充有稀薄氖气或其他稀有气体才会发出颜色各异的光,你知道霓虹灯为 什么能发出颜色各异的光吗?
节日燃放的五颜六色的焰火
夜空中的激光
1. 我们看到的LED灯光、霓虹灯光、激光、焰火都与什么有关?
提示:与原子核外电子发生跃迁有关。
2. 什么是基态原子和激发态原子?
提示:处于最低能量状态的原子叫做基态原子。基态原子吸收能量,它的电子会跃迁 到较高能量的轨道,变为激发态原子。
3. 某些金属进行焰色反应产生不同火焰颜色的原因是什么?
提示:某些金属原子的电子在高温火焰中,接受能量,使原子外层的电子从基态跃迁 到激发态;处于激发态的电子是不稳定的,在极短的时间内(约10-8 s)便跃迁到基 态或较低能级上,在跃迁过程中将产生发射光谱。
重点 讲解
1. 基态与激发态
(1)基态原子
处于最低能量状态的原子叫做基态原子。
(2)激发态原子
基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。
(3)基态原子与激发态原子的关系
2. 光(辐射)是电子跃迁释放能量的重要形式
电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。日常生 活中看到的霓虹灯光、激光、焰火等都与原子核外电子跃迁释放能量有关。
3. 光谱
(1)原子光谱
不同元素原子的电子在不同能量的轨道之间发生跃迁时会吸收或释放不同的光,可以 用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
(2)原子光谱的成因与分类
(3)光谱分析
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。光谱分析 的依据是每一种元素都有自己的特征谱线。
研习 经典
A. 原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐射), 这也是原子光谱产生的原因
B. 霓虹灯光、激光、焰火、物理成像都与电子跃迁释放能量有关
C. 通过原子光谱可以发现新的元素,也可以鉴定某些元素
D. 同一原子的发射光谱和吸收光谱的特征谱线位置相同
B
解析:原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐 射),这也是原子光谱产生的原因,电子从基态向激发态跃迁时会吸收能量,形成吸 收光谱,电子从激发态向基态跃迁时释放能量,形成发射光谱,A正确;焰火、激 光、霓虹灯光都与电子跃迁释放能量有关,而物理成像与电子跃迁释放能量无关,B 错误;在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,C 正确;同一原子的发射光谱和吸收光谱的特征谱线位置相同,故D正确。
A. 基态时的能量比激发态时高
B. 激发态时比较稳定
C. 由基态转化为激发态过程中吸收能量
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
解析:激发态时能量较高,较不稳定,A、B不正确。原子光谱分为吸收光谱和发射 光谱,电子从较低能量的基态跃迁到较高能量的激发态时,会产生原子吸收光谱,D 不正确。
C
A. ③④ B. ①②③⑤ C. ④ D. ①②③④
解析:棱镜分光是由于不同色彩的光在玻璃中的折射率不同引起的,与电子跃迁无 关,故①不符合题意;石油蒸馏是利用石油中各成分的沸点不同加以分离,与电子跃 迁无关,故②不符合题意;凸透镜聚光是由光的折射形成的,与电子跃迁无关,故③ 不符合题意;日光灯通电发光是因为电子发生能级跃迁时将多余的能量以光的形式放 出,与电子跃迁有关,故④符合题意;冷却结晶是由于温度降低,溶液的溶解度减小 析出溶质,与电子跃迁无关,故⑤不符合题意。
C
A. K元素的焰色反应呈紫色(透过蓝色钴玻璃),产生紫色的原因是化学变化
B. 如图实验装置测得的是氢元素的吸收光谱
C. 电子仅由激发态跃迁到基态才会产生原子光谱
D. 原子光谱可以用于定性鉴定元素
D
解析:K元素的焰色反应呈紫色(透过蓝色钴玻璃),是钾原子中电子发生跃迁的结 果,属于物理变化,A错误;题给实验装置测得的是氢原子的发射光谱,B错误;原 子光谱有吸收光谱和发射光谱两种,电子由激发态跃迁到基态时会产生原子发射光 谱,C错误。
课时作业
A. 玻尔 B. 道尔顿 C. 卢瑟福 D. 汤姆孙
解析:1911年,卢瑟福根据α粒子散射实验提出“原子结构的核式模型”,故选C。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. ①② B. ②③ C. ①④ D. ③④
解析:同一原子,基态时的能量比激发态时低,基态时比较稳定,②③正确, ①④错误。
B
A. n=1 B. n=2 C. n=3 D. n=4
解析:对氢原子而言,电子处于n=1的轨道时能量最低,称为基态。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 原子的核外电子处于能量最低的状态称为基态
B. 原子的核外电子吸收能量而高于基态能量的状态称为激发态
C. 焰色是电子从能量较低的轨道跃迁到能量较高的轨道时产生的
D. 原子的核外电子由能量较高的轨道跃迁到能量较低的轨道时,辐射的能量可能以 光的形式表现出来
解析:基态原子是处于最低能量状态的原子,A正确;焰色是电子从激发态的能 量较高的轨道跃迁到能量较低的轨道时产生的,C错误;原子的核外电子由能量 较高的轨道跃迁到能量较低的轨道时,会放出能量,发光是释放能量的主要形 式之一,D正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 在原子中只有某些电子能够跃迁产生光谱
B. 原子中的电子可以处于某些特定的能量状态,即电子所处轨道的能量是量子化的
C. 原子发射的光是单色光
D. 白光可以由多种单色光组成
解析:光谱分为连续光谱和线状光谱,无论是单色光还是白光,都是连续光谱,原子 光谱是线状光谱,是由具有特定频率的光形成的谱线。原子光谱之所以产生这种特定 的谱线,是由于电子的能量是量子化的,电子跃迁吸收或释放的能量也是量子化的。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流的作用下,氖原子与构成灯管的物质发生反应
解析:霓虹灯发红光是因为电子吸收能量后跃迁到能量较高的轨道,能量较高轨道上 的电子会跃迁回能量较低的轨道而以光的形式释放能量。故选A。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 焰色反应是化学变化
B. 在现代化学中,常利用光谱分析法来鉴定元素
C. 同一原子处于激发态时的能量一定大于其处于基态时的能量
D. 焰色反应中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光 的颜色
解析:焰色反应是物理变化,A项错误;不同元素的特征谱线不同,故可以利用光谱 分析法来鉴定元素,B项正确;基态是原子能量最低时的状态,C项正确;焰色反应 中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光的颜色,D项 正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 基态NO2与NO2*具有的能量不同
D. 测得荧光强度越大,说明汽车尾气中NO含量越高
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 证明了原子核外电子在圆形轨道上运动
B. 提出了原子核是可以进一步细分的
C. 解决了氢原子光谱和原子能级之间的关系
D. 应用了量子力学理论中的概念和方法
解析:玻尔把量子论用于原子,与卢瑟福核式原子模型结合起来,提出电子在一定轨 道上运动的原子结构模型,成功地解释了氢原子光谱是线状光谱的原因,为后来人们 用更多的量子数来标记核外电子的运动状态、来解释复杂的原子光谱提供了可以借鉴 的方法。所以D说法正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 自然界中所有原子都处于基态
B. 同一原子处于激发态时的能量一定高于基态时的能量
C. 无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D. 激发态原子的能量较高,极易失去电子,表现出较强的还原性
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:自然界中的原子有的处于基态,有的处于激发态,放射性元素处于激发态,A 说法错误;激发态是基态原子的电子吸收能量跃迁到较高能量的轨道的状态,故同一 种原子处于激发态时的能量一定高于基态时的能量,B说法正确;不同原子的基态原 子的能量不一定低于激发态原子的能量,但同一种原子激发态时的能量一定高于基态 时的能量,C说法错误;激发态原子的能量较高,容易跃迁到能量较低的激发态或基 态,能量降低。激发态原子若要失去电子,仍必须再吸收能量,失去电子难易程度需 根据原子的具体情况而定,有的激发态原子易失去电子,有的激发态原子难失去电 子,D说法错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 氢原子光谱为线状光谱
B. 在一给定的稳定轨道上,运动的核外电子不辐射能量
C. 电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时会辐射或吸收能量
D. 有外加磁场时氢原子光谱增加多条谱线
解析:玻尔理论是针对电子的稳定存在和氢原子光谱为线状光谱的事实提出的,A项 不符合题意;根据玻尔理论,在一给定的稳定轨道上,运动的核外电子不辐射能量, 电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时会辐射或吸收能量, B、C项不符合题意;而对于有外加磁场时氢原子光谱增加多条谱线这一现象,玻尔 的原子结构模型已无法解释,必须借助量子力学加以解释,D项符合题意。
D
1
2
3
4
5
6
7
8
9
10
11
12
连续
线状
基态
激发态
吸
收
激发态
基态
释放
紫
激发态的电子从能量较高的轨道跃迁到能量较低的
轨道时,以一定波长(可见光区域)光的形式释放能量
1
2
3
4
5
6
7
8
9
10
11
12
第1章 原子结构与元素性质
第1节 原子结构模型
第1课时 氢原子光谱和玻尔的原子结构模型
第*页
研习任务一 原子结构模型的演变
[目标导航]1.了解原子结构模型的演变历程和玻尔的原子结构模型的内容。2.理解基 态、激发态和原子光谱等概念,认识原子光谱分析的应用。
教材 认知
时间或年代 原子结构模型 模型名称 相关科学家
1803年 实心球体模型
1904年 模型
1911年 模型
1913年 模型
20世纪20年代中期 模型 薛定谔等
道尔顿
葡萄干布丁
汤姆孙
核式
卢瑟福
电子分层排布
玻尔
量子力学
[思考] 道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:①原子 是不能再分的粒子;②同种元素原子的各种性质和质量都相同;③原子是微小的实心 球体。从现代的观点看,你认为三个论点是否确切?请说明理由。
提示:①②③都不确切。从现代化学理论看:①原子是由原子核和核外电子构成的, 因此原子是能再分的粒子;②由于元素存在同位素,因此质子数相同的同种元素的原 子也会因中子数不同而导致其质量和物理性质不同,因此同种元素的原子的各种性质 和质量不一定相同;③原子核的体积很小,原子中大部分为空隙,电子在核外做高速 运动,因此原子不是微小的实心球体。
研习 经典
A. (1)(2)(3)(4) B. (2)(1)(3)(4)
C. (1)(3)(2)(4) D. (1)(3)(4)(2)
解析:卢瑟福提出了原子结构的核式模型;道尔顿认为原子是一个实心的球体;汤姆 孙发现了电子,并提出了原子结构的“葡萄干布丁”模型;玻尔在卢瑟福核式模型的 基础上建立起核外电子分层排布的原子结构模型,B项符合题意。
B
A. 阴极射线实验发现电子:道尔顿原子结构模型
B. α粒子散射实验发现原子核:卢瑟福原子结构模型
C. 氢原子光谱发现电子分层排布:卢瑟福原子结构模型
D. α粒子散射实验发现电子:汤姆孙原子结构模型
解析:汤姆孙通过阴极射线实验发现电子,故A错误;卢瑟福根据α粒子散射实验提 出了原子结构的核式模型,故B正确;玻尔为了解释氢原子光谱,提出了核外电子分 层排布的原子结构模型,即玻尔原子结构模型,故C错误;汤姆孙发现电子,并提出 “葡萄干布丁”模型,故D错误。
B
第*页
研习任务二 氢原子光谱和玻尔的原子结构模型
教材 认知
一、氢原子光谱
1. 光谱
(1)光谱的含义:利用原子光谱仪将物质吸收的光或发射的光的 (或波 长)和 分布记录下来,得到光谱。
(2)形成原因:电子在能量不同的轨道之间 时,会辐射或吸收能量。
(3)光谱的类型
①连续光谱:若光谱是由各种波长的光所组成,波长的变化呈 ,则这种 光谱为连续光谱。例如,阳光形成的光谱即连续光谱。
②线状光谱:若光谱是由具有 、彼此分立的谱线组成,则所得光谱为线状光谱。
频率
强度
跃迁
连续分布
特定波长
2. 氢原子光谱特点
氢原子光谱是 光谱。
线状
二、玻尔的原子结构模型
1. 基本观点
原子核
不同
不连
续
升高
基
态
激发态
光谱
2. 贡献
(1)成功地解释了氢原子光谱是 的实验事实。
(2)阐明了原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的轨 道的能量是 的。
线状光谱
量子化
[思考] 根据玻尔原子结构模型解释为什么氢原子光谱是线状光谱?
提示:根据玻尔理论,氢原子核外电子所处的轨道的能量是量子化的,不连续 的,轨道的能量差也是不连续的,电子从一个轨道跃迁到另一个轨道时,辐射 或吸收的能量是不连续的,以光的形式表现出来的光的波长是不连续的,所以 氢原子光谱是线状光谱。
√
×
√
×
×
探究 活动
每到夜幕降临的时候,大街上的霓虹灯就会渐渐亮起来,整个城市也变得那么迷人。 霓虹灯内因为充有稀薄氖气或其他稀有气体才会发出颜色各异的光,你知道霓虹灯为 什么能发出颜色各异的光吗?
节日燃放的五颜六色的焰火
夜空中的激光
1. 我们看到的LED灯光、霓虹灯光、激光、焰火都与什么有关?
提示:与原子核外电子发生跃迁有关。
2. 什么是基态原子和激发态原子?
提示:处于最低能量状态的原子叫做基态原子。基态原子吸收能量,它的电子会跃迁 到较高能量的轨道,变为激发态原子。
3. 某些金属进行焰色反应产生不同火焰颜色的原因是什么?
提示:某些金属原子的电子在高温火焰中,接受能量,使原子外层的电子从基态跃迁 到激发态;处于激发态的电子是不稳定的,在极短的时间内(约10-8 s)便跃迁到基 态或较低能级上,在跃迁过程中将产生发射光谱。
重点 讲解
1. 基态与激发态
(1)基态原子
处于最低能量状态的原子叫做基态原子。
(2)激发态原子
基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。
(3)基态原子与激发态原子的关系
2. 光(辐射)是电子跃迁释放能量的重要形式
电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。日常生 活中看到的霓虹灯光、激光、焰火等都与原子核外电子跃迁释放能量有关。
3. 光谱
(1)原子光谱
不同元素原子的电子在不同能量的轨道之间发生跃迁时会吸收或释放不同的光,可以 用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
(2)原子光谱的成因与分类
(3)光谱分析
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。光谱分析 的依据是每一种元素都有自己的特征谱线。
研习 经典
A. 原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐射), 这也是原子光谱产生的原因
B. 霓虹灯光、激光、焰火、物理成像都与电子跃迁释放能量有关
C. 通过原子光谱可以发现新的元素,也可以鉴定某些元素
D. 同一原子的发射光谱和吸收光谱的特征谱线位置相同
B
解析:原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐 射),这也是原子光谱产生的原因,电子从基态向激发态跃迁时会吸收能量,形成吸 收光谱,电子从激发态向基态跃迁时释放能量,形成发射光谱,A正确;焰火、激 光、霓虹灯光都与电子跃迁释放能量有关,而物理成像与电子跃迁释放能量无关,B 错误;在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,C 正确;同一原子的发射光谱和吸收光谱的特征谱线位置相同,故D正确。
A. 基态时的能量比激发态时高
B. 激发态时比较稳定
C. 由基态转化为激发态过程中吸收能量
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
解析:激发态时能量较高,较不稳定,A、B不正确。原子光谱分为吸收光谱和发射 光谱,电子从较低能量的基态跃迁到较高能量的激发态时,会产生原子吸收光谱,D 不正确。
C
A. ③④ B. ①②③⑤ C. ④ D. ①②③④
解析:棱镜分光是由于不同色彩的光在玻璃中的折射率不同引起的,与电子跃迁无 关,故①不符合题意;石油蒸馏是利用石油中各成分的沸点不同加以分离,与电子跃 迁无关,故②不符合题意;凸透镜聚光是由光的折射形成的,与电子跃迁无关,故③ 不符合题意;日光灯通电发光是因为电子发生能级跃迁时将多余的能量以光的形式放 出,与电子跃迁有关,故④符合题意;冷却结晶是由于温度降低,溶液的溶解度减小 析出溶质,与电子跃迁无关,故⑤不符合题意。
C
A. K元素的焰色反应呈紫色(透过蓝色钴玻璃),产生紫色的原因是化学变化
B. 如图实验装置测得的是氢元素的吸收光谱
C. 电子仅由激发态跃迁到基态才会产生原子光谱
D. 原子光谱可以用于定性鉴定元素
D
解析:K元素的焰色反应呈紫色(透过蓝色钴玻璃),是钾原子中电子发生跃迁的结 果,属于物理变化,A错误;题给实验装置测得的是氢原子的发射光谱,B错误;原 子光谱有吸收光谱和发射光谱两种,电子由激发态跃迁到基态时会产生原子发射光 谱,C错误。
课时作业
A. 玻尔 B. 道尔顿 C. 卢瑟福 D. 汤姆孙
解析:1911年,卢瑟福根据α粒子散射实验提出“原子结构的核式模型”,故选C。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. ①② B. ②③ C. ①④ D. ③④
解析:同一原子,基态时的能量比激发态时低,基态时比较稳定,②③正确, ①④错误。
B
A. n=1 B. n=2 C. n=3 D. n=4
解析:对氢原子而言,电子处于n=1的轨道时能量最低,称为基态。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 原子的核外电子处于能量最低的状态称为基态
B. 原子的核外电子吸收能量而高于基态能量的状态称为激发态
C. 焰色是电子从能量较低的轨道跃迁到能量较高的轨道时产生的
D. 原子的核外电子由能量较高的轨道跃迁到能量较低的轨道时,辐射的能量可能以 光的形式表现出来
解析:基态原子是处于最低能量状态的原子,A正确;焰色是电子从激发态的能 量较高的轨道跃迁到能量较低的轨道时产生的,C错误;原子的核外电子由能量 较高的轨道跃迁到能量较低的轨道时,会放出能量,发光是释放能量的主要形 式之一,D正确。
C
1
2
3
4
5
6
7
8
9
10
11
12
A. 在原子中只有某些电子能够跃迁产生光谱
B. 原子中的电子可以处于某些特定的能量状态,即电子所处轨道的能量是量子化的
C. 原子发射的光是单色光
D. 白光可以由多种单色光组成
解析:光谱分为连续光谱和线状光谱,无论是单色光还是白光,都是连续光谱,原子 光谱是线状光谱,是由具有特定频率的光形成的谱线。原子光谱之所以产生这种特定 的谱线,是由于电子的能量是量子化的,电子跃迁吸收或释放的能量也是量子化的。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流的作用下,氖原子与构成灯管的物质发生反应
解析:霓虹灯发红光是因为电子吸收能量后跃迁到能量较高的轨道,能量较高轨道上 的电子会跃迁回能量较低的轨道而以光的形式释放能量。故选A。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 焰色反应是化学变化
B. 在现代化学中,常利用光谱分析法来鉴定元素
C. 同一原子处于激发态时的能量一定大于其处于基态时的能量
D. 焰色反应中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光 的颜色
解析:焰色反应是物理变化,A项错误;不同元素的特征谱线不同,故可以利用光谱 分析法来鉴定元素,B项正确;基态是原子能量最低时的状态,C项正确;焰色反应 中观察到的特殊焰色是金属原子的电子从激发态跃迁到基态时产生的光的颜色,D项 正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 基态NO2与NO2*具有的能量不同
D. 测得荧光强度越大,说明汽车尾气中NO含量越高
D
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 证明了原子核外电子在圆形轨道上运动
B. 提出了原子核是可以进一步细分的
C. 解决了氢原子光谱和原子能级之间的关系
D. 应用了量子力学理论中的概念和方法
解析:玻尔把量子论用于原子,与卢瑟福核式原子模型结合起来,提出电子在一定轨 道上运动的原子结构模型,成功地解释了氢原子光谱是线状光谱的原因,为后来人们 用更多的量子数来标记核外电子的运动状态、来解释复杂的原子光谱提供了可以借鉴 的方法。所以D说法正确。
D
1
2
3
4
5
6
7
8
9
10
11
12
A. 自然界中所有原子都处于基态
B. 同一原子处于激发态时的能量一定高于基态时的能量
C. 无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D. 激发态原子的能量较高,极易失去电子,表现出较强的还原性
B
1
2
3
4
5
6
7
8
9
10
11
12
解析:自然界中的原子有的处于基态,有的处于激发态,放射性元素处于激发态,A 说法错误;激发态是基态原子的电子吸收能量跃迁到较高能量的轨道的状态,故同一 种原子处于激发态时的能量一定高于基态时的能量,B说法正确;不同原子的基态原 子的能量不一定低于激发态原子的能量,但同一种原子激发态时的能量一定高于基态 时的能量,C说法错误;激发态原子的能量较高,容易跃迁到能量较低的激发态或基 态,能量降低。激发态原子若要失去电子,仍必须再吸收能量,失去电子难易程度需 根据原子的具体情况而定,有的激发态原子易失去电子,有的激发态原子难失去电 子,D说法错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 氢原子光谱为线状光谱
B. 在一给定的稳定轨道上,运动的核外电子不辐射能量
C. 电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时会辐射或吸收能量
D. 有外加磁场时氢原子光谱增加多条谱线
解析:玻尔理论是针对电子的稳定存在和氢原子光谱为线状光谱的事实提出的,A项 不符合题意;根据玻尔理论,在一给定的稳定轨道上,运动的核外电子不辐射能量, 电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时会辐射或吸收能量, B、C项不符合题意;而对于有外加磁场时氢原子光谱增加多条谱线这一现象,玻尔 的原子结构模型已无法解释,必须借助量子力学加以解释,D项符合题意。
D
1
2
3
4
5
6
7
8
9
10
11
12
连续
线状
基态
激发态
吸
收
激发态
基态
释放
紫
激发态的电子从能量较高的轨道跃迁到能量较低的
轨道时,以一定波长(可见光区域)光的形式释放能量
1
2
3
4
5
6
7
8
9
10
11
12
