鲁科版高中化学选择性必修2模块综合微评课件(共50张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2模块综合微评课件(共50张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:11:10 | ||
图片预览











文档简介
(共50张PPT)
第3章 不同聚集状态的物质与性质
模块综合微评
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符 合题意)
A. 1 mol Si晶体中含有2 mol非极性键
B. 基态Si原子的轨道表示式
C. SiHCl3的空间填充模型为
A
A. HF中的共价键为s-pσ键
B. H2O、SiF4均为极性分子
C. SiO2晶体为分子晶体
D. 基态氧原子的价电子轨道表示式为
A
解析:H只有s轨道,F最外层为2p轨道,则HF分子中的共价键是由H原子的1s轨道和F 原子未成对电子的2p轨道形成的s-pσ键,故A正确;水分子为角形结构,正、负电荷 重心不重合,属于极性分子,SiF4为正四面体形结构,正、负电荷重心重合,属于非 极性分子,故B错误;二氧化硅晶体是硅原子与氧原子通过共价键结合,属于共价晶 体,故C错误;基态氧原子的价电子排布式为2s22p4,价电子轨道表示式 为 ,故D错误。
A. 价电子排布为3d104s1的元素位于第4周期ⅠA族,是s区元素
B. SO2分子和O3分子的空间结构均为角形
D. 由于氢键的存在,水分子的稳定性好,高温下也很难分解
B
AgBr Na3[Ag(S2O3)2] Ag2S Ag+SO2
A. Na3[Ag(S2O3)2]晶体中所含的作用力只有离子键、配位键
D. 副产物SO2的键角小于120°的原因:SO2分子中S的孤电子对对成键电子对的排斥 作用使键角变小
A
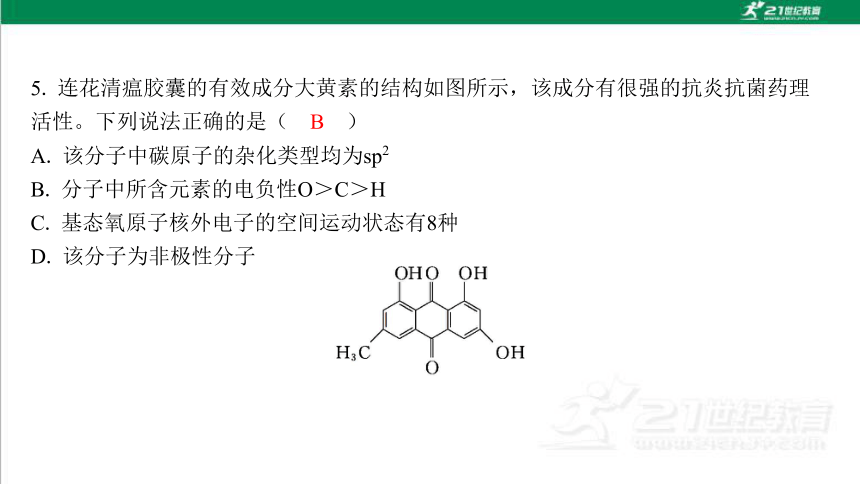
A. 该分子中碳原子的杂化类型均为sp2
B. 分子中所含元素的电负性O>C>H
C. 基态氧原子核外电子的空间运动状态有8种
D. 该分子为非极性分子
B
解析:由题给结构简式可知,该分子中碳原子除—CH3上采取sp3杂化之外,其余碳原 子的杂化类型均为sp2,A错误;根据同一周期元素从左到右电负性依次增大可知,电 负性:O>C,碳氢化合物中碳显负电性,H显正电性,故分子中所含元素的电负性: O>C>H,B正确;O是8号元素,核外有8个电子,基态氧原子的核外电子排布式为 1s22s22p4,共占据5个不同的轨道,故基态氧原子核外电子的空间运动状态有5种,C 错误;由题给有机物结构简式可知,该分子结构不高度对称,正、负电荷重心不重 合,故为极性分子,D错误。
A. SiCl4分子能与水分子形成氢键
B. N-甲基咪唑分子中有σ键和π键
C. M2+中Si的配位数为6
D. 咪唑环中的碳原子杂化方式为sp2
A
解析:SiCl4分子中的氯原子半径较大,电负性较小,不能形成氢键,A错误;单键为 σ键,双键中有1个σ键和1个π键,故N-甲基咪唑分子中有σ键和π键,B正确;由题图 可知,M2+中Si为+4价,故中心Si原子与Cl之间,与N原子之间均形成配位键,故其 配位数是6,C正确;由N-甲基咪唑的结构简式可知,双键碳原子的价电子对数为 3,杂化方式为sp2,故D正确。
选项 实验事实 理论解释
A 金刚石比晶体硅熔点高 碳原子半径比硅原子半径小
B 白磷为正四面体分子 白磷分子中P—P的键角是 109°28'
C I2在H2O中的溶解能力比I2在CCl4中的溶解 能力小 “相似相溶”原理
D 对羟基苯甲醛( )
比邻羟基苯甲醛( )的沸点高 对羟基苯甲醛形成分子间氢 键,邻羟基苯甲醛形成分子内 氢键
B
解析:碳原子半径比硅原子半径小,C—C键长比Si—Si 键长短,则键能更大,故金 刚石比晶体硅熔点高,故A正确;白磷为正四面体分子,白磷分子中P—P的键角是 60°,故B错误;I2、CCl4均为非极性分子,H2O为极性分子,根据“相似相溶”原理 可知,I2在H2O中的溶解能力比I2在CCl4中的溶解能力小,故C正确;对羟基苯甲醛形 成分子间氢键,形成分子间氢键可提高物质的熔、沸点,邻羟基苯甲醛形成分子内氢 键,形成分子内氢键会降低物质的熔、沸点,则对羟基苯甲醛( ) 比邻羟基苯甲醛( )的沸点高,故D正确。
A. Ru配合物中第2周期元素的电负性由大到小的顺序为O>N>C
B. 如图结构的吡啶环( )中C、N原子的杂化方式分别为sp2、sp3
C. 该配合物中Ru的配位数是6
D. HCOOH的沸点比CH3CHO高,主要原因是HCOOH分子间存 在范德华力和氢键,而CH3CHO分子间只有范德华力
B
解析:第2周期主族元素从左到右元素电负性逐渐增大,因此电负性由大到小的顺序 为O>N>C,A正确;如图结构的吡啶环( )中C、N原子的价电子对数均为3,故 杂化方式均为sp2,B错误;由题图结构可知,该配合物中Ru的配位数是6,C正确; HCOOH存在范德华力和氢键,因此HCOOH的沸点比HCHO高,D正确。
A. 该配合物中的配离子存在多种异构体
B. 对该配合物进行加热时,配体H2O比NH3更容易失去
C. 提供电子对形成配位键的原子在基态时核外电子具有相同数目的空间运动状态
D. 常温下,向含1 mol该配合物的溶液中滴加AgNO3溶液,滴定结束后生成2 mol AgCl沉淀
C
解析:配体在中心离子Cr3+周围形成八面体结构,如图 为八面体,如两个 水分子可以排在1和2、2和3、3和4、1和6的位置,所以该配合物中的配离子有多种异 构体,故A正确;配位原子电负性越大,吸引电子的能力越强,则给出电子对和中心 元素配合的能力越弱,形成的配位键越弱,加热时易失去,电负性:O>N,该配合 物加热时,首先失去配离子中的配体是H2O,故B正确;提供电子对形成配位键的原 子为N、O、Cl,N、O、Cl原子核外电子排布中分别占据轨道数是5、5、9,所以N、 O、Cl原子在基态时核外电子空间运动状态分别是5、5、9种,故C错误;常温下,向含1 mol该配合物的溶液中滴加AgNO3溶液,只有外界的Cl-能发生电离,所以该配合物分子能电离出2个氯离子,则向含1 mol该配合物的溶液中滴加AgNO3溶液,滴定结束后生成2 mol AgCl沉淀,故D正确。
选项 实例 解释
A 用He替代H2填充探空气球更安全 He的电子构型稳定,不易得失电子
B BF3与NH3形成配合物[H3N→BF3] BF3中的B有空轨道接受NH3中N的孤电子对
C 碱金属中Li的熔点最高 碱金属中Li的价电子数最少,金属键最强
D 不存在稳定的NF5分子 N原子价电子只有4个原子轨道,不能形成5个N—F键
C
解析:氢气具有可燃性,使用氢气填充气球存在一定的安全隐患,而相比之下,氦气 是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的氦气填 充气球更加安全可靠,故A正确;三氟化硼分子中硼原子具有空轨道,能与氨分子中 具有孤对电子的氮原子形成配位键,所以三氟化硼能与氨分子形成配合物 [H3N→BF3],故B正确;碱金属元素的价电子数相等,都为1,锂离子的离子半径在 碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,故C错误;氮原子 价电子只有4个原子轨道,3个不成对电子,由共价键的饱和性可知,氮原子不能形成 5个氮氟键, 所以不存在稳定的五氟化氮分子,故D正确。
A. Z、M的最简单气态氢化物的键角:M>Z
B. 第一电离能比Z小且与Z同周期的元素有4种
C. X、Y形成的链状化合物YmXn中σ键数为m+n-1
D. Y、Z两种元素与X元素形成的最简单气态氢化物,均非极性分子
C
解析:X、Y、Z、N、M为原子序数依次增大的短周期元素,X、N位于同一主族,杀 虫剂结构中X形成1个共价键,而N形成+1价阳离子,且N与X的原子序数相差不小于 3,故X为H元素、N为Na元素;Y、Z位于同一个周期,二者处于第2周期,杀虫剂结 构中Y形成4个共价键、Z形成3个共价键,故Y为C元素、Z为N元素,结构中M形成2 个共价键,其中1个M原子获得1个电子,则M处于ⅥA族,M的原子序数大于Na,故 M为S元素。N、S的最简单气态氢化物为NH3和H2S,二者中心原子的杂化类型都是 sp3,但NH3中N有1对孤电子对,H2S中S有2对孤电子对,则键角:NH3>H2S,故A错 误;同周期元素从左到右第一电离能总体上呈增大的趋势,但由于N元素2p轨道为半 充满状态,相对稳定,故第一电离能:N>O>C>Be>B>Li,第一电离能比N小且 与N同周期的元素有5种,故B错误;C、H形成的链状化合物CmHn,C—H键为σ键, 共n个C—H σ键,C原子与C原子之间形成的σ键共m-1个,σ键数为m+n-1,故C 正确;C、N两种元素与H元素形成的最简单气态氢化物为CH4和NH3,NH3为极性分 子,故D错误。
A. Ni、Co均属于元素周期表中的d区元素
B. CCl4、NaCl、金刚石三种物质的熔点依次升高
D. 12 g金刚石(晶体结构如图2所示)
中含有C—C键的数目为4NA
D
B. 原子半径:Ga>As
C. GaAs的熔点为1 238 ℃,硬度大,晶体类型为共价晶体
A
A. 该超导材料的最简化学式为K2Ni2S2
B. Ni位于元素周期表中的ds区
C. 晶胞中S的配位数为4
C
二、非选择题(本题包括4个小题,共58分)
15. (14分)聚合物锂离子电池具有超薄化特征,适用于多种设备,电极材料涵盖 LiFePO4、LiNiO2、LiPF6、LiAsF6等物质。
(1)磷酸为磷的最高价含氧酸,其空间结构如图所示:
小于
温度升高,磷酸分子间
氢键被破坏
(2)聚合物锂离子电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移,过程如图所示 (图中阴离子未画出)。
c
正八面体形
第4周
期Ⅷ族
12
M
哑铃形
B
解析:基态Si原子中,核外电子占据三层,其中最高能层的符号为M,占据最 高能级为p层,电子的电子云轮廓图形状为哑铃形;基态Ga原子的核外电子排布为 [Ar]3d104s24p1,其转化为激发态时,吸收能量最少,则基态原子中的电子进入高能级 的电子最少,电子从基态进入高能级电子由多到少的顺序为C>B,A、D违反洪特规 则,所以所需能量最少的为B。
解析:Si原子半径大,原子之间形成的σ键键长较长,p-p轨道“肩并肩”重叠 程度小或几乎不重叠,难以形成π键。
Si原子半径大,原子之间形成的σ键键长
较长,p-p轨道“肩并肩”重叠程度小或几乎不重叠,难以形成π键
正四面体形
sp2和sp3
GaCl3为分子晶体,熔化时破坏分子间作用力,GaF3为离子晶体,熔化时破
坏离子键,离子键强于分子间作用力
解析:GaCl3的熔点为77.9 ℃,GaCl3为分子晶体,熔化时破坏分子间作用力, GaF3的熔点为1 000 ℃,为离子晶体,熔化时破坏离子键,离子键强于分子间作用 力,所以GaCl3的熔点低于GaF3;气态GaCl3常以二聚体形式存在,二聚体中各原子均 满足8e-结构,说明Ga形成一个配位键,二聚体的结构式为 。
MgB2
17. (15分)硅材料在生活中占有重要地位。请回答下列问题:
正四面体形
sp3
Si周围的NH2基团体积较大,受热时斥力较强,Si(NH2)4中Si—N键能
相对较小;产物中气态分子数显著增多
A. 微粒半径:③>①>②
B. 电子排布属于基态原子(或离子)的是①②
C. 电离一个电子所需最低能量:①>②>③
D. 得电子能力:①>②
AB
解析:电子排布式分别为①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,可推知 分别为基态Si原子、Si+、激发态Si原子;激发态Si原子有四层电子,Si+失去了一个 电子,根据微粒电子层数及各层电子数多少可推知,微粒半径:③>①>②,选项A 正确;根据上述分析可知,电子排布属于基态原子(或离子)的是①②,选项B正 确;激发态Si原子不稳定,容易失去电子,基态Si原子失去一个电子是硅的第一电离 能,Si+失去一个电子是硅的第二电离能,由于I2>I1,可以得出电离一个电子所需最 低能量:②>①>③,选项C错误;由C项可知,②比①更难失电子,则②比①更容 易得电子,即得电子能力:②>①,选项D错误。
共价晶体
SiP2
18. (14分)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
解析:常温常压下,HOF为无色气体,则HOF的沸点较低,因此,固态HOF的 晶体类型为分子晶体。HOF分子中F显-1价,其水解时结合H2O电离的H+生成HF, 则OH+结合H2O电离的OH-,两者反应生成H2O2,H2O2不稳定,其分解生成O2,因 此,HOF水解反应的产物为HF、H2O2和O2。
分子晶体
HF 、H2O2和O2
sp2
>
ClO2分子中Cl—O键的键长小于Cl2O中Cl—O键的键长,其原因是ClO2分子
中既存在σ键,又存在大π键,原子轨道重叠的程度较大,因此其中Cl—O键的键长较
小,而Cl2O只存在普通的σ键
第3章 不同聚集状态的物质与性质
模块综合微评
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符 合题意)
A. 1 mol Si晶体中含有2 mol非极性键
B. 基态Si原子的轨道表示式
C. SiHCl3的空间填充模型为
A
A. HF中的共价键为s-pσ键
B. H2O、SiF4均为极性分子
C. SiO2晶体为分子晶体
D. 基态氧原子的价电子轨道表示式为
A
解析:H只有s轨道,F最外层为2p轨道,则HF分子中的共价键是由H原子的1s轨道和F 原子未成对电子的2p轨道形成的s-pσ键,故A正确;水分子为角形结构,正、负电荷 重心不重合,属于极性分子,SiF4为正四面体形结构,正、负电荷重心重合,属于非 极性分子,故B错误;二氧化硅晶体是硅原子与氧原子通过共价键结合,属于共价晶 体,故C错误;基态氧原子的价电子排布式为2s22p4,价电子轨道表示式 为 ,故D错误。
A. 价电子排布为3d104s1的元素位于第4周期ⅠA族,是s区元素
B. SO2分子和O3分子的空间结构均为角形
D. 由于氢键的存在,水分子的稳定性好,高温下也很难分解
B
AgBr Na3[Ag(S2O3)2] Ag2S Ag+SO2
A. Na3[Ag(S2O3)2]晶体中所含的作用力只有离子键、配位键
D. 副产物SO2的键角小于120°的原因:SO2分子中S的孤电子对对成键电子对的排斥 作用使键角变小
A
A. 该分子中碳原子的杂化类型均为sp2
B. 分子中所含元素的电负性O>C>H
C. 基态氧原子核外电子的空间运动状态有8种
D. 该分子为非极性分子
B
解析:由题给结构简式可知,该分子中碳原子除—CH3上采取sp3杂化之外,其余碳原 子的杂化类型均为sp2,A错误;根据同一周期元素从左到右电负性依次增大可知,电 负性:O>C,碳氢化合物中碳显负电性,H显正电性,故分子中所含元素的电负性: O>C>H,B正确;O是8号元素,核外有8个电子,基态氧原子的核外电子排布式为 1s22s22p4,共占据5个不同的轨道,故基态氧原子核外电子的空间运动状态有5种,C 错误;由题给有机物结构简式可知,该分子结构不高度对称,正、负电荷重心不重 合,故为极性分子,D错误。
A. SiCl4分子能与水分子形成氢键
B. N-甲基咪唑分子中有σ键和π键
C. M2+中Si的配位数为6
D. 咪唑环中的碳原子杂化方式为sp2
A
解析:SiCl4分子中的氯原子半径较大,电负性较小,不能形成氢键,A错误;单键为 σ键,双键中有1个σ键和1个π键,故N-甲基咪唑分子中有σ键和π键,B正确;由题图 可知,M2+中Si为+4价,故中心Si原子与Cl之间,与N原子之间均形成配位键,故其 配位数是6,C正确;由N-甲基咪唑的结构简式可知,双键碳原子的价电子对数为 3,杂化方式为sp2,故D正确。
选项 实验事实 理论解释
A 金刚石比晶体硅熔点高 碳原子半径比硅原子半径小
B 白磷为正四面体分子 白磷分子中P—P的键角是 109°28'
C I2在H2O中的溶解能力比I2在CCl4中的溶解 能力小 “相似相溶”原理
D 对羟基苯甲醛( )
比邻羟基苯甲醛( )的沸点高 对羟基苯甲醛形成分子间氢 键,邻羟基苯甲醛形成分子内 氢键
B
解析:碳原子半径比硅原子半径小,C—C键长比Si—Si 键长短,则键能更大,故金 刚石比晶体硅熔点高,故A正确;白磷为正四面体分子,白磷分子中P—P的键角是 60°,故B错误;I2、CCl4均为非极性分子,H2O为极性分子,根据“相似相溶”原理 可知,I2在H2O中的溶解能力比I2在CCl4中的溶解能力小,故C正确;对羟基苯甲醛形 成分子间氢键,形成分子间氢键可提高物质的熔、沸点,邻羟基苯甲醛形成分子内氢 键,形成分子内氢键会降低物质的熔、沸点,则对羟基苯甲醛( ) 比邻羟基苯甲醛( )的沸点高,故D正确。
A. Ru配合物中第2周期元素的电负性由大到小的顺序为O>N>C
B. 如图结构的吡啶环( )中C、N原子的杂化方式分别为sp2、sp3
C. 该配合物中Ru的配位数是6
D. HCOOH的沸点比CH3CHO高,主要原因是HCOOH分子间存 在范德华力和氢键,而CH3CHO分子间只有范德华力
B
解析:第2周期主族元素从左到右元素电负性逐渐增大,因此电负性由大到小的顺序 为O>N>C,A正确;如图结构的吡啶环( )中C、N原子的价电子对数均为3,故 杂化方式均为sp2,B错误;由题图结构可知,该配合物中Ru的配位数是6,C正确; HCOOH存在范德华力和氢键,因此HCOOH的沸点比HCHO高,D正确。
A. 该配合物中的配离子存在多种异构体
B. 对该配合物进行加热时,配体H2O比NH3更容易失去
C. 提供电子对形成配位键的原子在基态时核外电子具有相同数目的空间运动状态
D. 常温下,向含1 mol该配合物的溶液中滴加AgNO3溶液,滴定结束后生成2 mol AgCl沉淀
C
解析:配体在中心离子Cr3+周围形成八面体结构,如图 为八面体,如两个 水分子可以排在1和2、2和3、3和4、1和6的位置,所以该配合物中的配离子有多种异 构体,故A正确;配位原子电负性越大,吸引电子的能力越强,则给出电子对和中心 元素配合的能力越弱,形成的配位键越弱,加热时易失去,电负性:O>N,该配合 物加热时,首先失去配离子中的配体是H2O,故B正确;提供电子对形成配位键的原 子为N、O、Cl,N、O、Cl原子核外电子排布中分别占据轨道数是5、5、9,所以N、 O、Cl原子在基态时核外电子空间运动状态分别是5、5、9种,故C错误;常温下,向含1 mol该配合物的溶液中滴加AgNO3溶液,只有外界的Cl-能发生电离,所以该配合物分子能电离出2个氯离子,则向含1 mol该配合物的溶液中滴加AgNO3溶液,滴定结束后生成2 mol AgCl沉淀,故D正确。
选项 实例 解释
A 用He替代H2填充探空气球更安全 He的电子构型稳定,不易得失电子
B BF3与NH3形成配合物[H3N→BF3] BF3中的B有空轨道接受NH3中N的孤电子对
C 碱金属中Li的熔点最高 碱金属中Li的价电子数最少,金属键最强
D 不存在稳定的NF5分子 N原子价电子只有4个原子轨道,不能形成5个N—F键
C
解析:氢气具有可燃性,使用氢气填充气球存在一定的安全隐患,而相比之下,氦气 是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的氦气填 充气球更加安全可靠,故A正确;三氟化硼分子中硼原子具有空轨道,能与氨分子中 具有孤对电子的氮原子形成配位键,所以三氟化硼能与氨分子形成配合物 [H3N→BF3],故B正确;碱金属元素的价电子数相等,都为1,锂离子的离子半径在 碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,故C错误;氮原子 价电子只有4个原子轨道,3个不成对电子,由共价键的饱和性可知,氮原子不能形成 5个氮氟键, 所以不存在稳定的五氟化氮分子,故D正确。
A. Z、M的最简单气态氢化物的键角:M>Z
B. 第一电离能比Z小且与Z同周期的元素有4种
C. X、Y形成的链状化合物YmXn中σ键数为m+n-1
D. Y、Z两种元素与X元素形成的最简单气态氢化物,均非极性分子
C
解析:X、Y、Z、N、M为原子序数依次增大的短周期元素,X、N位于同一主族,杀 虫剂结构中X形成1个共价键,而N形成+1价阳离子,且N与X的原子序数相差不小于 3,故X为H元素、N为Na元素;Y、Z位于同一个周期,二者处于第2周期,杀虫剂结 构中Y形成4个共价键、Z形成3个共价键,故Y为C元素、Z为N元素,结构中M形成2 个共价键,其中1个M原子获得1个电子,则M处于ⅥA族,M的原子序数大于Na,故 M为S元素。N、S的最简单气态氢化物为NH3和H2S,二者中心原子的杂化类型都是 sp3,但NH3中N有1对孤电子对,H2S中S有2对孤电子对,则键角:NH3>H2S,故A错 误;同周期元素从左到右第一电离能总体上呈增大的趋势,但由于N元素2p轨道为半 充满状态,相对稳定,故第一电离能:N>O>C>Be>B>Li,第一电离能比N小且 与N同周期的元素有5种,故B错误;C、H形成的链状化合物CmHn,C—H键为σ键, 共n个C—H σ键,C原子与C原子之间形成的σ键共m-1个,σ键数为m+n-1,故C 正确;C、N两种元素与H元素形成的最简单气态氢化物为CH4和NH3,NH3为极性分 子,故D错误。
A. Ni、Co均属于元素周期表中的d区元素
B. CCl4、NaCl、金刚石三种物质的熔点依次升高
D. 12 g金刚石(晶体结构如图2所示)
中含有C—C键的数目为4NA
D
B. 原子半径:Ga>As
C. GaAs的熔点为1 238 ℃,硬度大,晶体类型为共价晶体
A
A. 该超导材料的最简化学式为K2Ni2S2
B. Ni位于元素周期表中的ds区
C. 晶胞中S的配位数为4
C
二、非选择题(本题包括4个小题,共58分)
15. (14分)聚合物锂离子电池具有超薄化特征,适用于多种设备,电极材料涵盖 LiFePO4、LiNiO2、LiPF6、LiAsF6等物质。
(1)磷酸为磷的最高价含氧酸,其空间结构如图所示:
小于
温度升高,磷酸分子间
氢键被破坏
(2)聚合物锂离子电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移,过程如图所示 (图中阴离子未画出)。
c
正八面体形
第4周
期Ⅷ族
12
M
哑铃形
B
解析:基态Si原子中,核外电子占据三层,其中最高能层的符号为M,占据最 高能级为p层,电子的电子云轮廓图形状为哑铃形;基态Ga原子的核外电子排布为 [Ar]3d104s24p1,其转化为激发态时,吸收能量最少,则基态原子中的电子进入高能级 的电子最少,电子从基态进入高能级电子由多到少的顺序为C>B,A、D违反洪特规 则,所以所需能量最少的为B。
解析:Si原子半径大,原子之间形成的σ键键长较长,p-p轨道“肩并肩”重叠 程度小或几乎不重叠,难以形成π键。
Si原子半径大,原子之间形成的σ键键长
较长,p-p轨道“肩并肩”重叠程度小或几乎不重叠,难以形成π键
正四面体形
sp2和sp3
GaCl3为分子晶体,熔化时破坏分子间作用力,GaF3为离子晶体,熔化时破
坏离子键,离子键强于分子间作用力
解析:GaCl3的熔点为77.9 ℃,GaCl3为分子晶体,熔化时破坏分子间作用力, GaF3的熔点为1 000 ℃,为离子晶体,熔化时破坏离子键,离子键强于分子间作用 力,所以GaCl3的熔点低于GaF3;气态GaCl3常以二聚体形式存在,二聚体中各原子均 满足8e-结构,说明Ga形成一个配位键,二聚体的结构式为 。
MgB2
17. (15分)硅材料在生活中占有重要地位。请回答下列问题:
正四面体形
sp3
Si周围的NH2基团体积较大,受热时斥力较强,Si(NH2)4中Si—N键能
相对较小;产物中气态分子数显著增多
A. 微粒半径:③>①>②
B. 电子排布属于基态原子(或离子)的是①②
C. 电离一个电子所需最低能量:①>②>③
D. 得电子能力:①>②
AB
解析:电子排布式分别为①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,可推知 分别为基态Si原子、Si+、激发态Si原子;激发态Si原子有四层电子,Si+失去了一个 电子,根据微粒电子层数及各层电子数多少可推知,微粒半径:③>①>②,选项A 正确;根据上述分析可知,电子排布属于基态原子(或离子)的是①②,选项B正 确;激发态Si原子不稳定,容易失去电子,基态Si原子失去一个电子是硅的第一电离 能,Si+失去一个电子是硅的第二电离能,由于I2>I1,可以得出电离一个电子所需最 低能量:②>①>③,选项C错误;由C项可知,②比①更难失电子,则②比①更容 易得电子,即得电子能力:②>①,选项D错误。
共价晶体
SiP2
18. (14分)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
解析:常温常压下,HOF为无色气体,则HOF的沸点较低,因此,固态HOF的 晶体类型为分子晶体。HOF分子中F显-1价,其水解时结合H2O电离的H+生成HF, 则OH+结合H2O电离的OH-,两者反应生成H2O2,H2O2不稳定,其分解生成O2,因 此,HOF水解反应的产物为HF、H2O2和O2。
分子晶体
HF 、H2O2和O2
sp2
>
ClO2分子中Cl—O键的键长小于Cl2O中Cl—O键的键长,其原因是ClO2分子
中既存在σ键,又存在大π键,原子轨道重叠的程度较大,因此其中Cl—O键的键长较
小,而Cl2O只存在普通的σ键
