鲁科版高中化学选择性必修2第1章原子结构与元素性质微专题二元素性质的比较及元素的推断课件(共25张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质微专题二元素性质的比较及元素的推断课件(共25张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:14:42 | ||
图片预览





文档简介
(共25张PPT)
微专题二 元素性质的比较及元素的推断
专题 精讲
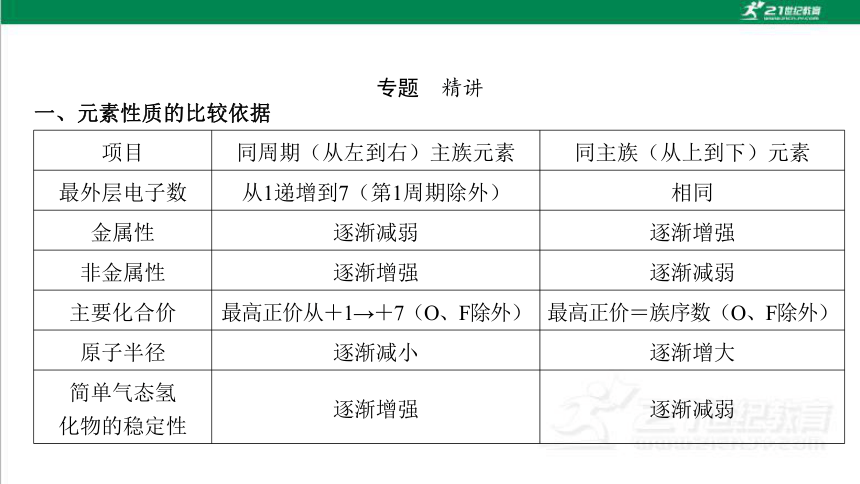
一、元素性质的比较依据
项目 同周期(从左到右)主族元素 同主族(从上到下)元素
最外层电子数 从1递增到7(第1周期除外) 相同
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
主要化合价 最高正价从+1→+7(O、F除外) 最高正价=族序数(O、F除外)
原子半径 逐渐减小 逐渐增大
简单气态氢
化物的稳定性 逐渐增强 逐渐减弱
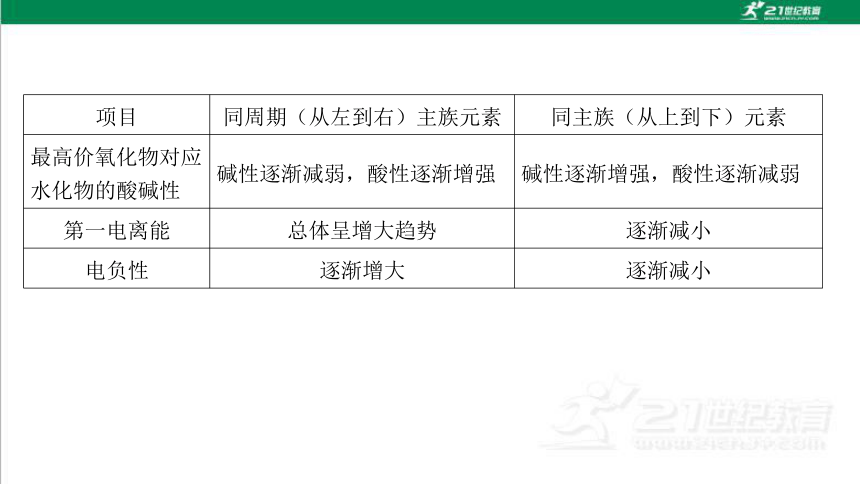
项目 同周期(从左到右)主族元素 同主族(从上到下)元素
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
第一电离能 总体呈增大趋势 逐渐减小
电负性 逐渐增大 逐渐减小
二、元素性质的比较方法
1. “三看”法比较简单微粒半径的大小
(1)“一看”电子层数:当最外层电子数相同时,一般电子层数越多,半径越大。
(2)“二看”核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
(3)“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越大,半 径越大。
2. 元素金属性、非金属性比较
(1)元素金属性和非金属性强弱的判断方法
金属性
比较 本质 原子越易失电子,金属性越强(与原子失电子数目无关)
判断
依据 ①在金属活动性顺序中位置越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或简单阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
非金属
性比较 本质 原子越易得电子,非金属性越强(与原子得电子数目无关)
判断依据 ①与H2化合越容易或气态氢化物越稳定,非金属性越强
非金属性比较 判断依据 ②单质氧化性越强或简单阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
(2)规避元素金属性和非金属性判断中的易错点
①对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟 无正价。
②判断元素非金属性或金属性的强弱,依据的是元素原子在化学反应中得失电子的难 易,而不是得失电子的多少。
③根据元素氧化物对应的水化物的酸碱性的强弱判断元素非金属性或金属性的强弱 时,必须是其最高价氧化物对应的水化物。
④必须用简单氢化物的稳定性讨论非金属性强弱,如C是CH4而不是其他烃,O是H2O 而不是H2O2。同时,注意不是利用氢化物的酸性、熔、沸点高低讨论非金属性。
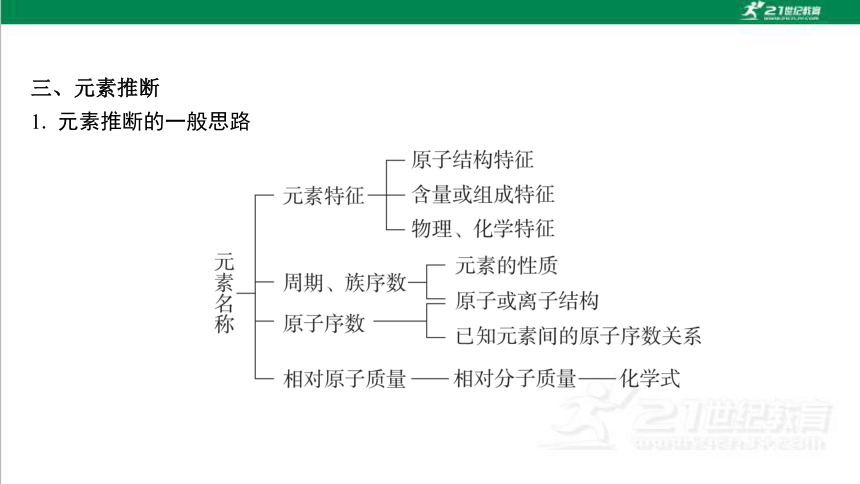
三、元素推断
1. 元素推断的一般思路
2. 元素推断的常用方法
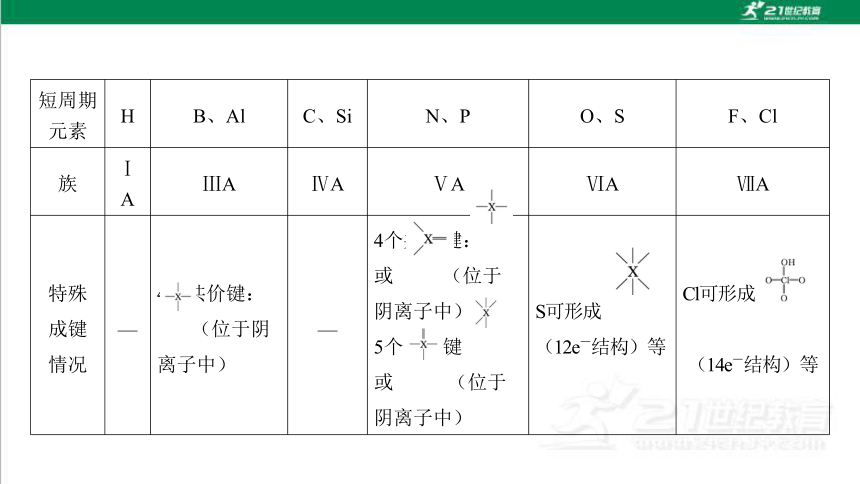
(1)短周期元素的成键特点
短周期
元素 H B、Al C、Si N、P O、S F、Cl
族 ⅠA ⅢA ⅣA ⅤA ⅥA ⅦA
常见成
键情况
(X对应上面的元素) 1个 共价
键: —X 3个共 价键:
4个共价 键: 或
3个共价键: 或 或 1个共价键:
—X
短周期元素 H B、Al C、Si N、P O、S F、Cl
族 ⅠA ⅢA ⅣA ⅤA ⅥA ⅦA
特殊
成键
情况 — 4个共价键:
(位于阴离子中) — 4个共价键: 或 (位于 阴离子中);
5个共价键 或 (位于 阴离子中) S可形成 (12e-结构)等 Cl可形成
(14e-结构)等
(2)依据短周期元素及其化合物的特征
信息 推断出的元素
(物质)
核素无中子 H
元素形成的化合物种类最多;某核素可用于考古断代;元素形成的常见不同单质的硬度差异很大 C
元素的气态氢化物可用作制冷剂,其水溶液呈碱性;元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应;元素的氧化物(气体)呈红棕色 N
信息 推断出的元素
(物质)
元素的单质(1个单质分子由3个原子构成)可用于自来水消毒;元素的单质液态时呈淡篮色;元素的氢化物常温下呈液态 O
元素的非金属性最强,元素的气态氢化物最稳定:元素的气态氢化物的水溶液可蚀刻玻璃,元素的单质可在常温下与水剧烈反应置换出氧气 F
元素在地壳中含量很高,但无游离态;某元素是传统无机非金属材料的主角,元素单质经常作为半导体材料:元素的氧化物可用作光导纤维 Si
元素的游离态常存在于火山喷发口附近;元素的气态氢化物与其气态氧化物反应生成该元素单质(淡黄色);含该元素的两种含氧酸式盐之间能发生反应 S
信息 推断出的元素(物质)
元素的单质为黄绿色有毒气体;元素的单质或氧化物可用于自来水消毒;可用浓氨水检验元素的单质是否泄漏;元素的气态氢化物和最高价氧化物对应的水化物均为一元强酸 Cl
短周期元素中原子半径最大;元素的焰色为黄色;元素的某合金可作为原子反应堆的导热剂;元素的过氧化物可作为供氧剂;元素原子的最外层电子数与最内层电子数相同 Be、Mg
地壳中含量最高的金属元素;工业上用电解氧化物的方法获取该金属;元素的单质可用于野外焊接铁轨;金属元素的单质、氧化物和氢氧化物既能溶于酸溶液也能溶于碱溶液 Al
导致酸雨形成的氧化物 氮氧化物、硫氧化物
温室气体 CO2、CH4等
有刺激性气味的气体 NH3、Cl2、SO2等
3. 由基态原子的价电子排布确定元素在元素周期表中的位置
(1)周期数=电子层数。
(2)主族元素的族序数=价电子数。
(3)ⅢB族~ⅦB族的价电子排布为(n-1)d1~5ns1~2(镧系、锕系除外)、
族序数=价电子数。如锰的价电子排布为3d54s2,它位于元素周期表中第4周期ⅦB族。
(4)ⅠB族和ⅡB族的价电子排布为(n-1)d10ns1~2,族序数=ns能级上的电子数。
专题 训练
元素 元素性质或原子结构
X 原子核外s能级上的电子总数与p能级上的电子总数相等,且第一电离能低 于同周期相邻元素
Y 原子核外s能级上的电子总数与p能级上的电子总数相等,且第一电离能高 于同周期相邻元素
Z 其价电子中,在不同形状的原子轨道中运动的电子数相等
N 只有一个不成对电子
B
A. 原子半径:Z>Y>X B. 元素的电负性:X>N>Z
C. 元素的第一电离能:Z>N>Y D. X的基态原子的电子轨道表示式:
解析:X、Y、Z、N是原子序数依次增大的4种短周期元素,X元素原子核外s能级上 的电子总数与p能级上的电子总数相等,且第一电离能都低于同周期相邻元素,为O 元素;Y原子核外s能级上的电子总数与p能级上的电子总数相等,且第一电离能都高 于同周期相邻元素,为Mg元素;Z元素价电子中,在不同形状的原子轨道中运动的电 子数相等,为Si元素;N元素只有一个不成对电子且则这几种元素中原子序数最大, 为Cl元素。X为O,Y为Mg,Z为Si,原子半径大小为Mg>Si>O,故A错误;X为O, Z为Si,N为Cl,电负性大小为O>Cl>Si,故B正确;Y为Mg,Z为Si,N为Cl,元素 的第一电离能:Cl>Si>Mg,故C错误;X为O,O的基态原子的电子轨道表示 式 ,故D错误。
A. 第一电离能:Y>Z>X
B. 电负性:Z>Y>X>W
C. Z、W原子形成稀有气体电子构型的简单离子的半径:W<Z
D. W2X2与水反应生成产物之一是非极性分子
A
解析:X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周 期,且只有X、 Y元素相邻。X基态原子核外有2个未成对电子,则X为C,Y为N,Z 为F;W原子在同周期中原子半径最大,则W为Na。根据同周期从左到右第一电离能 呈增大趋势,但ⅡA族大于ⅢA族,ⅤA族大于ⅥA族,则第一电离能:Z>Y>X,故A 错误;根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则电 负性:Z>Y>X>W,故B正确;根据同电子层结构核多径小,则Z、W原子形成稀 有气体电子构型的简单离子的半径:W<Z,故C正确;W2X2与水反应生成产物之一 为乙炔,乙炔是非极性分子,故D正确。
A. 电负性:X>Y>Z>W
B. 原子半径:X<Y<Z<W
C. Y和W的单质都能与水反应生成气体
D. Z元素最高价氧化物对应的水化物具有强氧化性
C
解析:根据题中所给的信息,基态X原子s轨道上的电子式与p轨道上的电子式相同, 可以推测X为O元素或Mg元素,由荧光粉的结构可知,X主要形成的是酸根,因此X 为O元素;基态X原子中未成键电子数为2,因此Y的未成键电子数为1,又因X、Y、 Z、W的原子序数依次增大,故Y可能为F元素、Na元素、Al元素、Cl元素,因题目中 给出W为金属元素且荧光粉的结构中Y与W化合,故Y为F元素或Cl元素;Z原子的未 成键电子数为3,又因其原子序数大于Y,故Y应为F元素、Z应为P元素;从荧光粉的 结构式可以看出W为某+2价元素,故其为Ca元素;综上所述,X、Y、Z、W四种元 素分别为O、F、P、Ca。电负性用来描述不同元素的原子对键合电子吸引力的大小, 根据其规律,同一周期从左到右依次增大,同一主族从上到下依次减小,故四种元素 的电负性大小为Y>X>Z>W,A错误;同一周期原子半径从左到右依次减小,同一 主族原子半径从上到下依次增大,故四种元素的原子半径大小为Y<X<Z<W,B错 误;F2与水反应生成HF和O2,Ca与水反应生成氢氧化钙和氢气,二者均可以生成气 体,C正确;Z元素的最高价氧化物对应的水化物为H3PO4,无强氧化性,D错误。
A. 电负性:Q>Z>X
B. 简单氢化物沸点:X>Q>Z
C. 第一电离能:X>Q>Mn
D. 最高价氧化物对应的水化物酸性:Z>X
C
A. 电负性:Y<X<R
B. 简单离子半径:Y<X<Z
C. 最高价氧化物对应水化物的酸性:R<Z
D. X分别与W、R、Y、Z元素均可以形成两种或两种以上的化合物
A
解析:由药物中间体的结构可知,Y最外层1个电子,W形成一个共价键,R形成4个 共价键,W、R、X、Y、Z为短周期元素且原子序数依次增大,则W与Y均为ⅠA族元 素,X、Z均为ⅥA族元素,所以W为H元素,R为C元素,X为O元素,Y为Na元素,Z 为S元素。电负性:Na<C<O,A错误;电子层越多,离子半径越大,具有相同电子 排布的离子,原子序数大的离子半径小,O2-、Na+核外有2个电子层,S2-核外有3个 电子层,但Na的原子序数大于O,则简单离子半径:Na+< O2-<S2-,B正确;非金 属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:S>C,所以酸性: H2CO3<H2SO4,C正确;X和W、R、Y、Z均形成至少两种二元化合物,如H2O、 H2O2、CO、CO2、Na2O、Na2O2 、SO2、 SO3,D正确。
A. 甲、乙、戊三种元素中,乙的电负性最大
B. 丙的单质一定是金属
C. 丙原子的最高能级中的电子均为未成对电子
D. 丁的最高价氧化物对应水化物一定能与NaOH反应
C
解析:根据元素周期表结构可知,甲~戊为2、3周期的元素,乙的单质为双原子分 子,且是地球空气的组成成分,则乙单质为氧气或氮气,若乙为O,则甲为N,戊为 S,丁为Si,丙为Al;若乙为N,则甲为C,戊为P,丁为Al,丙为Mg。同周期元素, 原子序数增大,电负性增大,同主族元素,原子序数越大,电负性越小,则乙的电负 性最大,A正确;丙为Al或Mg,其单质一定是金属,B正确;若丙为Mg,则其电子 排布式为1s22s22p63s2,若丙为Al,电子排布式为1s22s22p63s23p1,C错误;丁的最高价 氧化物对应水化物为Al(OH)3或H2SiO3,均能与NaOH反应,D正确。
微专题二 元素性质的比较及元素的推断
专题 精讲
一、元素性质的比较依据
项目 同周期(从左到右)主族元素 同主族(从上到下)元素
最外层电子数 从1递增到7(第1周期除外) 相同
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
主要化合价 最高正价从+1→+7(O、F除外) 最高正价=族序数(O、F除外)
原子半径 逐渐减小 逐渐增大
简单气态氢
化物的稳定性 逐渐增强 逐渐减弱
项目 同周期(从左到右)主族元素 同主族(从上到下)元素
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
第一电离能 总体呈增大趋势 逐渐减小
电负性 逐渐增大 逐渐减小
二、元素性质的比较方法
1. “三看”法比较简单微粒半径的大小
(1)“一看”电子层数:当最外层电子数相同时,一般电子层数越多,半径越大。
(2)“二看”核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
(3)“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越大,半 径越大。
2. 元素金属性、非金属性比较
(1)元素金属性和非金属性强弱的判断方法
金属性
比较 本质 原子越易失电子,金属性越强(与原子失电子数目无关)
判断
依据 ①在金属活动性顺序中位置越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或简单阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
非金属
性比较 本质 原子越易得电子,非金属性越强(与原子得电子数目无关)
判断依据 ①与H2化合越容易或气态氢化物越稳定,非金属性越强
非金属性比较 判断依据 ②单质氧化性越强或简单阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
(2)规避元素金属性和非金属性判断中的易错点
①对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟 无正价。
②判断元素非金属性或金属性的强弱,依据的是元素原子在化学反应中得失电子的难 易,而不是得失电子的多少。
③根据元素氧化物对应的水化物的酸碱性的强弱判断元素非金属性或金属性的强弱 时,必须是其最高价氧化物对应的水化物。
④必须用简单氢化物的稳定性讨论非金属性强弱,如C是CH4而不是其他烃,O是H2O 而不是H2O2。同时,注意不是利用氢化物的酸性、熔、沸点高低讨论非金属性。
三、元素推断
1. 元素推断的一般思路
2. 元素推断的常用方法
(1)短周期元素的成键特点
短周期
元素 H B、Al C、Si N、P O、S F、Cl
族 ⅠA ⅢA ⅣA ⅤA ⅥA ⅦA
常见成
键情况
(X对应上面的元素) 1个 共价
键: —X 3个共 价键:
4个共价 键: 或
3个共价键: 或 或 1个共价键:
—X
短周期元素 H B、Al C、Si N、P O、S F、Cl
族 ⅠA ⅢA ⅣA ⅤA ⅥA ⅦA
特殊
成键
情况 — 4个共价键:
(位于阴离子中) — 4个共价键: 或 (位于 阴离子中);
5个共价键 或 (位于 阴离子中) S可形成 (12e-结构)等 Cl可形成
(14e-结构)等
(2)依据短周期元素及其化合物的特征
信息 推断出的元素
(物质)
核素无中子 H
元素形成的化合物种类最多;某核素可用于考古断代;元素形成的常见不同单质的硬度差异很大 C
元素的气态氢化物可用作制冷剂,其水溶液呈碱性;元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应;元素的氧化物(气体)呈红棕色 N
信息 推断出的元素
(物质)
元素的单质(1个单质分子由3个原子构成)可用于自来水消毒;元素的单质液态时呈淡篮色;元素的氢化物常温下呈液态 O
元素的非金属性最强,元素的气态氢化物最稳定:元素的气态氢化物的水溶液可蚀刻玻璃,元素的单质可在常温下与水剧烈反应置换出氧气 F
元素在地壳中含量很高,但无游离态;某元素是传统无机非金属材料的主角,元素单质经常作为半导体材料:元素的氧化物可用作光导纤维 Si
元素的游离态常存在于火山喷发口附近;元素的气态氢化物与其气态氧化物反应生成该元素单质(淡黄色);含该元素的两种含氧酸式盐之间能发生反应 S
信息 推断出的元素(物质)
元素的单质为黄绿色有毒气体;元素的单质或氧化物可用于自来水消毒;可用浓氨水检验元素的单质是否泄漏;元素的气态氢化物和最高价氧化物对应的水化物均为一元强酸 Cl
短周期元素中原子半径最大;元素的焰色为黄色;元素的某合金可作为原子反应堆的导热剂;元素的过氧化物可作为供氧剂;元素原子的最外层电子数与最内层电子数相同 Be、Mg
地壳中含量最高的金属元素;工业上用电解氧化物的方法获取该金属;元素的单质可用于野外焊接铁轨;金属元素的单质、氧化物和氢氧化物既能溶于酸溶液也能溶于碱溶液 Al
导致酸雨形成的氧化物 氮氧化物、硫氧化物
温室气体 CO2、CH4等
有刺激性气味的气体 NH3、Cl2、SO2等
3. 由基态原子的价电子排布确定元素在元素周期表中的位置
(1)周期数=电子层数。
(2)主族元素的族序数=价电子数。
(3)ⅢB族~ⅦB族的价电子排布为(n-1)d1~5ns1~2(镧系、锕系除外)、
族序数=价电子数。如锰的价电子排布为3d54s2,它位于元素周期表中第4周期ⅦB族。
(4)ⅠB族和ⅡB族的价电子排布为(n-1)d10ns1~2,族序数=ns能级上的电子数。
专题 训练
元素 元素性质或原子结构
X 原子核外s能级上的电子总数与p能级上的电子总数相等,且第一电离能低 于同周期相邻元素
Y 原子核外s能级上的电子总数与p能级上的电子总数相等,且第一电离能高 于同周期相邻元素
Z 其价电子中,在不同形状的原子轨道中运动的电子数相等
N 只有一个不成对电子
B
A. 原子半径:Z>Y>X B. 元素的电负性:X>N>Z
C. 元素的第一电离能:Z>N>Y D. X的基态原子的电子轨道表示式:
解析:X、Y、Z、N是原子序数依次增大的4种短周期元素,X元素原子核外s能级上 的电子总数与p能级上的电子总数相等,且第一电离能都低于同周期相邻元素,为O 元素;Y原子核外s能级上的电子总数与p能级上的电子总数相等,且第一电离能都高 于同周期相邻元素,为Mg元素;Z元素价电子中,在不同形状的原子轨道中运动的电 子数相等,为Si元素;N元素只有一个不成对电子且则这几种元素中原子序数最大, 为Cl元素。X为O,Y为Mg,Z为Si,原子半径大小为Mg>Si>O,故A错误;X为O, Z为Si,N为Cl,电负性大小为O>Cl>Si,故B正确;Y为Mg,Z为Si,N为Cl,元素 的第一电离能:Cl>Si>Mg,故C错误;X为O,O的基态原子的电子轨道表示 式 ,故D错误。
A. 第一电离能:Y>Z>X
B. 电负性:Z>Y>X>W
C. Z、W原子形成稀有气体电子构型的简单离子的半径:W<Z
D. W2X2与水反应生成产物之一是非极性分子
A
解析:X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周 期,且只有X、 Y元素相邻。X基态原子核外有2个未成对电子,则X为C,Y为N,Z 为F;W原子在同周期中原子半径最大,则W为Na。根据同周期从左到右第一电离能 呈增大趋势,但ⅡA族大于ⅢA族,ⅤA族大于ⅥA族,则第一电离能:Z>Y>X,故A 错误;根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则电 负性:Z>Y>X>W,故B正确;根据同电子层结构核多径小,则Z、W原子形成稀 有气体电子构型的简单离子的半径:W<Z,故C正确;W2X2与水反应生成产物之一 为乙炔,乙炔是非极性分子,故D正确。
A. 电负性:X>Y>Z>W
B. 原子半径:X<Y<Z<W
C. Y和W的单质都能与水反应生成气体
D. Z元素最高价氧化物对应的水化物具有强氧化性
C
解析:根据题中所给的信息,基态X原子s轨道上的电子式与p轨道上的电子式相同, 可以推测X为O元素或Mg元素,由荧光粉的结构可知,X主要形成的是酸根,因此X 为O元素;基态X原子中未成键电子数为2,因此Y的未成键电子数为1,又因X、Y、 Z、W的原子序数依次增大,故Y可能为F元素、Na元素、Al元素、Cl元素,因题目中 给出W为金属元素且荧光粉的结构中Y与W化合,故Y为F元素或Cl元素;Z原子的未 成键电子数为3,又因其原子序数大于Y,故Y应为F元素、Z应为P元素;从荧光粉的 结构式可以看出W为某+2价元素,故其为Ca元素;综上所述,X、Y、Z、W四种元 素分别为O、F、P、Ca。电负性用来描述不同元素的原子对键合电子吸引力的大小, 根据其规律,同一周期从左到右依次增大,同一主族从上到下依次减小,故四种元素 的电负性大小为Y>X>Z>W,A错误;同一周期原子半径从左到右依次减小,同一 主族原子半径从上到下依次增大,故四种元素的原子半径大小为Y<X<Z<W,B错 误;F2与水反应生成HF和O2,Ca与水反应生成氢氧化钙和氢气,二者均可以生成气 体,C正确;Z元素的最高价氧化物对应的水化物为H3PO4,无强氧化性,D错误。
A. 电负性:Q>Z>X
B. 简单氢化物沸点:X>Q>Z
C. 第一电离能:X>Q>Mn
D. 最高价氧化物对应的水化物酸性:Z>X
C
A. 电负性:Y<X<R
B. 简单离子半径:Y<X<Z
C. 最高价氧化物对应水化物的酸性:R<Z
D. X分别与W、R、Y、Z元素均可以形成两种或两种以上的化合物
A
解析:由药物中间体的结构可知,Y最外层1个电子,W形成一个共价键,R形成4个 共价键,W、R、X、Y、Z为短周期元素且原子序数依次增大,则W与Y均为ⅠA族元 素,X、Z均为ⅥA族元素,所以W为H元素,R为C元素,X为O元素,Y为Na元素,Z 为S元素。电负性:Na<C<O,A错误;电子层越多,离子半径越大,具有相同电子 排布的离子,原子序数大的离子半径小,O2-、Na+核外有2个电子层,S2-核外有3个 电子层,但Na的原子序数大于O,则简单离子半径:Na+< O2-<S2-,B正确;非金 属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:S>C,所以酸性: H2CO3<H2SO4,C正确;X和W、R、Y、Z均形成至少两种二元化合物,如H2O、 H2O2、CO、CO2、Na2O、Na2O2 、SO2、 SO3,D正确。
A. 甲、乙、戊三种元素中,乙的电负性最大
B. 丙的单质一定是金属
C. 丙原子的最高能级中的电子均为未成对电子
D. 丁的最高价氧化物对应水化物一定能与NaOH反应
C
解析:根据元素周期表结构可知,甲~戊为2、3周期的元素,乙的单质为双原子分 子,且是地球空气的组成成分,则乙单质为氧气或氮气,若乙为O,则甲为N,戊为 S,丁为Si,丙为Al;若乙为N,则甲为C,戊为P,丁为Al,丙为Mg。同周期元素, 原子序数增大,电负性增大,同主族元素,原子序数越大,电负性越小,则乙的电负 性最大,A正确;丙为Al或Mg,其单质一定是金属,B正确;若丙为Mg,则其电子 排布式为1s22s22p63s2,若丙为Al,电子排布式为1s22s22p63s23p1,C错误;丁的最高价 氧化物对应水化物为Al(OH)3或H2SiO3,均能与NaOH反应,D正确。
