鲁科版高中化学选择性必修2第1章原子结构与元素性质微专题一核外电子排布的表示方法、书写及应用课件(共17张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质微专题一核外电子排布的表示方法、书写及应用课件(共17张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:15:04 | ||
图片预览






文档简介
(共17张PPT)
微专题一 核外电子排布的表示方法、书写及应用
专题 精讲
1. 核外电子排布的表示方法和书写
原子(离子) 结构示意图 含义 将每个电子层上的电子总数表示在原子核外的式子
意义 能直观反映出核内质子数、核外的电子层数和各电子层 上的电子数
实例
电子排布式 含义 用数字在能级符号右上角标明该能级上排布的电子数, 这就是电子排布式
意义 能直观反映出核外的电子层、能级及各能级上的电子数
实例 K:1s22s22p63s23p64s1
简化电子排布 式 含义 为了避免电子排布式书写过于繁琐,把内层电子达到稀 有气体原子结构的部分以相应稀有气体元素符号外加方 括号表示
意义 避免书写电子排布式过于繁琐
实例 K:[Ar]4s1
价电子排布式 含义 价电子排布式即可能参与化学反应的电子排布式
意义 能直观反映出基态原子的电子层数,参与成键的电子数 及最外层电子数
实例 Al:3s23p1、Fe:3d64s2
轨道表示式 含义 每个方框或小圆圈代表一个原子轨道,每个箭头代表一 个电子
意义 能直观反映出电子的排布情况及电子的自旋状态
实例 Al:
电子式 含义 在元素符号周围用“·”或“×”来表示元素原子的最 外层电子的式子叫作电子式
意义 能直观反映出原子的最外层电子数
实例 ·
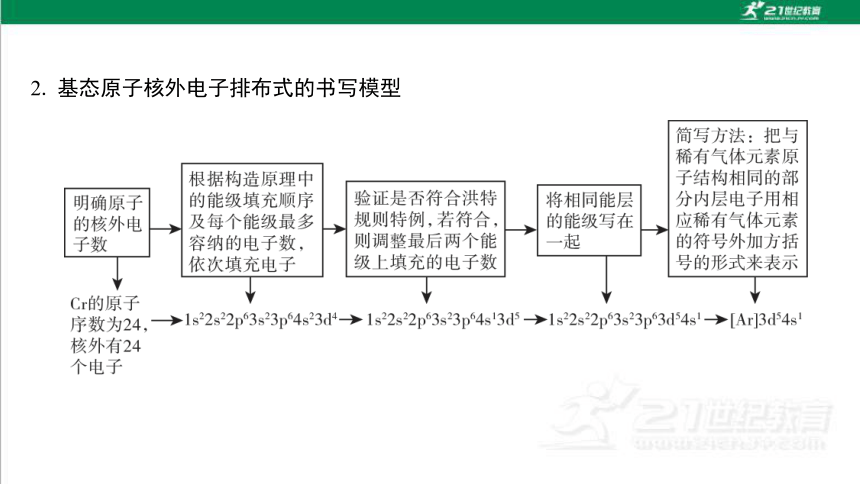
2. 基态原子核外电子排布式的书写模型
(1)价电子排布式的书写:对于主族元素和0族元素,写出最外层电子排布式即可; 对于过渡金属元素,其价电子排布式一般符合(n-1)d1~10ns1~2(n≥4)。如Cr 的价电子排布式为3d54s1。
(2)离子核外电子排布式的书写方法:先写出基态原子的核外电子排布式,再由外 向内失去电子或补充电子(基态原子失去电子时总是优先失去最外层电子),即得到 相应阳离子或阴离子的核外电子排布式。如Cr3+的核外电子排布式为 1s22s22p63s23p63d3或[Ar]3d3。
(3)防范两类常见的有关核外电子排布的错误
①3d、4s书写顺序混乱:当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填 充,但在书写电子排布式时,应把(n-1)d放在ns前。
如Fe:1s22s22p63s23p64s23d6( ),1s22s22p63s23p63d64s2(√)。
在失去电子时,优先失去4s轨道上的电子,
如Fe2+:1s22s22p63s23p63d6。②不符合洪特规则例,
如Cu:1s22s22p63s23p63d94s2( ),1s22s22p63s23p63d104s1(√)。
3. 电子式书写方法及常见错误
(1)陌生物质电子式的书写方法
①确定该物质是属于共价化合物还是离子化合物。
②确定该物质中各原子的成键方式。
③根据各原子最外层电子(价电子)数和成键后各原子达到最外层8(或2)电子稳定 结构的要求,分析各原子共用电子对的情况。
④根据化合物类型、成键方式和原子稳定结构分析书写电子式。
(2)电子式书写常见的6大误区
内容 实例
误区1 漏写未参与成键的电子
误区2 化合物类型不清楚,漏写或多 写“[ ]”及错写电荷数
误区3 书写不规范,错写共用电子对
内容 实例
误区4 不考虑原子间的成键顺序
误区5 不考虑原子最外层有几个电 子,均写成8电子结构
误区6 不考虑AB2型离子化合物中2个B是分开写还是一起写
专题 训练
B. 基态铜原子的价电子轨道表示式:
C. Se的简化电子排布式:[Ar]3d104s24p4
D. F-的结构示意图:
C
A. ns电子的能量可能低于(n-1)p电子的能量
C. 21Sc的电子排布式:1s22s22p63s23p63d3,违反了能量最低原理
D. 22Ti的电子排布式:1s22s22p63s23p10,违反了泡利不相容原理
解析:ns电子的能量一定高于(n-1)p电子的能量,A错误;根据洪特规则知,
2p能级上的2个电子应排在2个不同的轨道上,B正确;根据能量最低原理知,
电子先排能量低的轨道,后排能量高的轨道,故应先排4s轨道,即电子排布式应为 1s22s22p63s23p63d14s2,C正确;根据泡利不相容原理知,3p能级最多容纳6个电子,
D正确。
A
3. (1)基态镍原子的价电子排布式为 ,排布时能量最高的电子所占能级 的原子轨道有 个伸展方向。
(2)Cu2+基态核外电子排布式为 。
解析:Cu位于第4周期ⅠB族,其价电子排布式为3d104s1,因此Cu2+基态核外电 子排布式为1s22s22p63s23p63d9或[Ar]3d9。
3d84s2
5
1s22s22p63s23p63d9(或[Ar]3d9)
4. A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族, A的原子结构示意图为 ,B是同周期元素(稀有气体元素除外)中原子半径 最大的元素,C的最外层有3个未成对电子,E的价电子排布式为3d64s2。回答下列问题:
(1)A为 (填元素符号,下同),基态原子电子排布式 是 。
(2)B为 ,简化电子排布式是 。
(3)C为 ,价电子排布式是 。
Si
1s22s22p63s23p2
Na
[Ne]3s1
P
3s23p3
(4)D为 ,轨道表示式为 。
(5)E为 ,原子结构示意图是 。
N
Fe
(3)基态铁原子价电子的轨道表示式为 。
(3)基态铁原子的核外电子排布式为1s22s22p63s23p63d64s2,因此价电子轨道表示式 为 。
(4)锌原子核外电子排布式为 。
(5)CN-的电子式是 。
1s22s22p63s23p63d104s2(或[Ar]3d104s2)
微专题一 核外电子排布的表示方法、书写及应用
专题 精讲
1. 核外电子排布的表示方法和书写
原子(离子) 结构示意图 含义 将每个电子层上的电子总数表示在原子核外的式子
意义 能直观反映出核内质子数、核外的电子层数和各电子层 上的电子数
实例
电子排布式 含义 用数字在能级符号右上角标明该能级上排布的电子数, 这就是电子排布式
意义 能直观反映出核外的电子层、能级及各能级上的电子数
实例 K:1s22s22p63s23p64s1
简化电子排布 式 含义 为了避免电子排布式书写过于繁琐,把内层电子达到稀 有气体原子结构的部分以相应稀有气体元素符号外加方 括号表示
意义 避免书写电子排布式过于繁琐
实例 K:[Ar]4s1
价电子排布式 含义 价电子排布式即可能参与化学反应的电子排布式
意义 能直观反映出基态原子的电子层数,参与成键的电子数 及最外层电子数
实例 Al:3s23p1、Fe:3d64s2
轨道表示式 含义 每个方框或小圆圈代表一个原子轨道,每个箭头代表一 个电子
意义 能直观反映出电子的排布情况及电子的自旋状态
实例 Al:
电子式 含义 在元素符号周围用“·”或“×”来表示元素原子的最 外层电子的式子叫作电子式
意义 能直观反映出原子的最外层电子数
实例 ·
2. 基态原子核外电子排布式的书写模型
(1)价电子排布式的书写:对于主族元素和0族元素,写出最外层电子排布式即可; 对于过渡金属元素,其价电子排布式一般符合(n-1)d1~10ns1~2(n≥4)。如Cr 的价电子排布式为3d54s1。
(2)离子核外电子排布式的书写方法:先写出基态原子的核外电子排布式,再由外 向内失去电子或补充电子(基态原子失去电子时总是优先失去最外层电子),即得到 相应阳离子或阴离子的核外电子排布式。如Cr3+的核外电子排布式为 1s22s22p63s23p63d3或[Ar]3d3。
(3)防范两类常见的有关核外电子排布的错误
①3d、4s书写顺序混乱:当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填 充,但在书写电子排布式时,应把(n-1)d放在ns前。
如Fe:1s22s22p63s23p64s23d6( ),1s22s22p63s23p63d64s2(√)。
在失去电子时,优先失去4s轨道上的电子,
如Fe2+:1s22s22p63s23p63d6。②不符合洪特规则例,
如Cu:1s22s22p63s23p63d94s2( ),1s22s22p63s23p63d104s1(√)。
3. 电子式书写方法及常见错误
(1)陌生物质电子式的书写方法
①确定该物质是属于共价化合物还是离子化合物。
②确定该物质中各原子的成键方式。
③根据各原子最外层电子(价电子)数和成键后各原子达到最外层8(或2)电子稳定 结构的要求,分析各原子共用电子对的情况。
④根据化合物类型、成键方式和原子稳定结构分析书写电子式。
(2)电子式书写常见的6大误区
内容 实例
误区1 漏写未参与成键的电子
误区2 化合物类型不清楚,漏写或多 写“[ ]”及错写电荷数
误区3 书写不规范,错写共用电子对
内容 实例
误区4 不考虑原子间的成键顺序
误区5 不考虑原子最外层有几个电 子,均写成8电子结构
误区6 不考虑AB2型离子化合物中2个B是分开写还是一起写
专题 训练
B. 基态铜原子的价电子轨道表示式:
C. Se的简化电子排布式:[Ar]3d104s24p4
D. F-的结构示意图:
C
A. ns电子的能量可能低于(n-1)p电子的能量
C. 21Sc的电子排布式:1s22s22p63s23p63d3,违反了能量最低原理
D. 22Ti的电子排布式:1s22s22p63s23p10,违反了泡利不相容原理
解析:ns电子的能量一定高于(n-1)p电子的能量,A错误;根据洪特规则知,
2p能级上的2个电子应排在2个不同的轨道上,B正确;根据能量最低原理知,
电子先排能量低的轨道,后排能量高的轨道,故应先排4s轨道,即电子排布式应为 1s22s22p63s23p63d14s2,C正确;根据泡利不相容原理知,3p能级最多容纳6个电子,
D正确。
A
3. (1)基态镍原子的价电子排布式为 ,排布时能量最高的电子所占能级 的原子轨道有 个伸展方向。
(2)Cu2+基态核外电子排布式为 。
解析:Cu位于第4周期ⅠB族,其价电子排布式为3d104s1,因此Cu2+基态核外电 子排布式为1s22s22p63s23p63d9或[Ar]3d9。
3d84s2
5
1s22s22p63s23p63d9(或[Ar]3d9)
4. A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族, A的原子结构示意图为 ,B是同周期元素(稀有气体元素除外)中原子半径 最大的元素,C的最外层有3个未成对电子,E的价电子排布式为3d64s2。回答下列问题:
(1)A为 (填元素符号,下同),基态原子电子排布式 是 。
(2)B为 ,简化电子排布式是 。
(3)C为 ,价电子排布式是 。
Si
1s22s22p63s23p2
Na
[Ne]3s1
P
3s23p3
(4)D为 ,轨道表示式为 。
(5)E为 ,原子结构示意图是 。
N
Fe
(3)基态铁原子价电子的轨道表示式为 。
(3)基态铁原子的核外电子排布式为1s22s22p63s23p63d64s2,因此价电子轨道表示式 为 。
(4)锌原子核外电子排布式为 。
(5)CN-的电子式是 。
1s22s22p63s23p63d104s2(或[Ar]3d104s2)
