鲁科版高中化学选择性必修2第1章原子结构与元素性质综合微评(一)课件(共40张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质综合微评(一)课件(共40张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:17:01 | ||
图片预览











文档简介
(共40张PPT)
综合微评(一)
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符 合题意)
A. 因为s轨道的形状是球形的,所以s电子做的是圆周运动
B. 3px、3py、3pz轨道上电子(基态)的能量不同
C. 处于同一轨道上的电子可以有多个,它们的运动状态完全相同
D. 钾原子的3p轨道的能量比2s轨道的高
D
解析:s轨道是球形的,是指电子云轮廓图,表示电子在单位体积内出现概率的大 小,不是表示电子的运动轨迹,故A错误;3px、3py、3pz属于同一能级上的原子轨 道,轨道上电子的能量相同,但轨道延伸方向不同,故B错误;根据泡利不相容原理 可知,每个轨道最多容纳2个电子且自旋相反,故C错误;钾原子的3p轨道的能量比2s 轨道的能量高,故D正确。
A. x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的轨道表示式为
D. 该原子结构中共有5个能级上填充电子
解析:在原子结构示意图中,第一能层上只能排2个电子,故x=2,最外能层有4个 电子,为Si元素,其原子的电子排布式为1s22s22p63s23p2,A、B两项均错误;根据洪 特规则,该原子3p轨道上的两个电子应分占两个不同的p轨道且自旋平行,C项错 误;该原子的电子排布式为1s22s22p63s23p2,共有5个能级上填充了电子,D项正确。
D
A. ns电子的能量不一定高于(n-1)p电子的能量
B. 能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C. 同一原子中,1s、2s、3s电子的能量逐渐降低
D. 电子云的空间伸展方向与电子的能量大小无关
解析:ns电子的能量一定高于(n-1)p电子的能量,A错误;能量低的电子在离核 近的区域出现的概率大,能量高的电子在离核远的区域出现的概率大,B错误;同一 原子中能层序数越大,能级能量越高,故1s、2s、3s电子的能量逐渐升高,C错误; 同一能级的电子具有相同的能量,与电子云的空间伸展方向无关,与其自旋状态也无 关,D正确。
D
A. 在K能层中,有自旋相反的两条轨道
B. 最外层电子排布式为ns2的基态原子所对应元素一定位于ⅡA族
C. p能级能量一定比s能级的能量高
D. 焰色反应的原理是电子由较高能量的激发态跃迁到较低能量的激发态或基态时, 以光的形式释放能量
D
解析:K层只有1个s能级,只有1个s轨道,故A错误;最外层电子排布式为ns2的 基态原子所对应元素不一定位于ⅡA族,例如He位于0族,故B错误;当s和p能级 不在同一能层时,p能级能量不一定比s能级的能量高,故C错误;焰色反应是某 些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应,焰色 反应的原理是电子由较高能量的激发态跃迁到较低能量的激发态或基态时,以 光的形式释放能量,故D正确。
A. 基态氯原子核外电子占据的最高能级的电子云轮廓图为哑铃形
C. 基态24Cr的价电子排布式为3d44s2
D. 电负性:Cl>O>H
A
A. 基态原子是指处于最低能量状态的原子
B. 3p2表示3p能级的两个轨道上各有一个电子
C. 电负性的大小可以作为判断元素非金属性强弱的依据
D. 第一电离能的大小可以作为判断元素金属性强弱的依据
D
解析:处于最低能量状态的原子叫基态原子,A正确;根据洪特规则,3p2表示3p能级 的两个轨道上各有一个电子,且自旋状态平行,B正确;电负性表示不同元素原子对 键合电子吸引力的大小,电负性越大的原子,对键合电子的吸引力越大,所以电负性 越强非金属性也越强,即电负性的大小可以作为判断元素非金属性强弱的依据,C正 确;气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量叫第一 电离能,同族元素从上到下第一电离能逐渐变小,同周期元素第一电离能从左到右呈 增大的趋势,但是ⅡA族的第一电离能大于同周期ⅢA族,ⅤA族的第一电离能大于同 周期ⅥA族,所以第一电离能的大小不能作为判断元素金属性强弱的依据,D错误。
A. Zn处于元素周期表中的ds区
B. 基态Ge的价电子排布式为3d104s24p2
C. 基态O原子的哑铃形轨道中电子具有的能量都相同
D. 三种元素电负性由大到小的顺序是O>Ge>Zn
解析:锌元素的原子序数为30,基态原子的价电子排布式为3d104s2,则锌元素处于元 素周期表中的ds区,故A正确;锗元素的原子序数为32,基态原子的价电子排布式为 4s24p2,故B错误;氧元素的原子序数为8,基态原子的价电子排布式为2s22p4,哑铃 形2p轨道中电子具有的能量都相同,伸展方向不同,故C正确;金属元素的电负性小 于非金属元素,非金属元素的非金属性越强,电负性越大,则三种元素电负性由大到 小的顺序是O>Ge>Zn,故D正确。
B
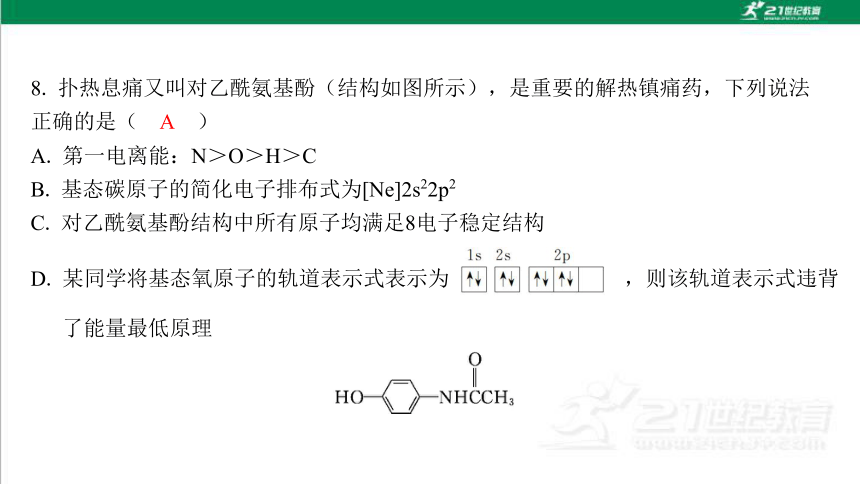
A. 第一电离能:N>O>H>C
B. 基态碳原子的简化电子排布式为[Ne]2s22p2
C. 对乙酰氨基酚结构中所有原子均满足8电子稳定结构
D. 某同学将基态氧原子的轨道表示式表示为 ,则该轨道表示式违背了能量最低原理
A
解析:N、O第一电离能反常,N>O>C,又因为O的第一电离能大于H,且C的第一 电离能小于H,故第一电离能:N>O>H>C,故A正确; 基态碳原子的简化电子排 布式为[He]2s22p2,故B错误;对乙酰氨基酚结构中H是2电子稳定结构,不满足8电子 稳定结构,故C错误;某同学将基态氧原子的轨道表示式表示为 , 则该轨道表示式违背了洪特规则,故D错误。
A. M2+的电子排布式为1s22s22p63s23p63d5,则元素M在周期表中位于第4周期ⅦB族
B. 最外层电子数为ns2的原子,其价电子数也为2
C. 元素周期表各周期总是从ns能级开始,以np能级结束
D. p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道数也在增多
解析:某元素+2价离子电子排布式为1s22s22p63s23p63d5,则该元素是25Mn,位于元 素周期表中的第4周期ⅦB族,A正确;最外层电子数为ns2的原子,过渡元素的价电 子还包括(n-1)d上的电子,B错误;第一周期元素以ns能级开始,以ns能级结 束,C错误;p能级的原子轨道呈哑铃形,p能级原子轨道有3个,即px、py和pz,随 着能层序数的增加,p能级原子轨道数不变,D错误。
A
A. 简单氢化物的稳定性:Y>Z
B. 第一电离能:X>Y
C. 简单离子半径:Y>M
D. M位于元素周期表的p区
A
解析:Z是周期表中电负性最大的元素,则Z为F元素;M是地壳中含量最多的金属元 素,则M为Al元素;X核外未成对电子数为3,且原子序数小于F,则为N元素;Y原子 序数位于Z和X之间,则Y为O元素。Y为O元素,Z为F元素,同一周期从左到右,元 素的非金属性增强,非金属性:O<F,简单氢化物的稳定性:H2O<HF,A错误;N 原子核外电子排布式为1s22s22p3,处于半充满稳定状态,第一电离能大于同周期相邻 元素,则第一电离能:N>O,B正确;电子层数越多半径越大,电子层数相同时,核 电荷数越大,半径越小,则离子半径:O2->Al3+,C正确;M为Al元素,基态Al原 子核外电子排布式为1s22s22p63s23p1,最后填充的电子是p能级中,Al位于元素周期表 的p区,D正确。
A. 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B. 价电子排布式为5s25p1的元素位于第5周期ⅠA族,是s区元素
C. 24Cr原子的核外电子排布式是
1s22s22p63s23p63d44s2
D. 所有原子任一电子层的s电子云轮廓图都是球形,但球的半径大小不同
解析:3p轨道电子能量比3s轨道电子能量高,镁原子由1s22s22p63s2→1s22s22p63p2时, 原子吸收能量,由基态转化成激发态,故A错误;价电子排布式为5s25p1的元素位于 第5周期ⅢA族,属于p区元素,故B错误;由于3d轨道处于半充满状态时能量较低, 则24Cr原子的核外电子排布式是1s22s22p63s23p63d54s1,故C错误;所有原子任一电子 层的s电子云轮廓图都是球形,能层越大,球的半径越大,故D正确。
D
A. 上述元素中未成对电子最多的是c元素
B. a、b和d元素的氧化物都是酸性氧化物
C. d元素所在周期中,元素的第一电离能小于d的有4种
D. 上述元素中,原子半径最大和最小的元素形成的化合物中只含离子键
C
解析:a、b、c、d、e为原子序数依次增大的前20号元素,a元素的s轨道电子数是p轨 道电子数的2倍,a为碳;c元素的最外层电子数是次外层电子数的3倍,c为氧,则b为 氮;常温下,0.05 mol·L-1d的最高价氧化物对应的水化物溶液中,由水电离出的c (OH-)为10-13 mol·L-1,则pH=1,d形成的酸为二元强酸,d为硫;e是前20号元 素中电负性最小的元素,为钾。上述元素中未成对电子氧为2,氮为3,则未成对电子 数最多的是氮元素,故A错误; CO、NO、NO2不是酸性氧化物,B错误;同一周期 随着原子序数变大,第一电离能呈增大的趋势,P的3p轨道为半充满稳定状态,第一 电离能大于同周期相邻元素,则S元素所在周期中,元素的第一电离能小于S的有钠、 镁、铝、硅4种,C正确;电子层数越多,半径越大,电子层数相同时,核电荷数越 大,半径越小;上述元素中,原子半径最大和最小的元素分别为钾、氧,形成的过氧 化钾中的过氧根离子中存在氧氧共价键,D错误。
元素 电离能/(kJ·mol-1)
I1 I2 I3 I4
C 578 1 817 2 745 11 575
A
A. 离子半径:C>A>B
B. C的最高价氧化物对应的水化物可溶于D的最高价氧化物对应的水化物的水溶液
C. 化合物DB3中含离子键和共价键
D. 元素D的核外电子运动具有10种不同的空间运动状态
A. 第一电离能:W>Q>Z>Y
B. 电负性:W>Q>Z>Y>X
C. 最高价氧化物对应的水化物的酸性:Z>Y>M
D. 基态原子未成对电子数:Y>Z>W
解析:X、Y、Z、Q、W、M是原子序数依次增大的短周期主族元素,由阻燃剂的结 构式中各原子的成键数目可知,元素X、Y、Z、Q、W、M分别是H、C、N、O、F、 P。第一电离能:F>N>O>C,故A错误;电负性:F>O>N>C>H,故B正确;最 高价氧化物对应的水化物的酸性:HNO3>H3PO4>H2CO3,故C错误;基态原子未成 对电子数:N>C>F,故D错误。
B
解析:激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释 放出能量,属于发射光谱。
发射
解析:Ti是22号元素,故其核外电子排布式为1s22s22p63s23p63d24s2,电子最后 进入3d能级,故Ti原子位于元素周期表中的d区,最高能层为第4层,即4s电子,s能级 的电子云轮廓图为球形,其价电子排布式为3d24s2,与Ti同周期的过渡元素中,未成 对电子数最多的即Cr,其基态原子的价电子轨道表示式为 。
d
球
3d24s2
(3)Mn、Fe两元素的部分电离能数据如下表:
元素 Mn Fe
电离能/(kJ·mol-1) I1 717 759
I2 1 509 1 561
I3 3 248 2 957
Mn2+的价电子排布式为3d5,处于半充满状态,
能量比较低,再失去一个电子需要的能量较大
解析:锰元素位于第4周期ⅦB族,是25号元素,基态Mn2+的价电子排布 式为1s22s22p63s23p63d5或[Ar]3d5,Mn2+的价电子排布式为3d5,Fe2+的价电子 排布式为3d6,Mn2+的价电子处于半充满状态,能量比较低,再失去一个电子需 要的能量较大。
解析:由于Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,而3d全充 满能量越低结构越稳定,所以Fe3+比Fe2+更稳定,Fe2+更易被氧化为Fe3+。
Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,而3d全充满能量越低结
构越稳定,所以Fe3+比Fe2+更稳定,Fe2+更易被氧化为Fe3+
解析:当原子核外电子排布的电子层数相同时,核外电子数越多则有效核电荷 数越少,对应的微粒半径越大,故Fe3+的核外电子数比Fe2+少,故半径大小关系为 Fe3+小于Fe2+。
小于
16. (15分)1906年,哈伯在60 ℃高温、200 MPa高压的条件下,用锇(Os)作催化 剂,首次成功得到了氨,但产率较低。随着科学的进步以及科学家们对催化剂的研究 改进,现在工业上普遍采用铁触媒作合成氨的催化剂,大大提高了合成氨的产率。
解析:空间运动状态数=电子所占轨道数目,基态氮原子有5个轨道,因此有5 种空间运动状态;基态氮原子中,能量最高的电子为2p电子,电子云在空间有3个伸 展方向。
5
3
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、 CaO、MgO、Cr2O3等氧化物中的几种。
Cu
Al、O
解析:①Cr为24号元素,价电子排布式为3d54s1,价电子轨道表示为 ;第4周期ds区元素中,铜的价电子为3d104s1,与基态Cr原子最外层电子数目相同,元素符号为Cu。②题述氧化物所涉及的元素中,处于元素周期表中p区的元素有Al、O。
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨 工业的温度、压强分别降到了350 ℃、1 MPa,这是近年来合成氨反应研究中的重要 突破。
第4周期ⅦB族
5
<
Fe2+价电子
排布式为3d6,易失去一个电子形成比较稳定的3d5半充满状态,而Mn2+的价电子排布
式为3d5,处于较稳定的半充满状态,所以难失去,故第三电离能I3(Fe)<I3
(Mn)
解析:①Mn为25号元素,在元素周期表中位于第4周期ⅦB族;基态Mn原子的 核外电子排布式为[Ar]3d54s2,故基态Mn原子未成对的电子数为5。②Fe2+价电子排 布式为3d6,易失去一个电子形成比较稳定的3d5半充满状态,而Mn2+的价电子排布式 为3d5,处于较稳定的半充满状态,所以难失去,故第三电离能I3(Fe)<I3(Mn)。
17. (15分)现有七种元素A、B、C、D、E、F、G,其中A、B、C、D、E为短周期 主族元素,F和G为第4周期元素,它们的原子序数依次增大,请根据下列相关信息, 回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具
B元素原子的核外p电子数比s电子数少1
C元素是地壳中含量最多的元素
D元素原子的第一至第四电离能分别是
I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;
I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1
E原子核外所有p轨道全满或半满
F在元素周期表的第8纵列
G元素原子最外层只有1个电子,其次外层内的所有轨道的电子都成对
解析:A、B、C、D、E为短周期主族元素,F和G为第4周期元素,它们的原子序数 依次增大,A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工 具,为金刚石,则A为C元素;B元素原子的核外p电子数比s电子数少1,B有2个电子 层,故B为N元素;C元素是地壳中含量最多的元素,即C为O元素;根据D原子电离 能数据可知,D原子的最外层电子数为2,其为ⅡA族元素,为Mg;E属于短周期主族 元素,E原子核外所有p轨道全满或半满,即P;F在元素周期表的第8纵列,为第4周 期元素,则F为Fe;G元素原子最外层只有一个电子,其次外层内的所有轨道的电子 都成对,其价电子排布式为3d104s1,G为Cu。
解析:洪特规则是指在相同能量的轨道上,电子总是尽可能分占不同的轨道且 自旋方向相同;题图中2p轨道自旋方向相反,其违反了洪特规则。
解析:同周期从左到右,元素的电负性逐渐增大,N元素的电负性小于O元素的 电负性。
洪特规则
小于
解析:题图中b所示的3s轨道为全满较稳定状态,电离最外层一个电子所需能量 最大;当该原子从b状态到c状态,3s电子到3p轨道吸收能量发生跃迁,所形成的是吸 收光谱。
b
吸收
解析:E为P元素,P元素能量最高的电子是3p轨道上的电子,其电子云在空间 有px、py和pz 3个伸展方向。
解析:F原子为26号元素铁,基态Fe原子核外电子排布为1s22s22p63s23p63d64s2, 故价电子排布式为3d64s2。
解析:G为铜,基态Cu原子核外电子排布式为1s22s22p63s23p63d104s1,位于元素 周期表的ds区,该区元素价电子的结构特点是d轨道为全满。
3
3d64s2
ds
d轨道为全
满
18. (14分)有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外 其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三 种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为 nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素 的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对 电子,其内层所有轨道全部充满,但并不是ⅠA族元素。回答下列问题:
3d104s1
氯
解析:由X的原子中没有成对电子,可判断X为H元素,由Y元素基态原子中电子占据 三种能量不同的原子轨道且每种轨道中的电子数相同,知Y为C元素,由Z元素原子的 价电子排布式为nsnnpn+1,可判断Z为N元素,Q的基态原子核外成对电子数是成单 电子数的3倍,知Q为O元素,由E与Q同周期,E的原子序数比Q的原子序数大,可判 断E为F元素,根据M元素的第一电离能在同周期主族元素中从大到小排第三位,且 X、Y、Z、Q、E、M、G原子序数依次递增,确定M为S元素,G的价电子排布式为 3d104s1,G为Cu元素。
(1)Cu的原子序数为29,基态Cu原子的价电子排布式为3d104s1,Cu的未成对 电子数是1,第3周期中含有1个未成对电子的元素有Na、Al、Cl三种元素,但电负性 最大的是Cl元素。
解析:Z、Q、M分别为N、O、S,N的2p轨道为半充满稳定结构,N的第一电 离能大于O的第一电离能,同主族元素从上到下元素的第一电离能逐渐减小,所以O 的第一电离能大于S的第一电离能。
N>O>S
解析:X与Q形成的化合物为H2O和H2O2。
解析:Z、M、E所形成的简单离子为N3-、S2-、F-,半径由大到小的顺序为S2 ->N3->F-。
解析:X、Y、Z、Q分别为H、C、N、O,同周期从左到右元素的电负性增大, 所以电负性:O>N>C,CH4中C显负价,所以电负性:O>N>C>H。
H2O、H2O2
O>N>C>H
综合微评(一)
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符 合题意)
A. 因为s轨道的形状是球形的,所以s电子做的是圆周运动
B. 3px、3py、3pz轨道上电子(基态)的能量不同
C. 处于同一轨道上的电子可以有多个,它们的运动状态完全相同
D. 钾原子的3p轨道的能量比2s轨道的高
D
解析:s轨道是球形的,是指电子云轮廓图,表示电子在单位体积内出现概率的大 小,不是表示电子的运动轨迹,故A错误;3px、3py、3pz属于同一能级上的原子轨 道,轨道上电子的能量相同,但轨道延伸方向不同,故B错误;根据泡利不相容原理 可知,每个轨道最多容纳2个电子且自旋相反,故C错误;钾原子的3p轨道的能量比2s 轨道的能量高,故D正确。
A. x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的轨道表示式为
D. 该原子结构中共有5个能级上填充电子
解析:在原子结构示意图中,第一能层上只能排2个电子,故x=2,最外能层有4个 电子,为Si元素,其原子的电子排布式为1s22s22p63s23p2,A、B两项均错误;根据洪 特规则,该原子3p轨道上的两个电子应分占两个不同的p轨道且自旋平行,C项错 误;该原子的电子排布式为1s22s22p63s23p2,共有5个能级上填充了电子,D项正确。
D
A. ns电子的能量不一定高于(n-1)p电子的能量
B. 能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C. 同一原子中,1s、2s、3s电子的能量逐渐降低
D. 电子云的空间伸展方向与电子的能量大小无关
解析:ns电子的能量一定高于(n-1)p电子的能量,A错误;能量低的电子在离核 近的区域出现的概率大,能量高的电子在离核远的区域出现的概率大,B错误;同一 原子中能层序数越大,能级能量越高,故1s、2s、3s电子的能量逐渐升高,C错误; 同一能级的电子具有相同的能量,与电子云的空间伸展方向无关,与其自旋状态也无 关,D正确。
D
A. 在K能层中,有自旋相反的两条轨道
B. 最外层电子排布式为ns2的基态原子所对应元素一定位于ⅡA族
C. p能级能量一定比s能级的能量高
D. 焰色反应的原理是电子由较高能量的激发态跃迁到较低能量的激发态或基态时, 以光的形式释放能量
D
解析:K层只有1个s能级,只有1个s轨道,故A错误;最外层电子排布式为ns2的 基态原子所对应元素不一定位于ⅡA族,例如He位于0族,故B错误;当s和p能级 不在同一能层时,p能级能量不一定比s能级的能量高,故C错误;焰色反应是某 些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应,焰色 反应的原理是电子由较高能量的激发态跃迁到较低能量的激发态或基态时,以 光的形式释放能量,故D正确。
A. 基态氯原子核外电子占据的最高能级的电子云轮廓图为哑铃形
C. 基态24Cr的价电子排布式为3d44s2
D. 电负性:Cl>O>H
A
A. 基态原子是指处于最低能量状态的原子
B. 3p2表示3p能级的两个轨道上各有一个电子
C. 电负性的大小可以作为判断元素非金属性强弱的依据
D. 第一电离能的大小可以作为判断元素金属性强弱的依据
D
解析:处于最低能量状态的原子叫基态原子,A正确;根据洪特规则,3p2表示3p能级 的两个轨道上各有一个电子,且自旋状态平行,B正确;电负性表示不同元素原子对 键合电子吸引力的大小,电负性越大的原子,对键合电子的吸引力越大,所以电负性 越强非金属性也越强,即电负性的大小可以作为判断元素非金属性强弱的依据,C正 确;气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量叫第一 电离能,同族元素从上到下第一电离能逐渐变小,同周期元素第一电离能从左到右呈 增大的趋势,但是ⅡA族的第一电离能大于同周期ⅢA族,ⅤA族的第一电离能大于同 周期ⅥA族,所以第一电离能的大小不能作为判断元素金属性强弱的依据,D错误。
A. Zn处于元素周期表中的ds区
B. 基态Ge的价电子排布式为3d104s24p2
C. 基态O原子的哑铃形轨道中电子具有的能量都相同
D. 三种元素电负性由大到小的顺序是O>Ge>Zn
解析:锌元素的原子序数为30,基态原子的价电子排布式为3d104s2,则锌元素处于元 素周期表中的ds区,故A正确;锗元素的原子序数为32,基态原子的价电子排布式为 4s24p2,故B错误;氧元素的原子序数为8,基态原子的价电子排布式为2s22p4,哑铃 形2p轨道中电子具有的能量都相同,伸展方向不同,故C正确;金属元素的电负性小 于非金属元素,非金属元素的非金属性越强,电负性越大,则三种元素电负性由大到 小的顺序是O>Ge>Zn,故D正确。
B
A. 第一电离能:N>O>H>C
B. 基态碳原子的简化电子排布式为[Ne]2s22p2
C. 对乙酰氨基酚结构中所有原子均满足8电子稳定结构
D. 某同学将基态氧原子的轨道表示式表示为 ,则该轨道表示式违背了能量最低原理
A
解析:N、O第一电离能反常,N>O>C,又因为O的第一电离能大于H,且C的第一 电离能小于H,故第一电离能:N>O>H>C,故A正确; 基态碳原子的简化电子排 布式为[He]2s22p2,故B错误;对乙酰氨基酚结构中H是2电子稳定结构,不满足8电子 稳定结构,故C错误;某同学将基态氧原子的轨道表示式表示为 , 则该轨道表示式违背了洪特规则,故D错误。
A. M2+的电子排布式为1s22s22p63s23p63d5,则元素M在周期表中位于第4周期ⅦB族
B. 最外层电子数为ns2的原子,其价电子数也为2
C. 元素周期表各周期总是从ns能级开始,以np能级结束
D. p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道数也在增多
解析:某元素+2价离子电子排布式为1s22s22p63s23p63d5,则该元素是25Mn,位于元 素周期表中的第4周期ⅦB族,A正确;最外层电子数为ns2的原子,过渡元素的价电 子还包括(n-1)d上的电子,B错误;第一周期元素以ns能级开始,以ns能级结 束,C错误;p能级的原子轨道呈哑铃形,p能级原子轨道有3个,即px、py和pz,随 着能层序数的增加,p能级原子轨道数不变,D错误。
A
A. 简单氢化物的稳定性:Y>Z
B. 第一电离能:X>Y
C. 简单离子半径:Y>M
D. M位于元素周期表的p区
A
解析:Z是周期表中电负性最大的元素,则Z为F元素;M是地壳中含量最多的金属元 素,则M为Al元素;X核外未成对电子数为3,且原子序数小于F,则为N元素;Y原子 序数位于Z和X之间,则Y为O元素。Y为O元素,Z为F元素,同一周期从左到右,元 素的非金属性增强,非金属性:O<F,简单氢化物的稳定性:H2O<HF,A错误;N 原子核外电子排布式为1s22s22p3,处于半充满稳定状态,第一电离能大于同周期相邻 元素,则第一电离能:N>O,B正确;电子层数越多半径越大,电子层数相同时,核 电荷数越大,半径越小,则离子半径:O2->Al3+,C正确;M为Al元素,基态Al原 子核外电子排布式为1s22s22p63s23p1,最后填充的电子是p能级中,Al位于元素周期表 的p区,D正确。
A. 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B. 价电子排布式为5s25p1的元素位于第5周期ⅠA族,是s区元素
C. 24Cr原子的核外电子排布式是
1s22s22p63s23p63d44s2
D. 所有原子任一电子层的s电子云轮廓图都是球形,但球的半径大小不同
解析:3p轨道电子能量比3s轨道电子能量高,镁原子由1s22s22p63s2→1s22s22p63p2时, 原子吸收能量,由基态转化成激发态,故A错误;价电子排布式为5s25p1的元素位于 第5周期ⅢA族,属于p区元素,故B错误;由于3d轨道处于半充满状态时能量较低, 则24Cr原子的核外电子排布式是1s22s22p63s23p63d54s1,故C错误;所有原子任一电子 层的s电子云轮廓图都是球形,能层越大,球的半径越大,故D正确。
D
A. 上述元素中未成对电子最多的是c元素
B. a、b和d元素的氧化物都是酸性氧化物
C. d元素所在周期中,元素的第一电离能小于d的有4种
D. 上述元素中,原子半径最大和最小的元素形成的化合物中只含离子键
C
解析:a、b、c、d、e为原子序数依次增大的前20号元素,a元素的s轨道电子数是p轨 道电子数的2倍,a为碳;c元素的最外层电子数是次外层电子数的3倍,c为氧,则b为 氮;常温下,0.05 mol·L-1d的最高价氧化物对应的水化物溶液中,由水电离出的c (OH-)为10-13 mol·L-1,则pH=1,d形成的酸为二元强酸,d为硫;e是前20号元 素中电负性最小的元素,为钾。上述元素中未成对电子氧为2,氮为3,则未成对电子 数最多的是氮元素,故A错误; CO、NO、NO2不是酸性氧化物,B错误;同一周期 随着原子序数变大,第一电离能呈增大的趋势,P的3p轨道为半充满稳定状态,第一 电离能大于同周期相邻元素,则S元素所在周期中,元素的第一电离能小于S的有钠、 镁、铝、硅4种,C正确;电子层数越多,半径越大,电子层数相同时,核电荷数越 大,半径越小;上述元素中,原子半径最大和最小的元素分别为钾、氧,形成的过氧 化钾中的过氧根离子中存在氧氧共价键,D错误。
元素 电离能/(kJ·mol-1)
I1 I2 I3 I4
C 578 1 817 2 745 11 575
A
A. 离子半径:C>A>B
B. C的最高价氧化物对应的水化物可溶于D的最高价氧化物对应的水化物的水溶液
C. 化合物DB3中含离子键和共价键
D. 元素D的核外电子运动具有10种不同的空间运动状态
A. 第一电离能:W>Q>Z>Y
B. 电负性:W>Q>Z>Y>X
C. 最高价氧化物对应的水化物的酸性:Z>Y>M
D. 基态原子未成对电子数:Y>Z>W
解析:X、Y、Z、Q、W、M是原子序数依次增大的短周期主族元素,由阻燃剂的结 构式中各原子的成键数目可知,元素X、Y、Z、Q、W、M分别是H、C、N、O、F、 P。第一电离能:F>N>O>C,故A错误;电负性:F>O>N>C>H,故B正确;最 高价氧化物对应的水化物的酸性:HNO3>H3PO4>H2CO3,故C错误;基态原子未成 对电子数:N>C>F,故D错误。
B
解析:激发态的电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释 放出能量,属于发射光谱。
发射
解析:Ti是22号元素,故其核外电子排布式为1s22s22p63s23p63d24s2,电子最后 进入3d能级,故Ti原子位于元素周期表中的d区,最高能层为第4层,即4s电子,s能级 的电子云轮廓图为球形,其价电子排布式为3d24s2,与Ti同周期的过渡元素中,未成 对电子数最多的即Cr,其基态原子的价电子轨道表示式为 。
d
球
3d24s2
(3)Mn、Fe两元素的部分电离能数据如下表:
元素 Mn Fe
电离能/(kJ·mol-1) I1 717 759
I2 1 509 1 561
I3 3 248 2 957
Mn2+的价电子排布式为3d5,处于半充满状态,
能量比较低,再失去一个电子需要的能量较大
解析:锰元素位于第4周期ⅦB族,是25号元素,基态Mn2+的价电子排布 式为1s22s22p63s23p63d5或[Ar]3d5,Mn2+的价电子排布式为3d5,Fe2+的价电子 排布式为3d6,Mn2+的价电子处于半充满状态,能量比较低,再失去一个电子需 要的能量较大。
解析:由于Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,而3d全充 满能量越低结构越稳定,所以Fe3+比Fe2+更稳定,Fe2+更易被氧化为Fe3+。
Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,而3d全充满能量越低结
构越稳定,所以Fe3+比Fe2+更稳定,Fe2+更易被氧化为Fe3+
解析:当原子核外电子排布的电子层数相同时,核外电子数越多则有效核电荷 数越少,对应的微粒半径越大,故Fe3+的核外电子数比Fe2+少,故半径大小关系为 Fe3+小于Fe2+。
小于
16. (15分)1906年,哈伯在60 ℃高温、200 MPa高压的条件下,用锇(Os)作催化 剂,首次成功得到了氨,但产率较低。随着科学的进步以及科学家们对催化剂的研究 改进,现在工业上普遍采用铁触媒作合成氨的催化剂,大大提高了合成氨的产率。
解析:空间运动状态数=电子所占轨道数目,基态氮原子有5个轨道,因此有5 种空间运动状态;基态氮原子中,能量最高的电子为2p电子,电子云在空间有3个伸 展方向。
5
3
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、 CaO、MgO、Cr2O3等氧化物中的几种。
Cu
Al、O
解析:①Cr为24号元素,价电子排布式为3d54s1,价电子轨道表示为 ;第4周期ds区元素中,铜的价电子为3d104s1,与基态Cr原子最外层电子数目相同,元素符号为Cu。②题述氧化物所涉及的元素中,处于元素周期表中p区的元素有Al、O。
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨 工业的温度、压强分别降到了350 ℃、1 MPa,这是近年来合成氨反应研究中的重要 突破。
第4周期ⅦB族
5
<
Fe2+价电子
排布式为3d6,易失去一个电子形成比较稳定的3d5半充满状态,而Mn2+的价电子排布
式为3d5,处于较稳定的半充满状态,所以难失去,故第三电离能I3(Fe)<I3
(Mn)
解析:①Mn为25号元素,在元素周期表中位于第4周期ⅦB族;基态Mn原子的 核外电子排布式为[Ar]3d54s2,故基态Mn原子未成对的电子数为5。②Fe2+价电子排 布式为3d6,易失去一个电子形成比较稳定的3d5半充满状态,而Mn2+的价电子排布式 为3d5,处于较稳定的半充满状态,所以难失去,故第三电离能I3(Fe)<I3(Mn)。
17. (15分)现有七种元素A、B、C、D、E、F、G,其中A、B、C、D、E为短周期 主族元素,F和G为第4周期元素,它们的原子序数依次增大,请根据下列相关信息, 回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具
B元素原子的核外p电子数比s电子数少1
C元素是地壳中含量最多的元素
D元素原子的第一至第四电离能分别是
I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;
I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1
E原子核外所有p轨道全满或半满
F在元素周期表的第8纵列
G元素原子最外层只有1个电子,其次外层内的所有轨道的电子都成对
解析:A、B、C、D、E为短周期主族元素,F和G为第4周期元素,它们的原子序数 依次增大,A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工 具,为金刚石,则A为C元素;B元素原子的核外p电子数比s电子数少1,B有2个电子 层,故B为N元素;C元素是地壳中含量最多的元素,即C为O元素;根据D原子电离 能数据可知,D原子的最外层电子数为2,其为ⅡA族元素,为Mg;E属于短周期主族 元素,E原子核外所有p轨道全满或半满,即P;F在元素周期表的第8纵列,为第4周 期元素,则F为Fe;G元素原子最外层只有一个电子,其次外层内的所有轨道的电子 都成对,其价电子排布式为3d104s1,G为Cu。
解析:洪特规则是指在相同能量的轨道上,电子总是尽可能分占不同的轨道且 自旋方向相同;题图中2p轨道自旋方向相反,其违反了洪特规则。
解析:同周期从左到右,元素的电负性逐渐增大,N元素的电负性小于O元素的 电负性。
洪特规则
小于
解析:题图中b所示的3s轨道为全满较稳定状态,电离最外层一个电子所需能量 最大;当该原子从b状态到c状态,3s电子到3p轨道吸收能量发生跃迁,所形成的是吸 收光谱。
b
吸收
解析:E为P元素,P元素能量最高的电子是3p轨道上的电子,其电子云在空间 有px、py和pz 3个伸展方向。
解析:F原子为26号元素铁,基态Fe原子核外电子排布为1s22s22p63s23p63d64s2, 故价电子排布式为3d64s2。
解析:G为铜,基态Cu原子核外电子排布式为1s22s22p63s23p63d104s1,位于元素 周期表的ds区,该区元素价电子的结构特点是d轨道为全满。
3
3d64s2
ds
d轨道为全
满
18. (14分)有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外 其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三 种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为 nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素 的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对 电子,其内层所有轨道全部充满,但并不是ⅠA族元素。回答下列问题:
3d104s1
氯
解析:由X的原子中没有成对电子,可判断X为H元素,由Y元素基态原子中电子占据 三种能量不同的原子轨道且每种轨道中的电子数相同,知Y为C元素,由Z元素原子的 价电子排布式为nsnnpn+1,可判断Z为N元素,Q的基态原子核外成对电子数是成单 电子数的3倍,知Q为O元素,由E与Q同周期,E的原子序数比Q的原子序数大,可判 断E为F元素,根据M元素的第一电离能在同周期主族元素中从大到小排第三位,且 X、Y、Z、Q、E、M、G原子序数依次递增,确定M为S元素,G的价电子排布式为 3d104s1,G为Cu元素。
(1)Cu的原子序数为29,基态Cu原子的价电子排布式为3d104s1,Cu的未成对 电子数是1,第3周期中含有1个未成对电子的元素有Na、Al、Cl三种元素,但电负性 最大的是Cl元素。
解析:Z、Q、M分别为N、O、S,N的2p轨道为半充满稳定结构,N的第一电 离能大于O的第一电离能,同主族元素从上到下元素的第一电离能逐渐减小,所以O 的第一电离能大于S的第一电离能。
N>O>S
解析:X与Q形成的化合物为H2O和H2O2。
解析:Z、M、E所形成的简单离子为N3-、S2-、F-,半径由大到小的顺序为S2 ->N3->F-。
解析:X、Y、Z、Q分别为H、C、N、O,同周期从左到右元素的电负性增大, 所以电负性:O>N>C,CH4中C显负价,所以电负性:O>N>C>H。
H2O、H2O2
O>N>C>H
