鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质第1节共价键模型第1课时共价键的形成与特征共价键的类型课件(共60张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质第1节共价键模型第1课时共价键的形成与特征共价键的类型课件(共60张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览










文档简介
(共60张PPT)
第2章 微粒间相互作用与物质性质
第1节 共价键模型
第1课时 共价键的形成与特征 共价键的类型
第*页
研习任务一 共价键的形成与特征
[目标导航]1.熟知共价键的概念与形成,知道共价键的特征——具有饱和性和方向 性。2.能够从不同的角度对共价键分类,会分析σ键和π键的形成及特点。3.会判断极 性共价键和非极性共价键。
教材 认知
1. 氢分子中共价键(H—H)的形成
项目 用电子云
表示形成过程 能量变化
相距
较远时
1s1相互靠拢1s1 体系的能量 等于 两个氢原子的能量之和(能量 最高不稳定)
原子轨
道重叠
原子轨道相互重叠 两原子逐渐接近时,原子轨道部分重叠,体系能量 逐渐 ◆◆◆ 降低
等于
降低
项目 用电子云
表示形成过程 能量变化
形成
共价键
形成氢分子的
共价键(H—H) 原子轨道重叠,两个单电子以自旋状态不同的方式 形成 共用电子对 即形成共价键(核间距为 0.074 nm时,能量最低)
共用电子对
2. 共价键的形成
概念 原子间通过 共用电子 形成的化学键
本质 高概率出现在两个原子核之间的电子与两个原子核之间的 电性 作用
形成
元素 通常电负性相同或差值小的 非金属元素原子之间 形成共价键
表示
方法 ①用一条短线表示由 一对共用电子 所形成的共价键,如H—H
②用“ ”表示原子间共用 两对电子 所形成的共价键,如C C
③用“≡”表示原子间共用 三对电子 所形成的共价键,如C≡C
共用电子
电性
非金属元素原子之间
一对共用电子
两对电子
三对电子
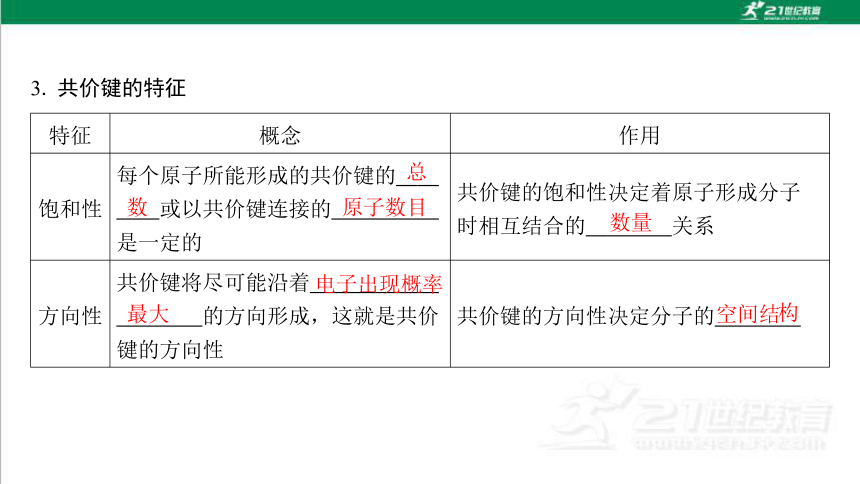
3. 共价键的特征
特征 概念 作用
饱和性 每个原子所能形成的共价键的 总 数 或以共价键连接的 原子数目 是一定的 共价键的饱和性决定着原子形成分子 时相互结合的 数量 关系
方向性 共价键将尽可能沿着 电子出现概率最大 的方向形成,这就是共价键的方向性 共价键的方向性决定分子的 空间结
总
数
原子数目
数量
电子出现概率
最大
空间结
构
[思考] 共价键是有饱和性和方向性的,共价键的饱和性是由 决定的,共价键的 方向性是由 决定的,共价键的强弱与 有关。
提示:成键原子的未成对电子数 成键原子的轨道的方向性 原子轨道的重叠程度
判断
×
√
×
×
√
探究 活动
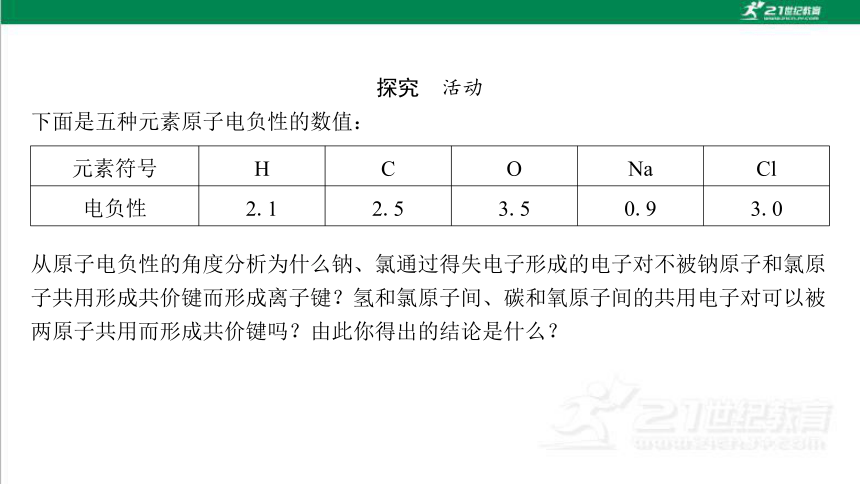
下面是五种元素原子电负性的数值:
元素符号 H C O Na Cl
电负性 2.1 2.5 3.5 0.9 3.0
从原子电负性的角度分析为什么钠、氯通过得失电子形成的电子对不被钠原子和氯原 子共用形成共价键而形成离子键?氢和氯原子间、碳和氧原子间的共用电子对可以被 两原子共用而形成共价键吗?由此你得出的结论是什么?
提示:钠、氯电负性之差(绝对值)为2.1>1.7,故Na和Cl之间通过得失电子形成的 是Na+和Cl-,Na+与Cl-形成的是离子键。氢、氯电负性之差为0.9,碳、氧电负性 之差为1,均小于1.7,故氢、氯之间形成的电子对被共用,碳、氧之间形成的电子对 也被共用,能形成共价键。由此得出的结论是:①当原子的电负性相差很大(一般大 于1.7)时,原子间形成的电子对不会被共用,形成的是离子键;②当原子的电负性 相差不大(一般小于1.7)时,原子间形成的电子对能被共用,形成的是共价键。
重点 讲解
1. 共价键的饱和性
(1)按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋 状态相反的电子配对成键,这就是共价键的饱和性。
(2)用轨道表示式表示HF分子中共用电子对的形成如下:
F原子与H原子间只能形成1个共价键,所形成的简单化合物为HF而不是H2F。同理, H原子、F原子分别只能形成H2、F2,不能形成H3、F3。
(3)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
2. 共价键的方向性
(1)共价键的方向性解释:共价键形成时,两个参与成键的原子轨道总是尽可能沿 着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现的概率 越大,形成的共价键就越牢固。电子所在的原子轨道都有一定的形状,所以要达到最 大重叠,共价键必然有方向性。
(2)共价键的方向性决定了分子的空间结构,并不是所有共价键都具有方向性,如 两个s轨道上的电子形成的共价键就没有方向性。
研习 经典
A. 共用电子在两原子核之间高概率出现
B. 共用的电子必须配对
C. 成键后体系能量降低,趋于稳定
D. 两原子核体积大小要适中
解析:成键原子之间以共用电子结合,形成稳定的共价键后体系能量降低,共用电子 在两原子核之间高概率出现是共价键的成键因素,A、B、C正确;成键原子的原子核 体积的大小对共价键的形成没有影响,D错误。
D
A. Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B. H2O与H2S 的空间结构一样是由共价键的饱和性决定的
C. 并非所有的共价键都有方向性
D. 两原子轨道发生重叠后,电子在两核间出现的概率减小
解析:Cl2是双原子分子,H2S是三原子分子,这是由共价键的饱和性决定的,A不正 确;H2O与H2S的空间结构一样是由共价键的方向性决定的,B不正确;氢气中的共价 键没有方向性,C正确;两原子轨道发生重叠后,电子在两核间出现的概率增大,D 不正确。
C
A. 由①到④,电子在核间区域出现的概率增大
B. 由④到⑤,需要由外界提供能量
C. 有催化剂存在时,若键的键长增大,则键能也增大
D. 两个氢原子的核间距从无穷远到0.074 nm的过程是成键过程,对外释放能量
C
解析:共价键的本质就是高概率地出现在原子核间的电子与原子核间的电性作用,所 以由①到④,电子在核间出现的概率增加,故A正确;④为稳定状态,通过吸收能量 变为⑤,因此需要由外界提供能量,故B正确;催化剂不能改变键长和键能,故C错 误;根据能量越低越稳定,氢气是稳定的状态,则两个氢原子的核间距从无穷远到 0.074 nm的过程是成键过程,形成新键释放能量,故D正确。
(1)共价键的饱和性决定了分子的组成,共价键的方向性决定了分子的空间结构。所有的共价键都具有饱和性,但并不是所有的共价键都具有方向性,如两个s轨
道重叠形成的共价键就没有方向性。
(2)共价键的存在
①非金属单质分子中(稀有气体除外),如O2、Cl2等。
②非金属元素形成的化合物中,如HClO、HCl、有机物分子等。
③某些金属与非金属元素形成的化合物中,如AlCl3、BeCl2等。
④某些离子化合物中,如NaOH、NaClO等。
第*页
研习任务二 共价键的类型
教材 认知
1. σ键与π键
(1)σ键
①定义
头碰头
②类型
形成 成键原子的s轨道或p轨道“ 头碰头 ”重叠而形成
类型 s-s型
s-p型
p-p型
头碰头
(2)π键
①定义
②p-p π键的形成
形成 由两个原子的p轨道“ 肩并肩 ”重叠形成
p-p型
肩并肩
肩并肩
2. 极性键和非极性键
(1)分类标准:共用电子是否偏移。
类型 形成元素 共用电子对偏移 原子电性
非极
性键 同种元素 两原子电负性相同,
共用电子 不偏移 两原子都不显电性
极性键 不同种元素 共用电子偏向电负
性 较大 的原子 电负性较大的原子显 电性,
电负性较小的原子显 正电性
同种
不偏移
不同种
较
大
负
正
大
判断
√
√
×
×
探究 活动
下面是乙烷、乙烯、乙炔的球棍模型和空间填充模型:
乙烷 乙烯 乙炔
1. 仔细观察乙烷、乙烯、乙炔的分子结构,指出它们分子中的共价键分别由几个σ键 和几个π键构成?
提示:
物质
共价键类别 乙烷 乙烯 乙炔
σ键数目 7 5 3
π键数目 0 1 2
物质
共价键类别
乙烷
乙烯
乙炔
σ键数目
7
5
3
π键数目
0
1
2
2. 乙烯和乙炔的化学性质为什么比乙烷活泼呢?
提示:乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠 程度小,不稳定,容易断裂;而乙烷中没有π键,σ键稳定,不易断裂。
3. H原子和H原子、H原子和Cl原子、Cl原子和Cl原子分别均以σ键结合成H2、HCl和 Cl2分子,共价键轨道完全相同吗?
提示:不相同。H原子的未成对电子位于1s轨道,Cl原子的未成对电子位于3p轨道, 即H原子和H原子成键以1s和1s轨道重叠,H原子和Cl原子以1s和3p轨道重叠,Cl原子 和Cl原子以3p和3p轨道“头碰头”重叠。
重点 讲解
1. 共价键的分类
分类依据 类型及特点
形成共价键的原子轨道重叠方式 σ键 原子轨道“头碰头”重叠
π键 原子轨道“肩并肩”重叠
形成共价键的电子对是否偏移 极性键 共用电子对发生偏移
非极性键 共用电子对不发生偏移
原子间共用电子对的数目 单键 原子间有一对共用电子对
双键 原子间有两对共用电子对
三键 原子间有三对共用电子对
2. σ键与π键的对比
项目 σ键 π键
定义 未成对电子的原子轨道采取 “头碰头”的方式重叠形成的共价键 未成对电子的原子轨道采取“肩并 肩”的方式重叠形成的共价键
类型 s-s σ键、s-p σ键、
p-p σ键 p-p π键
特征
(电子云形状) 原子轨道重叠部分沿键轴呈轴对称 原子轨道重叠部分分别位于两原子核构成平面的两侧,互为镜像对称
项目 σ键 π键
键的性质 σ键可沿键轴自由旋转,不易 断裂,稳定 π键不能旋转,易断裂,不稳定
存在的情况 能单独存在,可存在于任何含共价键的分子中 不能单独存在,必须与σ键共存,可存 在于双键和三键中
实例 CH4中只有σ键
示意图
(1)s轨道与s轨道重叠形成σ键时,电子不是只在两核间运动,而是 在两核间出现的概率较大。
(2)因s轨道是球形的,故s轨道和s轨道形成σ键时,无方向性。两个s轨道只能形成σ 键,不能形成π键。
(3)两个原子间可以只形成σ键,但不能只形成π键。
3. σ键与π键的判断
由物质的
结构式判断 通过物质的结构式可以快速有效地判断共价键的种类及数目。共价 单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两 个π键
由成键轨道
类型判断 s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ 键,形成π键的电子不占据杂化轨道
4. 乙烷、乙烯、乙炔成键分析
名称 乙烷 乙烯 乙炔
球棍模型
空间填充模型
碳碳键成键方式 1个σ键 1个σ键、1个π键 1个σ键、2个π键
5. 极性键与非极性键的比较
共价键 极性共价键 非极性共价键
成键原子 不同种元素的原子 同种元素的原子
电子对 发生偏移 不发生偏移
成键原子
的电性 电负性弱的原子呈正电性(δ+), 电负性强的原子呈负电性(δ-) 电中性
示例 H2、O2、Cl2
研习 经典
①s-s σ键与s-p σ键的电子云对称性不同
②π键不能单独存在,一定要和σ键共存
③含有π键的化合物与只含σ键的化合物的化学性质不同
④两个非金属元素的原子之间形成的化学键是共价键
⑤分子中含有共价键,则一定只含有1个σ键
⑥成键的原子间原子轨道重叠程度越大,共价键越牢固
⑦1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
A. 1个 B. 2个 C. 3个 D. 4个
B
解析:s-s σ键与s-p σ键的对称性相同,均为轴对称,①错误;分子中可以只含σ 键,π键不能单独存在,一定要和σ键共存,②正确;π键不稳定,易断裂,含有π键的 化合物化学性质较活泼,与只含σ键的化合物的化学性质不同,③正确;非金属原子 常以共用电子对形成化学键,两个非金属元素的原子之间形成的化学键是共价键,④ 正确;分子中含有共价键,不一定只含有1个σ键,如水分子中含有2个σ键,⑤错误; 成键的原子间原子轨道重叠程度越大,成键原子间的距离越小,共价键越牢固,⑥正 确;N原子最外层有5个电子,有3个未成对电子,1个N原子最多只能与3个H原子结 合形成NH3分子,是由共价键的饱和性决定的,⑦正确。
A. 所有的σ键的强度都比π键大
B. σ键是原子轨道“头碰头”式重叠,π键是原子轨道“肩并肩”式重叠
C. s-sσ键与s-pσ键的电子云形状的对称性相同
D. σ键可以绕键轴旋转,π键一定不能绕键轴旋转
解析:一般情况下,σ键的强度比π键大,但也有特殊情况,如N≡N中σ键的强度比π键 小,A错误;σ键电子云重叠程度较大,是原子轨道“头碰头”式重叠,π键电子云重 叠程度较小,是原子轨道“肩并肩”式重叠,B正确;σ键有方向性,两个成键原子 必须沿着对称轴方向接近,才能达到最大重叠,s-sσ键与s-pσ键都是轴对称的,C 正确;σ键为单键,可以绕键轴旋转,π键在双键、三键中存在,不能旋转,D正确。
A
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A. ①②③ B. ③④⑤⑥ C. ①③⑥ D. ③⑤⑥
解析:HCl、H2O、H2O2的结构式分别为 、 、 ,分子中 不含π键;N2、C2H4、C2H2的结构式分别为 、 、 ,分子 中既有σ键又有π键。
D
4. (1)现有以下物质:A. HF B. Br2 C. H2O
D. N2 E. C2H4 F. C2H6 G. H2 H. H2O2
I. H—C N J. CO2 K. HCHO
DEIJK
ACEFHIK
饱和
方向
(2)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大不 同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不能形成π键。从原子半径 大小的角度分析,为何C、O原子间能形成π键,而Si、O原子间不能形成π键?
答:C原子半径较小,C、O原子能充分接近,p-p轨道“肩并肩”重叠程度较大,能形成较稳定的π键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道“肩并肩”重叠程度较小,不能形成稳定的π键。
解析:Br2、H2、HF、H2O、H2O2、C2H6中均只含σ键;N2分子中含σ键和π键;C2H4 含双键;H—C N分子中含单键、三键;CO2分子中含两个双键;HCHO分子中含 有一个双键。含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键是指由H原 子与其他原子形成的共价键。
①H2 ②HCl ③NH3 ④H2O2 ⑤CO2 ⑥CCl4 ⑦C2H6
解析:同种元素的原子间形成非极性键,不同种元素的原子间形成极性键,H2O2的2 个氧原子间存在非极性键,C2H6分子中碳原子间存在非极性键。
②③⑤⑥
①
④⑦
A. 在离子化合物中不可能存在非极性键
B. 在共价化合物中不可能存在离子键
C. 不同种非金属原子组成的多原子分子中的化学键一定全部是极性共价键
D. 非极性键只存在于双原子单质分子里
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. H2O2(过氧化氢):H—O O—H
B. N2H4(肼):
C. C2H5SH(乙硫醇):
D. SiHCl3(三氯氢硅):
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 分子中只要含有共价键,则至少含有一个σ键
B. s-s σ键、p-p σ键与s-p σ键都是轴对称的
C. p-p σ键和p-p π键的重叠方式是相同的
D. 含有π键的化合物与只含σ键的化合物的化学性质不同
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 若把H2S写成H3S,违背了共价键的饱和性
B. H3O+的存在说明共价键不具有饱和性
C. 成键原子中自旋状态相同的未成对电子可以形成共用电子对
D. 两个原子轨道发生重叠后,两核中的电子不仅存在于两核之间,还会绕两核运动
解析:硫原子有两个未成对电子,根据共价键的饱和性,形成的氢化物为H2S,A项 正确;H2O能结合1个H+形成H3O+,不能说明共价键不具有饱和性,B项错误;成键 原子中自旋状态相同的未成对电子不能形成共用电子对,C项错误;两个原子轨道发 生重叠后,只有共用电子对在两核之间绕两个原子核运动,D项错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. HF H2O NH3 CH4
B. CH4 NH3 H2O HF
C. H2O HF CH4 NH3
D. HF H2O CH4 NH3
解析:共价键极性的强弱取决于形成共价键的两原子的电负性差值,其电负性相差越 大,形成的共价键极性越强,A项符合题意。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 分子中只有极性键
B. 分子中N≡C键的键长大于C—C键的键长
C. 分子中含有2个σ键和4个π键
D. 可以和氢氧化钠溶液发生反应
解析:分子中N≡C键是极性键,C—C键是非极性键;成键原子半径越小,键长越 短,N原子半径小于C原子半径,故N≡C键比C—C键的键长短;(CN)2分子中含有3 个σ键和4个π键;由于与卤素性质相似,故可以和氢氧化钠溶液反应。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. H2S分子中两个共价键的键角接近90°的原因是共价键有方向性
B. N2分子中有1个σ键,2个π键
C. 两个原子形成的共价键中只有1个σ键,其他为π键
D. 在碳碳双键中,σ键的牢固程度小于π键
解析:S原子的价电子排布式是3s23p4,有2个未成对电子,当与2个H原子配对成键 时,形成的2个共价键间夹角接近90°,这体现了共价键的方向性,是由轨道的伸展 方向决定的,A正确;N2的结构式为N≡N,分子中有共价三键,其中有1个σ键,2个π 键,B正确;两个原子形成的共价键,只有一个σ键,其余为π键,C正确;σ键的重叠 程度比π键大,故σ键比π键牢固,D错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A. ②⑤⑥ B. ①②⑤⑥ C. ②③④ D. ②④⑥
解析:①NH3中存在H—N键,只有σ键,故错误;②N2的结构式为N≡N,含有σ键和π 键,N与N之间为非极性键,故正确;③H2O中只存在H—O σ键,故错误;④HCl中只 存在H—Cl σ键,故错误;⑤C2H4结构式为 ,分子中的氢原子和碳原子之 间存在共价单键、碳碳之间存在共价双键,含有σ键和π键,C与C之间为非极性键, 故正确;⑥C2H2结构式为H—C≡C—H,分子中的氢原子和碳原子之间存在共价单 键、碳碳之间存在共价三键,所以含有σ键和π键,C与C之间为非极性键,故正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 分子中含8个σ键
B. 分子式为C3H2O3
C. 分子中只有极性键
D. 8.6 g该物质完全燃烧得到6.72 L CO2(标准状况)
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. N2+3H2 2NH3
B. 2C2H2+5O2 2H2O+4CO2
C. Cl2+H2 2HCl
D. C2H4+H2 C2H6
解析:氮气中断裂π键,故A不符合题意;乙炔中π键断裂,故B不符合题意;氯气、 氢气中均为σ键断裂,故C符合题意;乙烯中π键断裂,故D不符合题意。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 硝基胍分子中只含有极性键,不含非极性键
B. N原子间只能形成σ键
C. 硝基胍分子中σ键与π键的个数比是4∶1
D. 10.4 g硝基胍中含有1.1×6.02×1023个原子
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 为使该转化成功进行,Y可以是酸性KMnO4溶液
B. 等物质的量的T、X分子中含有π键的数目均为NA
C. X分子中含有的σ键个数是T分子中含有的σ键个数的2倍
D. T分子中只含有极性键,X分子中既含有极性键又含有非极性键
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:由结构模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,Y为氧化 剂,可以选择氧化性较强的酸性KMnO4溶液,A项正确;要注意等物质的量并不一定 是1 mol,B项错误;X分子中含有的σ键个数为 5,T分子中含有的σ键个数为3,C项 错误;T、X分子中均只含有极性键,无非极性键,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13. 有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2。
①③
②④
⑦
⑤⑥⑧
①②③⑥⑦⑧
④⑤
⑦
①③⑤⑥
⑧
②④⑤⑥
⑧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:由题意可知,A+为Na+,B2-为O2-。
Na
离子
离子
非极性(或
共价)
极性
离子
极性(或共价)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:除共价单键全部为σ键外,双键中有一个为σ键,另一个为π键,三键中有 一个为σ键,另两个为π键,故该有机物分子中σ键总数为7,π键总数为3。
7
3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
第2章 微粒间相互作用与物质性质
第1节 共价键模型
第1课时 共价键的形成与特征 共价键的类型
第*页
研习任务一 共价键的形成与特征
[目标导航]1.熟知共价键的概念与形成,知道共价键的特征——具有饱和性和方向 性。2.能够从不同的角度对共价键分类,会分析σ键和π键的形成及特点。3.会判断极 性共价键和非极性共价键。
教材 认知
1. 氢分子中共价键(H—H)的形成
项目 用电子云
表示形成过程 能量变化
相距
较远时
1s1相互靠拢1s1 体系的能量 等于 两个氢原子的能量之和(能量 最高不稳定)
原子轨
道重叠
原子轨道相互重叠 两原子逐渐接近时,原子轨道部分重叠,体系能量 逐渐 ◆◆◆ 降低
等于
降低
项目 用电子云
表示形成过程 能量变化
形成
共价键
形成氢分子的
共价键(H—H) 原子轨道重叠,两个单电子以自旋状态不同的方式 形成 共用电子对 即形成共价键(核间距为 0.074 nm时,能量最低)
共用电子对
2. 共价键的形成
概念 原子间通过 共用电子 形成的化学键
本质 高概率出现在两个原子核之间的电子与两个原子核之间的 电性 作用
形成
元素 通常电负性相同或差值小的 非金属元素原子之间 形成共价键
表示
方法 ①用一条短线表示由 一对共用电子 所形成的共价键,如H—H
②用“ ”表示原子间共用 两对电子 所形成的共价键,如C C
③用“≡”表示原子间共用 三对电子 所形成的共价键,如C≡C
共用电子
电性
非金属元素原子之间
一对共用电子
两对电子
三对电子
3. 共价键的特征
特征 概念 作用
饱和性 每个原子所能形成的共价键的 总 数 或以共价键连接的 原子数目 是一定的 共价键的饱和性决定着原子形成分子 时相互结合的 数量 关系
方向性 共价键将尽可能沿着 电子出现概率最大 的方向形成,这就是共价键的方向性 共价键的方向性决定分子的 空间结
总
数
原子数目
数量
电子出现概率
最大
空间结
构
[思考] 共价键是有饱和性和方向性的,共价键的饱和性是由 决定的,共价键的 方向性是由 决定的,共价键的强弱与 有关。
提示:成键原子的未成对电子数 成键原子的轨道的方向性 原子轨道的重叠程度
判断
×
√
×
×
√
探究 活动
下面是五种元素原子电负性的数值:
元素符号 H C O Na Cl
电负性 2.1 2.5 3.5 0.9 3.0
从原子电负性的角度分析为什么钠、氯通过得失电子形成的电子对不被钠原子和氯原 子共用形成共价键而形成离子键?氢和氯原子间、碳和氧原子间的共用电子对可以被 两原子共用而形成共价键吗?由此你得出的结论是什么?
提示:钠、氯电负性之差(绝对值)为2.1>1.7,故Na和Cl之间通过得失电子形成的 是Na+和Cl-,Na+与Cl-形成的是离子键。氢、氯电负性之差为0.9,碳、氧电负性 之差为1,均小于1.7,故氢、氯之间形成的电子对被共用,碳、氧之间形成的电子对 也被共用,能形成共价键。由此得出的结论是:①当原子的电负性相差很大(一般大 于1.7)时,原子间形成的电子对不会被共用,形成的是离子键;②当原子的电负性 相差不大(一般小于1.7)时,原子间形成的电子对能被共用,形成的是共价键。
重点 讲解
1. 共价键的饱和性
(1)按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋 状态相反的电子配对成键,这就是共价键的饱和性。
(2)用轨道表示式表示HF分子中共用电子对的形成如下:
F原子与H原子间只能形成1个共价键,所形成的简单化合物为HF而不是H2F。同理, H原子、F原子分别只能形成H2、F2,不能形成H3、F3。
(3)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
2. 共价键的方向性
(1)共价键的方向性解释:共价键形成时,两个参与成键的原子轨道总是尽可能沿 着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现的概率 越大,形成的共价键就越牢固。电子所在的原子轨道都有一定的形状,所以要达到最 大重叠,共价键必然有方向性。
(2)共价键的方向性决定了分子的空间结构,并不是所有共价键都具有方向性,如 两个s轨道上的电子形成的共价键就没有方向性。
研习 经典
A. 共用电子在两原子核之间高概率出现
B. 共用的电子必须配对
C. 成键后体系能量降低,趋于稳定
D. 两原子核体积大小要适中
解析:成键原子之间以共用电子结合,形成稳定的共价键后体系能量降低,共用电子 在两原子核之间高概率出现是共价键的成键因素,A、B、C正确;成键原子的原子核 体积的大小对共价键的形成没有影响,D错误。
D
A. Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B. H2O与H2S 的空间结构一样是由共价键的饱和性决定的
C. 并非所有的共价键都有方向性
D. 两原子轨道发生重叠后,电子在两核间出现的概率减小
解析:Cl2是双原子分子,H2S是三原子分子,这是由共价键的饱和性决定的,A不正 确;H2O与H2S的空间结构一样是由共价键的方向性决定的,B不正确;氢气中的共价 键没有方向性,C正确;两原子轨道发生重叠后,电子在两核间出现的概率增大,D 不正确。
C
A. 由①到④,电子在核间区域出现的概率增大
B. 由④到⑤,需要由外界提供能量
C. 有催化剂存在时,若键的键长增大,则键能也增大
D. 两个氢原子的核间距从无穷远到0.074 nm的过程是成键过程,对外释放能量
C
解析:共价键的本质就是高概率地出现在原子核间的电子与原子核间的电性作用,所 以由①到④,电子在核间出现的概率增加,故A正确;④为稳定状态,通过吸收能量 变为⑤,因此需要由外界提供能量,故B正确;催化剂不能改变键长和键能,故C错 误;根据能量越低越稳定,氢气是稳定的状态,则两个氢原子的核间距从无穷远到 0.074 nm的过程是成键过程,形成新键释放能量,故D正确。
(1)共价键的饱和性决定了分子的组成,共价键的方向性决定了分子的空间结构。所有的共价键都具有饱和性,但并不是所有的共价键都具有方向性,如两个s轨
道重叠形成的共价键就没有方向性。
(2)共价键的存在
①非金属单质分子中(稀有气体除外),如O2、Cl2等。
②非金属元素形成的化合物中,如HClO、HCl、有机物分子等。
③某些金属与非金属元素形成的化合物中,如AlCl3、BeCl2等。
④某些离子化合物中,如NaOH、NaClO等。
第*页
研习任务二 共价键的类型
教材 认知
1. σ键与π键
(1)σ键
①定义
头碰头
②类型
形成 成键原子的s轨道或p轨道“ 头碰头 ”重叠而形成
类型 s-s型
s-p型
p-p型
头碰头
(2)π键
①定义
②p-p π键的形成
形成 由两个原子的p轨道“ 肩并肩 ”重叠形成
p-p型
肩并肩
肩并肩
2. 极性键和非极性键
(1)分类标准:共用电子是否偏移。
类型 形成元素 共用电子对偏移 原子电性
非极
性键 同种元素 两原子电负性相同,
共用电子 不偏移 两原子都不显电性
极性键 不同种元素 共用电子偏向电负
性 较大 的原子 电负性较大的原子显 电性,
电负性较小的原子显 正电性
同种
不偏移
不同种
较
大
负
正
大
判断
√
√
×
×
探究 活动
下面是乙烷、乙烯、乙炔的球棍模型和空间填充模型:
乙烷 乙烯 乙炔
1. 仔细观察乙烷、乙烯、乙炔的分子结构,指出它们分子中的共价键分别由几个σ键 和几个π键构成?
提示:
物质
共价键类别 乙烷 乙烯 乙炔
σ键数目 7 5 3
π键数目 0 1 2
物质
共价键类别
乙烷
乙烯
乙炔
σ键数目
7
5
3
π键数目
0
1
2
2. 乙烯和乙炔的化学性质为什么比乙烷活泼呢?
提示:乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠 程度小,不稳定,容易断裂;而乙烷中没有π键,σ键稳定,不易断裂。
3. H原子和H原子、H原子和Cl原子、Cl原子和Cl原子分别均以σ键结合成H2、HCl和 Cl2分子,共价键轨道完全相同吗?
提示:不相同。H原子的未成对电子位于1s轨道,Cl原子的未成对电子位于3p轨道, 即H原子和H原子成键以1s和1s轨道重叠,H原子和Cl原子以1s和3p轨道重叠,Cl原子 和Cl原子以3p和3p轨道“头碰头”重叠。
重点 讲解
1. 共价键的分类
分类依据 类型及特点
形成共价键的原子轨道重叠方式 σ键 原子轨道“头碰头”重叠
π键 原子轨道“肩并肩”重叠
形成共价键的电子对是否偏移 极性键 共用电子对发生偏移
非极性键 共用电子对不发生偏移
原子间共用电子对的数目 单键 原子间有一对共用电子对
双键 原子间有两对共用电子对
三键 原子间有三对共用电子对
2. σ键与π键的对比
项目 σ键 π键
定义 未成对电子的原子轨道采取 “头碰头”的方式重叠形成的共价键 未成对电子的原子轨道采取“肩并 肩”的方式重叠形成的共价键
类型 s-s σ键、s-p σ键、
p-p σ键 p-p π键
特征
(电子云形状) 原子轨道重叠部分沿键轴呈轴对称 原子轨道重叠部分分别位于两原子核构成平面的两侧,互为镜像对称
项目 σ键 π键
键的性质 σ键可沿键轴自由旋转,不易 断裂,稳定 π键不能旋转,易断裂,不稳定
存在的情况 能单独存在,可存在于任何含共价键的分子中 不能单独存在,必须与σ键共存,可存 在于双键和三键中
实例 CH4中只有σ键
示意图
(1)s轨道与s轨道重叠形成σ键时,电子不是只在两核间运动,而是 在两核间出现的概率较大。
(2)因s轨道是球形的,故s轨道和s轨道形成σ键时,无方向性。两个s轨道只能形成σ 键,不能形成π键。
(3)两个原子间可以只形成σ键,但不能只形成π键。
3. σ键与π键的判断
由物质的
结构式判断 通过物质的结构式可以快速有效地判断共价键的种类及数目。共价 单键全为σ键,双键中有一个σ键和一个π键,三键中有一个σ键和两 个π键
由成键轨道
类型判断 s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ 键,形成π键的电子不占据杂化轨道
4. 乙烷、乙烯、乙炔成键分析
名称 乙烷 乙烯 乙炔
球棍模型
空间填充模型
碳碳键成键方式 1个σ键 1个σ键、1个π键 1个σ键、2个π键
5. 极性键与非极性键的比较
共价键 极性共价键 非极性共价键
成键原子 不同种元素的原子 同种元素的原子
电子对 发生偏移 不发生偏移
成键原子
的电性 电负性弱的原子呈正电性(δ+), 电负性强的原子呈负电性(δ-) 电中性
示例 H2、O2、Cl2
研习 经典
①s-s σ键与s-p σ键的电子云对称性不同
②π键不能单独存在,一定要和σ键共存
③含有π键的化合物与只含σ键的化合物的化学性质不同
④两个非金属元素的原子之间形成的化学键是共价键
⑤分子中含有共价键,则一定只含有1个σ键
⑥成键的原子间原子轨道重叠程度越大,共价键越牢固
⑦1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
A. 1个 B. 2个 C. 3个 D. 4个
B
解析:s-s σ键与s-p σ键的对称性相同,均为轴对称,①错误;分子中可以只含σ 键,π键不能单独存在,一定要和σ键共存,②正确;π键不稳定,易断裂,含有π键的 化合物化学性质较活泼,与只含σ键的化合物的化学性质不同,③正确;非金属原子 常以共用电子对形成化学键,两个非金属元素的原子之间形成的化学键是共价键,④ 正确;分子中含有共价键,不一定只含有1个σ键,如水分子中含有2个σ键,⑤错误; 成键的原子间原子轨道重叠程度越大,成键原子间的距离越小,共价键越牢固,⑥正 确;N原子最外层有5个电子,有3个未成对电子,1个N原子最多只能与3个H原子结 合形成NH3分子,是由共价键的饱和性决定的,⑦正确。
A. 所有的σ键的强度都比π键大
B. σ键是原子轨道“头碰头”式重叠,π键是原子轨道“肩并肩”式重叠
C. s-sσ键与s-pσ键的电子云形状的对称性相同
D. σ键可以绕键轴旋转,π键一定不能绕键轴旋转
解析:一般情况下,σ键的强度比π键大,但也有特殊情况,如N≡N中σ键的强度比π键 小,A错误;σ键电子云重叠程度较大,是原子轨道“头碰头”式重叠,π键电子云重 叠程度较小,是原子轨道“肩并肩”式重叠,B正确;σ键有方向性,两个成键原子 必须沿着对称轴方向接近,才能达到最大重叠,s-sσ键与s-pσ键都是轴对称的,C 正确;σ键为单键,可以绕键轴旋转,π键在双键、三键中存在,不能旋转,D正确。
A
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A. ①②③ B. ③④⑤⑥ C. ①③⑥ D. ③⑤⑥
解析:HCl、H2O、H2O2的结构式分别为 、 、 ,分子中 不含π键;N2、C2H4、C2H2的结构式分别为 、 、 ,分子 中既有σ键又有π键。
D
4. (1)现有以下物质:A. HF B. Br2 C. H2O
D. N2 E. C2H4 F. C2H6 G. H2 H. H2O2
I. H—C N J. CO2 K. HCHO
DEIJK
ACEFHIK
饱和
方向
(2)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大不 同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不能形成π键。从原子半径 大小的角度分析,为何C、O原子间能形成π键,而Si、O原子间不能形成π键?
答:C原子半径较小,C、O原子能充分接近,p-p轨道“肩并肩”重叠程度较大,能形成较稳定的π键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道“肩并肩”重叠程度较小,不能形成稳定的π键。
解析:Br2、H2、HF、H2O、H2O2、C2H6中均只含σ键;N2分子中含σ键和π键;C2H4 含双键;H—C N分子中含单键、三键;CO2分子中含两个双键;HCHO分子中含 有一个双键。含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键是指由H原 子与其他原子形成的共价键。
①H2 ②HCl ③NH3 ④H2O2 ⑤CO2 ⑥CCl4 ⑦C2H6
解析:同种元素的原子间形成非极性键,不同种元素的原子间形成极性键,H2O2的2 个氧原子间存在非极性键,C2H6分子中碳原子间存在非极性键。
②③⑤⑥
①
④⑦
A. 在离子化合物中不可能存在非极性键
B. 在共价化合物中不可能存在离子键
C. 不同种非金属原子组成的多原子分子中的化学键一定全部是极性共价键
D. 非极性键只存在于双原子单质分子里
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. H2O2(过氧化氢):H—O O—H
B. N2H4(肼):
C. C2H5SH(乙硫醇):
D. SiHCl3(三氯氢硅):
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 分子中只要含有共价键,则至少含有一个σ键
B. s-s σ键、p-p σ键与s-p σ键都是轴对称的
C. p-p σ键和p-p π键的重叠方式是相同的
D. 含有π键的化合物与只含σ键的化合物的化学性质不同
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 若把H2S写成H3S,违背了共价键的饱和性
B. H3O+的存在说明共价键不具有饱和性
C. 成键原子中自旋状态相同的未成对电子可以形成共用电子对
D. 两个原子轨道发生重叠后,两核中的电子不仅存在于两核之间,还会绕两核运动
解析:硫原子有两个未成对电子,根据共价键的饱和性,形成的氢化物为H2S,A项 正确;H2O能结合1个H+形成H3O+,不能说明共价键不具有饱和性,B项错误;成键 原子中自旋状态相同的未成对电子不能形成共用电子对,C项错误;两个原子轨道发 生重叠后,只有共用电子对在两核之间绕两个原子核运动,D项错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. HF H2O NH3 CH4
B. CH4 NH3 H2O HF
C. H2O HF CH4 NH3
D. HF H2O CH4 NH3
解析:共价键极性的强弱取决于形成共价键的两原子的电负性差值,其电负性相差越 大,形成的共价键极性越强,A项符合题意。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 分子中只有极性键
B. 分子中N≡C键的键长大于C—C键的键长
C. 分子中含有2个σ键和4个π键
D. 可以和氢氧化钠溶液发生反应
解析:分子中N≡C键是极性键,C—C键是非极性键;成键原子半径越小,键长越 短,N原子半径小于C原子半径,故N≡C键比C—C键的键长短;(CN)2分子中含有3 个σ键和4个π键;由于与卤素性质相似,故可以和氢氧化钠溶液反应。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. H2S分子中两个共价键的键角接近90°的原因是共价键有方向性
B. N2分子中有1个σ键,2个π键
C. 两个原子形成的共价键中只有1个σ键,其他为π键
D. 在碳碳双键中,σ键的牢固程度小于π键
解析:S原子的价电子排布式是3s23p4,有2个未成对电子,当与2个H原子配对成键 时,形成的2个共价键间夹角接近90°,这体现了共价键的方向性,是由轨道的伸展 方向决定的,A正确;N2的结构式为N≡N,分子中有共价三键,其中有1个σ键,2个π 键,B正确;两个原子形成的共价键,只有一个σ键,其余为π键,C正确;σ键的重叠 程度比π键大,故σ键比π键牢固,D错误。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A. ②⑤⑥ B. ①②⑤⑥ C. ②③④ D. ②④⑥
解析:①NH3中存在H—N键,只有σ键,故错误;②N2的结构式为N≡N,含有σ键和π 键,N与N之间为非极性键,故正确;③H2O中只存在H—O σ键,故错误;④HCl中只 存在H—Cl σ键,故错误;⑤C2H4结构式为 ,分子中的氢原子和碳原子之 间存在共价单键、碳碳之间存在共价双键,含有σ键和π键,C与C之间为非极性键, 故正确;⑥C2H2结构式为H—C≡C—H,分子中的氢原子和碳原子之间存在共价单 键、碳碳之间存在共价三键,所以含有σ键和π键,C与C之间为非极性键,故正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 分子中含8个σ键
B. 分子式为C3H2O3
C. 分子中只有极性键
D. 8.6 g该物质完全燃烧得到6.72 L CO2(标准状况)
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. N2+3H2 2NH3
B. 2C2H2+5O2 2H2O+4CO2
C. Cl2+H2 2HCl
D. C2H4+H2 C2H6
解析:氮气中断裂π键,故A不符合题意;乙炔中π键断裂,故B不符合题意;氯气、 氢气中均为σ键断裂,故C符合题意;乙烯中π键断裂,故D不符合题意。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 硝基胍分子中只含有极性键,不含非极性键
B. N原子间只能形成σ键
C. 硝基胍分子中σ键与π键的个数比是4∶1
D. 10.4 g硝基胍中含有1.1×6.02×1023个原子
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 为使该转化成功进行,Y可以是酸性KMnO4溶液
B. 等物质的量的T、X分子中含有π键的数目均为NA
C. X分子中含有的σ键个数是T分子中含有的σ键个数的2倍
D. T分子中只含有极性键,X分子中既含有极性键又含有非极性键
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:由结构模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,Y为氧化 剂,可以选择氧化性较强的酸性KMnO4溶液,A项正确;要注意等物质的量并不一定 是1 mol,B项错误;X分子中含有的σ键个数为 5,T分子中含有的σ键个数为3,C项 错误;T、X分子中均只含有极性键,无非极性键,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13. 有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2。
①③
②④
⑦
⑤⑥⑧
①②③⑥⑦⑧
④⑤
⑦
①③⑤⑥
⑧
②④⑤⑥
⑧
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:由题意可知,A+为Na+,B2-为O2-。
Na
离子
离子
非极性(或
共价)
极性
离子
极性(或共价)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:除共价单键全部为σ键外,双键中有一个为σ键,另一个为π键,三键中有 一个为σ键,另两个为π键,故该有机物分子中σ键总数为7,π键总数为3。
7
3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
