鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质第2节共价键与分子的空间结构第3课时分子的空间结构与分子性质课件(共54张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质第2节共价键与分子的空间结构第3课时分子的空间结构与分子性质课件(共54张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览










文档简介
(共54张PPT)
第2章 微粒间相互作用与物质性质
第2节 共价键与分子的空间结构
第3课时 分子的空间结构与分子性质
第*页
研习任务一 分子的对称性
[目标导航]1.知道手性分子的概念,会判断不对称碳原子。2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法,并据此对分子的一些典型性质及其应用作出解释。
教材 认知
1. 对称分子
(1)概念
(3)与分子性质的关系
对称轴
对称面
对称
极性
角度
重叠
手性
单键
不相同
判断
√
√
√
√
探究 活动
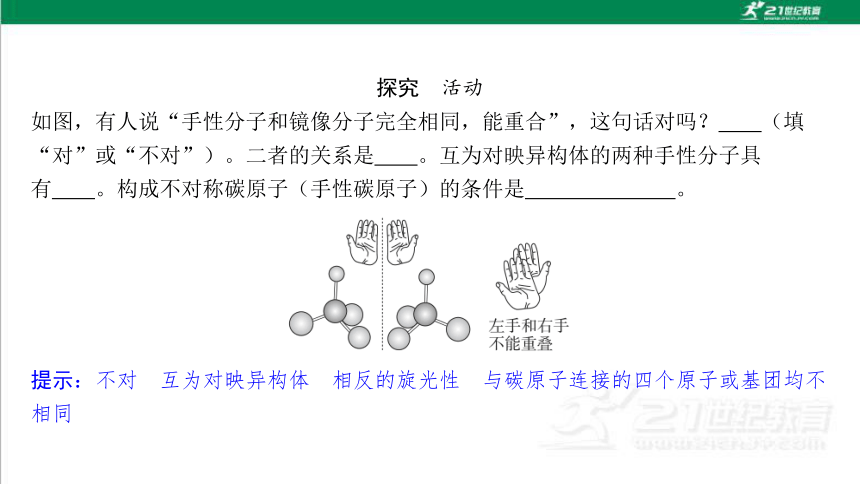
如图,有人说“手性分子和镜像分子完全相同,能重合”,这句话对吗? (填 “对”或“不对”)。二者的关系是 。互为对映异构体的两种手性分子具 有 。构成不对称碳原子(手性碳原子)的条件是 。
提示:不对 互为对映异构体 相反的旋光性 与碳原子连接的四个原子或基团均不 相同
研习 经典
A. 互为对映异构体的分子互为镜像
B. 利用手性催化剂可主要得到一种手性分子
C. 对映异构体分子组成相同
D. 对映异构体性质相同
解析:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像, 却在三维空间里不能重叠,互为对映异构体,但对映异构体的分子结构不同,其性质 也不完全相同,故A、C正确,D项不正确;在手性合成中,与催化剂手性匹配的分子 在反应过程中会与手性催化剂形成一种最稳定的过渡态,从而只诱导生成一种手性分 子,故B正确。
D
A. CH2Cl2 B. CH3CH2OH
C. CH3CH(CH3)2 D. CH3CH(CH3)CHClCOOH
解析:CH3CH(CH3)CHClCOOH分子中,有一个碳原子所连的四个基团分别是羧 基、异丙基、氢原子和氯原子。
D
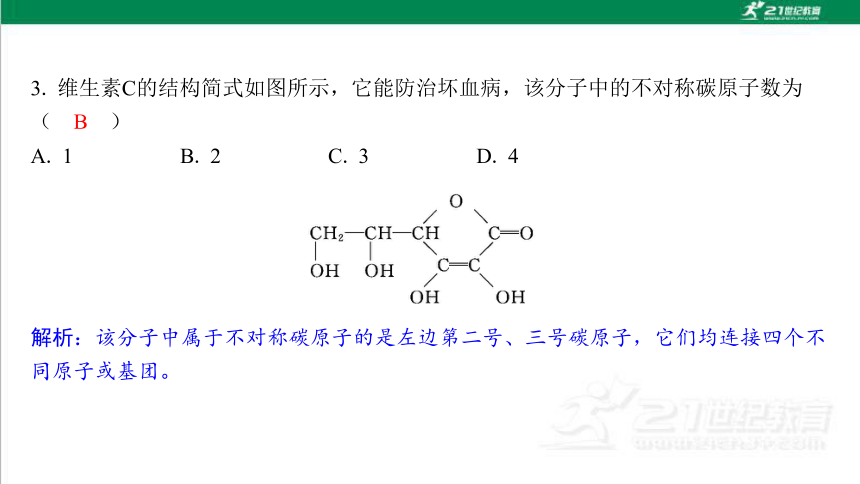
A. 1 B. 2 C. 3 D. 4
解析:该分子中属于不对称碳原子的是左边第二号、三号碳原子,它们均连接四个不 同原子或基团。
B
解析:题给有机物中与—OH相连的碳原子为不对称碳原子,具有手性,与H2加成 后,该碳原子连有两个乙基,不再具有手性。
具有
不具有
第*页
研习任务二 分子的极性
教材 认知
1. 极性分子与非极性分子
(1)极性分子:分子内存在正、负两极的分子。
(2)非极性分子:分子内不存在正、负两极的分子。
2. 分子极性的判断
非极性
极性
非极性
极性
非极性
[思考] 在HF、H2O、NH3、CS2、CH4、N2分子中,以非极性键结合的非极性分子 是 ;以极性键结合的具有直线形结构的非极性分子是 ;以极性键结合的具有 正四面体形结构的非极性分子是 。
提示:N2 CS2 CH4。
CS2与CO2相似,是以极性键结合的直线形非极性分子;CH4中碳原子与氢原子形成极 性键,为正四面体结构,是非极性分子;N2是由非极性键结合的非极性分子。
√
×
×
×
×
探究 活动
(1)下列是九种物质的结构:
①上述九种物质中含非极性共价键的物质有哪些?
②上述九种物质中,哪些是非极性分子?哪些是极性分子?
提示:①P4中的P—P为非极性共价键,C60中的C—C为非极性共价键。
②P4、C60、CO2、BF3、CH4为非极性分子,HCN、H2O、NH3、CH3Cl为极性分子。
(2)已知H2O2分子的空间结构可在二面角中表示,如图所示:
①H2O2分子中共价键的类型有哪些?
②H2O2分子中正、负电荷重心是否重合?H2O2属于极性分子还是非极性分子?
提示:①H2O2分子中H—O为极性共价键,O—O为非极性共价键。
②不重合;H2O2属于极性分子。
重点 讲解
1. 非极性分子和极性分子
类型 非极性分子 极性分子
形成原因 正、负电荷
重心重合的分子 正、负电荷重心不重合的分子,使分子的某一部分呈正电性(δ+),另一部分呈负电性(δ-)
存在的共价键 非极性键或极性键 非极性键或极性键
分子内原子排列 对称 不对称
示例 P4、CO2 H2O、CH3Cl
2. 键的极性与分子的极性关系
3. 键的极性对化学性质的影响
(1)羧酸酸性与pKa的关系
羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
(2)羧酸的酸性大小与分子组成和结构的关系
①酸性强弱顺序
a.氟乙酸>氯乙酸>溴乙酸>碘乙酸
b.三氯乙酸>二氯乙酸>一氯乙酸
c.三氟乙酸>三氯乙酸>三溴乙酸>三碘乙酸
d.甲酸>乙酸>丙酸>丁酸
②原因解释(以三氟乙酸>三氯乙酸为例)
由于氟的电负性大于氯,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C— 的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+,故酸性:三氟 乙酸>三氯乙酸。
③烃基(R—)对羧酸酸性的影响
烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越 小,羧酸的酸性越弱,故酸性:甲酸>乙酸>丙酸>丁酸。
4. 分子极性的判断方法
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子。如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子。如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的 是极性分子。
①化合价法:ABm型分子中,中心原子的化合价的绝对值等于该元素的价电子数时, 该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等 于其价电子数,则分子的空间结构不对称,其分子为极性分子,具体实例如下:
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
中心原子化合价绝对值 3 4 5 6 2 3 4
中心原子价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
②ABn型分子极性的经验规律
a.若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若 不等,则为极性分子。
b.若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
(4)根据分子所含键的类型及分子空间结构判断
分子所含原子个数 键的极性 键角 空间结构 分子极性
单原子 He、Ne — — — 非极性分子
双原子 H2 非极性键 — 直线形 非极性分子
HCl 极性键 — 直线形 极性分子
三原子 H2O 极性键 104.5° 角形 极性分子
CO2 极性键 180° 直线形 非极性分子
四原子 BF3 极性键 120° 平面三角形 非极性分子
NH3 极性键 107.3° 三角锥形 极性分子
五原子 CH4 极性键 109°28' 正四面体形 非极性分子
CH3Cl 极性键 — 四面体形 极性分子
研习 经典
A. 极性分子构成的溶质一定易溶于极性溶剂,非极性分子构成的溶质一定易溶于非 极性溶剂
B. Br2和H2O均是极性分子,CCl4是非极性分子,所以Br2难溶于H2O而易溶于CCl4
C. CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于CS2
D. H2O是极性分子,CO2可溶于H2O,因此CO2是极性分子
C
解析:“相似相溶”规律是经验规律,存在特殊情况,部分有机物分子是极性分子, 但因为极性很弱,所以大部分难溶于水,故A错误;Br2是非极性分子,H2O是极性分 子,CCl4是非极性分子,根据“相似相溶”,Br2难溶于H2O而易溶于CCl4,故B错 误;CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于 CS2,故C正确;CO2是非极性分子,CO2溶于H2O时,部分与H2O反应生成H2CO3,故 D错误。
A. CH4 B. CO2 C. SO3 D. NH3
解析:CH4空间结构为正四面体,结构对称,属于非极性分子;CO2空间结构为直线 形,结构对称,属于非极性分子;SO3空间结构为平面三角形,结构对称,属于非极 性分子;NH3空间结构为三角锥形,结构不对称,正、负电荷重心不重合,属于极性 分子,故选D。
D
3. 在①HF、②H2O、③NH3、④CS2、⑤CH4、⑥N2、⑦BF3分子中:
⑥
④
⑤
③
②
⑦
课时作业
A. CH4 B. C2H4 C. C2H2 D. CH3CH(Cl)Br
解析:当一个碳原子所连接的四个原子或基团都不相同时,这个碳原子为不对称碳原 子,又称手性碳原子,具有不对称碳原子的分子既没有对称轴,也没有对称面,是不 对称分子,没有对称性。D项中物质分子的结构可表示为 ,没有对称性。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. B.
C. D.
C
解析:A、B、D三项中化合物均只含有1个不对称碳原子,C项中 标*的为不 对称碳原子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. SO2 B. NH3 C. BBr3 D. COCl2
解析:根据价电子对互斥模型可得四种分子的结构如下:
、 、 、 。SO2、NH3分子中含有极性键,正负 电荷重心不重合,为极性分子;C项,虽然BBr3分子中含有极性键,空间结构为平面 三角形,正负电荷重心重合,为非极性分子;D项,COCl2分子中正、负电荷的重心 不重合,为极性分子。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. SO2 B. HCHO C. CCl4 D. C2H5OH
解析:SO2、HCHO、C2H5OH均为极性分子,H2O也为极性分子,根据“相似相溶” 原理,它们均易溶于水,CCl4为非极性分子,难溶于水。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. CH4和H2O B. CO2和HCl
C. NH3和H2S D. HCN和BF3
解析:NH3是呈三角锥形的极性分子;CO2是呈直线形的非极性分子;H2O、H2S都是 呈角形的极性分子;HCl、HCN都是呈直线形的极性分子;CH4是呈正四面体形的非 极性分子,BF3是呈平面三角形的非极性分子。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不处在2个H原子连线的中央
D. CO2是非极性分子,分子中C原子不处在2个O原子连线的中央
解析:NH3中的N原子采取sp3杂化,形成三角锥形结构,是极性分子;CCl4分子中 C—Cl键为极性键,碳原子采取sp3杂化,且无孤电子对,空间结构为正四面体形,碳 原子位于正四面体的中心;H2O分子中H—O键为极性键,氧采取sp3杂化,且有两对 孤电子对,空间结构为角形,为极性分子;CO2分子中碳采取sp杂化,空间结构为直 线形,为非极性分子,碳原子位于2个氧原子连线的中央。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. CCl4与I2的相对分子质量相差较小,而H2O与I2的相对分子质量相差较大
B. CCl4与I2都是直线形分子,而H2O不是直线形分子
C. CCl4和I2都不含氢元素,而H2O中含氢元素
D. CCl4和I2都是非极性分子,而H2O是极性分子
解析:因水分子为极性分子,CCl4、I2分子均为非极性分子,根据“相似相溶”原 理,碘单质在水中的溶解度很小,但在CCl4中的溶解度很大,故选D。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 卤化氢易溶于水,也易溶于CCl4
B. 白磷(P4)易溶于CS2,但难溶于水
C. 碘易溶于苯,微溶于水
D. NaCl易溶于水,难溶于CCl4
解析:卤化氢、水是极性分子,CCl4、P4、CS2、碘、苯都是非极性分子,根据“相 似相溶”原理,卤化氢难溶于CCl4。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①乳酸[CH3CH(OH)COOH]
②2-丁醇[CH3CH(OH)CH2CH3]
③
④丙三醇( )
A. 只有① B. ①和② C. ①②③ D. ①②③④
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 二者互为同分异构体
B. 二者是同一物质
C. 二者是手性分子
D. 二者互为同系物
解析:手性分子中应含有不对称碳原子,即同一个碳原子上连有四个不同的原子或基 团,所以二者不是手性分子;二者的分子式相同,结构也相同,故二者是同一物质。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. T元素有一种单质的空间结构为正四面体形
B. ZQ分子中含有1个σ键和2个π键
C. X和Q元素能形成两种只含极性键的极性分子
D. Z与X、Q元素均能形成直线形非极性分子
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:X元素原子的M能层的p轨道上有两个未成对电子且无空轨道,X为硫元素;Z 元素原子的L能层的p轨道有一个空轨道,Z为碳元素;Q元素原子的L能层的p轨道上 只有一对成对电子,Q为氧元素;T元素原子M能层上p轨道有3个未成对电子,T为磷 元素。白磷的空间结构为正四面体形,A正确;CO与N2分子互为等电子体,CO与N2 具有相同的结构,故CO的结构式为C≡O,其中含有1个σ键和2个π键,B正确;SO2为 角形分子,属于极性分子,SO3为平面三角形结构,属于非极性分子,C错误;CS2与 CO2互为等电子体,两者结构相似,为直线形分子,属于非极性分子,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12. 在HF、H2S、NH3、CO2、CCl4、N2、C60、SO2分子中:
解析:HF是以极性键形成的极性分子;H2S中心原子S的孤电子对数为2,成键电子对 数为2,价电子对数为4,S原子sp3杂化,空间结构为角形分子,H2S是极性键形成的 极性分子;NH3中心原子N的孤电子对数为1,成键电子对数为3,价电子对数为4,N 原子sp3杂化,NH3为三角锥形结构,NH3是极性键形成的极性分子;CO2中心原子C 的孤电子对数为0,成键电子对数为2,价电子对数为2,C原子sp2杂化,CO2为直线形 结构,CO2是极性键形成的非极性分子;CCl4中心原子C的孤电子对数为0,成键电子 对数为4,价电子对数为4,C原子sp3杂化,CCl4为正四面体结构,CCl4是极性键形成 的非极性分子;N2是非极性键形成的非极性分子;C60是非极性键形成的非极性分 子;SO2中心原子S的孤电子对数为1,成键电子对数为2,价电子对数为3,S原子sp2 杂化,SO2为角形结构,SO2是极性键形成的极性分子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:(1)以非极性键相结合的非极性分子是N2、C60。
解析:(2)以极性键相结合,具有直线形结构的非极性分子是CO2。
解析:(3)以极性键相结合,具有正四面体结构的非极性分子是CCl4。
解析:(4)以极性键相结合,具有三角锥形结构的极性分子是NH3。
解析:(5)以极性键相结合,具有角形结构的极性分子是H2S、SO2。
N2、C60
CO2
CCl4
NH3
H2S、SO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:(6)以极性键相结合的极性分子是HF、H2S、NH3、SO2,而且极性最大的分 子是HF。
HF
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13. 在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用d表示。 极性分子的极性强弱与偶极长和电荷量(q)有关,一般用偶极矩(μ)来衡量。分 子的偶极矩是偶极长和电荷量的乘积,即μ=dq。在非极性分子中,其正、负电荷重 心重合,故μ为0。试回答下列问题:
解析:HCl是由极性键形成的极性分子;根据价电子对互斥模型可知,CS2是直 线形分子,正、负电荷重心重合,为非极性分子,其偶极矩为0;H2S、SO2都是角形 结构,是极性分子。
CS2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)实验测得:μ(PF3)=1.03、μ(BCl3)=0。
解析:①μ(PF3)=1.03,说明PF3是极性分子,则PF3是三角锥形结构。
②μ(BCl3)=0,说明BCl3是非极性分子,其正、负电荷重心重合,是平面三角形结 构;B的杂化方式是sp2。
三角锥形
平面三角形
sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分 子,NH3和Cl分别对称分布在四边形的4个顶点上,即正、负电荷重心重合,故淡黄 色化合物的结构简式为 ;若μ>0,则为极性分子,NH3和Cl在四边形的4 个顶点上的分布是不对称的,即正、负电荷重心不重合,故棕黄色化合物的结构简式 为 。根据“相似相溶”原理,水是极性分子,因此属于极性分子的溶质易 溶解在水中,即在水中溶解度较大的是棕黄色化合物,其结构简式为 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14. 已知N、P同属于元素周期表的ⅤA族元素。NH3呈三角锥形,N原子位于锥顶,3 个H原子位于锥底,N—H键间的夹角是107.3°。
解析:N4分子呈正四面体形,是一种非极性分子。
非极性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:NH3分子与PH3分子互为等电子体,结构相似,P—H为不同元素原子之 间形成的共价键,为极性键,PH3分子的空间结构为三角锥形,正、负电荷重心不重 合,为极性分子。
相似
有
有
1
2
3
4
5
6
7
8
9
10
11
12
13
14
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
第2章 微粒间相互作用与物质性质
第2节 共价键与分子的空间结构
第3课时 分子的空间结构与分子性质
第*页
研习任务一 分子的对称性
[目标导航]1.知道手性分子的概念,会判断不对称碳原子。2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法,并据此对分子的一些典型性质及其应用作出解释。
教材 认知
1. 对称分子
(1)概念
(3)与分子性质的关系
对称轴
对称面
对称
极性
角度
重叠
手性
单键
不相同
判断
√
√
√
√
探究 活动
如图,有人说“手性分子和镜像分子完全相同,能重合”,这句话对吗? (填 “对”或“不对”)。二者的关系是 。互为对映异构体的两种手性分子具 有 。构成不对称碳原子(手性碳原子)的条件是 。
提示:不对 互为对映异构体 相反的旋光性 与碳原子连接的四个原子或基团均不 相同
研习 经典
A. 互为对映异构体的分子互为镜像
B. 利用手性催化剂可主要得到一种手性分子
C. 对映异构体分子组成相同
D. 对映异构体性质相同
解析:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像, 却在三维空间里不能重叠,互为对映异构体,但对映异构体的分子结构不同,其性质 也不完全相同,故A、C正确,D项不正确;在手性合成中,与催化剂手性匹配的分子 在反应过程中会与手性催化剂形成一种最稳定的过渡态,从而只诱导生成一种手性分 子,故B正确。
D
A. CH2Cl2 B. CH3CH2OH
C. CH3CH(CH3)2 D. CH3CH(CH3)CHClCOOH
解析:CH3CH(CH3)CHClCOOH分子中,有一个碳原子所连的四个基团分别是羧 基、异丙基、氢原子和氯原子。
D
A. 1 B. 2 C. 3 D. 4
解析:该分子中属于不对称碳原子的是左边第二号、三号碳原子,它们均连接四个不 同原子或基团。
B
解析:题给有机物中与—OH相连的碳原子为不对称碳原子,具有手性,与H2加成 后,该碳原子连有两个乙基,不再具有手性。
具有
不具有
第*页
研习任务二 分子的极性
教材 认知
1. 极性分子与非极性分子
(1)极性分子:分子内存在正、负两极的分子。
(2)非极性分子:分子内不存在正、负两极的分子。
2. 分子极性的判断
非极性
极性
非极性
极性
非极性
[思考] 在HF、H2O、NH3、CS2、CH4、N2分子中,以非极性键结合的非极性分子 是 ;以极性键结合的具有直线形结构的非极性分子是 ;以极性键结合的具有 正四面体形结构的非极性分子是 。
提示:N2 CS2 CH4。
CS2与CO2相似,是以极性键结合的直线形非极性分子;CH4中碳原子与氢原子形成极 性键,为正四面体结构,是非极性分子;N2是由非极性键结合的非极性分子。
√
×
×
×
×
探究 活动
(1)下列是九种物质的结构:
①上述九种物质中含非极性共价键的物质有哪些?
②上述九种物质中,哪些是非极性分子?哪些是极性分子?
提示:①P4中的P—P为非极性共价键,C60中的C—C为非极性共价键。
②P4、C60、CO2、BF3、CH4为非极性分子,HCN、H2O、NH3、CH3Cl为极性分子。
(2)已知H2O2分子的空间结构可在二面角中表示,如图所示:
①H2O2分子中共价键的类型有哪些?
②H2O2分子中正、负电荷重心是否重合?H2O2属于极性分子还是非极性分子?
提示:①H2O2分子中H—O为极性共价键,O—O为非极性共价键。
②不重合;H2O2属于极性分子。
重点 讲解
1. 非极性分子和极性分子
类型 非极性分子 极性分子
形成原因 正、负电荷
重心重合的分子 正、负电荷重心不重合的分子,使分子的某一部分呈正电性(δ+),另一部分呈负电性(δ-)
存在的共价键 非极性键或极性键 非极性键或极性键
分子内原子排列 对称 不对称
示例 P4、CO2 H2O、CH3Cl
2. 键的极性与分子的极性关系
3. 键的极性对化学性质的影响
(1)羧酸酸性与pKa的关系
羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
(2)羧酸的酸性大小与分子组成和结构的关系
①酸性强弱顺序
a.氟乙酸>氯乙酸>溴乙酸>碘乙酸
b.三氯乙酸>二氯乙酸>一氯乙酸
c.三氟乙酸>三氯乙酸>三溴乙酸>三碘乙酸
d.甲酸>乙酸>丙酸>丁酸
②原因解释(以三氟乙酸>三氯乙酸为例)
由于氟的电负性大于氯,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C— 的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+,故酸性:三氟 乙酸>三氯乙酸。
③烃基(R—)对羧酸酸性的影响
烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越 小,羧酸的酸性越弱,故酸性:甲酸>乙酸>丙酸>丁酸。
4. 分子极性的判断方法
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子。如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子。如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的 是极性分子。
①化合价法:ABm型分子中,中心原子的化合价的绝对值等于该元素的价电子数时, 该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等 于其价电子数,则分子的空间结构不对称,其分子为极性分子,具体实例如下:
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
中心原子化合价绝对值 3 4 5 6 2 3 4
中心原子价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
②ABn型分子极性的经验规律
a.若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若 不等,则为极性分子。
b.若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
(4)根据分子所含键的类型及分子空间结构判断
分子所含原子个数 键的极性 键角 空间结构 分子极性
单原子 He、Ne — — — 非极性分子
双原子 H2 非极性键 — 直线形 非极性分子
HCl 极性键 — 直线形 极性分子
三原子 H2O 极性键 104.5° 角形 极性分子
CO2 极性键 180° 直线形 非极性分子
四原子 BF3 极性键 120° 平面三角形 非极性分子
NH3 极性键 107.3° 三角锥形 极性分子
五原子 CH4 极性键 109°28' 正四面体形 非极性分子
CH3Cl 极性键 — 四面体形 极性分子
研习 经典
A. 极性分子构成的溶质一定易溶于极性溶剂,非极性分子构成的溶质一定易溶于非 极性溶剂
B. Br2和H2O均是极性分子,CCl4是非极性分子,所以Br2难溶于H2O而易溶于CCl4
C. CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于CS2
D. H2O是极性分子,CO2可溶于H2O,因此CO2是极性分子
C
解析:“相似相溶”规律是经验规律,存在特殊情况,部分有机物分子是极性分子, 但因为极性很弱,所以大部分难溶于水,故A错误;Br2是非极性分子,H2O是极性分 子,CCl4是非极性分子,根据“相似相溶”,Br2难溶于H2O而易溶于CCl4,故B错 误;CS2和白磷均是非极性分子,H2O是极性分子,所以白磷难溶于H2O而易溶于 CS2,故C正确;CO2是非极性分子,CO2溶于H2O时,部分与H2O反应生成H2CO3,故 D错误。
A. CH4 B. CO2 C. SO3 D. NH3
解析:CH4空间结构为正四面体,结构对称,属于非极性分子;CO2空间结构为直线 形,结构对称,属于非极性分子;SO3空间结构为平面三角形,结构对称,属于非极 性分子;NH3空间结构为三角锥形,结构不对称,正、负电荷重心不重合,属于极性 分子,故选D。
D
3. 在①HF、②H2O、③NH3、④CS2、⑤CH4、⑥N2、⑦BF3分子中:
⑥
④
⑤
③
②
⑦
课时作业
A. CH4 B. C2H4 C. C2H2 D. CH3CH(Cl)Br
解析:当一个碳原子所连接的四个原子或基团都不相同时,这个碳原子为不对称碳原 子,又称手性碳原子,具有不对称碳原子的分子既没有对称轴,也没有对称面,是不 对称分子,没有对称性。D项中物质分子的结构可表示为 ,没有对称性。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. B.
C. D.
C
解析:A、B、D三项中化合物均只含有1个不对称碳原子,C项中 标*的为不 对称碳原子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. SO2 B. NH3 C. BBr3 D. COCl2
解析:根据价电子对互斥模型可得四种分子的结构如下:
、 、 、 。SO2、NH3分子中含有极性键,正负 电荷重心不重合,为极性分子;C项,虽然BBr3分子中含有极性键,空间结构为平面 三角形,正负电荷重心重合,为非极性分子;D项,COCl2分子中正、负电荷的重心 不重合,为极性分子。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. SO2 B. HCHO C. CCl4 D. C2H5OH
解析:SO2、HCHO、C2H5OH均为极性分子,H2O也为极性分子,根据“相似相溶” 原理,它们均易溶于水,CCl4为非极性分子,难溶于水。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. CH4和H2O B. CO2和HCl
C. NH3和H2S D. HCN和BF3
解析:NH3是呈三角锥形的极性分子;CO2是呈直线形的非极性分子;H2O、H2S都是 呈角形的极性分子;HCl、HCN都是呈直线形的极性分子;CH4是呈正四面体形的非 极性分子,BF3是呈平面三角形的非极性分子。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不处在2个H原子连线的中央
D. CO2是非极性分子,分子中C原子不处在2个O原子连线的中央
解析:NH3中的N原子采取sp3杂化,形成三角锥形结构,是极性分子;CCl4分子中 C—Cl键为极性键,碳原子采取sp3杂化,且无孤电子对,空间结构为正四面体形,碳 原子位于正四面体的中心;H2O分子中H—O键为极性键,氧采取sp3杂化,且有两对 孤电子对,空间结构为角形,为极性分子;CO2分子中碳采取sp杂化,空间结构为直 线形,为非极性分子,碳原子位于2个氧原子连线的中央。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. CCl4与I2的相对分子质量相差较小,而H2O与I2的相对分子质量相差较大
B. CCl4与I2都是直线形分子,而H2O不是直线形分子
C. CCl4和I2都不含氢元素,而H2O中含氢元素
D. CCl4和I2都是非极性分子,而H2O是极性分子
解析:因水分子为极性分子,CCl4、I2分子均为非极性分子,根据“相似相溶”原 理,碘单质在水中的溶解度很小,但在CCl4中的溶解度很大,故选D。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 卤化氢易溶于水,也易溶于CCl4
B. 白磷(P4)易溶于CS2,但难溶于水
C. 碘易溶于苯,微溶于水
D. NaCl易溶于水,难溶于CCl4
解析:卤化氢、水是极性分子,CCl4、P4、CS2、碘、苯都是非极性分子,根据“相 似相溶”原理,卤化氢难溶于CCl4。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①乳酸[CH3CH(OH)COOH]
②2-丁醇[CH3CH(OH)CH2CH3]
③
④丙三醇( )
A. 只有① B. ①和② C. ①②③ D. ①②③④
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 二者互为同分异构体
B. 二者是同一物质
C. 二者是手性分子
D. 二者互为同系物
解析:手性分子中应含有不对称碳原子,即同一个碳原子上连有四个不同的原子或基 团,所以二者不是手性分子;二者的分子式相同,结构也相同,故二者是同一物质。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. T元素有一种单质的空间结构为正四面体形
B. ZQ分子中含有1个σ键和2个π键
C. X和Q元素能形成两种只含极性键的极性分子
D. Z与X、Q元素均能形成直线形非极性分子
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:X元素原子的M能层的p轨道上有两个未成对电子且无空轨道,X为硫元素;Z 元素原子的L能层的p轨道有一个空轨道,Z为碳元素;Q元素原子的L能层的p轨道上 只有一对成对电子,Q为氧元素;T元素原子M能层上p轨道有3个未成对电子,T为磷 元素。白磷的空间结构为正四面体形,A正确;CO与N2分子互为等电子体,CO与N2 具有相同的结构,故CO的结构式为C≡O,其中含有1个σ键和2个π键,B正确;SO2为 角形分子,属于极性分子,SO3为平面三角形结构,属于非极性分子,C错误;CS2与 CO2互为等电子体,两者结构相似,为直线形分子,属于非极性分子,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12. 在HF、H2S、NH3、CO2、CCl4、N2、C60、SO2分子中:
解析:HF是以极性键形成的极性分子;H2S中心原子S的孤电子对数为2,成键电子对 数为2,价电子对数为4,S原子sp3杂化,空间结构为角形分子,H2S是极性键形成的 极性分子;NH3中心原子N的孤电子对数为1,成键电子对数为3,价电子对数为4,N 原子sp3杂化,NH3为三角锥形结构,NH3是极性键形成的极性分子;CO2中心原子C 的孤电子对数为0,成键电子对数为2,价电子对数为2,C原子sp2杂化,CO2为直线形 结构,CO2是极性键形成的非极性分子;CCl4中心原子C的孤电子对数为0,成键电子 对数为4,价电子对数为4,C原子sp3杂化,CCl4为正四面体结构,CCl4是极性键形成 的非极性分子;N2是非极性键形成的非极性分子;C60是非极性键形成的非极性分 子;SO2中心原子S的孤电子对数为1,成键电子对数为2,价电子对数为3,S原子sp2 杂化,SO2为角形结构,SO2是极性键形成的极性分子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:(1)以非极性键相结合的非极性分子是N2、C60。
解析:(2)以极性键相结合,具有直线形结构的非极性分子是CO2。
解析:(3)以极性键相结合,具有正四面体结构的非极性分子是CCl4。
解析:(4)以极性键相结合,具有三角锥形结构的极性分子是NH3。
解析:(5)以极性键相结合,具有角形结构的极性分子是H2S、SO2。
N2、C60
CO2
CCl4
NH3
H2S、SO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:(6)以极性键相结合的极性分子是HF、H2S、NH3、SO2,而且极性最大的分 子是HF。
HF
1
2
3
4
5
6
7
8
9
10
11
12
13
14
13. 在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用d表示。 极性分子的极性强弱与偶极长和电荷量(q)有关,一般用偶极矩(μ)来衡量。分 子的偶极矩是偶极长和电荷量的乘积,即μ=dq。在非极性分子中,其正、负电荷重 心重合,故μ为0。试回答下列问题:
解析:HCl是由极性键形成的极性分子;根据价电子对互斥模型可知,CS2是直 线形分子,正、负电荷重心重合,为非极性分子,其偶极矩为0;H2S、SO2都是角形 结构,是极性分子。
CS2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)实验测得:μ(PF3)=1.03、μ(BCl3)=0。
解析:①μ(PF3)=1.03,说明PF3是极性分子,则PF3是三角锥形结构。
②μ(BCl3)=0,说明BCl3是非极性分子,其正、负电荷重心重合,是平面三角形结 构;B的杂化方式是sp2。
三角锥形
平面三角形
sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分 子,NH3和Cl分别对称分布在四边形的4个顶点上,即正、负电荷重心重合,故淡黄 色化合物的结构简式为 ;若μ>0,则为极性分子,NH3和Cl在四边形的4 个顶点上的分布是不对称的,即正、负电荷重心不重合,故棕黄色化合物的结构简式 为 。根据“相似相溶”原理,水是极性分子,因此属于极性分子的溶质易 溶解在水中,即在水中溶解度较大的是棕黄色化合物,其结构简式为 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14. 已知N、P同属于元素周期表的ⅤA族元素。NH3呈三角锥形,N原子位于锥顶,3 个H原子位于锥底,N—H键间的夹角是107.3°。
解析:N4分子呈正四面体形,是一种非极性分子。
非极性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:NH3分子与PH3分子互为等电子体,结构相似,P—H为不同元素原子之 间形成的共价键,为极性键,PH3分子的空间结构为三角锥形,正、负电荷重心不重 合,为极性分子。
相似
有
有
1
2
3
4
5
6
7
8
9
10
11
12
13
14
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
