鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质第2节共价键与分子的空间结构第2课时价电子对互斥理论和等电子原理课件(共44张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质第2节共价键与分子的空间结构第2课时价电子对互斥理论和等电子原理课件(共44张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览










文档简介
(共44张PPT)
第2章 微粒间相互作用与物质性质
第2节 共价键与分子的空间结构
第2课时 价电子对互斥理论和等电子原理
第*页
研习任务一 价电子对互斥理论
[目标导航]理解价电子对互斥理论和等电子原理,能根据有关理论判断简单分子或离 子的空间结构。
教材 认知
1. 价电子对互斥理论
(2)空间取向的说明
成键电子对
孤电子对
相互排斥
成键
孤电子对
中心原子的价电子数
未成对电子数
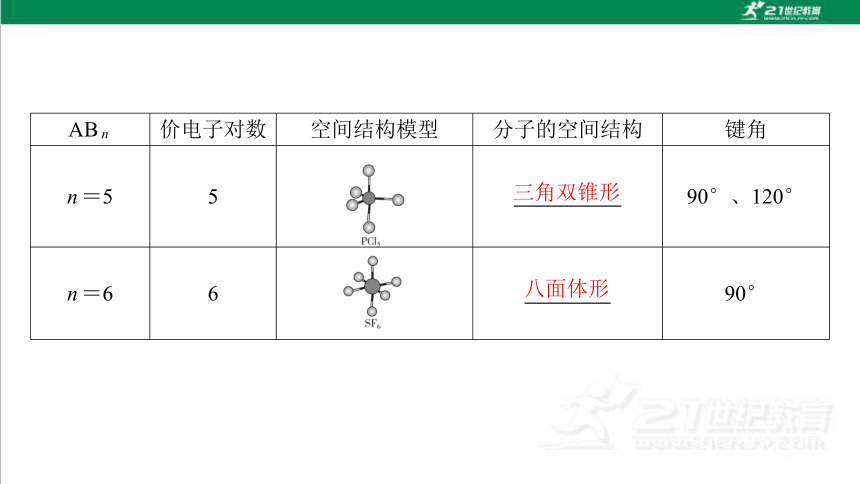
2. 价电子对与分子空间结构的对应关系表
ABn 价电子对数 空间结构模型 分子的空间结构 键角
n=2 2 直线形 180°
n=3 3 平面三角形 20°
n=4 4 正四面体形 109°28'
直线形
120°
正四面体形
ABn 价电子对数 空间结构模型 分子的空间结构 键角
n=5 5 三角双锥形 90°、120°
n=6 6 八面体形 90°
三角双锥形
八面体形
[思考] 下列分子的空间结构为正四面体形的是 。
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
提示:①③④。
NH3的空间结构是三角锥形、H2S的空间结构是角形、CO2的空间结构是直线形,故选 ①③④。
判断
√
×
×
×
√
研习 经典
A. 1 B. 2 C. 3 D. 4
解析:该有机物中碳原子不存在孤电子对,价电子对数=σ键数=3,故选C。
C
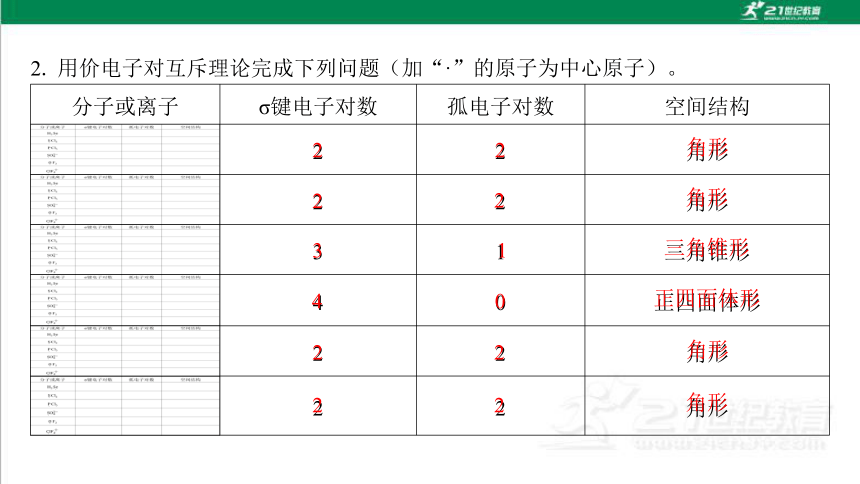
2. 用价电子对互斥理论完成下列问题(加“·”的原子为中心原子)。
分子或离子 σ键电子对数 孤电子对数 空间结构
2 2 角形
2 2 角形
3 1 三角锥形
4 0 正四面体形
2 2 角形
2 2 角形
2
2
角形
2
2
角形
3
1
三角锥形
4
0
正四面体形
2
2
角形
2
2
角形
3. 试回答下列问题。
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
平面三角形
直线形
角形
三角形
直线形
(2)利用价电子对互斥理论推断键角的大小:
<
<
sp3
NH3分子中N有一对孤电子对,对成键电子对的斥力作用大,
使得NH3分子键角减小
第*页
研习任务二 等电子原理
教材 认知
化学通式
价电子总数
分子或离子
空间结构
化学键类型
2. 应用举例
利用等电子原理可以推断简单分子或离子的结构。
16
S C S
sp
直线形
24
三角形
8
三角锥形
32
正四面体形
探究 活动
(2)NH3和H3O+两种微粒是等电子体吗?为什么?若是,微粒的空间结构是什么?
提示:NH3和H3O+两种微粒的化学通式相同,价电子总数相等,是等电子体, 其空间结构相似,为三角锥形。
研习 经 典
A. 12CO2和14CO B. H2O和NH3
C. NO+和CN- D. NO和CO
解析:根据等电子体的条件;①原子总数相同,②价电子总数相等。NO+和CN-互 为等电子体。
C
A. SO2与O3 B. CO2与NO2
C. CS2与NO2 D. PCl3与BF3
解析:A项中SO2与O3原子数相同,价电子总数均为18,互为等电子体,故结构 相似。
A
3. 根据等电子原理,由短周期元素组成的粒子,只要其原子总数相同,各原子最外 层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。
解析:仅由第2周期元素组成的共价分子中,即C、N、O、F组成的共价分子, 如N2与CO的价电子总数均为10,CO2与N2O的价电子总数均为16。
N2
CO
CO2
N2O
SO2、O3
(1)同主族替换法
同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素原子, 如O3与SO2、CO2与CS2互为等电子体。
(2)左右移位法
书写等电子体的方法
(3)叠加法
互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如N2与CO互 为等电子体,N2O与CO2也互为等电子体。
A. CS2分子的空间填充模型:
B. 基态Fe2+的价电子轨道表示式:
D
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. H2O2分子的氧原子杂化方式为sp3
B. NH3的VSEPR模型为平面三角形
C. SO2分子的空间结构为直线形
D. 基态Cu原子的价电子轨道表示式:
解析:H2O2分子的氧原子含有2个σ键和2个孤电子对,故杂化方式为sp3,故A正确; NH3中心N原子的价层电子对数为4,VSEPR模型为四面体形,故B错误;SO2分子中S 原子采用sp2杂化,含有1对孤电子对,故SO2分子的空间结构为角形,故C错误;基态 Cu原子的3d轨道为全充满状态,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 若n=2,则分子的空间结构为角形
B. 若n=3,则分子的空间结构为三角锥形
C. 若n=4,则分子的空间结构为正四面体形
D. 以上说法都不正确
解析:若中心原子A上没有未成键的孤电子对,则根据斥力最小的原则,当n=2时, 分子的空间结构为直线形;当n=3时,分子的空间结构为三角形;当n=4时,分子 的空间结构为正四面体形。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
B. NH3 C. H3O+ D. CO2
A
1
2
3
4
5
6
7
8
9
10
11
12
13
选项 粒子 中心原子的孤电子对数 粒子的空间结构
A BF3 0 平面三角形
B BeCl2 1 角形
C NH3 1 三角锥形
D 0 正四面体形
B
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. BeCl2和BF3
D. CO2和SO3
C
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. N2与CO不属于等电子体,故它们的熔、沸点、溶解度相差较大
D. 苯与硼氮苯(如图)属于等电子体,故硼氮苯中含有大π键,且形成大π键的电子 都由N原子提供
D
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. Zn的核外电子排布式为3d104s2
B. ZnCO3中阴离子空间结构为平面三角形
C. ZnCO3中C的杂化方式为sp3
D. 电负性:Zn>C>O
B
1
2
3
4
5
6
7
8
9
10
11
12
13
C. 碳原子均采取sp3杂化
A
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. SO2和SO3的VSEPR模型均为平面三角形
B. PCl3、NCl3的空间结构都是三角锥形
C. BF3和NF3均为sp2杂化
C
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
11. 根据杂化轨道理论可以判断分子的空间结构,试根据相关知识填空:
解析:AsCl3中As的价电子对数为4,孤电子对数为1,As的杂化方式为sp3, AsCl3分子的空间结构为三角锥形。
解析:CH3COOH的结构式为 ,分子中甲基上的碳原子采取sp3杂化,羧基中碳原子采取sp2杂化。
三角锥形
sp3
sp3、sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)一种有机化合物的结构简式如图所示:
解析:有机物中饱和碳原子采取sp3杂化,双键上的碳原子采取sp2杂化,三键上 的碳原子采取sp杂化。①该分子中有2个sp2杂化碳原子;6个sp3杂化碳原子。②该分 子中有3个sp2-sp3 σ键,3个sp3-sp3 σ键。
2
6
3
3
1
2
3
4
5
6
7
8
9
10
11
12
13
杂化。
直线
sp
24
平面三角形
sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
正四面体形
CCl4(或SiCl4,合理答案均
可)
1
2
3
4
5
6
7
8
9
10
11
12
13
构;PCl3为三角锥形结构
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:因为BF3的空间结构为平面三角形,所以F—B—F的键角为120°。
120°
sp2
正四面体形
三角锥形
sp3
解析:H3O+中氧原子采取sp3杂化。
sp3
H2O中氧原子有2对孤电子对,与成键电子对
排斥作用大,H3O+中氧原子只有1对孤电子对,与成键电子对排斥作用较小
1
2
3
4
5
6
7
8
9
10
11
12
13
第2章 微粒间相互作用与物质性质
第2节 共价键与分子的空间结构
第2课时 价电子对互斥理论和等电子原理
第*页
研习任务一 价电子对互斥理论
[目标导航]理解价电子对互斥理论和等电子原理,能根据有关理论判断简单分子或离 子的空间结构。
教材 认知
1. 价电子对互斥理论
(2)空间取向的说明
成键电子对
孤电子对
相互排斥
成键
孤电子对
中心原子的价电子数
未成对电子数
2. 价电子对与分子空间结构的对应关系表
ABn 价电子对数 空间结构模型 分子的空间结构 键角
n=2 2 直线形 180°
n=3 3 平面三角形 20°
n=4 4 正四面体形 109°28'
直线形
120°
正四面体形
ABn 价电子对数 空间结构模型 分子的空间结构 键角
n=5 5 三角双锥形 90°、120°
n=6 6 八面体形 90°
三角双锥形
八面体形
[思考] 下列分子的空间结构为正四面体形的是 。
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
提示:①③④。
NH3的空间结构是三角锥形、H2S的空间结构是角形、CO2的空间结构是直线形,故选 ①③④。
判断
√
×
×
×
√
研习 经典
A. 1 B. 2 C. 3 D. 4
解析:该有机物中碳原子不存在孤电子对,价电子对数=σ键数=3,故选C。
C
2. 用价电子对互斥理论完成下列问题(加“·”的原子为中心原子)。
分子或离子 σ键电子对数 孤电子对数 空间结构
2 2 角形
2 2 角形
3 1 三角锥形
4 0 正四面体形
2 2 角形
2 2 角形
2
2
角形
2
2
角形
3
1
三角锥形
4
0
正四面体形
2
2
角形
2
2
角形
3. 试回答下列问题。
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
平面三角形
直线形
角形
三角形
直线形
(2)利用价电子对互斥理论推断键角的大小:
<
<
sp3
NH3分子中N有一对孤电子对,对成键电子对的斥力作用大,
使得NH3分子键角减小
第*页
研习任务二 等电子原理
教材 认知
化学通式
价电子总数
分子或离子
空间结构
化学键类型
2. 应用举例
利用等电子原理可以推断简单分子或离子的结构。
16
S C S
sp
直线形
24
三角形
8
三角锥形
32
正四面体形
探究 活动
(2)NH3和H3O+两种微粒是等电子体吗?为什么?若是,微粒的空间结构是什么?
提示:NH3和H3O+两种微粒的化学通式相同,价电子总数相等,是等电子体, 其空间结构相似,为三角锥形。
研习 经 典
A. 12CO2和14CO B. H2O和NH3
C. NO+和CN- D. NO和CO
解析:根据等电子体的条件;①原子总数相同,②价电子总数相等。NO+和CN-互 为等电子体。
C
A. SO2与O3 B. CO2与NO2
C. CS2与NO2 D. PCl3与BF3
解析:A项中SO2与O3原子数相同,价电子总数均为18,互为等电子体,故结构 相似。
A
3. 根据等电子原理,由短周期元素组成的粒子,只要其原子总数相同,各原子最外 层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。
解析:仅由第2周期元素组成的共价分子中,即C、N、O、F组成的共价分子, 如N2与CO的价电子总数均为10,CO2与N2O的价电子总数均为16。
N2
CO
CO2
N2O
SO2、O3
(1)同主族替换法
同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素原子, 如O3与SO2、CO2与CS2互为等电子体。
(2)左右移位法
书写等电子体的方法
(3)叠加法
互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如N2与CO互 为等电子体,N2O与CO2也互为等电子体。
A. CS2分子的空间填充模型:
B. 基态Fe2+的价电子轨道表示式:
D
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. H2O2分子的氧原子杂化方式为sp3
B. NH3的VSEPR模型为平面三角形
C. SO2分子的空间结构为直线形
D. 基态Cu原子的价电子轨道表示式:
解析:H2O2分子的氧原子含有2个σ键和2个孤电子对,故杂化方式为sp3,故A正确; NH3中心N原子的价层电子对数为4,VSEPR模型为四面体形,故B错误;SO2分子中S 原子采用sp2杂化,含有1对孤电子对,故SO2分子的空间结构为角形,故C错误;基态 Cu原子的3d轨道为全充满状态,故D错误。
A
1
2
3
4
5
6
7
8
9
10
11
12
13
A. 若n=2,则分子的空间结构为角形
B. 若n=3,则分子的空间结构为三角锥形
C. 若n=4,则分子的空间结构为正四面体形
D. 以上说法都不正确
解析:若中心原子A上没有未成键的孤电子对,则根据斥力最小的原则,当n=2时, 分子的空间结构为直线形;当n=3时,分子的空间结构为三角形;当n=4时,分子 的空间结构为正四面体形。
C
1
2
3
4
5
6
7
8
9
10
11
12
13
B. NH3 C. H3O+ D. CO2
A
1
2
3
4
5
6
7
8
9
10
11
12
13
选项 粒子 中心原子的孤电子对数 粒子的空间结构
A BF3 0 平面三角形
B BeCl2 1 角形
C NH3 1 三角锥形
D 0 正四面体形
B
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. BeCl2和BF3
D. CO2和SO3
C
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. N2与CO不属于等电子体,故它们的熔、沸点、溶解度相差较大
D. 苯与硼氮苯(如图)属于等电子体,故硼氮苯中含有大π键,且形成大π键的电子 都由N原子提供
D
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. Zn的核外电子排布式为3d104s2
B. ZnCO3中阴离子空间结构为平面三角形
C. ZnCO3中C的杂化方式为sp3
D. 电负性:Zn>C>O
B
1
2
3
4
5
6
7
8
9
10
11
12
13
C. 碳原子均采取sp3杂化
A
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
A. SO2和SO3的VSEPR模型均为平面三角形
B. PCl3、NCl3的空间结构都是三角锥形
C. BF3和NF3均为sp2杂化
C
1
2
3
4
5
6
7
8
9
10
11
12
13
1
2
3
4
5
6
7
8
9
10
11
12
13
11. 根据杂化轨道理论可以判断分子的空间结构,试根据相关知识填空:
解析:AsCl3中As的价电子对数为4,孤电子对数为1,As的杂化方式为sp3, AsCl3分子的空间结构为三角锥形。
解析:CH3COOH的结构式为 ,分子中甲基上的碳原子采取sp3杂化,羧基中碳原子采取sp2杂化。
三角锥形
sp3
sp3、sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)一种有机化合物的结构简式如图所示:
解析:有机物中饱和碳原子采取sp3杂化,双键上的碳原子采取sp2杂化,三键上 的碳原子采取sp杂化。①该分子中有2个sp2杂化碳原子;6个sp3杂化碳原子。②该分 子中有3个sp2-sp3 σ键,3个sp3-sp3 σ键。
2
6
3
3
1
2
3
4
5
6
7
8
9
10
11
12
13
杂化。
直线
sp
24
平面三角形
sp2
1
2
3
4
5
6
7
8
9
10
11
12
13
正四面体形
CCl4(或SiCl4,合理答案均
可)
1
2
3
4
5
6
7
8
9
10
11
12
13
构;PCl3为三角锥形结构
1
2
3
4
5
6
7
8
9
10
11
12
13
解析:因为BF3的空间结构为平面三角形,所以F—B—F的键角为120°。
120°
sp2
正四面体形
三角锥形
sp3
解析:H3O+中氧原子采取sp3杂化。
sp3
H2O中氧原子有2对孤电子对,与成键电子对
排斥作用大,H3O+中氧原子只有1对孤电子对,与成键电子对排斥作用较小
1
2
3
4
5
6
7
8
9
10
11
12
13
