鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质微专题三杂化轨道类型和分子空间结构的判断方法课件(共19张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质微专题三杂化轨道类型和分子空间结构的判断方法课件(共19张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:21:30 | ||
图片预览






文档简介
(共19张PPT)
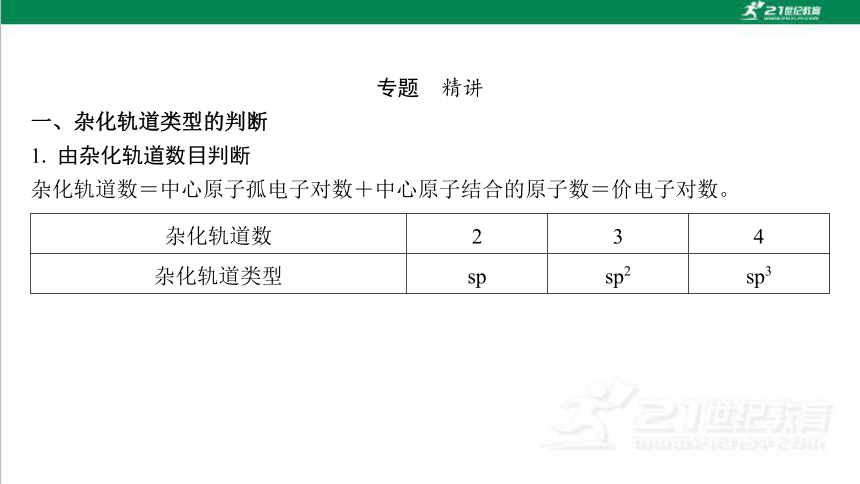
微专题三 杂化轨道类型和分子空间结构的判断方法
专题 精讲
一、杂化轨道类型的判断
1. 由杂化轨道数目判断
杂化轨道数=中心原子孤电子对数+中心原子结合的原子数=价电子对数。
杂化轨道数 2 3 4
杂化轨道类型 sp sp2 sp3
2. 根据杂化轨道的空间分布判断
(1)若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子采取sp3 杂化。
(2)若杂化轨道在空间的分布为平面三角形,则分子的中心原子采取sp2杂化。
(3)若杂化轨道在空间的分布为直线形,则分子的中心原子采取sp杂化。
3. 根据杂化轨道之间的夹角判断
若杂化轨道之间的夹角为109°28',则分子的中心原子采取sp3杂化;若杂化轨道之间 的夹角为120°,则分子的中心原子采取sp2杂化;若杂化轨道之间的夹角为180°, 则分子的中心原子采取sp杂化。
4. 有机物中碳原子的杂化方式可根据成键情况判断
若碳原子形成的全部为单键,则为sp3杂化,若有一个双键,则为sp2杂化,若有三 键,则为sp杂化。
二、键角大小的判断键角大小判断的一般步骤
1. 首先看中心原子杂化类型
中心原子杂化类型是决定键角大小的最根本的原因,如下表:
中心原子杂化类型 sp sp2 sp3
杂化轨道空间分布
直线形
平面三角形
四面体形
轨道夹角 180° 120° 109°28'
中心原子分别为sp3、sp2和sp杂化类型的,它们对应的键角会依次增大。
2. 确定中心原子孤电子对数
对于中心原子杂化类型相同的分子,中心原子所含孤电子对数目越多,键角越小。
3. 看电负性
对于中心原子杂化类型且孤电子对数相同的分子,可以比较原子的电负性
①若中心原子相同,则配位原子电负性越大,键角越小,如NF3与NCl3:电负性F>Cl,键角NF3<NCl3。
②若配位原子相同,则中心原子电负性越大,键角越大。
如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为角形,由于电负性:O>S,键角:H2O>H2S。
4. 同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键间,则 键角大小不同。如甲醛中: ,键角:α>β。
专题 训练
一、杂化轨道类型的判断
A. sp-p B. sp2-s
C. sp2-p D. sp3-p
C
A. BeCl2与BF3 B. CO2与SO2
C. CCl4与NH3 D. C2H2与C2H4
解析:A项中,BeCl2分子、BF3分子中杂化轨道数分别为2、3,中心原子杂化轨道类 型分别为sp、sp2;B项中,CO2分子中杂化轨道数为2,SO2分子中杂化轨道数为3,中 心原子杂化轨道类型分别为sp、sp2;C项中,中心原子杂化轨道类型均为sp3;D项 中,C2H2和C2H4中心原子杂化轨道类型分别为sp、sp2。
C
D
D. 三氧化硫的三聚分子( )中S原子的杂化轨道类型为sp3杂化
B
解析:乙二胺中N形成3个单键,含有1对孤电子对,属于sp3杂化;C形成4个单 键,不存在孤电子对,也是sp3杂化。
解析:根据抗坏血酸的分子结构,该结构中有两种碳原子,全形成单键的碳原子和形 成双键的碳原子,全形成单键的碳原子为sp3杂化,形成双键的碳原子为sp2杂化。
sp3
sp3
sp3
σ
sp3、sp2
(5)氨硼烷在催化剂作用下水解释放氢气:
正四面体形
4
sp3
sp3
sp2
二、键角大小的判断
A. 等于120° B. 大于120°
C. 小于120° D. 等于180°
解析:由于SO2分子的价电子对互斥模型为平面三角形,从理论上讲其键角应为 120°,但是SO2分子中的S原子有1对孤电子对,对其他的两个成键电子对存在排斥 作用,因此分子中的键角要小于120°。
C
A. ⑤④①②③ B. ④①②⑤③
C. ⑤①④②③ D. ③②④①⑤
C
解析:
微粒 中心原子的孤电子对数 中心原子的
价电子对数 价电子对
互斥模型 杂化
轨道类型 空间结构 键角
①BCl3 0 3 平面三角形 sp2 平面
三角形 120°
②NH3 1 4 四面体形 sp3 三角
锥形 107.3°
③H2O 2 4 四面体形 sp3 角形 104.5°
0 4 四面体形 sp3 正四面
体形 109°28'
⑤BeCl2 0 2 直线形 sp 直线形 180°
故键角由大到小的顺序为⑤①④②③。
A. NH3>NF3>NCl3
B. NCl3>NF3>NH3
C. NH3>NCl3>NF3
D. NF3>NCl3>NH3
解析:由于电负性F>Cl>H,故键角的大小顺序为NH3>NCl3>NF3。
C
解析:CH4、BF3、CO2的中心原子分别为sp3、sp2和sp杂化,它们对应的键角为 109°28'、120°、180°,键角增大。
解析:H2O、NH3、CH4分子的中心原子均采取sp3杂化,H2O、NH3、CH4的键 角分别是104.5°、107.3°、109°28',故键角由大到小的顺序为CH4>NH3>H2O。
解析:H2O与H2S分子中的O与S原子都采取sp3杂化,都有2对孤电子对,但O原 子的电负性大,故H2O比H2S键角大。
CO2>BF3>CH4
CH4>NH3>H2O
H2O>H2S
解析:NF3与NH3中心原子都为sp3杂化,但因为F原子的电负性大于H原子,所 以NF3键角更小。
解析:在HCHO分子中,C原子为sp2杂化,但由于C原子与O原子间以双键 C O结合,该双键对C—H键的斥力要更大些,所以两个C—H键的键角小于120°。
NH3>NF3
<
微专题三 杂化轨道类型和分子空间结构的判断方法
专题 精讲
一、杂化轨道类型的判断
1. 由杂化轨道数目判断
杂化轨道数=中心原子孤电子对数+中心原子结合的原子数=价电子对数。
杂化轨道数 2 3 4
杂化轨道类型 sp sp2 sp3
2. 根据杂化轨道的空间分布判断
(1)若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子采取sp3 杂化。
(2)若杂化轨道在空间的分布为平面三角形,则分子的中心原子采取sp2杂化。
(3)若杂化轨道在空间的分布为直线形,则分子的中心原子采取sp杂化。
3. 根据杂化轨道之间的夹角判断
若杂化轨道之间的夹角为109°28',则分子的中心原子采取sp3杂化;若杂化轨道之间 的夹角为120°,则分子的中心原子采取sp2杂化;若杂化轨道之间的夹角为180°, 则分子的中心原子采取sp杂化。
4. 有机物中碳原子的杂化方式可根据成键情况判断
若碳原子形成的全部为单键,则为sp3杂化,若有一个双键,则为sp2杂化,若有三 键,则为sp杂化。
二、键角大小的判断键角大小判断的一般步骤
1. 首先看中心原子杂化类型
中心原子杂化类型是决定键角大小的最根本的原因,如下表:
中心原子杂化类型 sp sp2 sp3
杂化轨道空间分布
直线形
平面三角形
四面体形
轨道夹角 180° 120° 109°28'
中心原子分别为sp3、sp2和sp杂化类型的,它们对应的键角会依次增大。
2. 确定中心原子孤电子对数
对于中心原子杂化类型相同的分子,中心原子所含孤电子对数目越多,键角越小。
3. 看电负性
对于中心原子杂化类型且孤电子对数相同的分子,可以比较原子的电负性
①若中心原子相同,则配位原子电负性越大,键角越小,如NF3与NCl3:电负性F>Cl,键角NF3<NCl3。
②若配位原子相同,则中心原子电负性越大,键角越大。
如H2O、H2S中,中心原子均为sp3杂化,分子空间结构均为角形,由于电负性:O>S,键角:H2O>H2S。
4. 同一粒子中不同共价键的键角,由于斥力:双键间>双键与单键间>单键间,则 键角大小不同。如甲醛中: ,键角:α>β。
专题 训练
一、杂化轨道类型的判断
A. sp-p B. sp2-s
C. sp2-p D. sp3-p
C
A. BeCl2与BF3 B. CO2与SO2
C. CCl4与NH3 D. C2H2与C2H4
解析:A项中,BeCl2分子、BF3分子中杂化轨道数分别为2、3,中心原子杂化轨道类 型分别为sp、sp2;B项中,CO2分子中杂化轨道数为2,SO2分子中杂化轨道数为3,中 心原子杂化轨道类型分别为sp、sp2;C项中,中心原子杂化轨道类型均为sp3;D项 中,C2H2和C2H4中心原子杂化轨道类型分别为sp、sp2。
C
D
D. 三氧化硫的三聚分子( )中S原子的杂化轨道类型为sp3杂化
B
解析:乙二胺中N形成3个单键,含有1对孤电子对,属于sp3杂化;C形成4个单 键,不存在孤电子对,也是sp3杂化。
解析:根据抗坏血酸的分子结构,该结构中有两种碳原子,全形成单键的碳原子和形 成双键的碳原子,全形成单键的碳原子为sp3杂化,形成双键的碳原子为sp2杂化。
sp3
sp3
sp3
σ
sp3、sp2
(5)氨硼烷在催化剂作用下水解释放氢气:
正四面体形
4
sp3
sp3
sp2
二、键角大小的判断
A. 等于120° B. 大于120°
C. 小于120° D. 等于180°
解析:由于SO2分子的价电子对互斥模型为平面三角形,从理论上讲其键角应为 120°,但是SO2分子中的S原子有1对孤电子对,对其他的两个成键电子对存在排斥 作用,因此分子中的键角要小于120°。
C
A. ⑤④①②③ B. ④①②⑤③
C. ⑤①④②③ D. ③②④①⑤
C
解析:
微粒 中心原子的孤电子对数 中心原子的
价电子对数 价电子对
互斥模型 杂化
轨道类型 空间结构 键角
①BCl3 0 3 平面三角形 sp2 平面
三角形 120°
②NH3 1 4 四面体形 sp3 三角
锥形 107.3°
③H2O 2 4 四面体形 sp3 角形 104.5°
0 4 四面体形 sp3 正四面
体形 109°28'
⑤BeCl2 0 2 直线形 sp 直线形 180°
故键角由大到小的顺序为⑤①④②③。
A. NH3>NF3>NCl3
B. NCl3>NF3>NH3
C. NH3>NCl3>NF3
D. NF3>NCl3>NH3
解析:由于电负性F>Cl>H,故键角的大小顺序为NH3>NCl3>NF3。
C
解析:CH4、BF3、CO2的中心原子分别为sp3、sp2和sp杂化,它们对应的键角为 109°28'、120°、180°,键角增大。
解析:H2O、NH3、CH4分子的中心原子均采取sp3杂化,H2O、NH3、CH4的键 角分别是104.5°、107.3°、109°28',故键角由大到小的顺序为CH4>NH3>H2O。
解析:H2O与H2S分子中的O与S原子都采取sp3杂化,都有2对孤电子对,但O原 子的电负性大,故H2O比H2S键角大。
CO2>BF3>CH4
CH4>NH3>H2O
H2O>H2S
解析:NF3与NH3中心原子都为sp3杂化,但因为F原子的电负性大于H原子,所 以NF3键角更小。
解析:在HCHO分子中,C原子为sp2杂化,但由于C原子与O原子间以双键 C O结合,该双键对C—H键的斥力要更大些,所以两个C—H键的键角小于120°。
NH3>NF3
<
