鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质综合微评(二)课件(共49张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质综合微评(二)课件(共49张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 18:23:23 | ||
图片预览










文档简介
(共49张PPT)
第2章 微粒间相互作用与物质性质
综合微评(二)
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符 合题意)
A. 基态Br原子价电子排布式为4s24p5
B. CO2的立体结构模型
C. 用原子轨道描述氢气分子中化学键的形成
D. S2-的结构示意图:
A
解析:溴元素的原子序数为35,价电子排布式为4s24p5,故A正确;二氧化碳的空间 结构为直线形,立体结构模型为 ,故B错误;氢原子的价电子排布式为 1s1,s电子云为球形,则用原子轨道描述氢气分子中化学键的形成 为 ,故C错误;硫离子的核电荷数为16,其结构 示意图为 ,故D错误。
A. N2的沸点比CO低
B. 常温常压下,CO2为气体,CS2为液体
C. HCl气体易溶于水
D. 用毛皮摩擦过的橡胶棒靠近水流,水流方向发生变化
B
解析:N2与CO的相对分子质量相同,由于CO是极性分子,导致分子间作用力强于 N2,则N2的沸点比CO低,故A不符合题意;CO2和CS2都为非极性分子,两者组成和 结构相似,相对分子质量越大的分子间作用力越大,其熔点和沸点越高,故B符合题 意;HCl和水都是极性分子,HCl气体易溶于水和分子极性有关,故C不符合题意;用 毛皮摩擦过的橡胶棒带电荷,水分子是极性分子,所以靠近水流,水流方向发生变 化,故D不符合题意。
A. HCl和Cl2分子中均含有s-pσ键
C. HF的相对分子质量小于HCl,故HF的沸点小于HCl
D. 酸性:CH3COOH<CHCl2COOH<CCl3COOH
D
A. 基态原子未成对电子数:Cr>Mn>As
B. 酸性:CH3COOH>CH2ClCOOH>CH2FCOOH
D. 沸点:AsH3>PH3>NH3
A
A. 乙醇能和水互溶,则乙硫醇(CH3CH2SH)也可与水互溶
B. O的非金属性强于S,则O2-的还原性弱于S2-
C. O原子半径小,相邻的O原子间斥力大,则仅含O原子的长链状分子骨架很难形成
D. S原子有空的3d轨道,则在含S的分子中,1 mol S形成的共价键的数目可以大于2NA
解析:乙醇能和水形成氢键,而乙硫醇不能,则乙硫醇不能与水互溶,A错误;元素 非金属性越强,其阴离子的还原性越弱,B正确;O原子半径小,相邻的O原子间斥力 大,O—O单键键能小,易断裂,则仅含O原子的长链状分子骨架很难形成,C正确; 1 mol S形成的共价键的数目可以大于2NA,例如SF6,D正确。
A
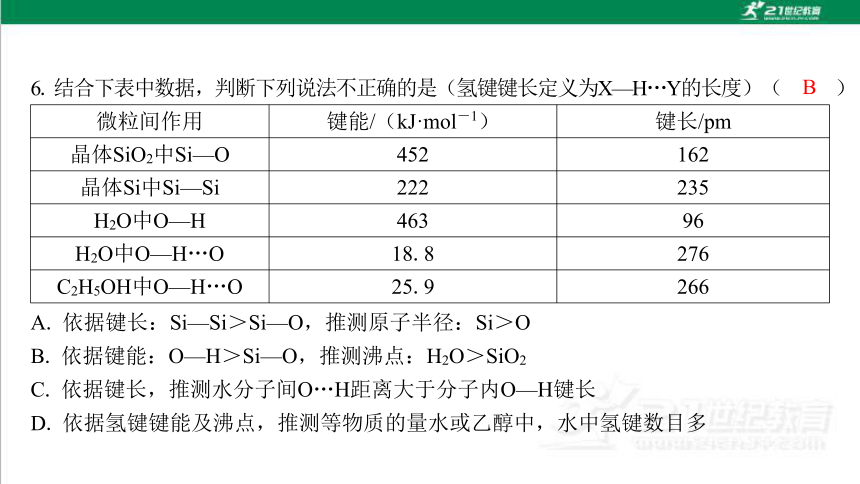
微粒间作用 键能/(kJ·mol-1) 键长/pm
晶体SiO2中Si—O 452 162
晶体Si中Si—Si 222 235
H2O中O—H 463 96
H2O中O—H…O 18.8 276
C2H5OH中O—H…O 25.9 266
B
A. 依据键长:Si—Si>Si—O,推测原子半径:Si>O
B. 依据键能:O—H>Si—O,推测沸点:H2O>SiO2
C. 依据键长,推测水分子间O…H距离大于分子内O—H键长
D. 依据氢键键能及沸点,推测等物质的量水或乙醇中,水中氢键数目多
解析:原子半径越大,键长越长,A正确;水的沸点高与分子间氢键有关,SiO2是由 原子构成的,沸点与Si—O键有关,B错误;根据表中数据276 pm>96 pm知,水分子 间O…H距离大于分子内O—H键长,C正确;氢键键能:H2O<CH3CH2OH,但是沸 点:H2O>C2H5OH,说明水中氢键数目多,D正确。
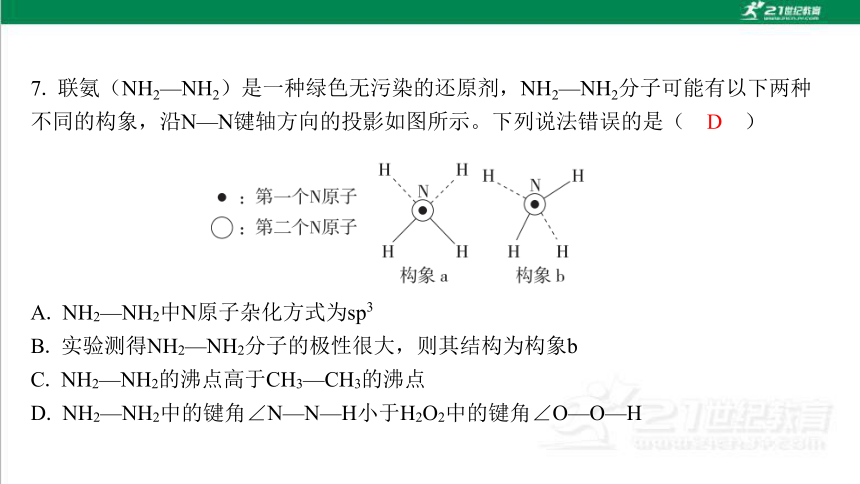
A. NH2—NH2中N原子杂化方式为sp3
B. 实验测得NH2—NH2分子的极性很大,则其结构为构象b
C. NH2—NH2的沸点高于CH3—CH3的沸点
D. NH2—NH2中的键角∠N—N—H小于H2O2中的键角∠O—O—H
D
解析:NH2—NH2中每个N原子周围均形成了3个σ键还有1对孤电子对,价电子 对数为4,故N的杂化方式为sp3,A正确;构象a的正、负电荷重心重合,为非极 性分子,而构象b的正、负电荷重心不重合,为极性分子,B正确;NH2—NH2中 存在分子间氢键,CH3CH3中不存在分子间氢键,熔、沸点NH2—NH2大于 CH3—CH3,C正确;两种分子中,N和O均为sp3杂化,而NH2—NH2中N原子的 孤电子对数为1,而H2O2中O原子的孤电子对数为2,孤电子对数越多,对成键 电子对的斥力越大,键角越小,D错误。
A. ClO2为非极性分子
C
B. CO和N2的原子总数、价电子总数均相等,故二者的性质完全相同
C. COCl2分子中所有原子的最外层都不满足8电子稳定结构
D. 已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,则[ZnCl4]2-的空间结构为正四 面体形
D
A. 分子中含有2个手性碳原子
B. 该物质防晒的原因是碳碳之间的σ键和π键吸收紫外线后能被激发
C. 分子中所有原子都满足8电子稳定结构
D. C、O原子的杂化方式均有两种
D
解析:分子中连接—CH2CH3的碳原子为手性碳原子,即分子中含有1个手性碳原子, 故A错误;σ键稳定、π键不稳定,π电子吸收紫外线后能被激发,从而防止皮肤被晒 伤,故B错误;分子中H原子满足2电子稳定结构,故C错误;饱和碳原子、饱和O原 子都采用sp3杂化,不饱和碳原子和不饱和氧原子都采用sp2杂化,故D正确。
C. P原子间难形成三键而N原子间可以,是因为P的原子半径大于N,难形成p-p π键
B
A. N2H4中N原子杂化方式为sp2,为平面形分子
C. CO(NH2)2中C、N、O三种元素第一电离能的大小顺序是C<N<O
D. 肼的沸点远高于乙烯的原因是肼能形成分子间氢键
D
A. 熔、沸点:吡咯<卟吩
C. 苯分子中也存在离域π键
D. 吡咯和卟吩中N原子的杂化方式都是sp3
D
A. 实验中C—I键的产生,可通过红外光谱结果证明
B. C—I键比C—Cl键更易形成,且键能更大
C. ClCH2COOH中存在sp2-sp3σ键
D. ClCH2COOH的酸性比CH3COOH强
B
解析:红外光谱可用于确定化学键类型,故A正确;I原子半径大于Cl,因此C—I键长 比C—Cl键长要长,键长越长,键能越小,故B错误;羧基中C原子采取sp2杂化,羧 基相连的碳原子采取sp3杂化,两碳原子之间形成sp2-sp3σ键,故C正确;Cl原子的电 负性大于H,导致ClCH2COOH中O—H键的极性大于CH3COOH中O—H键, ClCH2COOH中羧基更易电离出H+,酸性强于CH3COOH,故D正确。
二、非选择题(本题包括4个小题,共58分)
15. (14分)如图表示不同类型共价键形成时电子云重叠情况:
解析:以形成共价键的两原子核的连线为轴作旋转操作,共价键的电子云的图 形不变,这种共价键称为σ键,这种特征称为轴对称。σ键的种类有s-s σ键、s-p σ 键、p-pσ键三种。形成的化学键属于轴对称的有①2个s轨道以“头碰头”方式发生 重叠,形成稳定的σ键,②1个s轨道和1个p轨道,③2个p轨道以“头碰头”方式发生 重叠,形成稳定的σ键,故答案为①②③。
①②③
A. Cl2 B. HCl C. N2 D. H2
解析:方式①为s-sσ键,故为氢气,两个H原子通过1s轨道形成σ键;方式②为 s-pσ键,故为HCl,H原子通过1s轨道与Cl原子的3p轨道形成σ键;只通过方式③的 为p-pσ键,故为氯气,两个氯原子的3p轨道形成σ键;同时含有③、④、⑤三种方式 化学键的物质是氮气,两个N原子通过2px轨道形成σ键,同时另外2个py和2个pz轨道 分别以“肩并肩”的方式形成2个π键。
D
B
A
C
(3)甲、乙、丙三种有机物的结构如下:
甲:
8
2
有
不是
2∶1
②乙分子中含有C—H极性键,乙烯分子的正、负电荷重心重合,不是极性分子。
③丙分子中含有—C≡N,三键中含有1个σ键和2个π键,分子中σ键与π键的数目之比为 2∶1。
16. (15分)卤素单质及其化合物在生产、生活、化工、医药、材料等领域中有着非 常广泛的应用。回答下列问题:
解析:Br原子位于第4周期ⅦA族,价电子轨道表示式为 。
A. HCl易溶于H2O
B. Cl2易溶于NaOH溶液
C. Br2易溶于CCl4
D. I2易溶于CS2
B
解析:HCl为极性分子,H2O为极性分子,故HCl易溶于H2O符合“相似相溶” 原理,A正确;Cl2易溶于NaOH溶液是因为氯气和氢氧化钠溶液反应,不符合“相似 相溶”原理,B错误;Br2为非极性分子,CCl4为非极性分子,Br2易溶于CCl4,符合 “相似相溶”原理,C正确;I2为非极性分子,CS2为非极性分子,I2易溶于CS2,符合 “相似相溶”原理,D正确。
②
3∶1
(5)请在下图含溴有机物的结构简式中,用星号(*)标出含有的手性碳原子。
解析:手性碳原子为连有4个不同的原子或原子团的碳原子,可表示为 。
>
F的电负性比Cl大,F—C的极性大于Cl—C的极性,导致F3C—的极性大于
Cl3C—的极性,使得三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子
17. (14分)高氯酸三碳酰肼合镍
{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。回答下列问题:
解析:镍为28号元素,所以基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2。
1s22s22p63s23p63d84s2
解析:在同一原子轨道下最多可以有两个自旋状态不同的电子,自旋状态不 同,运动状态也就不相同,即运动状态个数等于电子数;基态碳原子核外电子有6种 不同运动状态。
6
4
四面体形
(4)化学式中的CHZ为碳酰肼,其结构为 ,是一种新型的环保锅
炉水除氧剂。
sp3
11
=
sp2、sp3
<
NCl3
A. 分子的极性:BCl3<NCl3
B. Mn的+2价比Fe的+2价稳定
C. 物质的沸点:HF<HCl
D. 在CS2中的溶解度:CCl4<H2O
AB
解析:BCl3是平面三角形,分子中正、负电荷重心重合,是非极性分子;NCl3 的N原子上有一对孤电子对,是三角锥形,分子中正、负电荷重心不重合,是极性分 子,所以分子极性:BCl3<NCl3,A正确;基态Mn原子的价电子排布式为3d54s2,Mn 的+2价离子3d轨道半充满,能量低更稳定,B正确;HCl分子间只存在分子间作用 力,而HF分子间除存在分子间作用力外,还存在分子间氢键,因此HF的沸点比HCl 的高,C错误;CCl4、CS2都是由非极性分子构成的物质,H2O是由极性分子构成的物 质,根据“相似相溶”原理可知,由非极性分子构成的溶质CCl4容易溶解在由非极性 分子构成的溶剂CS2中,由极性分子H2O构成的溶质不容易溶解在由非极性分子构成 的溶剂CS2中,所以溶解度:CCl4>H2O,D错误。
A. 某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7价
B. 钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C. CH2ClCOOH酸性大于CH3CH2COOH酸性
D. 邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
ACD
解析:某元素原子核外电子总数是最外层电子数的5倍,此元素是35号元素Br, 位于第4周期ⅦA族,价电子排布式为4s24p5,最高正价为+7价,A正确;金属钠比 镁活泼,容易失去电子,因此钠的第一电离能小于Mg的第一电离能,Na最外层只有 一个电子,再失去一个电子,出现能层的变化,需要的能量增大,Mg最外层有2个电 子,因此Na的第二电离能大于Mg的第二电离能,B错误;由于Cl电负性大于H,故酸 性:CH2ClCOOH>CH3CH2COOH,C正确;邻羟基苯甲醛形成分子内氢键,降低物 质熔点,对羟基苯甲醛形成分子间氢键,增大物质熔点,因此邻羟基苯甲醛的熔点低 于对羟基苯甲醛的熔点,D正确。
正四面体形
4
sp3
解析:苯胺比甲苯的熔、沸点都高,苯胺中存在电负性较强的N,可以形成氢 键,因此比甲苯的熔、沸点高。
苯胺分子之间存在氢键
(5)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl (用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
A. 中心原子的杂化轨道类型 B. 中心原子的价电子对数
C. 空间结构 D. 共价键类型
ABD
C
5
(H3O+)O—
H…N
第2章 微粒间相互作用与物质性质
综合微评(二)
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符 合题意)
A. 基态Br原子价电子排布式为4s24p5
B. CO2的立体结构模型
C. 用原子轨道描述氢气分子中化学键的形成
D. S2-的结构示意图:
A
解析:溴元素的原子序数为35,价电子排布式为4s24p5,故A正确;二氧化碳的空间 结构为直线形,立体结构模型为 ,故B错误;氢原子的价电子排布式为 1s1,s电子云为球形,则用原子轨道描述氢气分子中化学键的形成 为 ,故C错误;硫离子的核电荷数为16,其结构 示意图为 ,故D错误。
A. N2的沸点比CO低
B. 常温常压下,CO2为气体,CS2为液体
C. HCl气体易溶于水
D. 用毛皮摩擦过的橡胶棒靠近水流,水流方向发生变化
B
解析:N2与CO的相对分子质量相同,由于CO是极性分子,导致分子间作用力强于 N2,则N2的沸点比CO低,故A不符合题意;CO2和CS2都为非极性分子,两者组成和 结构相似,相对分子质量越大的分子间作用力越大,其熔点和沸点越高,故B符合题 意;HCl和水都是极性分子,HCl气体易溶于水和分子极性有关,故C不符合题意;用 毛皮摩擦过的橡胶棒带电荷,水分子是极性分子,所以靠近水流,水流方向发生变 化,故D不符合题意。
A. HCl和Cl2分子中均含有s-pσ键
C. HF的相对分子质量小于HCl,故HF的沸点小于HCl
D. 酸性:CH3COOH<CHCl2COOH<CCl3COOH
D
A. 基态原子未成对电子数:Cr>Mn>As
B. 酸性:CH3COOH>CH2ClCOOH>CH2FCOOH
D. 沸点:AsH3>PH3>NH3
A
A. 乙醇能和水互溶,则乙硫醇(CH3CH2SH)也可与水互溶
B. O的非金属性强于S,则O2-的还原性弱于S2-
C. O原子半径小,相邻的O原子间斥力大,则仅含O原子的长链状分子骨架很难形成
D. S原子有空的3d轨道,则在含S的分子中,1 mol S形成的共价键的数目可以大于2NA
解析:乙醇能和水形成氢键,而乙硫醇不能,则乙硫醇不能与水互溶,A错误;元素 非金属性越强,其阴离子的还原性越弱,B正确;O原子半径小,相邻的O原子间斥力 大,O—O单键键能小,易断裂,则仅含O原子的长链状分子骨架很难形成,C正确; 1 mol S形成的共价键的数目可以大于2NA,例如SF6,D正确。
A
微粒间作用 键能/(kJ·mol-1) 键长/pm
晶体SiO2中Si—O 452 162
晶体Si中Si—Si 222 235
H2O中O—H 463 96
H2O中O—H…O 18.8 276
C2H5OH中O—H…O 25.9 266
B
A. 依据键长:Si—Si>Si—O,推测原子半径:Si>O
B. 依据键能:O—H>Si—O,推测沸点:H2O>SiO2
C. 依据键长,推测水分子间O…H距离大于分子内O—H键长
D. 依据氢键键能及沸点,推测等物质的量水或乙醇中,水中氢键数目多
解析:原子半径越大,键长越长,A正确;水的沸点高与分子间氢键有关,SiO2是由 原子构成的,沸点与Si—O键有关,B错误;根据表中数据276 pm>96 pm知,水分子 间O…H距离大于分子内O—H键长,C正确;氢键键能:H2O<CH3CH2OH,但是沸 点:H2O>C2H5OH,说明水中氢键数目多,D正确。
A. NH2—NH2中N原子杂化方式为sp3
B. 实验测得NH2—NH2分子的极性很大,则其结构为构象b
C. NH2—NH2的沸点高于CH3—CH3的沸点
D. NH2—NH2中的键角∠N—N—H小于H2O2中的键角∠O—O—H
D
解析:NH2—NH2中每个N原子周围均形成了3个σ键还有1对孤电子对,价电子 对数为4,故N的杂化方式为sp3,A正确;构象a的正、负电荷重心重合,为非极 性分子,而构象b的正、负电荷重心不重合,为极性分子,B正确;NH2—NH2中 存在分子间氢键,CH3CH3中不存在分子间氢键,熔、沸点NH2—NH2大于 CH3—CH3,C正确;两种分子中,N和O均为sp3杂化,而NH2—NH2中N原子的 孤电子对数为1,而H2O2中O原子的孤电子对数为2,孤电子对数越多,对成键 电子对的斥力越大,键角越小,D错误。
A. ClO2为非极性分子
C
B. CO和N2的原子总数、价电子总数均相等,故二者的性质完全相同
C. COCl2分子中所有原子的最外层都不满足8电子稳定结构
D. 已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,则[ZnCl4]2-的空间结构为正四 面体形
D
A. 分子中含有2个手性碳原子
B. 该物质防晒的原因是碳碳之间的σ键和π键吸收紫外线后能被激发
C. 分子中所有原子都满足8电子稳定结构
D. C、O原子的杂化方式均有两种
D
解析:分子中连接—CH2CH3的碳原子为手性碳原子,即分子中含有1个手性碳原子, 故A错误;σ键稳定、π键不稳定,π电子吸收紫外线后能被激发,从而防止皮肤被晒 伤,故B错误;分子中H原子满足2电子稳定结构,故C错误;饱和碳原子、饱和O原 子都采用sp3杂化,不饱和碳原子和不饱和氧原子都采用sp2杂化,故D正确。
C. P原子间难形成三键而N原子间可以,是因为P的原子半径大于N,难形成p-p π键
B
A. N2H4中N原子杂化方式为sp2,为平面形分子
C. CO(NH2)2中C、N、O三种元素第一电离能的大小顺序是C<N<O
D. 肼的沸点远高于乙烯的原因是肼能形成分子间氢键
D
A. 熔、沸点:吡咯<卟吩
C. 苯分子中也存在离域π键
D. 吡咯和卟吩中N原子的杂化方式都是sp3
D
A. 实验中C—I键的产生,可通过红外光谱结果证明
B. C—I键比C—Cl键更易形成,且键能更大
C. ClCH2COOH中存在sp2-sp3σ键
D. ClCH2COOH的酸性比CH3COOH强
B
解析:红外光谱可用于确定化学键类型,故A正确;I原子半径大于Cl,因此C—I键长 比C—Cl键长要长,键长越长,键能越小,故B错误;羧基中C原子采取sp2杂化,羧 基相连的碳原子采取sp3杂化,两碳原子之间形成sp2-sp3σ键,故C正确;Cl原子的电 负性大于H,导致ClCH2COOH中O—H键的极性大于CH3COOH中O—H键, ClCH2COOH中羧基更易电离出H+,酸性强于CH3COOH,故D正确。
二、非选择题(本题包括4个小题,共58分)
15. (14分)如图表示不同类型共价键形成时电子云重叠情况:
解析:以形成共价键的两原子核的连线为轴作旋转操作,共价键的电子云的图 形不变,这种共价键称为σ键,这种特征称为轴对称。σ键的种类有s-s σ键、s-p σ 键、p-pσ键三种。形成的化学键属于轴对称的有①2个s轨道以“头碰头”方式发生 重叠,形成稳定的σ键,②1个s轨道和1个p轨道,③2个p轨道以“头碰头”方式发生 重叠,形成稳定的σ键,故答案为①②③。
①②③
A. Cl2 B. HCl C. N2 D. H2
解析:方式①为s-sσ键,故为氢气,两个H原子通过1s轨道形成σ键;方式②为 s-pσ键,故为HCl,H原子通过1s轨道与Cl原子的3p轨道形成σ键;只通过方式③的 为p-pσ键,故为氯气,两个氯原子的3p轨道形成σ键;同时含有③、④、⑤三种方式 化学键的物质是氮气,两个N原子通过2px轨道形成σ键,同时另外2个py和2个pz轨道 分别以“肩并肩”的方式形成2个π键。
D
B
A
C
(3)甲、乙、丙三种有机物的结构如下:
甲:
8
2
有
不是
2∶1
②乙分子中含有C—H极性键,乙烯分子的正、负电荷重心重合,不是极性分子。
③丙分子中含有—C≡N,三键中含有1个σ键和2个π键,分子中σ键与π键的数目之比为 2∶1。
16. (15分)卤素单质及其化合物在生产、生活、化工、医药、材料等领域中有着非 常广泛的应用。回答下列问题:
解析:Br原子位于第4周期ⅦA族,价电子轨道表示式为 。
A. HCl易溶于H2O
B. Cl2易溶于NaOH溶液
C. Br2易溶于CCl4
D. I2易溶于CS2
B
解析:HCl为极性分子,H2O为极性分子,故HCl易溶于H2O符合“相似相溶” 原理,A正确;Cl2易溶于NaOH溶液是因为氯气和氢氧化钠溶液反应,不符合“相似 相溶”原理,B错误;Br2为非极性分子,CCl4为非极性分子,Br2易溶于CCl4,符合 “相似相溶”原理,C正确;I2为非极性分子,CS2为非极性分子,I2易溶于CS2,符合 “相似相溶”原理,D正确。
②
3∶1
(5)请在下图含溴有机物的结构简式中,用星号(*)标出含有的手性碳原子。
解析:手性碳原子为连有4个不同的原子或原子团的碳原子,可表示为 。
>
F的电负性比Cl大,F—C的极性大于Cl—C的极性,导致F3C—的极性大于
Cl3C—的极性,使得三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子
17. (14分)高氯酸三碳酰肼合镍
{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。回答下列问题:
解析:镍为28号元素,所以基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2。
1s22s22p63s23p63d84s2
解析:在同一原子轨道下最多可以有两个自旋状态不同的电子,自旋状态不 同,运动状态也就不相同,即运动状态个数等于电子数;基态碳原子核外电子有6种 不同运动状态。
6
4
四面体形
(4)化学式中的CHZ为碳酰肼,其结构为 ,是一种新型的环保锅
炉水除氧剂。
sp3
11
=
sp2、sp3
<
NCl3
A. 分子的极性:BCl3<NCl3
B. Mn的+2价比Fe的+2价稳定
C. 物质的沸点:HF<HCl
D. 在CS2中的溶解度:CCl4<H2O
AB
解析:BCl3是平面三角形,分子中正、负电荷重心重合,是非极性分子;NCl3 的N原子上有一对孤电子对,是三角锥形,分子中正、负电荷重心不重合,是极性分 子,所以分子极性:BCl3<NCl3,A正确;基态Mn原子的价电子排布式为3d54s2,Mn 的+2价离子3d轨道半充满,能量低更稳定,B正确;HCl分子间只存在分子间作用 力,而HF分子间除存在分子间作用力外,还存在分子间氢键,因此HF的沸点比HCl 的高,C错误;CCl4、CS2都是由非极性分子构成的物质,H2O是由极性分子构成的物 质,根据“相似相溶”原理可知,由非极性分子构成的溶质CCl4容易溶解在由非极性 分子构成的溶剂CS2中,由极性分子H2O构成的溶质不容易溶解在由非极性分子构成 的溶剂CS2中,所以溶解度:CCl4>H2O,D错误。
A. 某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7价
B. 钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C. CH2ClCOOH酸性大于CH3CH2COOH酸性
D. 邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
ACD
解析:某元素原子核外电子总数是最外层电子数的5倍,此元素是35号元素Br, 位于第4周期ⅦA族,价电子排布式为4s24p5,最高正价为+7价,A正确;金属钠比 镁活泼,容易失去电子,因此钠的第一电离能小于Mg的第一电离能,Na最外层只有 一个电子,再失去一个电子,出现能层的变化,需要的能量增大,Mg最外层有2个电 子,因此Na的第二电离能大于Mg的第二电离能,B错误;由于Cl电负性大于H,故酸 性:CH2ClCOOH>CH3CH2COOH,C正确;邻羟基苯甲醛形成分子内氢键,降低物 质熔点,对羟基苯甲醛形成分子间氢键,增大物质熔点,因此邻羟基苯甲醛的熔点低 于对羟基苯甲醛的熔点,D正确。
正四面体形
4
sp3
解析:苯胺比甲苯的熔、沸点都高,苯胺中存在电负性较强的N,可以形成氢 键,因此比甲苯的熔、沸点高。
苯胺分子之间存在氢键
(5)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl (用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
A. 中心原子的杂化轨道类型 B. 中心原子的价电子对数
C. 空间结构 D. 共价键类型
ABD
C
5
(H3O+)O—
H…N
