鲁科版高中化学选择性必修2第3章不同聚集状态的物质与性质第2节几种简单的晶体结构模型第2课时共价晶体课件(共51张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第3章不同聚集状态的物质与性质第2节几种简单的晶体结构模型第2课时共价晶体课件(共51张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览











文档简介
(共51张PPT)
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第2课时 共价晶体
第*页
研习任务一 共价晶体的概念及结构特点
[目标导航]能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间 的作用对共价晶体物理性质的影响。
教材 认知
共价晶体的概念及结构特点
共价键
空间立体网状
原子
共价键
饱和性
方向性
共价键
分子
[思考] 氮化硼是一种超硬、耐磨、耐高温的物质,是一种共价晶体,它的原子是否 服从紧密堆积排列? (填“是”或“否”),说明理由: 。
它与下列物质 (填序号)属于同种类型的晶体。
①硝酸钠和金刚石 ②晶体硅和水晶
③冰和干冰 ④苯和萘
提示:否 由于共价键具有方向性和饱和性,共价晶体中每个原子周围排列的原子的 数目是有限的,故原子的排列不服从紧密堆积排列 ②
探究 活动
1. 怎样从原子结构的角度理解金刚石、晶体硅和晶体锗的熔点和硬度依次下降?
提示:由于金刚石、晶体硅和晶体锗的结构相似,原子半径:C<Si<Ge,键长: C—C<Si—Si<Ge—Ge,键能:C—C>Si—Si>Ge—Ge,所以三者的熔点和硬度依 次下降。
2. “具有共价键的晶体叫作共价晶体”,这种说法对吗?为什么?
提示:这种说法不对。“具有共价键”并不是判定共价晶体的唯一条件,有些分子晶 体的分子内部也有共价键,如冰和干冰晶体都是分子晶体,但H2O和CO2中存在共价 键。对共价晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
重点 讲解
判断晶体类型(共价晶体和分子晶体)的方法
(1)依据组成晶体的粒子和粒子间的作用力判断
组成共价晶体的粒子是原子,粒子间的作用力是共价键;组成分子晶体的粒子是分 子,粒子间的作用力是分子间作用力。
(2)依据物质的分类判断
①常见的共价晶体有:金刚石、晶体硼、晶体锗等单质;SiO2、SiC、BN、AlN、 Si3N4等化合物。
新型无机非金属材料“家庭”的成员(如Si3N4、BN等)熔点高、硬度大、耐高温、 抗氧化,它们大多属于共价晶体。
②大多数非金属单质(金刚石、石墨、晶体硅等除外)、气态氢化物、非金属氧化物 (SiO2除外)、酸、绝大多数有机物(有机盐除外)都是分子晶体。
(3)依据晶体的熔点判断
共价晶体的熔、沸点高,常在1 000 ℃以上;分子晶体的熔、沸点低,常在数百摄氏 度以下甚至更低。
(4)依据物质的状态判断
一般常温下呈气态或液态的单质(Hg除外)与化合物,其呈固态时都属于分子 晶体。
(5)依据物质的挥发性判断
一般易挥发的物质呈固态时都属于分子晶体。
(6)依据导电性判断
分子晶体为非导体,但部分分子晶体溶于水后能够导电;共价晶体多数为非导体,但 晶体硅、晶体锗是半导体。
(7)依据硬度和机械性能判断
共价晶体的硬度大,分子晶体的硬度小且较脆。
研习 经典
A. 共价晶体中,只存在共价键
B. 共价晶体具有空间网状结构
C. 共价晶体中不存在独立的分子
D. 共价晶体熔化时不破坏共价键
解析:共价晶体中原子之间通过共价键相连,在共价晶体中只存在共价键,故A正 确;共价晶体是相邻原子之间通过共价键结合而形成的空间网状结构的晶体,故B正 确;共价晶体是由原子以共价键相结合而形成的,不存在独立的分子,故C正确;共 价晶体是原子间通过共价键结合而形成的,熔化时需要破坏共价键,故D错误。
D
①干冰 ②SiO2 ③晶体硅 ④白磷 ⑤氨基乙酸 ⑥固态He
A. ①②③④⑤⑥ B. ②③④⑥
C. ②③ D. ①②⑤⑥
解析:干冰、白磷、氨基乙酸和固态He属于分子晶体,SiO2和晶体硅属于共价晶体, 故选C。
C
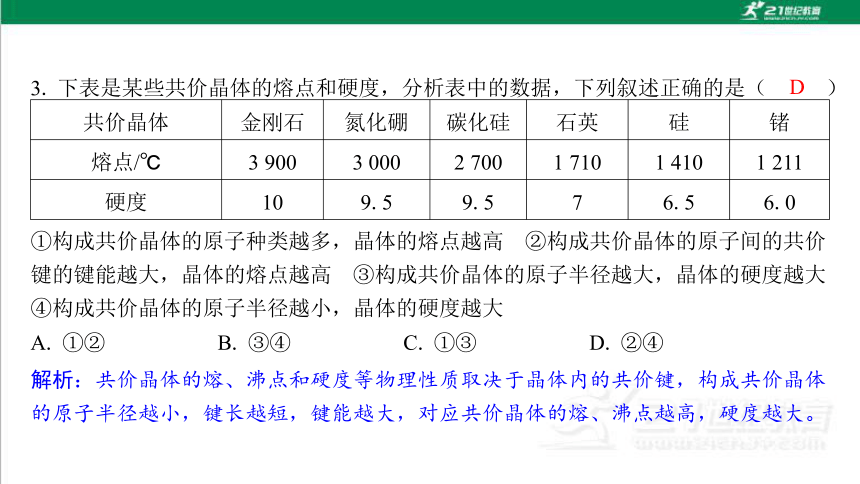
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ 3 900 3 000 2 700 1 710 1 410 1 211
硬度 10 9.5 9.5 7 6.5 6.0
D
①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价 键的键能越大,晶体的熔点越高 ③构成共价晶体的原子半径越大,晶体的硬度越大 ④构成共价晶体的原子半径越小,晶体的硬度越大
A. ①② B. ③④ C. ①③ D. ②④
解析:共价晶体的熔、沸点和硬度等物理性质取决于晶体内的共价键,构成共价晶体 的原子半径越小,键长越短,键能越大,对应共价晶体的熔、沸点越高,硬度越大。
第*页
研习任务二 典型共价晶体的结构分析与物理性质
教材 认知
一、典型共价晶体的结构分析
1. 金刚石晶体
(1)晶体结构示意图
4
109°28'
有限
松散
紧密堆积
2. SiC晶体
(1)晶体结构示意图
交替
1∶1
3. SiO2晶体
(1)晶体结构示意图
(2)结构分析
四
四
两
两
硅氧四面体
Si—O
1∶2
分子
[思考1] 水晶是一种宝石,晶体完好时呈六棱柱钻头形,它的成分是二氧化硅。水 晶的结构可以看成是硅晶体中每个Si—Si键中“插入”一个氧原子形成的。
(1)在水晶中“Si—O—Si”键 (填“是”或“不是”)直线形,原因 是 。
提示:不是 “Si—O—Si”键呈角形
(2)在SiO2晶体中,1 mol SiO2含 mol “Si—O”键。
提示:4
二、共价晶体的物理性质
根据表中有关数据分析,并填写表下面的空白。
晶体 键能/(kJ·mol-1) 熔点/℃ 硬度
金刚石 (C—C)347 大于3 500 10
碳化硅 (C—Si)301 2 830 9
晶体硅 (Si—Si)226 1 412 7
>
>
>
>
>
>
很高
很大
越小
越短
越大
[思考2] 为什么共价晶体结构比金属晶体和离子晶体结构松散,但却比金属晶体和 离子晶体有更强的稳定性?
提示:共价键具有方向性和饱和性,使共价晶体中某个原子周围结合的其他原子是有 限的,因此比较松散。但由于整个晶体中各原子都以强作用力的共价键相互结合,且 构成了空间网状结构,所以共价晶体更稳定。
探究 活动
下面是金刚石的多面体外形及晶体结构:
1. 金刚石晶体中有没有分子?晶体中碳原子之间的结合力是什么?
提示:金刚石晶体中不存在分子,存在的是碳原子。晶体中碳原子之间以共价 键结合。
2. 金刚石晶体中每个碳原子与几个碳原子相结合?这些碳原子之间形成的空间结构 是什么?碳原子的杂化轨道类型是什么?
提示:金刚石晶体中,每个碳原子与相邻的4个碳原子以共价键相结合,它们形成的 空间结构是正四面体形,碳原子采取sp3杂化。
3. 为什么金刚石的熔点高、硬度大?
提示:金刚石晶体中C—C共价键的键能很大,熔化时需破坏共价键,故金刚石的熔 点高、硬度大。
重点 讲解
金刚石、晶体硅、碳化硅、二氧化硅等共价晶体中的数值
(1)金刚石、晶体硅、碳化硅、二氧化硅等共价晶体中的成键数目。
①金刚石(或晶体硅)中,1 mol C(或Si)形成2 mol C—C(或Si—Si)。
②SiC晶体中,1 mol C或1 mol Si均形成4 mol C—Si。
③1 mol SiO2晶体中,共有4 mol Si—O。
(2)金刚石、晶体硅、碳化硅、二氧化碳中最小环上的原子数。
①金刚石、晶体硅、SiC晶体中最小环上的原子数分别为6个C、6个Si、3个Si和 3个C。
②SiO2晶体中最小环上有12个原子(6个Si和6个O)。
(3)金刚石、晶体硅的一个晶胞中,分别含有碳原子数为8、硅原子数为8。
研习 经典
1. 二氧化硅晶体是空间立体网状结构,如图所示:
C
A. 1 mol SiO2晶体中Si—O为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
解析:由二氧化硅晶体结构图可知,1个硅原子与周围4个氧原子形成了4个Si—O,1 mol SiO2含有1 mol硅原子,故1 mol SiO2晶体中含有的Si—O 为4 mol,故A错误;每 个硅原子周围连有4个氧原子,每个氧原子周围连有2个硅原子,Si、O原子个数比为 1∶2,化学式为SiO2,SiO2不是分子式,因为共价晶体不存在分子,故B错误;经过分 析可知,在SiO2晶体中,硅原子与氧原子最外层都达到了8电子稳定结构,故C正确; 由结构图可以看出,晶体中最小环上的原子数为12,其中包括6个硅原子和6个氧原 子,故D错误。
A. 氮化碳属于共价晶体
B. 氮化碳的化学式为C3N4
C. 碳、氮原子均采取sp3杂化
D. 1 mol氮化碳中含有4 mol N—C
D
解析:氮化碳为网状结构,硬度超过金刚石晶体,则氮化碳晶体为共价晶体,A项正确;
每个C与4个N形成共价键,每个N与3个C相连,所以氮化碳的化学式为C3N4,B项正确;
C、N原子均采取sp3杂化,C项正确;1 mol氮化碳中含有12 mol N—C,D项错误。
A. 共价晶体熔点高低取决于共价键的强弱
B. 共价晶体中所有原子之间以共价键结合成空间网状结构
C. 共价晶体中存在独立的“分子”
D. 共价晶体中必有共价键,不存在分子间作用力
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①Al2O3是两性氧化物
②硬度很大
③它的熔点为2 045 ℃
④自然界中的刚玉有红宝石和蓝宝石
A. ①② B. ②③ C. ①④ D. ③④
解析:Al2O3是两性氧化物,属于物质的分类,与晶体类型无关,①错误;硬度很 大、熔点为2 045 ℃(很高),都是共价晶体的物理性质,②③正确;红宝石、蓝宝 石是刚玉在自然界中的存在形式,与晶体类型无关,④错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 硬度:金刚石>碳化硅>晶体硅
B. 熔点:SiC>SiO2>Si>Ge
C. 沸点:HF>HBr>HCl
D. 硬度:白磷>冰>二氧化硅
解析:二氧化硅为共价晶体,硬度比分子晶体白磷、冰的大。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. n(Si)∶n(O)∶n(Si—O键)=1∶2∶4
B. CO2和SiO2是等电子体,晶体类型相同
C. 晶体中Si原子杂化方式为sp3,O原子杂化方式为sp
D. 晶体中最小环上的原子数为6
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:根据图知,该晶体中每个Si原子连接4个O原子、每个O原子连接2个Si原子,则 Si、O原子个数之比为2∶4=1∶2,每个Si原子含有4个硅氧键,则n(Si)∶n(O)∶n (Si—O键)=1∶2∶4,A正确;CO2晶体是由分子构成的,SiO2晶体是由原子构成的, 前者为分子晶体,后者为共价晶体,晶体类型不同,B错误;该晶体中每个Si原子形 成4个共价键,每个O原子形成2个共价键,且每个O原子还含有2对孤电子对,则Si、 O原子的价电子对数都是4,则Si、O原子都采用sp3杂化,C错误;由二氧化硅晶体结 构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为 12,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 熔点2 700 ℃,导电性好,延展性强
B. 无色晶体,熔点3 550 ℃,不导电,质硬,难溶于水和有机溶剂
C. 无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D. 熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
解析:延展性好不是共价晶体的特征,因为共价晶体中原子与原子之间以共价键结 合,而共价键有一定的方向性,使共价晶体质硬而脆,A项不符合,B项符合;C项不 符合共价晶体的特征;D项符合分子晶体的特征。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
晶体 AlCl3 SiCl4 晶体硼 金刚石 晶体硅
熔点/℃ 190 -60 2 300 3 550 1 410
沸点/℃ 183 57 2 550 4 827 2 355
A. SiCl4是分子晶体
B. 晶体硼是共价晶体
C. AlCl3是分子晶体,加热能升华
D. 金刚石中的C—C比晶体硅中的Si—Si弱
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:由题表中数据可知,SiCl4的熔、沸点较低,属于分子晶体,故A正确; 晶体硼的熔、沸点很高,所以晶体硼是共价晶体,故B正确;由题表中数据可 知,AlCl3的沸点比熔点高,所以AlCl3加热能升华,故C正确;C原子半径小于 Si的原子半径,金刚石中的C—C键长比晶体硅中的Si—Si键长短,键能也大, C—C比Si—Si强,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 在含4 mol Si—O二氧化硅晶体中,氧原子的数目为4NA
B. 金刚石晶体中,碳原子数与C—C数目之比为1∶2
C. 30 g二氧化硅晶体中含有0.5NA个二氧化硅分子
D. 晶体硅、晶体氖均是由相应原子直接构成的共价晶体
B
解析:在含4 mol Si—O二氧化硅晶体中,含Si原子是1 mol,由于O原子与2个Si原子 形成Si—O共价键,所以在含4 mol Si—O二氧化硅晶体中,含氧原子的数目为2NA, A错误;在金刚石晶体中,碳原子与相邻的4个C原子形成4个C—C,每个C—C为形成 共价键的2个C所共有,所以C原子数与C—C数目之比为1∶2,B正确;二氧化硅晶体属 于共价晶体,无二氧化硅分子,C错误;晶体硅是由相应原子直接构成的共价晶体, 晶体氖属于分子晶体,构成微粒是分子,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 该晶体属于共价晶体,其化学键比金刚石中的碳碳键更牢固
B. 该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. 该晶体与金刚石相似,碳原子个数与碳氮单键之比为1∶2
D. 该晶体中碳原子和氮原子的最外层都满足8电子结构
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合,则 C3N4晶体为共价晶体,碳最外层有4个电子,氮最外层有5个电子,则每个碳原子连接 4个氮原子、每个氮原子连接3个碳原子。晶体具有比金刚石还大的硬度,则该晶体属 于共价晶体,其化学键比金刚石更牢固,A正确;因为C的最外层有4个电子,每个电 子与另一个N形成C—N(一对共用电子对),因此一个碳原子连接4个N原子,因为N 的最外层有5个电子,每个单电子与另一个C形成N—C(一对共用电子对),因此一 个N原子连接3个C原子,B正确;根据以上分析可知,该晶体中碳原子个数与碳氮单 键之比为1∶4,C错误;构成该晶体的微粒间只以单键结合,每个碳原子连接4个氮原 子、每个氮原子连接3个碳原子,则晶体中碳原子和氮原子的最外层都满足8电子结 构,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 磷化硼的化学式为BP,其晶体属于分子晶体
B. 磷化硼晶体的熔点高,且熔融状态下能导电
C. 磷化硼晶体中每个原子均参与形成4个共价键
D. 磷化硼晶体在熔化时需克服范德华力
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 11B和10B互为同位素
B. N原子周围等距且最近的B原子数为4
C. 该晶胞中含有4个B原子,4个N原子
D. 立方氮化硼晶体属于共价晶体
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. S位于元素周期表p区
B. 该物质的化学式为H3S
C. S位于H构成的八面体空隙中
D. 该晶体属于分子晶体
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. SiC晶体中碳原子和硅原子均采取sp3杂化
B. 硅单质的熔点低于2 700 ℃
C. 距离硅原子最近的硅原子数为4
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
共价
解析:氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子、Si原子 和Si原子不直接相连,同时每个原子都满足8电子稳定结构,因此氮化硅的化学式为 Si3N4。
Si3N4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
共价晶体
12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4
正四面体形
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
第3章 不同聚集状态的物质与性质
第2节 几种简单的晶体结构模型
第2课时 共价晶体
第*页
研习任务一 共价晶体的概念及结构特点
[目标导航]能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间 的作用对共价晶体物理性质的影响。
教材 认知
共价晶体的概念及结构特点
共价键
空间立体网状
原子
共价键
饱和性
方向性
共价键
分子
[思考] 氮化硼是一种超硬、耐磨、耐高温的物质,是一种共价晶体,它的原子是否 服从紧密堆积排列? (填“是”或“否”),说明理由: 。
它与下列物质 (填序号)属于同种类型的晶体。
①硝酸钠和金刚石 ②晶体硅和水晶
③冰和干冰 ④苯和萘
提示:否 由于共价键具有方向性和饱和性,共价晶体中每个原子周围排列的原子的 数目是有限的,故原子的排列不服从紧密堆积排列 ②
探究 活动
1. 怎样从原子结构的角度理解金刚石、晶体硅和晶体锗的熔点和硬度依次下降?
提示:由于金刚石、晶体硅和晶体锗的结构相似,原子半径:C<Si<Ge,键长: C—C<Si—Si<Ge—Ge,键能:C—C>Si—Si>Ge—Ge,所以三者的熔点和硬度依 次下降。
2. “具有共价键的晶体叫作共价晶体”,这种说法对吗?为什么?
提示:这种说法不对。“具有共价键”并不是判定共价晶体的唯一条件,有些分子晶 体的分子内部也有共价键,如冰和干冰晶体都是分子晶体,但H2O和CO2中存在共价 键。对共价晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
重点 讲解
判断晶体类型(共价晶体和分子晶体)的方法
(1)依据组成晶体的粒子和粒子间的作用力判断
组成共价晶体的粒子是原子,粒子间的作用力是共价键;组成分子晶体的粒子是分 子,粒子间的作用力是分子间作用力。
(2)依据物质的分类判断
①常见的共价晶体有:金刚石、晶体硼、晶体锗等单质;SiO2、SiC、BN、AlN、 Si3N4等化合物。
新型无机非金属材料“家庭”的成员(如Si3N4、BN等)熔点高、硬度大、耐高温、 抗氧化,它们大多属于共价晶体。
②大多数非金属单质(金刚石、石墨、晶体硅等除外)、气态氢化物、非金属氧化物 (SiO2除外)、酸、绝大多数有机物(有机盐除外)都是分子晶体。
(3)依据晶体的熔点判断
共价晶体的熔、沸点高,常在1 000 ℃以上;分子晶体的熔、沸点低,常在数百摄氏 度以下甚至更低。
(4)依据物质的状态判断
一般常温下呈气态或液态的单质(Hg除外)与化合物,其呈固态时都属于分子 晶体。
(5)依据物质的挥发性判断
一般易挥发的物质呈固态时都属于分子晶体。
(6)依据导电性判断
分子晶体为非导体,但部分分子晶体溶于水后能够导电;共价晶体多数为非导体,但 晶体硅、晶体锗是半导体。
(7)依据硬度和机械性能判断
共价晶体的硬度大,分子晶体的硬度小且较脆。
研习 经典
A. 共价晶体中,只存在共价键
B. 共价晶体具有空间网状结构
C. 共价晶体中不存在独立的分子
D. 共价晶体熔化时不破坏共价键
解析:共价晶体中原子之间通过共价键相连,在共价晶体中只存在共价键,故A正 确;共价晶体是相邻原子之间通过共价键结合而形成的空间网状结构的晶体,故B正 确;共价晶体是由原子以共价键相结合而形成的,不存在独立的分子,故C正确;共 价晶体是原子间通过共价键结合而形成的,熔化时需要破坏共价键,故D错误。
D
①干冰 ②SiO2 ③晶体硅 ④白磷 ⑤氨基乙酸 ⑥固态He
A. ①②③④⑤⑥ B. ②③④⑥
C. ②③ D. ①②⑤⑥
解析:干冰、白磷、氨基乙酸和固态He属于分子晶体,SiO2和晶体硅属于共价晶体, 故选C。
C
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ 3 900 3 000 2 700 1 710 1 410 1 211
硬度 10 9.5 9.5 7 6.5 6.0
D
①构成共价晶体的原子种类越多,晶体的熔点越高 ②构成共价晶体的原子间的共价 键的键能越大,晶体的熔点越高 ③构成共价晶体的原子半径越大,晶体的硬度越大 ④构成共价晶体的原子半径越小,晶体的硬度越大
A. ①② B. ③④ C. ①③ D. ②④
解析:共价晶体的熔、沸点和硬度等物理性质取决于晶体内的共价键,构成共价晶体 的原子半径越小,键长越短,键能越大,对应共价晶体的熔、沸点越高,硬度越大。
第*页
研习任务二 典型共价晶体的结构分析与物理性质
教材 认知
一、典型共价晶体的结构分析
1. 金刚石晶体
(1)晶体结构示意图
4
109°28'
有限
松散
紧密堆积
2. SiC晶体
(1)晶体结构示意图
交替
1∶1
3. SiO2晶体
(1)晶体结构示意图
(2)结构分析
四
四
两
两
硅氧四面体
Si—O
1∶2
分子
[思考1] 水晶是一种宝石,晶体完好时呈六棱柱钻头形,它的成分是二氧化硅。水 晶的结构可以看成是硅晶体中每个Si—Si键中“插入”一个氧原子形成的。
(1)在水晶中“Si—O—Si”键 (填“是”或“不是”)直线形,原因 是 。
提示:不是 “Si—O—Si”键呈角形
(2)在SiO2晶体中,1 mol SiO2含 mol “Si—O”键。
提示:4
二、共价晶体的物理性质
根据表中有关数据分析,并填写表下面的空白。
晶体 键能/(kJ·mol-1) 熔点/℃ 硬度
金刚石 (C—C)347 大于3 500 10
碳化硅 (C—Si)301 2 830 9
晶体硅 (Si—Si)226 1 412 7
>
>
>
>
>
>
很高
很大
越小
越短
越大
[思考2] 为什么共价晶体结构比金属晶体和离子晶体结构松散,但却比金属晶体和 离子晶体有更强的稳定性?
提示:共价键具有方向性和饱和性,使共价晶体中某个原子周围结合的其他原子是有 限的,因此比较松散。但由于整个晶体中各原子都以强作用力的共价键相互结合,且 构成了空间网状结构,所以共价晶体更稳定。
探究 活动
下面是金刚石的多面体外形及晶体结构:
1. 金刚石晶体中有没有分子?晶体中碳原子之间的结合力是什么?
提示:金刚石晶体中不存在分子,存在的是碳原子。晶体中碳原子之间以共价 键结合。
2. 金刚石晶体中每个碳原子与几个碳原子相结合?这些碳原子之间形成的空间结构 是什么?碳原子的杂化轨道类型是什么?
提示:金刚石晶体中,每个碳原子与相邻的4个碳原子以共价键相结合,它们形成的 空间结构是正四面体形,碳原子采取sp3杂化。
3. 为什么金刚石的熔点高、硬度大?
提示:金刚石晶体中C—C共价键的键能很大,熔化时需破坏共价键,故金刚石的熔 点高、硬度大。
重点 讲解
金刚石、晶体硅、碳化硅、二氧化硅等共价晶体中的数值
(1)金刚石、晶体硅、碳化硅、二氧化硅等共价晶体中的成键数目。
①金刚石(或晶体硅)中,1 mol C(或Si)形成2 mol C—C(或Si—Si)。
②SiC晶体中,1 mol C或1 mol Si均形成4 mol C—Si。
③1 mol SiO2晶体中,共有4 mol Si—O。
(2)金刚石、晶体硅、碳化硅、二氧化碳中最小环上的原子数。
①金刚石、晶体硅、SiC晶体中最小环上的原子数分别为6个C、6个Si、3个Si和 3个C。
②SiO2晶体中最小环上有12个原子(6个Si和6个O)。
(3)金刚石、晶体硅的一个晶胞中,分别含有碳原子数为8、硅原子数为8。
研习 经典
1. 二氧化硅晶体是空间立体网状结构,如图所示:
C
A. 1 mol SiO2晶体中Si—O为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
解析:由二氧化硅晶体结构图可知,1个硅原子与周围4个氧原子形成了4个Si—O,1 mol SiO2含有1 mol硅原子,故1 mol SiO2晶体中含有的Si—O 为4 mol,故A错误;每 个硅原子周围连有4个氧原子,每个氧原子周围连有2个硅原子,Si、O原子个数比为 1∶2,化学式为SiO2,SiO2不是分子式,因为共价晶体不存在分子,故B错误;经过分 析可知,在SiO2晶体中,硅原子与氧原子最外层都达到了8电子稳定结构,故C正确; 由结构图可以看出,晶体中最小环上的原子数为12,其中包括6个硅原子和6个氧原 子,故D错误。
A. 氮化碳属于共价晶体
B. 氮化碳的化学式为C3N4
C. 碳、氮原子均采取sp3杂化
D. 1 mol氮化碳中含有4 mol N—C
D
解析:氮化碳为网状结构,硬度超过金刚石晶体,则氮化碳晶体为共价晶体,A项正确;
每个C与4个N形成共价键,每个N与3个C相连,所以氮化碳的化学式为C3N4,B项正确;
C、N原子均采取sp3杂化,C项正确;1 mol氮化碳中含有12 mol N—C,D项错误。
A. 共价晶体熔点高低取决于共价键的强弱
B. 共价晶体中所有原子之间以共价键结合成空间网状结构
C. 共价晶体中存在独立的“分子”
D. 共价晶体中必有共价键,不存在分子间作用力
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
①Al2O3是两性氧化物
②硬度很大
③它的熔点为2 045 ℃
④自然界中的刚玉有红宝石和蓝宝石
A. ①② B. ②③ C. ①④ D. ③④
解析:Al2O3是两性氧化物,属于物质的分类,与晶体类型无关,①错误;硬度很 大、熔点为2 045 ℃(很高),都是共价晶体的物理性质,②③正确;红宝石、蓝宝 石是刚玉在自然界中的存在形式,与晶体类型无关,④错误。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 硬度:金刚石>碳化硅>晶体硅
B. 熔点:SiC>SiO2>Si>Ge
C. 沸点:HF>HBr>HCl
D. 硬度:白磷>冰>二氧化硅
解析:二氧化硅为共价晶体,硬度比分子晶体白磷、冰的大。
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. n(Si)∶n(O)∶n(Si—O键)=1∶2∶4
B. CO2和SiO2是等电子体,晶体类型相同
C. 晶体中Si原子杂化方式为sp3,O原子杂化方式为sp
D. 晶体中最小环上的原子数为6
A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:根据图知,该晶体中每个Si原子连接4个O原子、每个O原子连接2个Si原子,则 Si、O原子个数之比为2∶4=1∶2,每个Si原子含有4个硅氧键,则n(Si)∶n(O)∶n (Si—O键)=1∶2∶4,A正确;CO2晶体是由分子构成的,SiO2晶体是由原子构成的, 前者为分子晶体,后者为共价晶体,晶体类型不同,B错误;该晶体中每个Si原子形 成4个共价键,每个O原子形成2个共价键,且每个O原子还含有2对孤电子对,则Si、 O原子的价电子对数都是4,则Si、O原子都采用sp3杂化,C错误;由二氧化硅晶体结 构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为 12,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 熔点2 700 ℃,导电性好,延展性强
B. 无色晶体,熔点3 550 ℃,不导电,质硬,难溶于水和有机溶剂
C. 无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D. 熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
解析:延展性好不是共价晶体的特征,因为共价晶体中原子与原子之间以共价键结 合,而共价键有一定的方向性,使共价晶体质硬而脆,A项不符合,B项符合;C项不 符合共价晶体的特征;D项符合分子晶体的特征。
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
晶体 AlCl3 SiCl4 晶体硼 金刚石 晶体硅
熔点/℃ 190 -60 2 300 3 550 1 410
沸点/℃ 183 57 2 550 4 827 2 355
A. SiCl4是分子晶体
B. 晶体硼是共价晶体
C. AlCl3是分子晶体,加热能升华
D. 金刚石中的C—C比晶体硅中的Si—Si弱
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:由题表中数据可知,SiCl4的熔、沸点较低,属于分子晶体,故A正确; 晶体硼的熔、沸点很高,所以晶体硼是共价晶体,故B正确;由题表中数据可 知,AlCl3的沸点比熔点高,所以AlCl3加热能升华,故C正确;C原子半径小于 Si的原子半径,金刚石中的C—C键长比晶体硅中的Si—Si键长短,键能也大, C—C比Si—Si强,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 在含4 mol Si—O二氧化硅晶体中,氧原子的数目为4NA
B. 金刚石晶体中,碳原子数与C—C数目之比为1∶2
C. 30 g二氧化硅晶体中含有0.5NA个二氧化硅分子
D. 晶体硅、晶体氖均是由相应原子直接构成的共价晶体
B
解析:在含4 mol Si—O二氧化硅晶体中,含Si原子是1 mol,由于O原子与2个Si原子 形成Si—O共价键,所以在含4 mol Si—O二氧化硅晶体中,含氧原子的数目为2NA, A错误;在金刚石晶体中,碳原子与相邻的4个C原子形成4个C—C,每个C—C为形成 共价键的2个C所共有,所以C原子数与C—C数目之比为1∶2,B正确;二氧化硅晶体属 于共价晶体,无二氧化硅分子,C错误;晶体硅是由相应原子直接构成的共价晶体, 晶体氖属于分子晶体,构成微粒是分子,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 该晶体属于共价晶体,其化学键比金刚石中的碳碳键更牢固
B. 该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. 该晶体与金刚石相似,碳原子个数与碳氮单键之比为1∶2
D. 该晶体中碳原子和氮原子的最外层都满足8电子结构
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合,则 C3N4晶体为共价晶体,碳最外层有4个电子,氮最外层有5个电子,则每个碳原子连接 4个氮原子、每个氮原子连接3个碳原子。晶体具有比金刚石还大的硬度,则该晶体属 于共价晶体,其化学键比金刚石更牢固,A正确;因为C的最外层有4个电子,每个电 子与另一个N形成C—N(一对共用电子对),因此一个碳原子连接4个N原子,因为N 的最外层有5个电子,每个单电子与另一个C形成N—C(一对共用电子对),因此一 个N原子连接3个C原子,B正确;根据以上分析可知,该晶体中碳原子个数与碳氮单 键之比为1∶4,C错误;构成该晶体的微粒间只以单键结合,每个碳原子连接4个氮原 子、每个氮原子连接3个碳原子,则晶体中碳原子和氮原子的最外层都满足8电子结 构,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 磷化硼的化学式为BP,其晶体属于分子晶体
B. 磷化硼晶体的熔点高,且熔融状态下能导电
C. 磷化硼晶体中每个原子均参与形成4个共价键
D. 磷化硼晶体在熔化时需克服范德华力
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. 11B和10B互为同位素
B. N原子周围等距且最近的B原子数为4
C. 该晶胞中含有4个B原子,4个N原子
D. 立方氮化硼晶体属于共价晶体
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. S位于元素周期表p区
B. 该物质的化学式为H3S
C. S位于H构成的八面体空隙中
D. 该晶体属于分子晶体
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A. SiC晶体中碳原子和硅原子均采取sp3杂化
B. 硅单质的熔点低于2 700 ℃
C. 距离硅原子最近的硅原子数为4
C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
共价
解析:氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子、Si原子 和Si原子不直接相连,同时每个原子都满足8电子稳定结构,因此氮化硅的化学式为 Si3N4。
Si3N4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
共价晶体
12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4
正四面体形
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
