鲁科版高中化学选择性必修2第3章不同聚集状态的物质与性质微专题五常见的晶体结构课件(共17张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第3章不同聚集状态的物质与性质微专题五常见的晶体结构课件(共17张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
微专题五 常见的晶体结构
专题 精讲
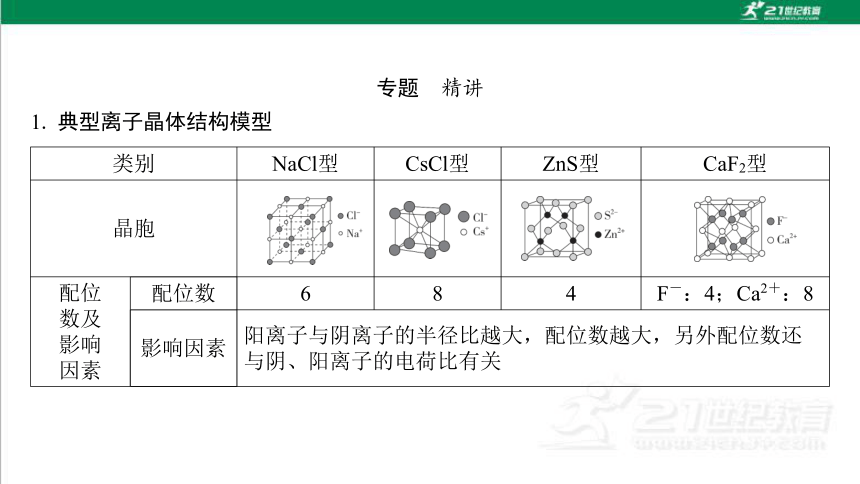
1. 典型离子晶体结构模型
类别 NaCl型 CsCl型 ZnS型 CaF2型
晶胞
配位 数及
影响 因素 配位数 6 8 4 F-:4;Ca2+:8
影响因素 阳离子与阴离子的半径比越大,配位数越大,另外配位数还与阴、阳离子的电荷比有关
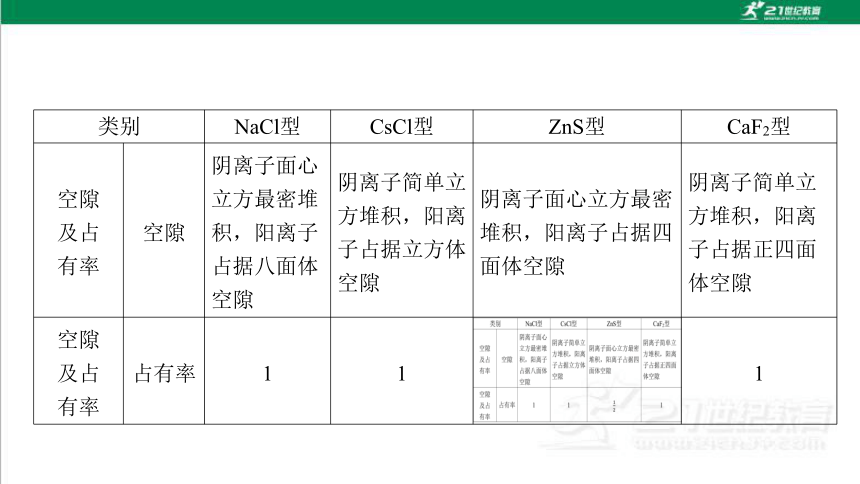
类别 NaCl型 CsCl型 ZnS型 CaF2型
空隙 及占 有率 空隙 阴离子面心立方最密堆积,阳离子占据八面体空隙 阴离子简单立方堆积,阳离子占据立方体空隙 阴离子面心立方最密堆积,阳离子占据四面体空隙 阴离子简单立方堆积,阳离子占据正四面体空隙
空隙 及占 有率 占有率 1 1 1
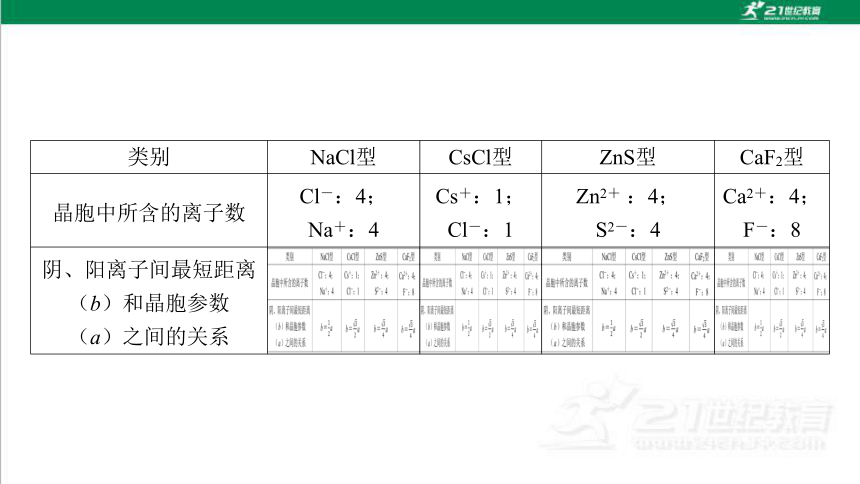
类别 NaCl型 CsCl型 ZnS型 CaF2型
晶胞中所含的离子数 Cl-:4; Na+:4 Cs+:1;
Cl-:1 Zn2+ :4;
S2-:4 Ca2+:4;
F-:8
阴、阳离子间最短距离 (b)和晶胞参数 (a)之间的关系
2. 典型共价晶体结构模型
晶体 晶体结构 结构分析
金
刚 石
晶体 晶体结构 结构分析
SiO2
晶体 晶体结构 结构分析
SiC、 BP、
AlN
3. 典型分子晶体结构模型
晶体 晶体结构 结构分析
干冰
白磷
4. 混合型晶体——石墨晶体
(1)石墨晶体属于混合型晶体,呈层状结构,每一层内碳原子之间以共价键的形式 形成平面六元并环结构。
(2)平均每个正六边形拥有2个碳原子,1 mol石墨中有1.5 mol C—C键;碳原子采 取sp2杂化。
(3)每一层内碳碳键的键长为1.42×10-10 m,比金刚石中碳碳键的键长(1.54×10 -10 m)短,所以石墨的熔、沸点高于金刚石。
层与层之间以分子间作用力结合,所 以石墨的硬度不大,有滑腻感,能导电。
专题 训练
A. NaCl中Na+的配位数大于干冰中CO2分子的配位数
B. CO2晶胞中,CO2分子的排列方式只有1种方向
C. 若金刚石的晶胞棱长为a cm,其中两个最近的碳原子之间的距离为a/2 cm
D. 石墨晶体层内是共价键,层间是范德华力,所以石墨是一种混合型晶体
D
A. CaO2晶体中,Ca2+的配位数为6
B. 氧化镁晶体中,与Mg2+距离最近且等距的Mg2+有8个
C. 碘晶体中,存在非极性共价键和范德华力
D. 金刚石晶体中,碳碳键的键角为109°28'
B
解析:由图可知,Ca2+位于顶角和面心,过氧根位于棱心和体心,与Ca2+等距且最 近的过氧根位于上下前后左右,共有6个,即CaO2晶胞中,Ca2+的配位数为6,A正 确;氧化镁晶体中,与顶角的Mg2+最近且等距的Mg2+位于面心,个数为12,B错 误;在碘晶体中,I2分子间存在范德华力,I2分子内存在碘碘非极性共价键,C正确; 在金刚石晶体中,每个C原子采取sp3杂化轨道与相邻的4个碳原子结合,碳碳键夹角 为109°28',D正确。
A. 一个晶胞中As原子的个数为2
B. 砷化镓晶体中每个原子均形成4个共价键
C. As的配位数是2
D. 砷化锌、砷化铝、砷化硼的熔、沸点逐渐降低
B
A. CaF2晶体属于离子晶体
C. 可用质谱法区分40Ca 和42Ca
B
微专题五 常见的晶体结构
专题 精讲
1. 典型离子晶体结构模型
类别 NaCl型 CsCl型 ZnS型 CaF2型
晶胞
配位 数及
影响 因素 配位数 6 8 4 F-:4;Ca2+:8
影响因素 阳离子与阴离子的半径比越大,配位数越大,另外配位数还与阴、阳离子的电荷比有关
类别 NaCl型 CsCl型 ZnS型 CaF2型
空隙 及占 有率 空隙 阴离子面心立方最密堆积,阳离子占据八面体空隙 阴离子简单立方堆积,阳离子占据立方体空隙 阴离子面心立方最密堆积,阳离子占据四面体空隙 阴离子简单立方堆积,阳离子占据正四面体空隙
空隙 及占 有率 占有率 1 1 1
类别 NaCl型 CsCl型 ZnS型 CaF2型
晶胞中所含的离子数 Cl-:4; Na+:4 Cs+:1;
Cl-:1 Zn2+ :4;
S2-:4 Ca2+:4;
F-:8
阴、阳离子间最短距离 (b)和晶胞参数 (a)之间的关系
2. 典型共价晶体结构模型
晶体 晶体结构 结构分析
金
刚 石
晶体 晶体结构 结构分析
SiO2
晶体 晶体结构 结构分析
SiC、 BP、
AlN
3. 典型分子晶体结构模型
晶体 晶体结构 结构分析
干冰
白磷
4. 混合型晶体——石墨晶体
(1)石墨晶体属于混合型晶体,呈层状结构,每一层内碳原子之间以共价键的形式 形成平面六元并环结构。
(2)平均每个正六边形拥有2个碳原子,1 mol石墨中有1.5 mol C—C键;碳原子采 取sp2杂化。
(3)每一层内碳碳键的键长为1.42×10-10 m,比金刚石中碳碳键的键长(1.54×10 -10 m)短,所以石墨的熔、沸点高于金刚石。
层与层之间以分子间作用力结合,所 以石墨的硬度不大,有滑腻感,能导电。
专题 训练
A. NaCl中Na+的配位数大于干冰中CO2分子的配位数
B. CO2晶胞中,CO2分子的排列方式只有1种方向
C. 若金刚石的晶胞棱长为a cm,其中两个最近的碳原子之间的距离为a/2 cm
D. 石墨晶体层内是共价键,层间是范德华力,所以石墨是一种混合型晶体
D
A. CaO2晶体中,Ca2+的配位数为6
B. 氧化镁晶体中,与Mg2+距离最近且等距的Mg2+有8个
C. 碘晶体中,存在非极性共价键和范德华力
D. 金刚石晶体中,碳碳键的键角为109°28'
B
解析:由图可知,Ca2+位于顶角和面心,过氧根位于棱心和体心,与Ca2+等距且最 近的过氧根位于上下前后左右,共有6个,即CaO2晶胞中,Ca2+的配位数为6,A正 确;氧化镁晶体中,与顶角的Mg2+最近且等距的Mg2+位于面心,个数为12,B错 误;在碘晶体中,I2分子间存在范德华力,I2分子内存在碘碘非极性共价键,C正确; 在金刚石晶体中,每个C原子采取sp3杂化轨道与相邻的4个碳原子结合,碳碳键夹角 为109°28',D正确。
A. 一个晶胞中As原子的个数为2
B. 砷化镓晶体中每个原子均形成4个共价键
C. As的配位数是2
D. 砷化锌、砷化铝、砷化硼的熔、沸点逐渐降低
B
A. CaF2晶体属于离子晶体
C. 可用质谱法区分40Ca 和42Ca
B
