鲁科版高中化学选择性必修2第3章不同聚集状态的物质与性质章末总结课件(共32张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第3章不同聚集状态的物质与性质章末总结课件(共32张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-11 00:00:00 | ||
图片预览









文档简介
(共32张PPT)
第3章 不同聚集状态的物质与性质
章末总结
第*页
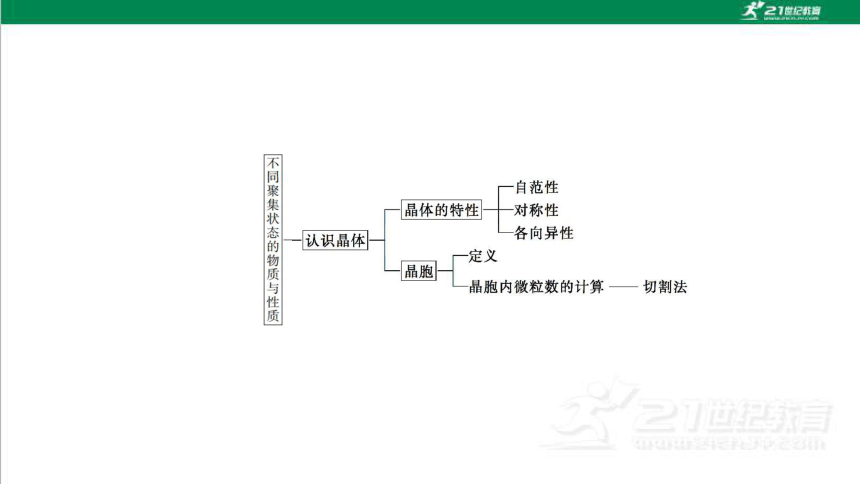
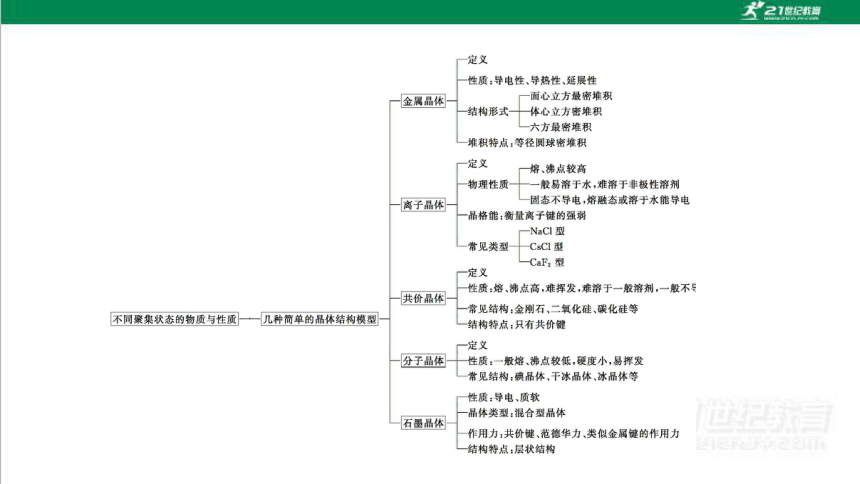
知识网络构建
第*页
高考素养提升
考向一 晶体结构的分析与计算
A. 与石墨相比,(CF)x导电性增强
B. 与石墨相比,(CF)x抗氧化性增强
C. (CF)x中C—C的键长比C—F短
D. 1 mol(CF)x中含有2x mol共价单键
B
解析:石墨晶体中每个碳原子上未参与杂化的1个2p轨道上电子在层内离域运 动,故石墨晶体能导电,而(CF)x中没有未参与杂化的2p轨道上的电子,故与 石墨相比,(CF)x导电性减弱,A错误;(CF)x中C原子的所有电子均参与成 键,未有未参与成键的孤电子或者不饱和键,故与石墨相比,(CF)x抗氧化性 增强,B正确;已知C的原子半径比F的大,故可知(CF)x中C—C的键长比C— F长,C错误;由题干结构示意图可知,在(CF)x中C与周围的3个碳原子形成 共价键,每个C—C键被2个碳原子共用,和1个F原子形成共价键,即1 mol (CF)x中含有2.5x mol共价单键,D错误。
2. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
A. 三种物质中均有碳碳原子间的σ键
B. 三种物质中的碳原子都是sp3杂化
C. 三种物质的晶体类型相同
D. 三种物质均能导电
A
解析:金刚石中所有碳原子均采取sp3杂化,石墨中所有碳原子均采取sp2杂化,石墨 炔中苯环上的碳原子采取sp2杂化,碳碳三键上的碳原子采取sp杂化,B项错误;金刚 石为共价晶体,石墨炔为分子晶体,石墨为混合型晶体,C项错误;金刚石中没有自 由移动电子,不能导电,D项错误。
A. 晶体最简化学式为KCaB6C6
B. 晶体中与K+最近且距离相等的Ca2+有8个
C. 晶胞中B和C原子构成的多面体有12个面
C
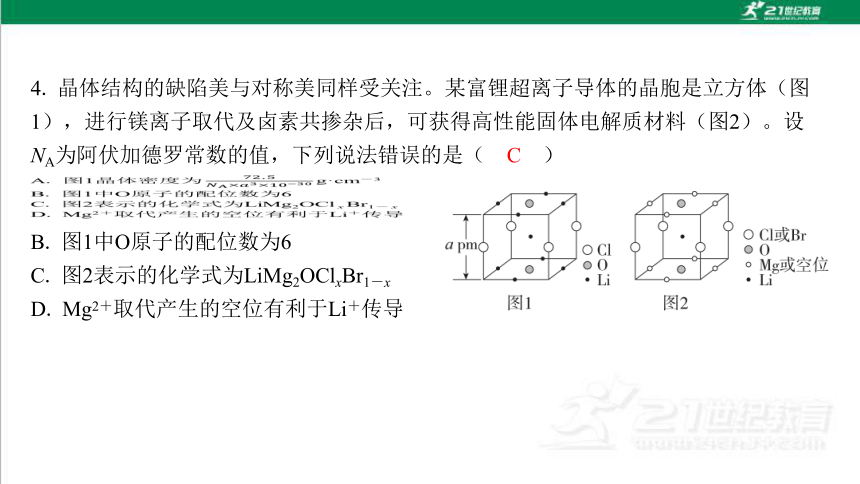
B. 图1中O原子的配位数为6
C. 图2表示的化学式为LiMg2OClxBr1-x
D. Mg2+取代产生的空位有利于Li+传导
C
A. LaH2晶体中La的配位数为8
B. 晶体中H和H的最短距离:LaH2>LaHx
C. 在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
C
A. 该氧化物的化学式为ZrO2
D. 若坐标取向不变,将p点Zr原子平移至原点,
则q点Zr原子位于晶胞xy面的面心
B
A. 中心原子的配位数是4
B. 晶胞中配合物分子的数目为2
C. 晶体中相邻分子间存在范德华力
D. 该晶体属于混合型晶体
D
8. 铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。
2
2∶1
bc
Ca2+
10. 钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图 所示:
KFe2Se2
解析:由平面投影图可知,位于棱上的铁原子与位于
面上的硒原子的距离最近,所以铁原子的配位数为4。
4
11. 如图是CZTS四元半导体化合物的四方晶胞。
Cu2ZnSnS4
考向二 配合物理论
A. Al2Cl6的结构式为
B. Al2Cl6为非极性分子
C. 该反应中NH3的配位能力大于氯
D. Al2Br6比Al2Cl6更难与NH3发生反应
D
解析:由双聚氯化铝分子中所有原子均满足8电子稳定结构可知,分子的结构式 为 ,则双聚氯化铝分子为结构对称的非极性分子,故A、B正确;由 化学方程式可知,氨分子更易与具有空轨道的铝原子形成配位键,配位能力大于氯原 子,故C正确;溴元素的电负性小于氯元素,溴原子的原子半径大于氯原子,则铝溴 键弱于铝氯键,所以双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与氨气反应, 故D错误。
13. 我国科学家发现一种钡配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中 间体包括Ⅱ和Ⅲ。
( 代表单键、双键或三键)
回答下列问题:
解析:根据配合物Ⅰ的结构图知,中心原子钒的配位原子有C、O、P、Cl。
C、O、P、Cl
解析:根据VSEPR模型,中心原子氧原子的价电子对数为4,其中孤电子对数为2,空间结构呈角形。
根据VSEPR模
型,氧原子的价电子对数为4,其中孤电子对数为2
解析:配合物Ⅱ中,第一电离能最大的配位原子是N。
N
解析:结合题干所给配合物Ⅱ和Ⅲ的结构,钒的化合价分别为+4和+3,配合物 Ⅱ中氮原子间是氮氮单键,配合物Ⅲ中为氮氮双键,N2中为氮氮三键,故配合物Ⅱ中 两个氮原子间键长最长。
配合物Ⅱ
子S的价电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能
做配位原子
第3章 不同聚集状态的物质与性质
章末总结
第*页
知识网络构建
第*页
高考素养提升
考向一 晶体结构的分析与计算
A. 与石墨相比,(CF)x导电性增强
B. 与石墨相比,(CF)x抗氧化性增强
C. (CF)x中C—C的键长比C—F短
D. 1 mol(CF)x中含有2x mol共价单键
B
解析:石墨晶体中每个碳原子上未参与杂化的1个2p轨道上电子在层内离域运 动,故石墨晶体能导电,而(CF)x中没有未参与杂化的2p轨道上的电子,故与 石墨相比,(CF)x导电性减弱,A错误;(CF)x中C原子的所有电子均参与成 键,未有未参与成键的孤电子或者不饱和键,故与石墨相比,(CF)x抗氧化性 增强,B正确;已知C的原子半径比F的大,故可知(CF)x中C—C的键长比C— F长,C错误;由题干结构示意图可知,在(CF)x中C与周围的3个碳原子形成 共价键,每个C—C键被2个碳原子共用,和1个F原子形成共价键,即1 mol (CF)x中含有2.5x mol共价单键,D错误。
2. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
A. 三种物质中均有碳碳原子间的σ键
B. 三种物质中的碳原子都是sp3杂化
C. 三种物质的晶体类型相同
D. 三种物质均能导电
A
解析:金刚石中所有碳原子均采取sp3杂化,石墨中所有碳原子均采取sp2杂化,石墨 炔中苯环上的碳原子采取sp2杂化,碳碳三键上的碳原子采取sp杂化,B项错误;金刚 石为共价晶体,石墨炔为分子晶体,石墨为混合型晶体,C项错误;金刚石中没有自 由移动电子,不能导电,D项错误。
A. 晶体最简化学式为KCaB6C6
B. 晶体中与K+最近且距离相等的Ca2+有8个
C. 晶胞中B和C原子构成的多面体有12个面
C
B. 图1中O原子的配位数为6
C. 图2表示的化学式为LiMg2OClxBr1-x
D. Mg2+取代产生的空位有利于Li+传导
C
A. LaH2晶体中La的配位数为8
B. 晶体中H和H的最短距离:LaH2>LaHx
C. 在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
C
A. 该氧化物的化学式为ZrO2
D. 若坐标取向不变,将p点Zr原子平移至原点,
则q点Zr原子位于晶胞xy面的面心
B
A. 中心原子的配位数是4
B. 晶胞中配合物分子的数目为2
C. 晶体中相邻分子间存在范德华力
D. 该晶体属于混合型晶体
D
8. 铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。
2
2∶1
bc
Ca2+
10. 钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图 所示:
KFe2Se2
解析:由平面投影图可知,位于棱上的铁原子与位于
面上的硒原子的距离最近,所以铁原子的配位数为4。
4
11. 如图是CZTS四元半导体化合物的四方晶胞。
Cu2ZnSnS4
考向二 配合物理论
A. Al2Cl6的结构式为
B. Al2Cl6为非极性分子
C. 该反应中NH3的配位能力大于氯
D. Al2Br6比Al2Cl6更难与NH3发生反应
D
解析:由双聚氯化铝分子中所有原子均满足8电子稳定结构可知,分子的结构式 为 ,则双聚氯化铝分子为结构对称的非极性分子,故A、B正确;由 化学方程式可知,氨分子更易与具有空轨道的铝原子形成配位键,配位能力大于氯原 子,故C正确;溴元素的电负性小于氯元素,溴原子的原子半径大于氯原子,则铝溴 键弱于铝氯键,所以双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与氨气反应, 故D错误。
13. 我国科学家发现一种钡配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中 间体包括Ⅱ和Ⅲ。
( 代表单键、双键或三键)
回答下列问题:
解析:根据配合物Ⅰ的结构图知,中心原子钒的配位原子有C、O、P、Cl。
C、O、P、Cl
解析:根据VSEPR模型,中心原子氧原子的价电子对数为4,其中孤电子对数为2,空间结构呈角形。
根据VSEPR模
型,氧原子的价电子对数为4,其中孤电子对数为2
解析:配合物Ⅱ中,第一电离能最大的配位原子是N。
N
解析:结合题干所给配合物Ⅱ和Ⅲ的结构,钒的化合价分别为+4和+3,配合物 Ⅱ中氮原子间是氮氮单键,配合物Ⅲ中为氮氮双键,N2中为氮氮三键,故配合物Ⅱ中 两个氮原子间键长最长。
配合物Ⅱ
子S的价电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能
做配位原子
