专题五 化学反应与能量变化章末能力整合五 学案(含含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 专题五 化学反应与能量变化章末能力整合五 学案(含含解析)2026届高三化学一轮总复习 |
|
|
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-10 00:00:00 | ||
图片预览

文档简介
专题五 化学反应与能量变化
章末能力整合五
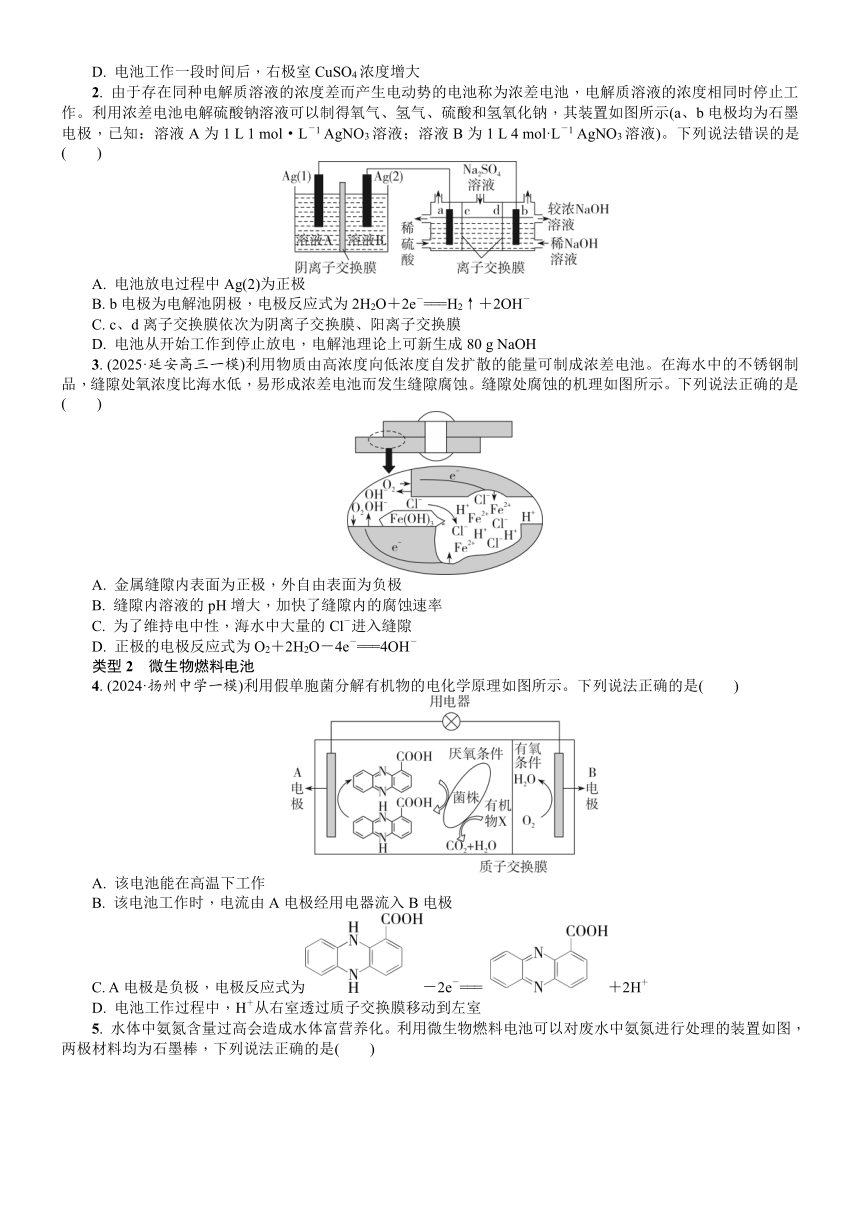
一、 有关电化学装置的分析
二、 浓差电池
浓差电池的分析方法
浓差电池是利用物质的浓度差产生电势的一种装置。两侧半电池中的特定物质有浓度差,离子均是由“高浓度”移向“低浓度”,依据阴离子移向负极区域,阳离子移向正极区域判断电池的正、负极,这是解题的关键。
三、 微生物燃料电池
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。其基本工作原理是在负极室厌氧环境下,有机物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和负极之间进行有效传递,并通过外电路传递到正极形成电流,而质子通过质子交换膜传递到正极,氧化剂(如氧气)在正极得到电子被还原。
四、 锂电池与锂离子电池
1. 锂电池
锂电池是一类由金属锂或锂合金为负极材料、使用非水电解质溶液的电池。工作时金属锂失去电子被氧化为Li+,负极反应均为Li-e-===Li+,负极生成的Li+经过电解质定向移动到正极。
2. 锂离子二次电池
(1)锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”原理;在两极形成的电势差的驱动下,Li+可以从电极材料提供的空间中“嵌入”或“脱嵌”。
(2)锂离子电池充电时阴极反应式一般为C6+xLi++xe-===LixC6;放电时负极反应是充电时阴极反应的逆过程:LixC6-xe-===C6+xLi+。
(3)锂离子电池的正极材料一般为含Li+的化合物,目前已商业化的正极材料有LiFePO4、LiCoO2、LiMn2O4等。
五、 物质循环转化型电池
根据物质转化中,注意电极反应与电极区反应,元素化合价的变化或离子的移动(阳离子移向正极区域,阴离子移向负极区域)判断电池的正、负极,是分析该电池的关键。
类型1 浓差电池
1. 由于存在离子浓度差而产生电动势的电池称为离子浓差电池,当两极室离子浓度相等时放电完成。某离子浓差电池的工作原理如图所示,下列说法中不正确的是( )
A. 该电池的隔膜为阳离子交换膜
B. 铜电极Ⅱ上发生氧化反应
C. 该电池工作时,化学能主要转化为电能
D. 电池工作一段时间后,右极室CuSO4浓度增大
2. 由于存在同种电解质溶液的浓度差而产生电动势的电池称为浓差电池,电解质溶液的浓度相同时停止工作。利用浓差电池电解硫酸钠溶液可以制得氧气、氢气、硫酸和氢氧化钠,其装置如图所示(a、b电极均为石墨电极,已知:溶液A为1 L 1 mol·L-1 AgNO3溶液;溶液B为1 L 4 mol·L-1 AgNO3溶液)。下列说法错误的是( )
A. 电池放电过程中Ag(2)为正极
B. b电极为电解池阴极,电极反应式为2H2O+2e-===H2↑+2OH-
C. c、d离子交换膜依次为阴离子交换膜、阳离子交换膜
D. 电池从开始工作到停止放电,电解池理论上可新生成80 g NaOH
3. (2025·延安高三一模)利用物质由高浓度向低浓度自发扩散的能量可制成浓差电池。在海水中的不锈钢制品,缝隙处氧浓度比海水低,易形成浓差电池而发生缝隙腐蚀。缝隙处腐蚀的机理如图所示。下列说法正确的是( )
A. 金属缝隙内表面为正极,外自由表面为负极
B. 缝隙内溶液的pH增大,加快了缝隙内的腐蚀速率
C. 为了维持电中性,海水中大量的Cl-进入缝隙
D. 正极的电极反应式为O2+2H2O-4e-===4OH-
类型2 微生物燃料电池
4. (2024·扬州中学一模)利用假单胞菌分解有机物的电化学原理如图所示。下列说法正确的是( )
A. 该电池能在高温下工作
B. 该电池工作时,电流由A电极经用电器流入B电极
C. A电极是负极,电极反应式为-2e-=== +2H+
D. 电池工作过程中,H+从右室透过质子交换膜移动到左室
5. 水体中氨氮含量过高会造成水体富营养化。利用微生物燃料电池可以对废水中氨氮进行处理的装置如图,两极材料均为石墨棒,下列说法正确的是( )
A. a极表面发生还原反应
B. 工作时H+通过质子交换膜移向左室
C. 标准状况下,每转移3 mol电子,负极生成11.2 L N2,且左室pH降低
D. 正极电极反应式为:2NO+10e-+6H2O===N2+12OH-
6. 微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置,以葡萄糖为燃料的微生物燃料电池结构示意图如图1所示,并利用此电池为电源模拟电化学降解NO,其原理如图2所示。下列说法正确的是( )
A. 电池工作时,电流由A极经电解质溶液流向B极
B. 电解过程中,阴极区溶液的pH不变
C. 每生成2.8 g N2,左右两侧溶液质量变化差7.2 g
D. 理论上,图1中每生成1 mol CO2,图2中生成N2的体积是8.96 L
类型3 锂电池与锂离子电池
7. 一种锂离子电池的结构如图所示,电池反应为C6+LiCoO2LixC6+Li1-xCoO2(x<1)。下列说法正确的是( )
A. 充电时a极接外电源的负极
B. 放电时Li+在电解质中由a极向b极迁移
C. 充电时若转移0.02 mol电子,石墨电极将减少0.14 g
D. 该废旧电池进行“放电处理”有利于锂在LiCoO2极回收
8. 稀土元素铕(Eu)掺杂的锂钛氧化物基材料(Li1-xEuTiO4)通常以改善材料的Li+扩散性为目的,铕并不参与电子的转移。该材料与嵌锂石墨(LixCy)组成的电池原理如图。下列说法错误的是( )
A. 放电时,正极反应为Li1-xEuTiO4+xe-+xLi+===LiEuTiO4
B. 放电时,溶液中Li+的浓度减小
C. 充电时,a极材料中Ti元素的化合价升高
D. 充电时,若转移1 mol电子,嵌锂石墨将增重7 g
9. (2024·全国模拟预测)锂硒电池是一种具有高电导率、高理论体积容量、高理论质量容量的新型电池,其工作原理如图所示,下列叙述正确的是( )
A. 放电时正极的电极反应式为Se+2Li+-2e-===Li2Se
B. 在Li2Se晶胞结构中,Li+占据的位置是顶点和面心
C. 石墨烯聚合物隔膜只允许Li+通过,防止硒扩散到另一极
D. 充电时外电路中转移1 mol电子,两极质量变化差为7 g
类型4 物质循环转化型电池
10. (2024·常州武进、金坛期末调研)某生物燃料电池以N2和H2为原料可在一定温度下制取NH3,电池中含有固氮酶和氢化酶两种蛋白酶,工作原理如图。下列说法正确的是( )
A. a电极是燃料电池的正极
B. 电极b的电极反应式为N2-6e-+6H+===2NH3
C. 该电池适宜在高温下使用
D. 电池工作时氢离子通过交换膜由a极区向b极区移动
11. (2024·苏州一模)科学家设计了一种以Cu和CuS为电极的可循环电池,电解质为AlCl3等溶液,其工作原理如图所示,充电时,Cl-向CuS电极方向移动,下列说法正确的是( )
A. 放电时电极上产生Al3+进入溶液
B. 放电时Cu电极上的反应为Cu+e-+2Cl-===CuCl
C. 充电时CuS电极连接电源的正极
D. 当0.15 mol Cu转化成CuCl时,溶液中Al3+减少0.1 mol
12. 全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池,其充电时工作原理如图所示。下列说法正确的是( )
A. 充电时,电极a与电源的正极相连,发生还原反应
B. 放电时总反应为VO2++V3++H2O===VO+2H++V2+
C. 充电一段时间后,右侧电解液的pH降低
D. 放电时,电路中转移1 mol e-,则有1 mol H+由右侧移向左侧
章末能力整合五
1. A 解析:要消除两极室的浓度差,则右边铜离子、硫酸根离子浓度要增大,左边两种离子浓度要减小,因此铜电极Ⅱ发生Cu-2e-===Cu2+,同时硫酸根离子通过隔膜进入右边,则隔膜为阴离子交换膜;因此铜电极Ⅰ发生Cu2++2e-===Cu。据分析,硫酸根离子要通过隔膜从左侧进入右侧,因此隔膜为阴离子交换膜,故A错误;据分析,铜电极Ⅱ为负极发生氧化反应,故B正确;该电池为原电池,是将化学能主要转化为电能的装置,故C正确;要消除两极室的浓度差,则右边铜离子、硫酸根离子浓度要增大,左边两种离子浓度要减小,故D正确。故选A。
2. D 解析:浓差电池为同种电解质溶液的浓度差而产生电动势的电池,溶液B浓度大,Ag(2)为正极,电极反应式为Ag++e-===Ag,A项正确;b极与负极相连,为阴极,发生还原反应,电极反应式为2H2O+2e-===H2↑+2OH-,B项正确;溶液B中的硝酸根离子由右池透过阴离子交换膜进入左池,硫酸根离子透过交换膜c进入阳极区,故c为阴离子交换膜,钠离子透过交换膜d进入阴极区,故d为阳离子交换膜,C项正确;浓差电池中左右两边溶液中Ag+浓度相同时,电池停止工作,溶液A中n(Ag+)=1 mol·L-1×1 L=1 mol,溶液B中n(Ag+)=1 L×4 mol·L-1=4 mol,放电时A中Ag+增加,B中Ag+减少,当Ag+物质的量为=2.5 mol时,停止放电,此时B中Ag+减少4 mol-2.5 mol=1.5 mol,电路中转移电子数为1.5 mol,由b极电极反应式:2H2O+2e-===H2↑+2OH-,生成氢氧化钠1.5 mol,质量为1.5 mol×40 g·mol-1=60 g,D项错误。故选D。
3. C 解析:根据氧气得电子发生还原反应生成氢氧根离子可知,金属缝隙外自由表面为正极,金属缝隙内表面为负极,故A项错误;金属缝隙外自由表面为正极,生成氢氧根离子,缝隙外溶液的pH增大,加快了缝隙内的腐蚀速率,故B项错误;阴离子由正极向负极移动,所以大量Cl-进入缝隙来维持电中性,故C项正确;正极为氧气得电子发生还原反应生成氢氧根离子,电极反应式O2+2H2O+4e-===4OH-,故D项错误。故选C。
4. C 解析:由装置图可知,A电极上转化为,发生氧化反应,A电极为负极,B电极上O2得电子生成H2O,发生还原反应,B电极为正极。A.该电池工作时有菌株参与,不能在高温下工作,A错误;由分析可知,A电极为负极,电极B为正极,原电池工作时电流由正极(B电极)经用电器流入负极(A电极),B错误;A电极是负极,电极上转化为,其电极反应式为-2e-=== +2H+,C正确;由原电池工作原理可知,H+从左室透过质子交换膜移动到右室,D错误。
5. C 解析:a极是铵根化合价升高,失去电子得到氮气,因此a极表面发生氧化反应,故A错误;根据前面A选项解析a极为负极,b极为正极,该燃料电池为原电池,根据原电池“同性相吸”,则工作时H+通过质子交换膜移向右室,故B错误;根据a极电极反应式2NH-6e-===N2↑+8H+,标准状况下,每转移3 mol电子,负极生成11.2 L N2,氢离子浓度增大,左室pH降低,故C正确;正极电极反应式为:2NO+10e-+12H+===N2↑+6H2O,故D错误。故选C。
6. C 解析:由于通氧气的一极是原电池的正极,微生物一端为原电池的负极,电池工作时电流从正极经过外电路电子流向负极,负极经过电解质溶液流向正极,即电流由B极经电解质溶液流向A极,A错误;电解时阴极区发生反应为:2NO+10e-+12H+===N2↑+6H2O,每转移10 mol电子时,左侧10 mol氢离子移向右侧,因此阴极区氢离子浓度减少,pH升高,B错误;每生成2.8 g N2,即0.1 mol N2,转移1 mol电子,有1 mol氢离子通过质子交换膜从左边到右边,右边减小2.8 g-1 g=1.8 g,左边阳极发生反应为2H2O-4e-===O2↑+4H+,左边减少0.5 mol水,质量为9 g,有左右两侧溶液质量变化差9 g-1.8 g=7.2 g,C正确;未告知状态,不能通过物质的量确定气体体积,D错误。故选C。
7. D 解析:C6+LiCoO2LixC6+Li1-xCoO2(x<1),充电时LiCoO2中Co元素化合价升高,发生氧化反应a极为电解池的阳极,石墨为阴极;放电时b极为负极,a极为正极。充电时a极为电解池的阳极,与电源的正极相连,A错误;放电时阳离子移向正极,Li+在电解质中由b极(负极)向a极(正极)迁移,B错误;充电时石墨电极发生反应C6+xLi++xe-===LixC6,若转移0.02 mol电子,C6得电子生成LixC6附着石墨电极上,使得石墨电极增加了0.14 g,C错误;废旧电池进行“放电处理”时Li1-xCoO2在正极得电子生成LiCoO2,有利于锂在LiCoO2极回收,D正确。故选D。
8. B 解析:该电池通过Li+在两个电极上的嵌入与脱嵌实现充放电,放电时Li+嵌入正极,正极反应式为Li1-xEuTiO4+xe-+xLi+===LiEuTiO4,A正确;放电时,Li+从负极脱嵌,负极反应式为LixCy-xe-===xLi++Cy,结合正极反应式可知放电过程中从负极脱嵌的Li+与嵌入正极的Li+的物质的量相等,且放电过程中电解质溶液体积不变,则放电过程中溶液中Li+的浓度不变,B错误;根据放电时的正极反应可得充电时的阳极反应:LiEuTiO4-xe-===Li1-xEuTiO4+xLi+,因为铕不参与电子的转移,且Li与O元素的化合价也不变,则充电时化合价升高的元素是Ti,C正确;根据放电时的负极反应可得充电时的阴极反应;Cy+xe-+xLi+===LixCy,每转移1 mol电子,有1 mol Li+嵌入阴极,使阴极的质量增加7 g,D正确。故选B。
9. C 解析:放电时,正极的电极反应式为Se+2Li++2e-===Li2Se,A错误;Li2Se晶胞结构与CaF2类似,Se2-占据顶点和面心,Li+填充在Se2-构成的四面体空隙中,B错误;石墨烯聚合物隔膜只允许Li+通过,是为了防止硒扩散到另一极,从而提高电池工作效率,C正确;充电时,Li电极为阴极,电极反应式为Li++e-===Li,Se电极为阳极,电极反应式为Li2Se-2e-===Se+2Li+,当外电路中转移1 mol电子时,Li电极质量增加7 g,Se电极质量减少7 g,两极质量变化差为14 g,D错误。故选C。
10. D 解析:a极上MV+失去电子转化为MV2+,电极反应式为MV+-e-===MV2+,所以a极是负极,b极为正极。根据分析可知,a极是负极,故A错误;从图示可以看出,在固氮酶表面,N2和MV+反应生成NH3和MV2+,在电极b上MV2+反应生成MV+,故电极b的电极反应式为MV2++e-===MV+,故B错误;酶在高温条件下易失活,故C错误;原电池中阳离子向正极运动,电池工作时氢离子通过交换膜由a极区向b极区移动,故D正确。
11. C 解析:由充电时,氯离子向CuS电极方向移动可知,充电时,CuS电极做阳极,Cu电极做阴极;放电时,铜电极为负极,铜失去电子,发生氧化反应,生成CuCl,电极反应式为Cu-e-+2Cl-===CuCl,CuS电极为正极,CuS得到电子,发生还原反应,生成AlxCuS,电极反应式为CuS+3xe-+xAl3+===AlxCuS。由分析可知,放电时,CuS电极为正极,CuS得到电子,发生还原反应,和Al3+反应生成AlxCuS,溶液中Al3+数目减少,故A错误;由分析可知,放电时,铜电极为负极,铜失去电子,发生氧化反应,生成CuCl,电极反应式为Cu-e-+2Cl-===CuCl,故B错误;由分析可知,充电时,CuS电极做阳极,CuS电极与直流电源正极相连,故C正确;由分析可知,放电时,铜电极为负极,铜失去电子,发生氧化反应,生成二氯合亚铜离子,CuS电极为正极,CuS得到电子,发生还原反应,生成AlxCuS,则当0.15 mol铜转化成CuCl时,溶液中Al3+减少的物质的量为0.05 mol,故D错误。
12. C 解析:充电时,V3+发生还原反应,即a电极上V3+发生得电子的还原反应生成V2+,则a电极为阴极,b电极为阳极,阴极电极反应为V3++e-===V2+,阳极极电极反应为VO2+-e-+H2O===VO+2H+,充电时原电池的正负极与电源正负极相接,则放电时,b电极为正极,正极反应为VO+2H++e-===VO2++H2O,a电极为负极,负极反应为V2+-e-===V3+,据此分析解答。由分析可知,充电时,电极a为阴极,应该与电源的负极相连,发生还原反应,A错误;由分析可知,放电时b电极为正极,正极反应为VO+2H++e-===VO2++H2O,a电极为负极,负极反应为V2+-e-===V3+,故总反应为VO+2H++V2+===VO2++V3++H2O,B错误;由分析可知,b电极为阳极,电极反应为VO2+-e-+H2O===VO+2H+,故充电一段时间后,右侧电解液的pH降低,C正确;由分析可知,放电时,a电极为负极,b电极为正极,故电路中转移1 mol e-,则有1 mol H+由左侧移向右侧,D错误。故选C。
章末能力整合五
一、 有关电化学装置的分析
二、 浓差电池
浓差电池的分析方法
浓差电池是利用物质的浓度差产生电势的一种装置。两侧半电池中的特定物质有浓度差,离子均是由“高浓度”移向“低浓度”,依据阴离子移向负极区域,阳离子移向正极区域判断电池的正、负极,这是解题的关键。
三、 微生物燃料电池
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。其基本工作原理是在负极室厌氧环境下,有机物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和负极之间进行有效传递,并通过外电路传递到正极形成电流,而质子通过质子交换膜传递到正极,氧化剂(如氧气)在正极得到电子被还原。
四、 锂电池与锂离子电池
1. 锂电池
锂电池是一类由金属锂或锂合金为负极材料、使用非水电解质溶液的电池。工作时金属锂失去电子被氧化为Li+,负极反应均为Li-e-===Li+,负极生成的Li+经过电解质定向移动到正极。
2. 锂离子二次电池
(1)锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”原理;在两极形成的电势差的驱动下,Li+可以从电极材料提供的空间中“嵌入”或“脱嵌”。
(2)锂离子电池充电时阴极反应式一般为C6+xLi++xe-===LixC6;放电时负极反应是充电时阴极反应的逆过程:LixC6-xe-===C6+xLi+。
(3)锂离子电池的正极材料一般为含Li+的化合物,目前已商业化的正极材料有LiFePO4、LiCoO2、LiMn2O4等。
五、 物质循环转化型电池
根据物质转化中,注意电极反应与电极区反应,元素化合价的变化或离子的移动(阳离子移向正极区域,阴离子移向负极区域)判断电池的正、负极,是分析该电池的关键。
类型1 浓差电池
1. 由于存在离子浓度差而产生电动势的电池称为离子浓差电池,当两极室离子浓度相等时放电完成。某离子浓差电池的工作原理如图所示,下列说法中不正确的是( )
A. 该电池的隔膜为阳离子交换膜
B. 铜电极Ⅱ上发生氧化反应
C. 该电池工作时,化学能主要转化为电能
D. 电池工作一段时间后,右极室CuSO4浓度增大
2. 由于存在同种电解质溶液的浓度差而产生电动势的电池称为浓差电池,电解质溶液的浓度相同时停止工作。利用浓差电池电解硫酸钠溶液可以制得氧气、氢气、硫酸和氢氧化钠,其装置如图所示(a、b电极均为石墨电极,已知:溶液A为1 L 1 mol·L-1 AgNO3溶液;溶液B为1 L 4 mol·L-1 AgNO3溶液)。下列说法错误的是( )
A. 电池放电过程中Ag(2)为正极
B. b电极为电解池阴极,电极反应式为2H2O+2e-===H2↑+2OH-
C. c、d离子交换膜依次为阴离子交换膜、阳离子交换膜
D. 电池从开始工作到停止放电,电解池理论上可新生成80 g NaOH
3. (2025·延安高三一模)利用物质由高浓度向低浓度自发扩散的能量可制成浓差电池。在海水中的不锈钢制品,缝隙处氧浓度比海水低,易形成浓差电池而发生缝隙腐蚀。缝隙处腐蚀的机理如图所示。下列说法正确的是( )
A. 金属缝隙内表面为正极,外自由表面为负极
B. 缝隙内溶液的pH增大,加快了缝隙内的腐蚀速率
C. 为了维持电中性,海水中大量的Cl-进入缝隙
D. 正极的电极反应式为O2+2H2O-4e-===4OH-
类型2 微生物燃料电池
4. (2024·扬州中学一模)利用假单胞菌分解有机物的电化学原理如图所示。下列说法正确的是( )
A. 该电池能在高温下工作
B. 该电池工作时,电流由A电极经用电器流入B电极
C. A电极是负极,电极反应式为-2e-=== +2H+
D. 电池工作过程中,H+从右室透过质子交换膜移动到左室
5. 水体中氨氮含量过高会造成水体富营养化。利用微生物燃料电池可以对废水中氨氮进行处理的装置如图,两极材料均为石墨棒,下列说法正确的是( )
A. a极表面发生还原反应
B. 工作时H+通过质子交换膜移向左室
C. 标准状况下,每转移3 mol电子,负极生成11.2 L N2,且左室pH降低
D. 正极电极反应式为:2NO+10e-+6H2O===N2+12OH-
6. 微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置,以葡萄糖为燃料的微生物燃料电池结构示意图如图1所示,并利用此电池为电源模拟电化学降解NO,其原理如图2所示。下列说法正确的是( )
A. 电池工作时,电流由A极经电解质溶液流向B极
B. 电解过程中,阴极区溶液的pH不变
C. 每生成2.8 g N2,左右两侧溶液质量变化差7.2 g
D. 理论上,图1中每生成1 mol CO2,图2中生成N2的体积是8.96 L
类型3 锂电池与锂离子电池
7. 一种锂离子电池的结构如图所示,电池反应为C6+LiCoO2LixC6+Li1-xCoO2(x<1)。下列说法正确的是( )
A. 充电时a极接外电源的负极
B. 放电时Li+在电解质中由a极向b极迁移
C. 充电时若转移0.02 mol电子,石墨电极将减少0.14 g
D. 该废旧电池进行“放电处理”有利于锂在LiCoO2极回收
8. 稀土元素铕(Eu)掺杂的锂钛氧化物基材料(Li1-xEuTiO4)通常以改善材料的Li+扩散性为目的,铕并不参与电子的转移。该材料与嵌锂石墨(LixCy)组成的电池原理如图。下列说法错误的是( )
A. 放电时,正极反应为Li1-xEuTiO4+xe-+xLi+===LiEuTiO4
B. 放电时,溶液中Li+的浓度减小
C. 充电时,a极材料中Ti元素的化合价升高
D. 充电时,若转移1 mol电子,嵌锂石墨将增重7 g
9. (2024·全国模拟预测)锂硒电池是一种具有高电导率、高理论体积容量、高理论质量容量的新型电池,其工作原理如图所示,下列叙述正确的是( )
A. 放电时正极的电极反应式为Se+2Li+-2e-===Li2Se
B. 在Li2Se晶胞结构中,Li+占据的位置是顶点和面心
C. 石墨烯聚合物隔膜只允许Li+通过,防止硒扩散到另一极
D. 充电时外电路中转移1 mol电子,两极质量变化差为7 g
类型4 物质循环转化型电池
10. (2024·常州武进、金坛期末调研)某生物燃料电池以N2和H2为原料可在一定温度下制取NH3,电池中含有固氮酶和氢化酶两种蛋白酶,工作原理如图。下列说法正确的是( )
A. a电极是燃料电池的正极
B. 电极b的电极反应式为N2-6e-+6H+===2NH3
C. 该电池适宜在高温下使用
D. 电池工作时氢离子通过交换膜由a极区向b极区移动
11. (2024·苏州一模)科学家设计了一种以Cu和CuS为电极的可循环电池,电解质为AlCl3等溶液,其工作原理如图所示,充电时,Cl-向CuS电极方向移动,下列说法正确的是( )
A. 放电时电极上产生Al3+进入溶液
B. 放电时Cu电极上的反应为Cu+e-+2Cl-===CuCl
C. 充电时CuS电极连接电源的正极
D. 当0.15 mol Cu转化成CuCl时,溶液中Al3+减少0.1 mol
12. 全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池,其充电时工作原理如图所示。下列说法正确的是( )
A. 充电时,电极a与电源的正极相连,发生还原反应
B. 放电时总反应为VO2++V3++H2O===VO+2H++V2+
C. 充电一段时间后,右侧电解液的pH降低
D. 放电时,电路中转移1 mol e-,则有1 mol H+由右侧移向左侧
章末能力整合五
1. A 解析:要消除两极室的浓度差,则右边铜离子、硫酸根离子浓度要增大,左边两种离子浓度要减小,因此铜电极Ⅱ发生Cu-2e-===Cu2+,同时硫酸根离子通过隔膜进入右边,则隔膜为阴离子交换膜;因此铜电极Ⅰ发生Cu2++2e-===Cu。据分析,硫酸根离子要通过隔膜从左侧进入右侧,因此隔膜为阴离子交换膜,故A错误;据分析,铜电极Ⅱ为负极发生氧化反应,故B正确;该电池为原电池,是将化学能主要转化为电能的装置,故C正确;要消除两极室的浓度差,则右边铜离子、硫酸根离子浓度要增大,左边两种离子浓度要减小,故D正确。故选A。
2. D 解析:浓差电池为同种电解质溶液的浓度差而产生电动势的电池,溶液B浓度大,Ag(2)为正极,电极反应式为Ag++e-===Ag,A项正确;b极与负极相连,为阴极,发生还原反应,电极反应式为2H2O+2e-===H2↑+2OH-,B项正确;溶液B中的硝酸根离子由右池透过阴离子交换膜进入左池,硫酸根离子透过交换膜c进入阳极区,故c为阴离子交换膜,钠离子透过交换膜d进入阴极区,故d为阳离子交换膜,C项正确;浓差电池中左右两边溶液中Ag+浓度相同时,电池停止工作,溶液A中n(Ag+)=1 mol·L-1×1 L=1 mol,溶液B中n(Ag+)=1 L×4 mol·L-1=4 mol,放电时A中Ag+增加,B中Ag+减少,当Ag+物质的量为=2.5 mol时,停止放电,此时B中Ag+减少4 mol-2.5 mol=1.5 mol,电路中转移电子数为1.5 mol,由b极电极反应式:2H2O+2e-===H2↑+2OH-,生成氢氧化钠1.5 mol,质量为1.5 mol×40 g·mol-1=60 g,D项错误。故选D。
3. C 解析:根据氧气得电子发生还原反应生成氢氧根离子可知,金属缝隙外自由表面为正极,金属缝隙内表面为负极,故A项错误;金属缝隙外自由表面为正极,生成氢氧根离子,缝隙外溶液的pH增大,加快了缝隙内的腐蚀速率,故B项错误;阴离子由正极向负极移动,所以大量Cl-进入缝隙来维持电中性,故C项正确;正极为氧气得电子发生还原反应生成氢氧根离子,电极反应式O2+2H2O+4e-===4OH-,故D项错误。故选C。
4. C 解析:由装置图可知,A电极上转化为,发生氧化反应,A电极为负极,B电极上O2得电子生成H2O,发生还原反应,B电极为正极。A.该电池工作时有菌株参与,不能在高温下工作,A错误;由分析可知,A电极为负极,电极B为正极,原电池工作时电流由正极(B电极)经用电器流入负极(A电极),B错误;A电极是负极,电极上转化为,其电极反应式为-2e-=== +2H+,C正确;由原电池工作原理可知,H+从左室透过质子交换膜移动到右室,D错误。
5. C 解析:a极是铵根化合价升高,失去电子得到氮气,因此a极表面发生氧化反应,故A错误;根据前面A选项解析a极为负极,b极为正极,该燃料电池为原电池,根据原电池“同性相吸”,则工作时H+通过质子交换膜移向右室,故B错误;根据a极电极反应式2NH-6e-===N2↑+8H+,标准状况下,每转移3 mol电子,负极生成11.2 L N2,氢离子浓度增大,左室pH降低,故C正确;正极电极反应式为:2NO+10e-+12H+===N2↑+6H2O,故D错误。故选C。
6. C 解析:由于通氧气的一极是原电池的正极,微生物一端为原电池的负极,电池工作时电流从正极经过外电路电子流向负极,负极经过电解质溶液流向正极,即电流由B极经电解质溶液流向A极,A错误;电解时阴极区发生反应为:2NO+10e-+12H+===N2↑+6H2O,每转移10 mol电子时,左侧10 mol氢离子移向右侧,因此阴极区氢离子浓度减少,pH升高,B错误;每生成2.8 g N2,即0.1 mol N2,转移1 mol电子,有1 mol氢离子通过质子交换膜从左边到右边,右边减小2.8 g-1 g=1.8 g,左边阳极发生反应为2H2O-4e-===O2↑+4H+,左边减少0.5 mol水,质量为9 g,有左右两侧溶液质量变化差9 g-1.8 g=7.2 g,C正确;未告知状态,不能通过物质的量确定气体体积,D错误。故选C。
7. D 解析:C6+LiCoO2LixC6+Li1-xCoO2(x<1),充电时LiCoO2中Co元素化合价升高,发生氧化反应a极为电解池的阳极,石墨为阴极;放电时b极为负极,a极为正极。充电时a极为电解池的阳极,与电源的正极相连,A错误;放电时阳离子移向正极,Li+在电解质中由b极(负极)向a极(正极)迁移,B错误;充电时石墨电极发生反应C6+xLi++xe-===LixC6,若转移0.02 mol电子,C6得电子生成LixC6附着石墨电极上,使得石墨电极增加了0.14 g,C错误;废旧电池进行“放电处理”时Li1-xCoO2在正极得电子生成LiCoO2,有利于锂在LiCoO2极回收,D正确。故选D。
8. B 解析:该电池通过Li+在两个电极上的嵌入与脱嵌实现充放电,放电时Li+嵌入正极,正极反应式为Li1-xEuTiO4+xe-+xLi+===LiEuTiO4,A正确;放电时,Li+从负极脱嵌,负极反应式为LixCy-xe-===xLi++Cy,结合正极反应式可知放电过程中从负极脱嵌的Li+与嵌入正极的Li+的物质的量相等,且放电过程中电解质溶液体积不变,则放电过程中溶液中Li+的浓度不变,B错误;根据放电时的正极反应可得充电时的阳极反应:LiEuTiO4-xe-===Li1-xEuTiO4+xLi+,因为铕不参与电子的转移,且Li与O元素的化合价也不变,则充电时化合价升高的元素是Ti,C正确;根据放电时的负极反应可得充电时的阴极反应;Cy+xe-+xLi+===LixCy,每转移1 mol电子,有1 mol Li+嵌入阴极,使阴极的质量增加7 g,D正确。故选B。
9. C 解析:放电时,正极的电极反应式为Se+2Li++2e-===Li2Se,A错误;Li2Se晶胞结构与CaF2类似,Se2-占据顶点和面心,Li+填充在Se2-构成的四面体空隙中,B错误;石墨烯聚合物隔膜只允许Li+通过,是为了防止硒扩散到另一极,从而提高电池工作效率,C正确;充电时,Li电极为阴极,电极反应式为Li++e-===Li,Se电极为阳极,电极反应式为Li2Se-2e-===Se+2Li+,当外电路中转移1 mol电子时,Li电极质量增加7 g,Se电极质量减少7 g,两极质量变化差为14 g,D错误。故选C。
10. D 解析:a极上MV+失去电子转化为MV2+,电极反应式为MV+-e-===MV2+,所以a极是负极,b极为正极。根据分析可知,a极是负极,故A错误;从图示可以看出,在固氮酶表面,N2和MV+反应生成NH3和MV2+,在电极b上MV2+反应生成MV+,故电极b的电极反应式为MV2++e-===MV+,故B错误;酶在高温条件下易失活,故C错误;原电池中阳离子向正极运动,电池工作时氢离子通过交换膜由a极区向b极区移动,故D正确。
11. C 解析:由充电时,氯离子向CuS电极方向移动可知,充电时,CuS电极做阳极,Cu电极做阴极;放电时,铜电极为负极,铜失去电子,发生氧化反应,生成CuCl,电极反应式为Cu-e-+2Cl-===CuCl,CuS电极为正极,CuS得到电子,发生还原反应,生成AlxCuS,电极反应式为CuS+3xe-+xAl3+===AlxCuS。由分析可知,放电时,CuS电极为正极,CuS得到电子,发生还原反应,和Al3+反应生成AlxCuS,溶液中Al3+数目减少,故A错误;由分析可知,放电时,铜电极为负极,铜失去电子,发生氧化反应,生成CuCl,电极反应式为Cu-e-+2Cl-===CuCl,故B错误;由分析可知,充电时,CuS电极做阳极,CuS电极与直流电源正极相连,故C正确;由分析可知,放电时,铜电极为负极,铜失去电子,发生氧化反应,生成二氯合亚铜离子,CuS电极为正极,CuS得到电子,发生还原反应,生成AlxCuS,则当0.15 mol铜转化成CuCl时,溶液中Al3+减少的物质的量为0.05 mol,故D错误。
12. C 解析:充电时,V3+发生还原反应,即a电极上V3+发生得电子的还原反应生成V2+,则a电极为阴极,b电极为阳极,阴极电极反应为V3++e-===V2+,阳极极电极反应为VO2+-e-+H2O===VO+2H+,充电时原电池的正负极与电源正负极相接,则放电时,b电极为正极,正极反应为VO+2H++e-===VO2++H2O,a电极为负极,负极反应为V2+-e-===V3+,据此分析解答。由分析可知,充电时,电极a为阴极,应该与电源的负极相连,发生还原反应,A错误;由分析可知,放电时b电极为正极,正极反应为VO+2H++e-===VO2++H2O,a电极为负极,负极反应为V2+-e-===V3+,故总反应为VO+2H++V2+===VO2++V3++H2O,B错误;由分析可知,b电极为阳极,电极反应为VO2+-e-+H2O===VO+2H+,故充电一段时间后,右侧电解液的pH降低,C正确;由分析可知,放电时,a电极为负极,b电极为正极,故电路中转移1 mol e-,则有1 mol H+由左侧移向右侧,D错误。故选C。
同课章节目录
